Снежный ком проблем с плюрипотентностью
09 июля 2011
Снежный ком проблем с плюрипотентностью
- 3282
- 0
- 9
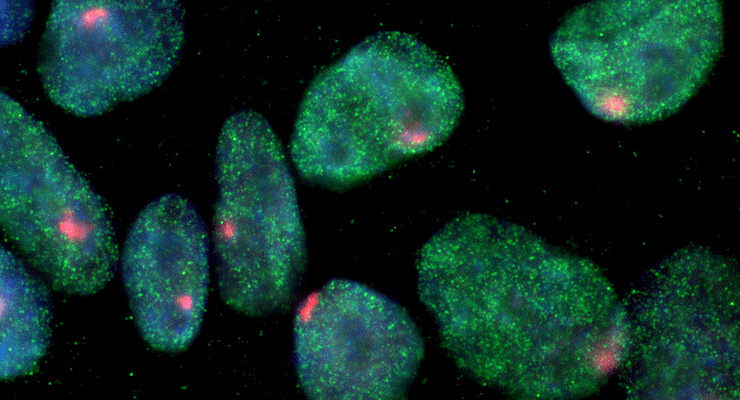
Индуцированные плюрипотентные стволовые клетки (ИПСК), полученные из клеток кожи. Синяя окраска соответствует ядрам клеток; зеленые «искорки» — белку NANOG, присутствующему в ИПСК, но отсутствующему в «нормальных» клетках; красные точки — инактивированным X-хромосомам.
-
Автор
-
Редакторы
Индуцированные плюрипотентные стволовые клетки — одна из новейших областей биологии, быстро набирающая обороты. Как и любая другая новая наука, сейчас она вступила в трудный «подростковый» период. Об этом и будет наш рассказ.
Пятилетний срок в науке — это очень небольшой промежуток времени. А ведь именно столько времени прошло с момента первой публикации Синьи Яманаки (Shinya Yamanaka) из Киотского университета Японии [1], где он заявил о создании метода «перепрограммирования» клеток кожи мышей в индуцированные плюрипотентные стволовые клетки (ИПСК). Эти клетки обладают способностью превращаться во многие другие виды клеток, что открывает необыкновенные возможности перед регенеративной медициной. («Биомолекула» уже писала об этом: «Была клетка простая, стала стволовая» [2] — П.С.) Годом позже этой же группой ученых был получен подобный результат и для человеческих клеток [3].
Подобно эмбриональным стволовым клеткам, ИПСК также потенциально могут использоваться для терапии, создания in vitro-моделей болезней или для поиска новых лекарств. Однако ИПСК имеют одно неоспоримое преимущество — они могут быть получены «здесь и сейчас» (прямо из взрослых клеток организма), что значительно упрощает вопрос объективности модели и совместимости будущих трансплантатов. Еще один плюс — для работы с ИПСК не требуются человеческие эмбрионы, что снимает ряд этических проблем. (См. также: «Щадящие стволовые клетки» [4].) Теперь клетки можно брать у конкретного пациента с определенной болезнью и изучать его болезнь в лаборатории, приближая эру персональной генетики и медицины.
Ученые предсказывают, что ИПСК изменят лицо биологии и медицины. За прошедшие пять лет были опубликованы сотни работ по изучению болезней на различных клеточных моделях, созданных с помощью ИПСК — от сердечных заболеваний [5] до моделей шизофрении [6]. Все идет к тому, что вскоре лечение с помощью ИПСК станет явью. В Калифорнии, например, команда ученых в течение трех лет надеется получить разрешение на лечение людей с врожденным заболеванием кожи — буллезным эпидермолизом, — используя кожу, выращенную из ИПСК самих пациентов.
Однако огромное количество работ и результатов выявили также и ряд проблем, которые возникают при использовании ИПСК. Так, например: репрограммирование может быть неполным или вызывать мутации; ИПСК могут дифференцироваться не во все типы клеток; не все ИПСК являются хорошими моделями для изучения болезней. И хотя нет сомнений, что перспективы ИПСК огромны, мы находимся только в самом начале пути, и говорить о том, что методика отработана, пока слишком рано.
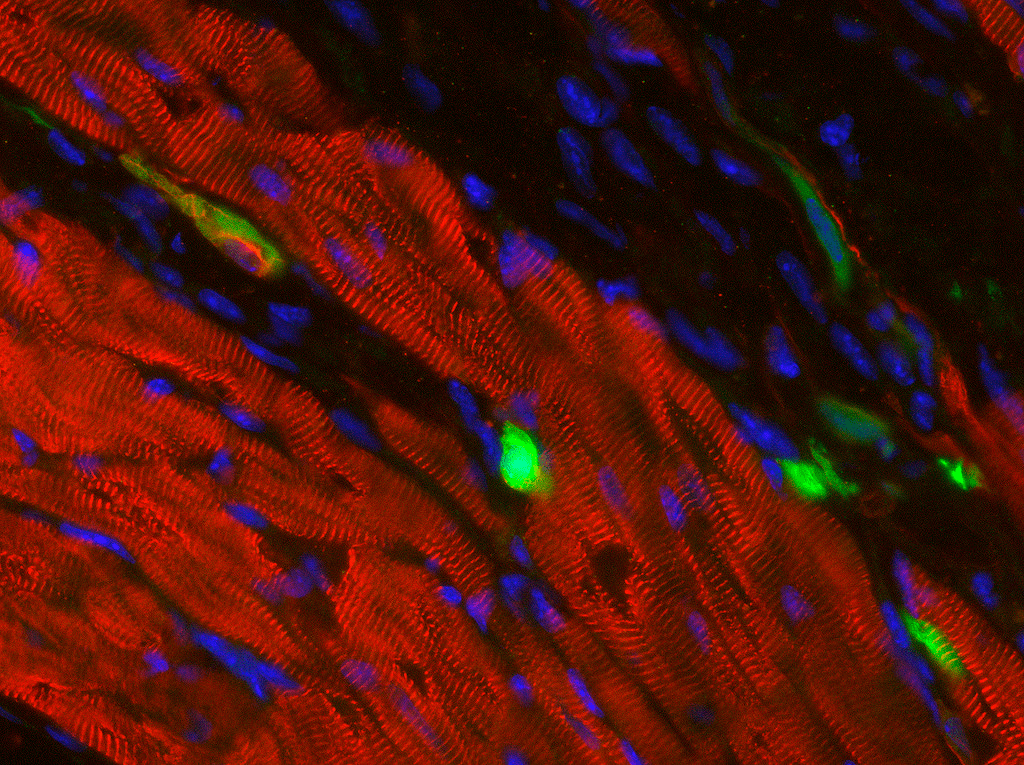
Рисунок 1. Сердечная мышца с ИПСК. Мышечные волокна содержат ИПСК, напрямую «перепрограммируемые» в кардиомиоциты. В перспективе эта же методика позволит смягчать последствия инфаркта или других поражений сердца.
В поисках рецепта

Рисунок 2. ИПСК превращаются в волосковые сенсорные клетки внутреннего уха. Электронная сканирующая микрофотография (23 000 ×) показывает морфологию ИПСК, превратившихся в слуховые клетки. В перспективе их можно будет пересаживать в ухо для течения некоторых форм глухоты или использовать для тестирования лекарств против нарушений слуха.
Биологи с самого начала пытались найти более безопасный и эффективный способ создания ИПСК, чем тот, что был предложен Яманакой. Напомним, в качестве вектора для доставки в клетку четырех репрограммирующих факторов (часть из которых — потенциальные онкогены) он использовал ретровирус [2]. Этот тип вирусов хорош тем, что он интегрирует свои гены прямо в геном клетки-хозяина, однако в этом же кроется и потенциальная опасность метода — нарушение целостности генома может непредсказуемо нарушить работу других генов, что является возможной предпосылкой к злокачественному перерождению ИПСК. «Возможная предпосылка» — звучит не слишком угрожающе, но такого рода предпосылки надо в принципе исключить перед тем, как начинать какое-либо лечение с применением ИПСК.
Новые схемы репрограммирования публикуются чуть ли не каждый месяц, однако по эффективности метод Яманаки до сих пор остается непревзойденным. Составляет эта эффективность 0,01% — именно столько клеток становится ИПСК после всех процедур. Для сравнения, аденовирусный метод (более «щадящий», потому что никакой интеграции в геном не происходит) эффективен только для 0,0001–0,0018% клеток, а физико-химическая доставка репрограммирующих факторов в клетки человека — лишь для 0,001%. Чем ниже эффективность репрограммирования, тем выше стоимость метода, и разница в 10 или 100 раз оставляет новые методы не удел (пусть они даже более безопасные). Кроме того, для каждого из них характерны свои индивидуальные сложности получения конечных ИПСК.
Одно из активно развиваемых направлений — уменьшение потенциальной канцерогенности факторов репрограммирования. В первую очередь под подозрение попадает фактор Мус (транскрипционный фактор человека), представляющий наибольшую потенциальную угрозу. Опубликованы работы, где исследователи пробовали не использовать Myc, но это еще сильнее уменьшало эффективность процесса. Попытки же пост-трансформационного выключения гена Myc с помощью коротких РНК не давали надежного эффекта: часто активность гена «воскресала» через непродолжительное время.
Описанные выше проблемы уже стали одной из самых горячих тем индуцированных стволовых клеток. И до сих пор ученые продолжают тасовать различные факторы с целью получить идеальный репрограммирующий коктейль, а также отрабатывают оптимальный носитель для его доставки. Так, в апреле 2011 года группа Эдварда Морриса из университета Пенсильвании объявила, что они нашли способ репрограммировать клетки с эффективностью на два порядка больше обычного показателя — около 1%, — используя ретровирус для доставки кластера микроРНК [7]. Насколько эта технология оправдает возложенные на нее надежды — покажет время.
Старые раны
Изучение стволовых клеток вызвало лавину новых вопросов, о которых ученые ранее даже не подозревали. Один из них — насколько критично влияние эпигенетического паттерна хроматина на эффективность последующего репрограммирования? В июне 2010 года группы Джорджа Дали (George Daley) [8] из Бостона и Конрада Хошедлингеера (Konrad Hochedlinger) [9] из Кембриджа опубликовали работы о том, что ИПСК после индукции и репрограммирования все равно сохраняют эпигенетические маркеры исходных клеток (хотя некоторая часть из них все-таки исчезает в процессе). Возможно, это одно из наиболее критичных отличий ИПСК от эмбриональных СК — на уровне эпигенетических маркеров эти две группы клеток различаются.
Кроме эпигенетических отличий, ИПСК содержат больше «традиционных» мутаций по сравнению с эмбриональными СК. Самое неприятное здесь то, что ряд мутаций и перестроек генома в ИПСК не унаследованы от родительских клеток, а приобретены в процессе репрограммирования. Также неожиданно обнаружилось, что часть таких мутаций при длительной культивации ИПСК постепенно уничтожается (наиболее вероятное тому объяснение — клетки с наиболее серьезными мутациями просто умирают). «Однако даже при длительном культивировании эпигенетические маркеры исходных клеток все равно не исчезают», — пишет Джозеф Эккер (Joseph Ecker) из Калифорнии [10]. Правда, другие ему возражают: так, группа под руководством Александра Мейснера (Alexander Meissner) из Гарварда, сравнив эпигенетику 20 эмбриональных СК с 12 ИПСК, не нашла серьезной разницы между ними [11].
Так или иначе, для Управления по контролю качества продуктов и лекарств (FDA) вся эта эпигенетика значит очень много, и они не пропустят ИПСК в медицину, пока вопрос с эпигенетическими маркерами не будет разрешен окончательно.
Многолики, но не универсальны
Хотя ИПСК необычайно пластичны, они все-таки не универсальны. Например, все с нетерпением ждут возможность получения клеток печени (гепатоцитов) из ИПСК. Теоретически они могли бы заменить животных при испытании токсичности лекарств, а также стать панацеей при циррозе печени. Но получить гепатоциты до сих пор не удается — причиной служит слишком сложный паттерн сигналов, которые управляют дифференцировкой этих клеток, и пока подобрать комбинацию для такого репрограммирования in vitro не удается. В литературе уже было несколько публикаций о создании методики репрограммирования, но последующие проверки выявляли те или иные ошибки в оценке результатов. Недавно опубликована новая статья, где описан метод получения клеток, подобных гепатоцитам, путем перепрограммированные клеток кожи мыши [12]. Однако насколько это так и будут ли они способны выполнять функции гепатоцитов — пока не ясно.
Другое горячее направление ИПСК — заместительная терапия при диабете I типа. При этом заболевании в результате аутоимунной атаки уничтожаются собственные клетки организма, продуцирующие инсулин. Перепрограммировать клетки больного в новые инсулин-продуцирующие клетки и вживить их в поджелудочную железу представляется очень заманчивым способом лечить этот недуг, однако на сегодня никто не способен этого сделать. Ученые просто не знают паттерн сигналов, позволяющих «перепрограммировать» СК в клетки Лангерганса. И хотя уже получены предшественники этих клеток — как из эмбриональных СК, так и из ИПСК, — получить зрелые инсулин-производящие клетки еще не удалось никому.
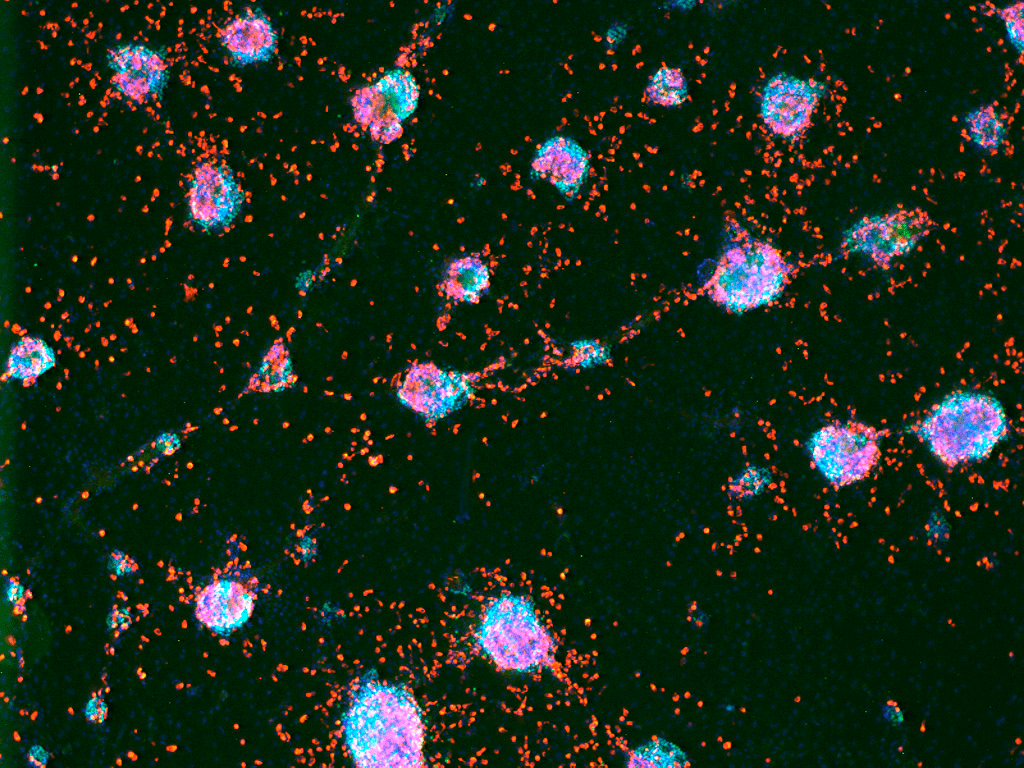
Рисунок 3. Предшественники инсулин-продуцирующих клеток, полученные из стволовых клеток. Пересаженные в поджелудочную железу мышей, инсулин-продуцирующие клетки смогут эффективно компенсировать потерю инсулина при диабете I типа. В будущем такая терапия будет использоваться для лечения диабета I типа.
Единый стандарт
Время — деньги. В науке это ощущается особенно отчетливо. Поэтому не удивительно, что хороший результат стараются опубликовать как можно быстрее, — иногда даже в ущерб истине. Простота получения ИПСК и актуальность темы открыла возможность работать с ними любому желающему. Это привело к тому, что часто группы, публикующие те или иные результаты работ с ИПСК, характеризуют их по частичным признакам, но не по полным стандартам (что заняло бы на порядок больше времени). В результате, думая, что работают с ИПСК, они публикуют результаты, полученные на клетках неопределенной породы.
Область стволовых клеток до сих пор требует введения стандартов, однозначно определяющих понятие «ИПСК», — так же, как в свое время была введена классификация иммунных клеток по комбинациям поверхностных маркеров. Надеемся, что такие стандарты будут введены в практику в ближайшем будущем.
ИПСК, или как померить IQ у нейронов в чашке Петри?
Исследователи могут создавать специфические для каждого пациента ИПСК для моделирования почти любого заболевания. Однако в некоторых случаях генетическая составляющая еще не является основным признаком болезни. Речь идет о нейродегенеративных заболеваниях. Сегодня создание нейрональных культур для изучения молекулярной биологии болезней — одна из самых спорных областей. Могут ли репрограммированные клетки пациентов с шизофренией или аутизмом быть полезными для изучения закономерностей протекания и лечения заболеваний in vitro? Другими словами, можно ли измерить IQ у нейронов в чашке Петри? Некоторые пытаются доказать, что это возможно, — важно лишь правильно ставить вопросы.
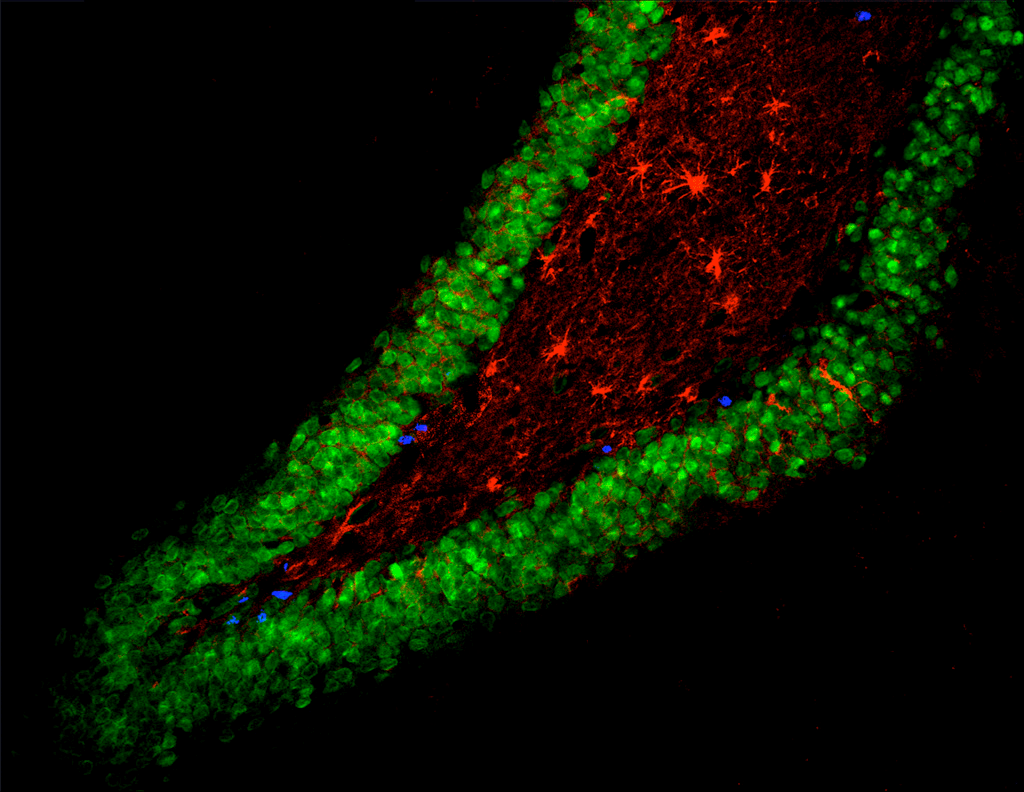
Рисунок 4. Естественные стволовые клетки. Стволовые клетки в небольших количествах присутствуют в тканях постоянно — на этом срезе мозга крысы они делятся, чтобы дать начало астроцитам и зрелым нейронам.
В апреле этого года Фред Гейдж (Fred Gage) из Калифорнии показал, что полученные в результате перепрограммирования нейроны из кожи больных шизофренией могут использоваться для подбора правильного лечения [6]. Чтобы доказать это, с помощью ряда манипуляций in vitro его группе удалось ликвидировать различия в физиологии нормальных нейронов и нейронов больных. Фред считает, что использование ИПСК поможет создать модели и показать, какие генетические факторы лежат в основе развития шизофрении.
Схожие работы проводятся и при изучении старения. Что происходит при старении ткани, и до какой степени это запрограммировано в геноме? Действительно, до этого момента единственной возможностью проверить in vitro влияние того или иного гена, неактивного при определенной болезни, было создание нокаутных линий клеток [13], в которых интересующий ген инактивирован. Как правило, это занимает около года; кроме того, это иллюстрирует эффект от неправильной работы только одного гена, тогда как при многих болезнях меняется экспрессия целых генных семейств. Поэтому нокаутные клетки — модель хоть и достоверная, но с довольно ограниченными возможностями. По сравнению с ней, ИПСК открывают поистине невиданные возможности. Взяв клетки кожи у любого интересующего нас больного и перепрограммировав их в нужный тип клеток, мы можем изучать весь набор генов, нарушенных у конкретного больного. Со временем эти данные достоверно укажут на разницу между патологией и нормой. Это, в конце концов, сможет пролить свет и на основной вопрос генетики: до какой степени болезни, рак и старение запрограммированы внутри нас?
ИПСК несут нам огромные перспективы. Остается дождаться, пока ученые разберутся со снежным комом проблем, с ними связанным, и разработают единую теорию работы с индуцированными стволовыми клетками. Однако избыток проблем — это обычная ситуация в новой науке: первый энтузиазм прошел и сменился реалистическим пониманием того, какие вопросы надо решать в первую очередь, а какие — оставить на потом.
По материалам новостей Nature [14].
Литература
- Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126, 663-676;
- Была клетка простая, стала стволовая;
- Kazutoshi Takahashi, Koji Tanabe, Mari Ohnuki, Megumi Narita, Tomoko Ichisaka, et. al.. (2007). Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872;
- Щадящие стволовые клетки;
- Ilanit Itzhaki, Leonid Maizels, Irit Huber, Limor Zwi-Dantsis, Oren Caspi, et. al.. (2011). Modelling the long QT syndrome with induced pluripotent stem cells. Nature. 471, 225-229;
- Kristen J. Brennand, Anthony Simone, Jessica Jou, Chelsea Gelboin-Burkhart, Ngoc Tran, et. al.. (2011). Modelling schizophrenia using human induced pluripotent stem cells. Nature. 473, 221-225;
- Frederick Anokye-Danso, Chinmay M. Trivedi, Denise Juhr, Mudit Gupta, Zheng Cui, et. al.. (2011). Highly Efficient miRNA-Mediated Reprogramming of Mouse and Human Somatic Cells to Pluripotency. Cell Stem Cell. 8, 376-388;
- K. Kim, A. Doi, B. Wen, K. Ng, R. Zhao, et. al.. (2010). Epigenetic memory in induced pluripotent stem cells. Nature. 467, 285-290;
- Jose M Polo, Susanna Liu, Maria Eugenia Figueroa, Warakorn Kulalert, Sarah Eminli, et. al.. (2010). Cell type of origin influences the molecular and functional properties of mouse induced pluripotent stem cells. Nat Biotechnol. 28, 848-855;
- Ryan Lister, Mattia Pelizzola, Yasuyuki S. Kida, R. David Hawkins, Joseph R. Nery, et. al.. (2011). Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells. Nature. 471, 68-73;
- Christoph Bock, Evangelos Kiskinis, Griet Verstappen, Hongcang Gu, Gabriella Boulting, et. al.. (2011). Reference Maps of Human ES and iPS Cell Variation Enable High-Throughput Characterization of Pluripotent Cell Lines. Cell. 144, 439-452;
- Pengyu Huang, Zhiying He, Shuyi Ji, Huawang Sun, Dao Xiang, et. al.. (2011). Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors. Nature. 475, 386-389;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Erika Check Hayden. (2011). Stem cells: The growing pains of pluripotency. Nature. 473, 272-274.