
Витрификация — контролируемая пауза развития в стеклоподобном состоянии
04 октября 2011
Витрификация — контролируемая пауза развития в стеклоподобном состоянии
- 5129
- 6
- 5
«Приручение холода» методами витрификации дает возможность контроля над онтогенезом преимплантационных эмбрионов и позволяет осуществлять их криоконсервацию и хранение на любой стадии.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Проблема сохранения живых и функциональных клеток вне организма чрезвычайно важна в современной медицине и затрагивает многие ее области, однако наиболее остро данный вопрос встает в центрах экстракорпорального оплодотворения (ЭКО), где необходима криоконсервация не только отдельных клеток — гамет, — но и целого организма — эмбриона на преимплантационной стадии развития. Наиболее перспективным и интенсивно развивающимся направлением в криоэмбриологии сейчас является витрификация, которая постепенно вытесняет традиционно используемое медленное замораживание.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Зачастую именно благодаря применению витрификации удается значительно повысить шансы наступления беременности, упростить схему лечения бесплодия и подарить счастливой супружеской паре долгожданного здорового ребенка. В данном обзоре проведено обобщение теоретических аспектов витрификации гамет и эмбрионов, отдельно обсуждены физические процессы, лежащие в его основе, что позволит ответить на вопросы относительно предпочтительной и более безопасной методики криоконсервации, устранить многие ошибки, предотвратить возникающие тупиковые и безосновательные споры, ведущие в итоге к снижению результативности методики .
Подробнее об ЭКО на «биомолекуле»: «“За экстракорпоральное оплодотворение” — это не тост, а Нобелевская премия!» [13]. — Ред.
Глубокая заморозка: жизнь коротка — притормози!
Процесс индивидуального развития организма — онтогенез — начинается с момента оплодотворения и заканчивается его смертью. И, как известно, этот процесс непрерывен во времени и носит необратимый характер. И как бы нам не хотелось, мы не можем его остановить или замедлить. Однако существуют и исключения: так, например, многие растения и беспозвоночные животные, а также некоторые примитивные позвоночные с наступлением отрицательных температур перестают проявлять свойства, характерные для живых систем. В этот период их существования практически полностью останавливаются процессы обмена веществ, возобновляющиеся с повышением температуры. Такой своеобразный период покоя получил название анабиоз, — то есть, в буквальном смысле, — отсутствие жизни. Многие живые организмы Сибири способны переносить понижение температуры до −90 °С и практически полную дегидратацию. При наблюдении этой паузы онтогенеза в природе закономерно возникает вопрос о возможности применения низких температур для временной и обратимой остановки жизнедеятельности высших позвоночных, в том числе и человека. Данной проблематикой занимается наука, получившая название криобиология. Еще в 1776 году Спаланцани были предприняты первые попытки сохранения ценных клеток человека (сперматозоидов) с использованием низких температур.
В настоящее время разработаны различные протоколы криоконсервации эмбрионов человека на различных стадиях развития: на стадии зиготы — формирования пронуклеусов, в период дробления и на стадии бластоцисты [1]. Эти методики несколько различаются в связи с различной проницаемостью клеток эмбриона на различных этапах развития для криопротекторов, но принципиальные подходы к криоконсервации биологических объектов остаются одинаковыми .
О криопротекторах на «биомолекуле»: «Установлен механизм действия „белков-антифризов“» [14]. — Ред.
Осуществляемые в центрах ЭКО процедуры лечения бесплодия немыслимы без процедуры криоконсервации, позволяющей сохранить эмбрионы и гаметы (в том числе, у пациентов, проходящих лечение рака или имеющих другие риски приобретения бесплодия), транспортировать биологический материал на любые расстояния, избежать многоплодной беременности, добиться беременности без дополнительной стимуляции, осуществлять программы донорства гамет и эмбрионов, создавать накопительные индивидуальные банки спермы для пациентов со значительной патологией эякулята [2]. Все это значительно увеличивает результативность процедуры ЭКО, сокращает ее стоимость и затрачиваемое время, что дает возможность оказать помощь большему количеству людей, желающих иметь ребенка [3].
Применение нового подхода к сверхбыстрому замораживанию — витрификации (достижения жидкостью стеклоподобного состояния без кристаллизации при сверхбыстром охлаждении) — позволяет добиться значительных успехов в криоконсервации гамет, эмбрионов и фрагментов тканей, что позволяет повысить результативность лечения бесплодия.
Но... не все так просто
Однако, главное, чего следует опасаться, подвергая эмбрионы криоконсервации, — чтобы данная пауза в их жизни, определяемая временем хранения, не была остановкой перед смертью. Иными словами, необходимо добиться максимальной сохранности замороженных клеток для полноценного функционирования после размораживания. Что же мешает использовать методы глубокого замораживания живых клеток и тканей тотально в медицине, и почему только сравнительно недавно стало возможным применять данный подход для эмбрионов? Дело в том, что процесс криоконсервации плохо переносится живыми клетками, ведь оптимумом их биологической активности являются температуры, лежащие в пределах 25–37 °C. Как известно, с понижением температуры замедляются процессы обмена веществ. При понижении температуры на 10 градусов скорость обмена веществ замедляется примерно в два раза, поэтому при температурах 20..−10 °C клетки переходят в состояние неполного анабиоза, характеризующееся сильным замедлением обменных процессов, уплотнением упаковки их мембран и переохлаждением клеток без формирования кристаллов льда. Так как содержимое клетки отлично от чистой воды, то и температура кристаллизации содержимого клеток (т.е. замерзания) отлична от нуля и сдвинута в сторону отрицательных температур. Другими словами, раствор солей и белков внутри клетки препятствует ее замерзанию при 0 °С и, подобно солевому раствору на улицах города зимой, превращающего снег и лед в грязь, поддерживает жидкое состояние цитоплазмы клеток. Естественно, такая «буферная» способность солей не безгранична, и с понижением температуры до −37 °С начинается кристаллизация внеклеточной, а затем и внутриклеточной воды (−80 °С) и переход клетки в состояние полного анабиоза. До −130 °C продолжается кристаллизация воды, и начинается кристаллизация адсорбированной воды (образующей тонкий слой около больших молекул (таких как белки) и представляющей собой сложноструктурированную воду с компактной упаковкой молекул, близкой к таковому в гелях). При дальнейшем понижении температуры образование кристаллов льда уже не происходит, и вода замерзает аморфной стеклоподобной массой.
Какие же основные факторы, кроме резкого снижения обмена веществ, препятствуют сохранности биологических объектов при замораживании?
- Образование кристаллов льда внутри клеток — пожалуй, самый важный повреждающий фактор при криоконсервации. Вода обладает свойством расширяться при замерзании: при образовании кристаллов льда их объем будет больше, чем у исходной жидкости. В связи с этим образовавшийся лед необратимо повредит клеточные структуры, и клетка погибнет. Даже небольшие кристаллики льда необратимо повреждают внутриклеточные структуры (ядро, митохондрии, аппарат Гольджи, эндоплазматическую сеть), без целостности которых, даже при сохранении цитоплазматической мембраны самой клетки, ее жизнедеятельность невозможна. Наибольшая вероятность формирования кристаллов внутри клеток возникает при их неконтролируемом замораживании.
- Образование кристаллов льда вне клеток на первый взгляд не столь критично, как образование внутриклеточного льда, однако реально это также приводит к гибели клеток за счет обезвоживания. В процессе заморозки образуются кристаллы льда, и за счет этого уменьшается количество свободной воды, способной взаимодействовать с электролитами раствора. Это приводит к увеличению концентрации растворенных веществ во внеклеточном пространстве (раствор становится гипертоническим по отношению к внутриклеточной среде), а также изменению pH. Соответственно, нарастает осмотическое давление, и начинает увеличиваться поток воды, выходящей из клетки, что приводит к уменьшению количества воды внутри клетки и, как следствие, к нарушению структуры белков. Чем ниже температура, тем больше воды вне клетки превратится в лед, а значит меньше свободной воды остается вне клеток, и чем сильнее клетки обезвоживаются, тем больше повреждаются их структуры, и тем меньше шансов остается на восстановление их функциональности после размораживания. Образование внеклеточного льда наиболее интенсивно при очень медленной скорости заморозки [4].
- Перегрев клеток в момент фазового перехода вода/лед — как ни парадоксально, в процессе заморозки клетки могут погибнуть от перегрева. При фазовом переходе внеклеточной воды из жидкого состояния в лед, обладающий значительно меньшей энтропией (твердое вещество) по сравнению с жидкостью, выделяется избыточное тепло, что может привести к необратимому повреждению клеток. Для предотвращения гибели клеток от перегрева их очень быстро охлаждают около точки фазового перехода — при температуре охлажденной жидкости, равной температуре начала кристаллизации раствора (сидинг), запуская формирование кристаллов льда.
- Фазовые переходы в липидном бислое мембран. В процессе медленного охлаждения при температуре около 0 °С наблюдаются сильные изменения структуры плазматической мембраны — резко уменьшается ее текучесть и повышается вязкость и, как следствие, изменяется проницаемость мембраны для ионов, что приводит к сдвигу pH. Прекращается работа Na+-каналов, а это приводит к накоплению ионов Na+ внутри клетки, а вместе с ними и воды. В результате клетка сильно разбухает, что может привезти к ее лизису.
- Холодовой шок — до конца необъясненное явление внезапной гибели клеток при низких температурах.
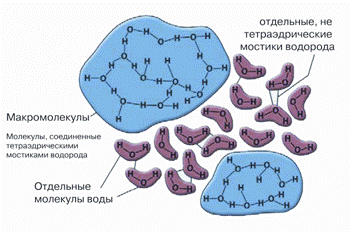
Рисунок 1. Образование кластера воды. Самопроизвольно возникающее повышение степени организации молекул жидкости — будущий центр кристаллизации при охлаждении раствора.
Однако, в большинстве случаев, процесс замораживания не убивает клетки. Наибольшие их потери происходят при размораживании. В первую очередь это связано с формированием кристаллов внутриклеточного льда, повреждающих клетку при перекристаллизации. Кристаллообразование включает два процесса: 1) формирование центров кристаллизации и 2) рост кристаллов. В процессе замораживания раствор проходит несколько критических состояний, каждому из которых соответствует определенный минимальный размер кристалла, при котором начинается его спонтанный рост. Кристаллы размером меньше критического для данных условий не могут расти и будут спонтанно растворяться. Таким образом, для превращения воды в лед необходимо формирование критического размера кристалла льда. Для кристаллизации воды был установлен его размер: 460–470 молекул с объемом 15,7 нм3, что соответствует сфере радиусом 1,56 нм. Образование и рост кристаллов льда хорошо описывается кластерной моделью структуры воды, предложенной X. Фрэнком и В. Уэном в 1957 г., согласно которой в жидкой воде постоянно появляются и распадаются кластеры (относительно устойчивые ассоциаты) молекул. Чем ниже температура, тем больше молекул воды входит в состав одного кластера. Таким образом, еще до формирования структуры льда в воде существуют структурно устойчивые льдоподобные образования, которые, достигая критического размера, запускают рост кристаллов льда (рис. 1).
Для возникновения крупных кластеров необходим центр кристаллизации — любой маленький объект или неоднородность в структуре воды (пузырек воздуха, пыль, кристалл другого вещества и т.п.). В отсутствии центров кристаллизации вода не замерзнет и не станет льдом, а будет прибывать в состоянии переохлажденной жидкости. Но, как только в такой жидкости образуются центры кристаллизации, она мгновенно перейдет в твердое состояние. Формирование центров кристаллизации наиболее активно происходит при температурах, близких к −40 °С. Такие температурные условия наиболее благоприятны для запуска процесса кристаллизации воды. Однако рост кристаллов льда интенсивней всего происходит при более высоких температурах: −2..−10 °C. Напротив, при −30 °С скорость роста кристаллов воды достаточно мала. Таким образом, проводя замораживание и постепенно охлаждая образец ниже 0 °С, мы вначале имеем мало центров кристаллизации и благоприятные условия для роста кристаллов (рис. 2). Таким образом, увеличивая скорость охлаждения, мы легко проходим оптимум температуры роста кристаллов без повреждения клеток. Дальнейшее охлаждение приводит к тому, что условия для роста кристаллов льда становятся неблагоприятными, и поэтому они (кристаллы) практически не образуются. В то же время возникает множество центров кристаллизации, которые пока никак не сказываются на жизнеспособности клетки.
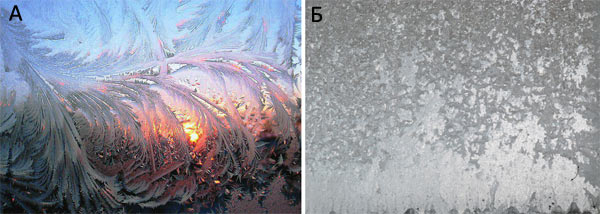
Рисунок 2. Рост кристаллов льда на стеклах трамвая или автобуса зимой. А — При небольшом морозе, когда трамвай выходит на маршрут из теплого депо, на его стеклах образуются причудливые и очень красивые узоры из огромных кристаллов льда — мало центров кристаллизации, но идеальные условия для роста кристаллов. Б — При сильном морозе стекла становятся матовыми — без узоров мороза, и, присмотревшись, мы сможем различить множество очень мелких кристалликов на них: есть множество центров кристаллизации, но условия роста кристаллов льда не подходящие.
Однако ситуация резко меняется при размораживании. Связано это со следующими особенностями: вначале, увеличивая температуру, мы снова проходим температуру, наиболее благоприятную для формирования центров кристаллизации (−40 °С), а затем, продолжая нагревание, приближаемся к оптимуму роста кристаллов (−10..−2 °C), и получаем лавинообразное образование кристаллов льда, интенсивно растущих и разрывающих клетки. Поэтому процесс размораживания требует максимально быстрого повышения температуры, что снижает вероятность роста кристаллов льда внутри клеток. Наиболее часто используемые методы размораживания — это погружение образца в теплую водяную баню и сверхвысокочастотное (СВЧ) электромагнитное нагревание. Кроме того, при плавлении внеклеточного льда в процессе размораживания возникает избыток свободной воды и, как следствие, резкое снижение осмолярности раствора, что может привести к гипотоническому шоку клеток [5].
Таким образом, процесс замораживания/размораживания клеток будет тем эффективнее, чем больше факторов риска удастся минимизировать. Для предотвращения образования кристаллов льда, губительно воздействующих на клетки, применяют разнообразные вещества с относительно низкими температурами замерзания — криоптротекторы.
Спасатели ото льда — криопротекторы
Криопротекторы — это вещества, способные снизить повреждающее действие физико-химических факторов при криоконсервации (рис. 3). Криопротекторы разделяют на проникающие (низкомолекулярные вещества с молекулярной массой менее 300 Да: метилформамид, пропандиол, глицерин, этиленгликоль, метанол, сахароза, трегалоза, диметилсульфосид, 2-метил-2,4-пентандиол) и непроникающие (высокомолекулярные веещства: некоторые белки, фикол, поливинилпиралидон, полиэтиленоксид, гидроксиэтилкрахмал, поливинилальдегид, полиэтиленгликоль желток куриного яйца, многие олигосахариды и др.).

Рисунок 3. Защитное действие криопротекторов. При отсутствии криопротектора в растворе, охлажденном ниже точки его замерзания, уже через минуту формируются кристаллы льда (верхний ряд), которые, несмотря на свою привлекательность, губительны для клеток. Напротив, при добавлении криопротекторов происходит подавление роста кристаллов в растворе (нижний ряд).
Соответственно, проникающие криопротекторы способны попасть внутрь клетки и препятствовать формированию кристаллов льда за счет формирования водородных связей с молекулами воды. Они сами замещают воду, что препятствует криодеструкции биологически важных макромолекул, и связывают некоторое количество свободной воды (что уменьшает общую дегидратацию клеток). Кроме того, проникающие криопротекторы образуют водородные связи с макромолекулами клетки, что стабилизирует их структуру [6]. Проникновение низкомолекулярных криопротекторов внутрь клетки осуществляется либо путем диффузии, либо, как было показано для глицерина, через специальные белковые каналы — аквапорины.
Непроникающие криопротекторы не могут пройти через цитоплазматическую мембрану и препятствуют осмотическим перепадам при замораживании и росту кристаллов внеклеточного льда. Также непроникающие криопротекторы позволяют снизить концентрацию проникающих, часто оказывающих токсическое влияние на клетку. Отмечено защитное действие непроникающих криопротекторв на фософолипидный компонент плазматической мембраны [7], [8], однако полностью защитное действие непроникающих криопротекторов не объяснено.
Для реализации своей функции — защиты клетки от повреждающего воздействия замораживания / размораживания — проникающим криопротекторам необходимо некоторое время для насыщения клетки. То есть биологический образец должен быть уравновешен с раствором проникающего криопротектора непосредственно перед заморозкой. Очевидно, что чем больше крипоротектора будет внутри клетки, тем эффективнее будет ее защита от кристаллов льда, однако большинство криопротекторов достаточно токсичны. Наибольшим токсическим эффектом обладают проникающие криопротекторы, поскольку они образуют неспецифические водородные связи не только с водой (защищая клетку от деструктивного действия кристаллов льда), но и с жизненно важными макромолекулами клетки (ДНК, РНК, ферментные системы), что приводит к нарушению их функционирования. Поэтому необходимо подбирать индивидуальные параметры насыщения того или иного типа клеток на разных стадиях развития растворами криопротекторов, варьируя их концентрацию и время экспозиции.
Наиболее эффективно использование комбинации проникающих и непроникающих криопротекторов: это значительно снижает токсичность раствора для криоконсервации. В качестве проникающих криопротекторов могут быть использованы дисахариды [9] или этиленгликоль, всего 11–15% которого в присутствии непроникающих криопротекторов позволяет и при небольших скоростях охлаждения добиться витрификации [10].
Так быстро, как только можно — жизнь в «стекле»
Витрификацию можно рассматривать как фазовый переход, в котором переохлажденный раствор при охлаждении ниже температуры стеклования (Tg), оставаясь аморфным, приобретает структуру стекла и свойства, аналогичные кристаллическим твердым телам. Удивительно, но и живые клетки, и даже целые эмбрионы можно таким образом превратить в «стекло». Стеклоподобное состояние жидкости при витрификации достигается за счет ее очень быстрого охлаждения — когда энтропия жидкости понижается быстрее, чем энтропия соответствующего кристаллического состояния. То есть, жидкость просто не успевает замерзать, когда ее энтропия приближается к энтропии кристалла. Однако, чтобы витрифицировать живую клетку, необходимо достижение скорости падения температур ≈108 °C/мин, что на практике является неосуществимой задачей, так как используемые криогенные жидкости имеют недостаточную для этого температуру, и невозможно использование объема витрифицируемого раствора меньше, чем объем ооцита или эмбриона.
Бругеллер и Майер показали, что добавление в среду для замораживания криопротекторов позволяет резко снизить скорость замораживания. Так, уже при концентрации 10% этиленгликоля и пропиленгликоля скорость замораживания можно снизить на порядок, при концентрации 40% этих веществ витрификация становится возможной при скорости охлаждения 103 °C/мин, а при концентрации 60% возможно ее снижение до 50 °С/мин. Но с увеличением концентрации криопротекторов, вносимых в среду, увеличивается и их негативное влияние на клетки, подвергаемые замораживанию. Медленное замораживание, по сути, также приводит к накоплению переохлажденной воды в биологическом объекте с последующей витрификацией внутриклеточного компонента, только достигается это состояние за счет сильной дегидратации клеток при образовании внеклеточного льда (рис. 4).

Рисунок 4. Быстро или медленно? Сравнение стратегий медленного замораживания, где необходимая концентрация криопротекторов достигается при постепенно контролируемом падении температуры среды с эмбрионами и ультрабыстрого снижения температуры при изначально высоком содержании в среде криопротекторов, приводящее к витрификации образца. То, как быстро изображенные на фото пингвины окажутся в водах океана, наглядно характеризует время, в течение которого криоконсервируемый образец подвергается охлаждению.
Таким образом, при достижении такого стеклоподобного состояния останавливаются процессы химической и физической деградации объекта [11]. Несмотря на достаточно сложный физический механизм процесса витрификации, вещества в таком состоянии зачастую встречаются и в нашей повседневной жизни — это собственно стекло, сладкая вата, некоторые виды силикона и множество других.
Другим способом резкого понижения температуры образца является возможность охлаждения гамет и эмбрионов при температурах более низких, чем температура жидкого азота. Самый холодный газ в жидком состоянии — это гелий (его температура кипения всего 4,2 К), и, естественно, охлаждение в нем будет наиболее эффективным. Но такие газы чрезвычайно трудно поддерживать в сжиженном состоянии, а сверхтекучесть гелия и его практически полная прозрачность делают любые манипуляции в нем практически невозможными. Поэтому был разработан метод криоконсервирования в не кипящем жидком азоте, температуру которого удается понизить до −220 °C. Этот эффект достижим при понижении давления, что приводит к понижению температуры кипения жидкости. При возвращении нормального давления непосредственно перед витрификацией материала азот не успевает нагреться и закипеть, что создает возможность замораживания в переохлажденном жидком азоте, — то есть, с большей скоростью охлаждения.
Однако определить необходимое количество криопротектора, которое нужно добавить в среду для эффективной витрификации эмбрионов, оказалось непростой задачей. Так как все процессы заморозки и оттаивания образца при витрификации происходят с очень большими скоростями за чрезвычайно малые промежутки времени и в объемах среды, не превышающих 3 мкл, отсутствуют возможность наблюдения за температурой образца или среды при помощи термометров и визуальный контроль изменения агрегатного состояния раствора. Поэтому описать кинетику процесса витрификации эмбрионов возможно лишь математически. Мазур вывел системы уравнений, которые позволяют высчитывать оптимальные схемы заморозки живых клеток, предотвращающие формирование кристаллов льда. Также данные уравнения позволяют оценить вероятность образования внутриклеточного льда при замораживании при температуре выше точки равновесия. Согласно этим теоретическим данным, маленькие объекты (такие как сперматозоиды или соматические клетки) могут быть витрифицированы вообще без добавления криопротекторов в объемах сред до 3 мкл с использованием открытых систем витрификации, где замораживаемый образец непосредственно контактирует с жидким азотом, или же витрифицированы в достаточно больших объемах среды с 10% содержанием криопротекторов и сравнительно низкими скоростями охлаждения (<3000 °C/мин). Другие же большие, более обводненные клетки (такие как ооциты и преимплантационные эмбрионы), безусловно, нуждаются в добавлении криопротекторов (рис. 5).
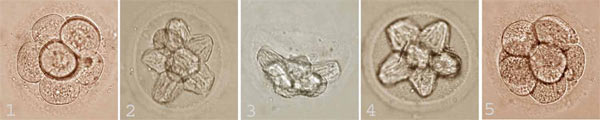
Рисунок 5. Фотографии эмбрионов человека, полученные на различных этапах витрификации. 1 — эмбрион до криоконсервации; 2 — криопротекторы почти полностью заместили собой воду в эмбрионе, что видно по его клеткам, сжавшимся в гипертооническом растворе; 3 — так выглядит эмбрион при температуре жидкого азота (−196 °C) — его клетки еще сильнее обезвожены, но живы: концентрация криопротекторов максимальна; 4 — восстановление объема клеток при оттаивании эмбриона в среде для отмывки без криопротекторов; 5 — восстановление размера клеток эмбриона за счет полного выхода из них криопротекторов.
Таким образом, процесс витрификации реально достижим для эмбрионов и гамет. Конечно, существует множество нюансов в витрификации эмбрионов на различных этапах развития in vitro в условиях ЭКО-лаборатории, но, что необходимо понимать прежде всего, — это то, что витрификация не является абсолютно новым методом криоконсервации биологического материала, а представляет собой лишь последний этап традиционного медленного замораживания. Благодаря трудам множества исследователей и клиницистов центров ВРТ, стало возможно осуществлять витрификацию не слепым методом с применением дорогостоящего программируемого замораживателя, а с использованием простейших приспособлений под полным контролем оператора, что позволяет значительно упростить методику и вместе с этим повысить ее результативность.
Однако, несмотря на значительные успехи в криоконсервации преимплантационных эмбрионов, все еще невозможна реализация идеи адекватного хранения органов или значительных объемов ткани при сверхнизких температурах. Вне зависимости от используемых методов и скоростей замораживания так же невозможно криоконсервировать, а затем вернуть к жизни целый организм человека, и поэтому следует относиться скептически к организациям, заявляющим о возможности «продления» жизни при помощи крионики. Понимание физических основ витрификации, очень кратко описанных в данной статье, полностью противоречит рекламным компаниям предприятий, заявляющих о применении крионики к человеку, а также позволит развеять ряд мифов и избежать предрассудков как в планировании экспериментальных работ, связанных с криобиологией, так и в клинической практике центров ЭКО.
Литература
- Vladimir Isachenko, Jose Luis Alabart, Maria Dattena, Frank Nawroth, Pietro Cappai, et. al.. (2003). New technology for vitrification and field (microscope-free) warming and transfer of small ruminant embryos. Theriogenology. 59, 1209-1218;
- Tucker M.J. and Liebermann J. Vitrification in ART. Informa UK Ltd, 2007. — 322 p.;
- Elkin Lucena, Diana Patricia Bernal, Carolina Lucena, Alejandro Rojas, Abby Moran, Andrés Lucena. (2006). Successful ongoing pregnancies after vitrification of oocytes. Fertility and Sterility. 85, 108-111;
- V. Isachenko. (2004). Developmental rate and ultrastructure of vitrified human pronuclear oocytes after step-wise versus direct rehydration. Human Reproduction. 19, 660-665;
- Gardner D.K., Weissman A., Howles C.M., Shoham Z. Textbook of Assisted Reproductive Technologies laboratory and clinical perspectives. Informa UK Ltd, 2009. — 944 p.;
- L.L. Kuleshova, D.R. MacFarlane, A.O. Trounson, J.M. Shaw. (1999). Sugars Exert a Major Influence on the Vitrification Properties of Ethylene Glycol-Based Solutions and Have Low Toxicity to Embryos and Oocytes. Cryobiology. 38, 119-130;
- Marcos Ariel Villarreal, Sonia B. Díaz, E. Aníbal Disalvo, Guillermo G. Montich. (2004). Molecular Dynamics Simulation Study of the Interaction of Trehalose with Lipid Membranes. Langmuir. 20, 7844-7851;
- Alex Patist, Hans Zoerb. (2005). Preservation mechanisms of trehalose in food and biosystems. Colloids and Surfaces B: Biointerfaces. 40, 107-113;
- Pierre Boutron, Jean-François Peyridieu. (1994). Reduction in Toxicity for Red Blood Cells in Buffered Solutions Containing High Concentrations of 2,3-Butanediol by Trehalose, Sucrose, Sorbitol, or Mannitol. Cryobiology. 31, 367-373;
- L.L. Kuleshova, J.M. Shaw, A.O. Trounson. (2001). Studies on Replacing Most of the Penetrating Cryoprotectant by Polymers for Embryo Cryopreservation. Cryobiology. 43, 21-31;
- W. F. Rall, G. M. Fahy. (1985). Ice-free cryopreservation of mouse embryos at −196 °C by vitrification. Nature. 313, 573-575;
- Peter Brüggeller, Erwin Mayer. (1980). Complete vitrification in pure liquid water and dilute aqueous solutions. Nature. 288, 569-571;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- Установлен механизм действия «белков-антифризов».







