Пептид 2A: два в одном
26 октября 2011
Пептид 2A: два в одном
- 1643
- 2
- 2
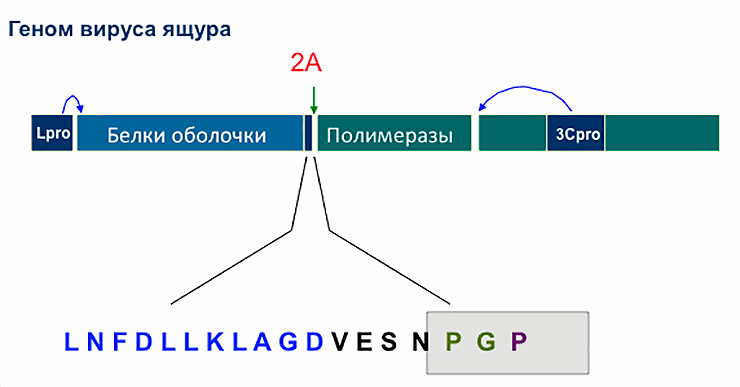
Схема генома вируса ящура, а также расположение и аминокислотная последовательность пептида 2A. На правом конце 2A в вирусном белке находится сайт первичного процессинга (разделения длинного полипептида вируса на более короткие молекулы). Пептид 2A, в отличие от «настоящих» протеаз Lpro и 3Cpro, также фрагментирующих первичный полипептид (показано пробелами), работает только во время белкового синтеза, прямо внутри рибосомы.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В статье рассказывается о механизме действия пептида 2A из вируса ящура, при вставке генетической последовательности которого между последовательностями двух других белков, в любой эукариотической клетке произойдет разделение синтезируемой белковой цепочки на две — прямо во время синтеза полипептида внутри рибосомы. Это свойство 2A применяется в биотехнологии для получения нескольких белков с одной РНК. В наших экспериментах показано, что в таком «расщеплении» принимают участие факторы терминации трансляции.
Конкурс «био/мол/текст»-2011
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2011.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2011.
Скачет зайка по лужайке:
Прыг да скок, прыг да скок,
Ну, а клетка в это время
Синтезирует белок.
Биотеатр Белгосуниверситета
Биосинтез белка
В общих чертах, синтез белка происходит одинаково во всех живых клетках, начиная от бактерий и заканчивая человеком. Для начала нужна инструкция, молекула РНК.
Малая субъединица рибосомы — молекулярной машины для синтеза белка — соединяется с большой субъединицей на стартовой тройке нуклеотидов информационной, или матричной РНК (мРНК) — кодоне AUG. Синтез происходит на интерфейсе между большой и малой субъединицами, где протянута нитка мРНК (рис. 1).
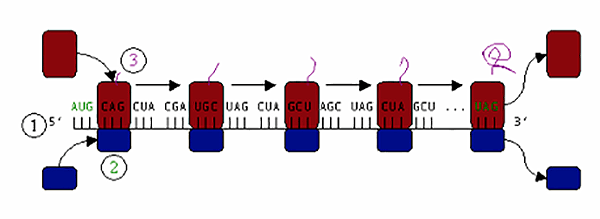
Рисунок 1. Схема синтеза белка. Малая субъединица рибосомы (2) присоединяется к большой (3) и начинает синтез белка (растущая фиолетовая линия) с кодона AUG (1). На стоп-кодоне UAG факторы терминации гидролизуют последнюю тРНК, белок высвобождается, субъединицы разъединяются.
Первая транспортная РНК (тРНК), к которой присоединена аминокислота метионин, узнав «свои» три нуклеотида (кодон) на мРНК, присоединяется к А-сайту рибосомы (рис. 2). Вторая тРНК узнает следующий кодон, который находится в Р-сайте рибосомы, и рибосома катализирует образование пептидной связи между двумя аминокислотами, находящимися «по соседству». После этого рибосома сдвигается на один кодон, первая тРНК отсоединяется от рибосомы, следующая тРНК с присоединенной к ней аминокислотой узнает следующий кодон и присоединяется к Р-сайту. И так далее — быстро, четко, с несколькими проверками качества, которые позволяют убедиться, что правильная аминокислота будет в правильном месте, и что белок будет работать.
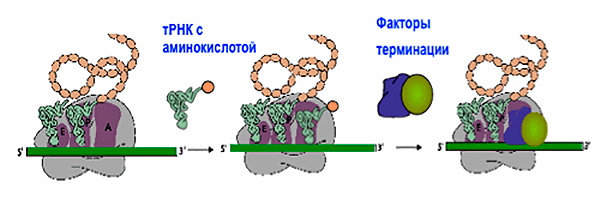
Рисунок 2. Схематическое строение рибосомы и ее «рабочий цикл». Рибосома пошагово синтезирует белок, пока не доходит стоп-кодона, когда вместо тРНК в А-сайт присоединяются факторы терминации, катализирующие расщепление связи между белком и последней тРНК.
Синтезируемая цепочка аминокислот направляется в рибосомальный тоннель в большой субъединице, словно нитка через игольное ушкó. До того, как вновь синтезированный полипептид выйдет за пределы рибосомы во внутреннее пространство клетки, полипептидная цепочка будет в длину минимум 30 аминокислот. Белок удлиняется до тех пор, пока в конце мРНК рибосома не встретит кодон, который не узнаёт ни одна тРНК — стоп-кодон. Как титры «The End» означают конец фильма, так и стоп-кодон означает конец синтеза белка.
Процесс прекращения синтеза белка, или терминации, как это ни странно, устроен проще у высших организмов, чем у бактерий. И у человека, и у братьев наших меньших — дрожжей — прекращение синтеза белка зависит от двух белков — факторов терминации 1 (ФТ1) и 3 (ФТ3) (ФТ2 у высших организмов отсутствует — история биологии, как любая история, штука нелогичная). По форме напоминающий букву Г, ФТ1 похож на тРНК. В основании «Г» расположены аминокислоты, которые узнают стоп-кодон, горизонтальная ручка «Г» участвует в гидролизе полипетидной цепочки, освобождая её от последней тРНК. В то время, как ФТ1 служит катализатором, ФТ3 поставляет энергию для гидролиза. Ошибочная терминация, когда факторы терминации присоединяются в середине белка, происходит крайне редко — один раз на один миллион присоединённых аминокислот.
Пептид из вируса рогов и копыт
Этой системой пользуются не только живые организмы, но и нечто не совсем живое — вирусы. Вирусы используют аппарат синтеза белка клетки, которую они заразили, для производства своих белков. Однако они, как и вирусы в компьютере, заставляют рибосомы выпускать несвойственную им продукцию.
Пожалуй, один из самых известных вирусов — вирус ящура, который заражает крупный рогатый скот и человека. Эпидемия ящура в 2007 году нанесла многомиллиардный ущерб британской экономике, а такие эпидемии случаются регулярно.
«Программа» вируса ящура заключена в длинной (около 6 тысяч нуклеотидов) молекуле РНК [1]. Поскольку белки вируса ящура считываются с этой молекулы в виде единого полипептида, который потом разделяется на более короткие фрагменты протеазами, «геном» называется последовательность, которая кодирует белок с самостоятельными функциями. С РНК сначала считываются белки оболочки вируса, потом протеазы, а затем вирусные полимеразы, которые скопируют РНК вируса и с этих копий синтезируют много копий вирусного генома. РНК вируса можно представить в виде телеграммы, которая начинается со «здравствуйте» (одного стартового кодона) и где пропущены слова «ЗПТ» или «ТЧК» — между генами отдельных белков.
Я расскажу о небольшом — в 20 аминокислот — пептиде, который называется 2A.
«Ген» 2A расположен между генами белков оболочки и полимеразами. 20 аминокислот, составляющие 2A, на первый взгляд, не играют никакой роли в воспроизводстве вируса. 2A не участвует в образовании белковой оболочки вирусных частиц и не попадает внутрь ее. Не принимает он участия и в образовании копий нуклеиновой кислоты. Однако у этих 20 аминокислот есть уникальное свойство.
Если ген, кодирующий 2A, вставить в середине какого-либо гена или между двумя генами любых белков, синтезировать соответствующую мРНК и поместить её в любую клетку с ядром или полученный из неё клеточный экстракт, рибосомы этой клетки начинают выпускать довольно странную продукцию. Это будет не один белок с лишними 20 аминокислотами в середине, как это произошло бы с любыми другими 20 аминокислотами, а два отдельных белка. Первый будет оканчиваться 19-ю аминокислотами от 2A справа (на C-конце), а второй всегда будет начинаться с пролина — последней (20-й) аминокислоты 2A (рис. 3).
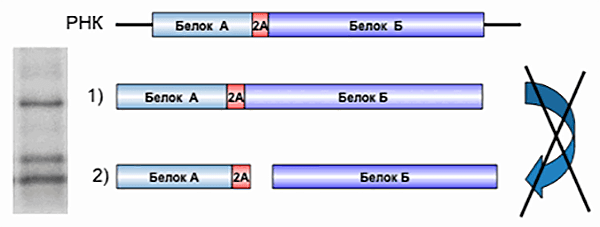
Рисунок 3. Схематическое действие 2A на синтез белка. «Нормальный синтез» — с одной РНК считывается она полипетидная цепь. При синтезе белков вируса ящура, когда 2A наиболее эффективен, этот продукт не образуется, но при использовании ровно 20 аминокислот этот продукт можно увидеть. 2) Образуется два независимых белка, причем 2A прикреплен к С-концу первого. Продукт «нормального синтеза» никогда не превращается в два независимых полипептида (то есть, это не автокаталитическое расщепление).
Механизм
Если синтезировать короткий белок с 2A в середине искусственно, с помощью химического синтеза, он никогда не распадается на две части и не разрезает другие белки. Это показывает, что 2A не является ферментом-протеазой, который режет полипетидные цепочки, в том числе и собственную . Каким же образом 2A вызывает образование двух белков там, где ДНК, а затем и РНК кодирует один?
А ведь белки способны на самомодификацию — не только «саморазрезание», но и «самовырезание» фрагментов из середины: «Белки против РНК — кто первым придумал сплайсинг?» [5]. — Ред.
Первый намек на механизм действия 2A был получен в экспериментах на пекарских дрожжах — тех самых, которые производят хлеб, вино и пиво [2]. Кроме этой полезной деятельности, дрожжи используются во многих молекулярно-биологических экспериментах, поскольку, как и человеческие клетки, содержат ядро, и многие процессы в них протекают сходно. В то же время, дрожжи растут на более простых, а значит, более дешёвых средах, делятся гораздо быстрее человеческих клеток, и существуют масса возможностей генетических манипуляций с ними.
Одна из клеточных органелл, которые есть и у дрожжей, и у человека — эндоплазматический ретикулум (ЭР). Он состоит из окруженной двуслойной липидной мембраной сети каналов, по которым транспортируются различные вещества.
Белки, которые будут транспортироваться по ЭР, синтезируются рибосомами, прикрепляющимися к ЭР со стороны цитоплазмы через белок-рецептор. При этом синтезируемый белок из рибосомального тоннеля сразу поступает внутрь канала ЭР. Это свойство рибосом было использовано для проверки, не разрезает ли белки, содержащие 2A, какая-нибудь клеточная протеаза, потому что к белку, синтезируемому прикрепленной к ЭР рибосомой, у протеазы доступа нет.
Молекулы ДНК, содержащие модифицированные гены зеленого флуоресцентного белка (ЗФБ), дрожжевого преальфафактора (ПАФ) и 2A были трансформированы в клетки дрожжей (рис. 4). ПАФ имеет сигнальную последовательность, которая вызывает его транспорт в ЭР и при присоединении к любому белку продолжает действовать так же. ЗФБ, мало того, что является стандартным экспериментальным белком в клеточной биологии, так ещё и светится, и его можно увидеть в ЭР клеток дрожжей под микроскопом .
Смотри также: «Флуоресцирующая Нобелевская премия по химии» [6]. — Ред.
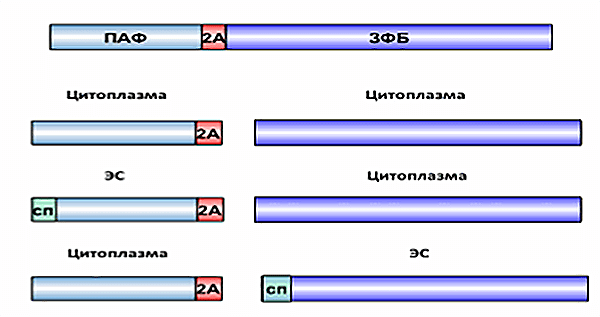
Рисунок 4. Схема действия 2A при транспорте белков. Сигнальная последовательность на N-конце белка вызывает транспорт первого, но не второго белка в эндоплазматическую сеть. Условные обозначения: СП — сигнальная последовательность; ПАФ — проальфафактор; ЗФБ — зеленый флуоресцентный белок.
Если сигнальная последовательность, которая должна вызывать транспорт белка в эндоплазматическую сеть, была на первом гене, первый белок с прикрепленным к нему 2A транспортировался в ЭР, а второй белок оставался в цитоплазме. Если только второй белок содержал сигнальную последовательность, в ЭР транспортировался только он. Это означает, что:
- Поскольку цитоплазматические протеазы не имеют доступа внутрь рибосомы, реакция, приписываемая 2A, не имеет к этим протеазам отношения;
- Рибосома определяет конец синтеза первой части белка как конец синтеза белка вообще и отсоединяется от белка-рецептора.
Следующим этапом исследования механизма действия 2A был поиск клеточных белков, которые принимают участие в реакции. Как сказал предтеча «C.S.I.: Место преступления» Шерлок Холмс: «Если отбросить невозможное, то всё, что останется, каким бы невероятным оно не казалось, должно быть истиной». Участие факторов терминации в гидролизе тРНК на смысловом кодоне было маловероятно, поскольку разделение белков, вызываемое 2A, происходит с вероятностью, близкой к единице, в то время как вероятность терминации на любом смысловом кодоне — около 10−6. Однако мы решили проверить эту возможность.
Для проверки вероятного участия факторов теминации в реакции, вызываемой 2A, уже упоминавшийся ген-«склейка» ПАФ—2A—ЗФБ экспрессировали в дрожжевых клетках [3]. Оказалось, что в клетках, мутантных по факторам терминации ФТ1 или ФТ3, продукция большого числа молекул 2A приводит к гибели клеток, — вероятно, потому что факторы терминации не могут действовать эффективно на клеточных РНК в присутствие большого числа синтезируемых молекул 2A. Осаждение отдельных частей белка с помощью антител показало, что клетках, мутантных по ФТ1 или ФТ3, а также клетках, в которых образование прионов уменьшает количество активного ФТ3, образуется меньше двух продуктов реакции с 2A и больше — «нормального», не разрезанного, белка. Эти эксперименты показывают, что факторы терминации принимают участие в разделении синтезируемого белка с 2A надвое.
Одним из контрольных экспериментов для подтверждения этой гипотезы было воспроизведение реакции in vitro. В бесклеточных экстрактах было показано, что для прохождения реакции РНК, кодирующей 2A, достаточно было иметь все кодоны, включая кодирующий последнюю аминокислоту 2A, P19 [4]. В этом случае можно видеть, как пептид отделяется от последней тРНК. Последующие кодоны не нужны, то есть достаточно иметь кодон в последнем, А-сайте рибосомы, где обычно присоединяются факторы терминации.
К нашему удивлению, замена кодона для P19 стоп-кодоном привела к остановке реакции, то есть тРНК оставалась прикрепленной к пептиду. Очевидно, в случае «странного пептида 2A» конфигурация рибосомы позволяет факторам терминации либо узнавать стоп-кодон, либо выполнять свою обычную функцию: катализировать отделение тРНК от пептида.
Многие белки человека состоят из нескольких отдельных субъединиц (полипептидов), и для лечения некоторых заболеваний нужно экспрессировать все эти полипептиды одновременно, причем — в равной пропорции. Поскольку 2A предложено использовать в генной терапии для одновременного производства нескольких отдельных белков с одного вектора (вместо использования нескольких векторов), данные эксперименты поднимают пока неотвеченный вопрос о том, что произойдет с клетками человека, в которых 2A продуцируется долго и в больших количествах.
Второй вопрос еще менее изучен: каким образом рибосома остается прикрепленной к мРНК после терминации на 2A, и что позволяет ей начинать синтез второй части белка в отсутствие стартового AUG.
Литература
- Pablo de Felipe, Garry A. Luke, Lorraine E. Hughes, David Gani, Claire Halpin, Martin D. Ryan. (2006). E unum pluribus: multiple proteins from a self-processing polyprotein. Trends in Biotechnology. 24, 68-75;
- Pablo de Felipe, Lorraine E. Hughes, Martin D. Ryan, Jeremy D. Brown. (2003). Co-translational, Intraribosomal Cleavage of Polypeptides by the Foot-and-mouth Disease Virus 2A Peptide. J. Biol. Chem.. 278, 11441-11448;
- V. A. Doronina, C. Wu, P. de Felipe, M. S. Sachs, M. D. Ryan, J. D. Brown. (2008). Site-Specific Release of Nascent Chains from Ribosomes at a Sense Codon. Molecular and Cellular Biology. 28, 4227-4239;
- Fu Yan, Victoria A. Doronina, Pamila Sharma, Jeremy D. Brown. (2010). Orchestrating ribosomal activity from inside: effects of the nascent chain on the peptidyltransferase centre: Figure 1. Biochm. Soc. Trans.. 38, 1576-1580;
- Белки против РНК — кто первым придумал сплайсинг?;
- Флуоресцирующая Нобелевская премия по химии.