
Французским исследователям удалось омолодить клетки столетних людей
22 ноября 2011
Французским исследователям удалось омолодить клетки столетних людей
- 2864
- 8
- 1
До недавнего времени для пожилых пациентов никак не удавалось получить индуцированные плюрипотентные стволовые клетки (ИПСК) — а ведь именно им это может принести пользу в первую очередь.
-
Автор
-
Редакторы
Практически сбылась мечта средневековых алхимиков — найти секрет омоложения. Французским ученым удалось омолодить клетки столетних старцев, перепрограммировав их в состояние, подобное эмбриональному. Одно лишь омрачает столь многообещающую новость — после перестройки клетка становится опасной для своего собственного организма.
Отличительной чертой живых организмов является способность к постоянному самовосстановлению — регенерации. Это понятие включает не только восстановление организмом утраченных частей тела и органов, но также и не столь заметные, но не менее важные процессы обновления тканей и клеток. Постоянную замену изношенным тканям обеспечивают стволовые клетки [1–4].
Однако с возрастом способность организма к регенерации тканей понижается. Это обусловлено множеством причин, в числе которых:
- накопление в организме старых клеток, выделяющих токсины, которые ингибируют пролиферацию стволовых клеток [5];
- снижение с возрастом количества стволовых клеток из-за возрастного ингибирования генов, поддерживающих их способность к размножению [5];
- понижение способности стволовых клеток старого организма активировать регенерацию других клеток, что делает малоэффективным лечение пожилых пациентов путем клеточной терапии их собственными стволовыми клетками [6].
В опытах на крысах показано, что старые стволовые клетки теряют способность дифференцироваться в некоторые типы клеток (например, в кардиомиоциты); кроме того, они выделяют значительно меньшее количество ростовых факторов, в связи с чем падает их способность влиять на регенерацию путем паракринной стимуляции [7]. Поэтому для борьбы с заболеваниями старческого возраста было бы идеальным разработать методы, которые позволят омолодить собственные клетки пожилых людей.
Выяснилось, что омолодить клетки позволяет перепрограммирование соматических клеток человека в индуцированные плюрипотентные стволовые клетки (ИПСК). Особенностью ИПСК является то, что они, подобно эмбриональным стволовым клеткам (ЭСК), способны дифференцироваться в различные типы клеток. Помимо универсальности, важным преимуществом ИПСК является то, что они могут быть получены из клеток взрослого организма (например, из клеток кожи или фибробластов) [3], [10]. Это позволяет брать клетки для клеточной терапии у самого пациента и таким образом избежать многих проблем, связанных с поиском доноров и вопросами этики, ограничивающих использование человеческих эмбрионов в качестве доноров.
Перепрограммирование соматических клеток в ИПСК приводит к их омоложению, о чем свидетельствует целый ряд показателей, например, восстановление длины теломеров — концевых участков хромосом, состоящих из коротких, следующих друг за другом повторов. У всех позвоночных эти повторы состоят из шести нуклеотидов TTAGGG. В каждом цикле репликации теломеры укорачиваются из-за особенностей ДНК-полимеразы — она не способна синтезировать копию ДНК до самого конца. Укорачивание теломер вызывает репликативное старение, так как со временем длина теломер на концах хромосом достигает критически малой длины, и деление клетки блокируется.
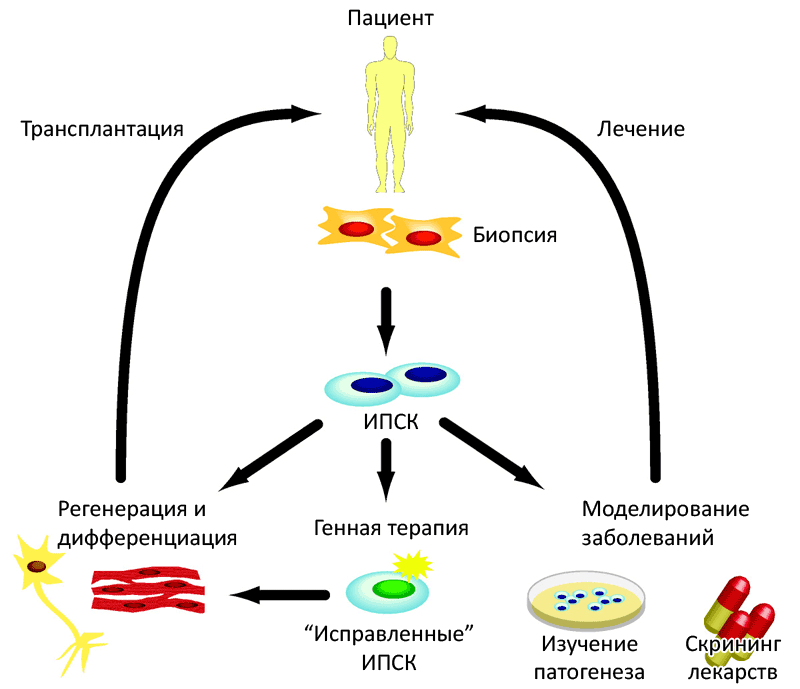
Рисунок 1. Перспективы применения индуцированных плюрипотентных стволовых клеток (ИПСК) в терапевтических целях. Соматические клетки пациента, полученные биопсией или из мочи, «перепрограммируются» в ИПСК. Затем их культивируют in vitro до необходимого количества и дифференцируют в нужный тип тканей для трансплантации. Помимо этого, полученные ИПСК можно использовать для лечения наследственных болезней, вызванных мутациями, внедрив в геном «терапевтические гены», которые возьмут на себя функции отсутствующих или неисправно функционирующих генов пациента. Такие исправленные ИПСК можно использовать для аутологичной клеточной терапии путем репопуляции пораженных тканей. ИПСК пациентов с генетическими заболеваниями можно использовать и для изучения патогенеза заболевания, или для разработки лекарств и скрининга. Данные, полученные на основе изучения культуры клеток, моделирующих конкретные заболевания, позволят выявить критические молекулярные и клеточные пути развития заболевания, что необходимо для разработки эффективной стратегии лечения.
Выяснилось, что перепрограммирование приводит к удлинению теломеров и их нормальному укорочению по мере дифференцировки ИПСК обратно в фибробласты [8]. Таким образом, при индуцированной плюрипотенции восстанавливается эмбриональная длина теломеров, а значит, увеличивается потенциальное число делений клетки, ограниченное так называемым лимитом Хейфлика.
Следует, однако, отметить, что ни ЭСК, ни ИПСК пока нельзя использовать в лечебных целях, так как, в отличие от эндогенных «взрослых» стволовых клеток организма, эти онтогенетически молодые клетки потенциально способны дать начало опухоли — так называемой тератоме, — свидетельствующей о том, что такие плюрипотентные клетки не всегда способны органично интегрироваться во взрослый организм. Если, однако, поместить ИПСК в ранний зародыш млекопитающего (на стадии бластоцисты), то они органично включаются в состав клеточной массы, и из такого эмбриона развивается нормальное животное [13]. Во взрослом же организме даже после дифференцировки стволовых клеток в соматические существует опасность их перерождения в раковые клетки [14].
В этой связи для непосредственного использования в регенеративной медицине пока подходят только мезенхимальные стволовые клетки (МСК). В отличие от онтогенетически молодых эмбриональных стволовых клеток или ИПСК, они не воспринимаются организмом взрослого человека как «чужаки», против которых необходимо мобилизовать иммунную систему, так как за время развития организма к ним развивается иммунологическая толерантность. Кроме того, они обычно не образуют тератом и не способны включиться в состав эмбриона [15]. Способность этих клеток существовать во взрослом организме, оставаясь плюрипотентными, может быть отчасти связана с их способностью влиять на функционирование иммунных клеток — они подавляют реакцию отторжения. Хотя возможно и то, что они каким-то образом подавляют морфогенетические сигналы со стороны окружающих их клеток или реагируют на них особым образом. Предполагается, что это связано с уникальным характером метилирования ДНК на участках, принадлежащих некоторым онтогенетически важным генам.
Все описанное выше справедливо, если пациент еще относительно молод — его клетки хорошо дедифференциируются в ИПСК. Однако чаще всего клеточная терапия требуется именно пожилым людям, а до недавнего времени считалось, что для перепрограммирования в ИПСК годятся только соматические клетки, полученные от пациентов не старше 60 лет.
И вот недавно французским исследователям группы Жан-Мари Лемайтра удалось подобрать состав перепрограммирующих факторов, позволяющий получать ИПСК от 70–100 летних пациентов [9]. Для этого исследователи добавили к стандартному набору четырех транскрипционных факторов Oct4, Klf4, Sox2 и c-Myc, используемых для получения ИПСК из клеток кожи молодых доноров [3], [10], еще два. Это ген белка NANOG и фактор Lin28, который блокирует созревание микроРНК let-7. Последние играют ключевую роль в подавлении регенерации и в активации клеточного старения, подавляя c-Myc, а также регулируя синтез факторов RAS (Ras GTPases) — эволюционно консервативный сигнальный путь регуляции старения [11]. Важно отметить, что вызываемая Lin28 блокировка созревания микроРНК let-7 может спровоцировать онкогенез [12].
Исследование ИПСК, полученных с использованием «коктейля» из этих шести факторов, показало, что клетки даже очень старых людей могут быть «омоложены» путем перепрограммирования в функционально активные ИПСК. Они были практически идентичны ЭСК человека и были способны к неограниченному делению и дифференциации в клетки любого типа.
Таким образом, доказано, что возраст не является непреодолимым препятствием для перепрограммирования соматических клеток в ИПСК. Теперь необходимо изучить пути «правильной» дифференцировки ИПСК, исключающие возможность их трансформации в опухолевые, и способы превращения ИПСК во взрослые стволовые клетки организма. После решения этих и других технических вопросов надежды на вечную молодость могут из сказки превратиться в быль.
Литература
- Ствол и ветки: стволовые клетки;
- Снежный ком проблем с плюрипотентностью;
- Была клетка простая, стала стволовая;
- Щадящие стволовые клетки;
- Darren J. Baker, Tobias Wijshake, Tamar Tchkonia, Nathan K. LeBrasseur, Bennett G. Childs, et. al.. (2011). Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479, 232-236;
- Ефименко А.Ю., Старостина Е.Е., Калинина Н.И., Парфенова Е.В. (2011). Влияние возраста на ангиогенные свойства мезенхимальных стволовых клеток жировой ткани. «Клеточная трансплантология и тканевая инженерия». VI, 48–57;
- Faizal Z Asumda, P Bryant Chase. (2011). Age-related changes in rat bone-marrow mesenchymal stem cell plasticity. BMC Cell Biol. 12;
- Shiran Yehezkel, Annie Rebibo-Sabbah, Yardena Segev, Maty Tzukerman, Rony Shaked, et. al.. (2011). Reprogramming of telomeric regions during the generation of human induced pluripotent stem cells and subsequent differentiation into fibroblast-like derivatives. Epigenetics. 6, 63-75;
- L. Lapasset, O. Milhavet, A. Prieur, E. Besnard, A. Babled, et. al.. (2011). Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes & Development. 25, 2248-2253;
- Kazutoshi Takahashi, Koji Tanabe, Mari Ohnuki, Megumi Narita, Tomoko Ichisaka, et. al.. (2007). Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872;
- Srinivas R. Viswanathan, George Q. Daley. (2010). Lin28: A MicroRNA Regulator with a Macro Role. Cell. 140, 445-449;
- Mario G. Mirisola, Valter D. Longo. (2011). Conserved role of Ras-GEFs in promoting aging: from yeast to mice. aging. 3, 340-343;
- Michael J. Boland, Jennifer L. Hazen, Kristopher L. Nazor, Alberto R. Rodriguez, Wesley Gifford, et. al.. (2009). Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94;
- Uri Ben-David, Nissim Benvenisty. (2011). The tumorigenicity of human embryonic and induced pluripotent stem cells. Nat Rev Cancer. 11, 268-277;
- Ralf Dressel. (2011). Effects of histocompatibility and host immune responses on the tumorigenicity of pluripotent stem cells. Semin Immunopathol. 33, 573-591;
- Mariusz Z. Ratajczak, Rui Liu, Janina Ratajczak, Magda Kucia, Dong-Myung Shin. (2011). The role of pluripotent embryonic-like stem cells residing in adult tissues in regeneration and longevity. Differentiation. 81, 153-161;
- Jia-Chi Yeo, Huck-Hui Ng. (2011). Transcriptomic analysis of pluripotent stem cells: insights into health and disease. Genome Medicine. 3, 68.





