Тернистый путь метастазов: через гипоксию в печень
20 февраля 2015
Тернистый путь метастазов: через гипоксию в печень
- 998
- 0
- 3
-
Автор
-
Редактор
Печально известно, что многие злокачественные заболевания желудочно-кишечного тракта сопровождаются метастазированием в печень. Не являются исключением и новообразования толстого кишечника, клетки которых могут отправляться в путешествие вместе с током крови для того, чтобы найти себе «тихую гавань» в печени, где они смогут продолжить бесконтрольно делиться. Этому процессу мешает естественный барьер — гипоксия, которую испытывают опухолевые клетки, преодолевая определенные участки печени. Однако они успешно берут этот барьер. Как им это удается, и как можно устранить опасных «путешественников»? На эти вопросы у ученых уже есть ответы.
Рак толстого кишечника ежегодно уносит жизни 600 000 человек по всему миру [1]. Это связано в первую очередь с тем, что у 70% пациентов наблюдается метастазирование опухоли в печень. На настоящий момент самым распространенным методом лечения метастазов является резекция печени в разном объеме с последующей химиотерапией, чтобы уменьшить вероятность рецидива. Иногда эта операция невозможна: например, когда опухоль занимает более 40% от объема печени. В таком случае проводят дооперационную химиотерапию, целью которой является уменьшение колоний опухолевых клеток до небольших очагов, которые можно удалить. Современные методы химиотерапии не слишком результативны: например, риск рецидива при их применении после операции снижается только на 7% [2]. Это связано с проблемой адресной доставки антиопухолевых агентов к метастазам, и для достижения большей эффективности терапии необходимо более детальное понимание механизмов распространения опухолевых клеток.
МикроРНК: малые бойцы сопротивления
О роли микроРНК — малых некодирующих молекул РНК*, участвующих в регуляции экспрессии множества генов, — в метастазировании опухолей известно уже давно. В отдельных случаях эти небольшие молекулы способствуют распространению опухоли в организме, блокируя экспрессию генов, которые не позволяют опухолевым клеткам передвигаться и заражать другие ткани [3]. В случае колоректального рака путем скрининга 661 микроРНК у человека были выявлены две молекулы — miR-483-5p и miR-551a, которые являются супрессорами распространения метастазов. Эти микроРНК блокируют общий ген-мишень, который кодирует креатинкиназу мозгового типа (ККМ) [2]. Данный фермент выделяется метастатическими клетками во внеклеточный матрикс и играет большую роль в обеспечении выживания опухолевой клетки в условиях гипоксии при попадании в печень.
* — «Обо всех РНК на свете, больших и малых» биомолекула уже поведала читателю [4] — Ред.
Несмотря на наличие супрессоров, опухолевые клетки приобрели хитроумный адаптивный механизм: они могут «терять» эти микроРНК и вовсю экспрессировать нужную им ККМ. Однако если вызвать избыточную экспрессию miR-483-5p и miR-551a, распространение метастазов уменьшается. Эксперименты in vitro показали, что данные супрессоры никак не связаны с пролиферацией опухолевых клеток [2]. Каким образом блокирование фермента, выделяемого во внеклеточную среду, может уменьшать размер опухолевых колоний? Чтобы ответить на этот вопрос, давайте разберемся в роли ККМ в выживании опухолевых клеток.
О роли ККМ: хочешь жить — умей делиться!
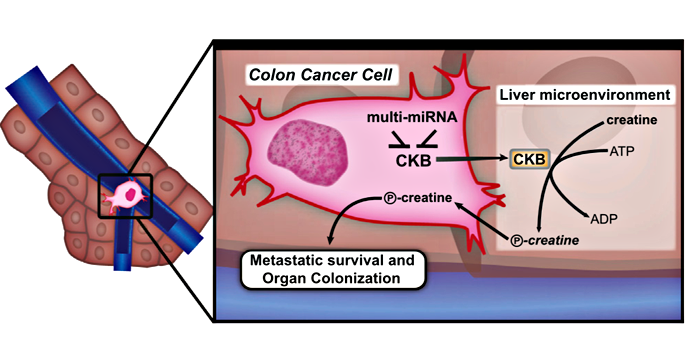
Рисунок 1. Механизм выживания опухолевой клетки в печени [2].
Когда опухолевая клетка только попадает из воротной вены в ткани печени, её сперва поджидают не самые благоприятные условия, ведь ей предстоит конкурировать с гепатоцитами, расходующими молекулы кислорода на собственные процессы гликолиза. Находясь в столь незавидном положении (гипоксии), она принимает очень интересное решение — начинает секретировать ККМ в межклеточное пространство. На первый взгляд это решение самоубийственно, поскольку благодаря ККМ в клетке происходит синтез высокоэнергетического фосфокреатина — соединения, гидролиз которого позволяет высвободить больше энергии, чем гидролиз АТФ.
Однако опухолевая клетка поступает так не по простодушию, а из хитрости. Печень представляет собой орган, богатый креатином — веществом, участвующим во многих энергетических процессах клетки. ККМ переносит фосфатную группу с АТФ на креатин, образуя фосфокреатин. Сверхсекреция ККМ в межклеточное пространство приводит к росту внеклеточной концентрации фосфокреатина, и он начинает поступать в метастатическую клетку с помощью транспортного белка SLC6a8. Посредством этого транспортера метастазы могут пополнять запасы фосфокреатина и таким образом переносить неблагоприятные условия, чтобы в дальнейшем размножаться и распространяться в другие области печени (рис. 1). Механизм настолько отлажен, что клетки со сверхпродукцией ККМ могут даже «делиться» фосфокреатином с клетками, синтезирующими мало этой креатинкиназы [2].
Выселение «нелегальных мигрантов», или Вирусная терапия как ключ к лечению
Поскольку за супрессию гена ККМ ответственны две молекулы микроРНК (miR-483-5p и miR-551a), закономерно, что при их переносе в метастатические клетки распространение этих клеток сильно уменьшается. Генетическая терапия in vivo предполагает для этого использование различных вирусных и невирусных векторов [5]. Исследователи из Рокфеллеровского университета (США) выбрали в качестве «курьеров» для доставки микроРНК аденоассоциированные вирусы (AAV). Такая система (рис. 2) оказалась довольно эффективной: степень распространения метастазов у мышей значительно снижалась уже после однократного введения AAV [2].
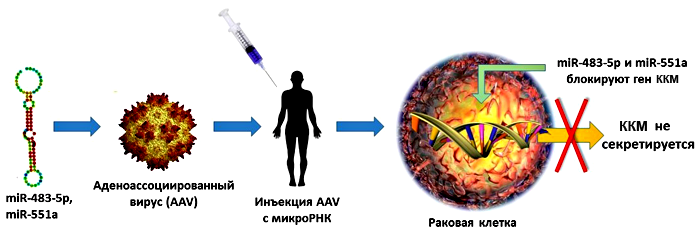
Рисунок 2. Теоретическая схема генной терапии с участием AAV. МикроРНК встраиваются в вирусы, которые вводятся в организм путем внутривенной инъекции. miR-483-5p и miR-551a связываются с мишенью — геном ККМ, блокируя его экспрессию. Рисунок из [2].
Несмотря на строгие ограничения проведения терапии с использованием микроРНК в качестве молекулярных зондов, печень является удачным исключением из этого перечня: именно в печень микроРНК доставить сравнительно легко — благодаря использованию различных векторов в виде наночастиц или вирусов [2]. В остальных же тканях существует большая проблема адресной доставки микроРНК к опухоли. Таким образом, можно с большой долей вероятности прогнозировать широкое использование описанного подхода к лечению многих пациентов с онкозаболеваниями, диагностированными уже на поздних стадиях. Возможно, благодаря подобным методам рак толстого кишечника с метастазами в печени перестанет быть приговором.
Литература
- Siegel R., Ma J., Zou Z., Jemal A. (2014). Cancer statistics, 2014. CA Cancer J. Clin. 64,
9–29 ; - Loo J., Scherl A., Nguyen A., Man F.,Weinberg E., Zeng Z. et al. (2015). Extracellular metabolic energetics can promote cancer progression. Cell. 160,
1–14 ; - МикроРНК участвуют в регуляции метастазирования опухолей;
- Обо всех РНК на свете, больших и малых;
- Генная терапия против рака.