От астроцита до нейрона: история одного превращения в живом мозге
15 февраля 2021
От астроцита до нейрона: история одного превращения в живом мозге
- 822
- 0
- 7
Главные герои статьи — астроциты
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Ученые провели множество исследований, в которых превращали одни виды клеток в другие. Также не менее популярным остается изучение причин развития болезни Паркинсона и способов ее терапии. В этой статье вы узнаете о том, как ученые убили двух зайцев сразу: провели превращение клеток в мозге живой мыши и при помощи этого шага избавили ее от проблем, вызванных гибелью клеток мозга.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Не секрет, что двигательные расстройства при болезни Паркинсона обусловлены потерей дофаминергических нейронов в черной субстанции головного мозга. Причина гибели этих клеток кроется в нарушении их метаболизма: рост концентрации белка α-синуклеина и выведение из строя «энергетических станций клетки» — митохондрий — приводит к необратимым последствиям [1]. Признаки болезни — повышение тонуса мышц, дрожь в руках, замедленные движения, — развиваются постепенно, по мере снижения уровня дофамина. Наряду с двигательными расстройствами появляется тревога, нарушается сон и страдают когнитивные функции. Борьба с недугом основывается на лекарстве леводопе [2]. Прием этого вещества позволяет компенсировать симптомы, но не предотвратить потерю нейронов. Поэтому исследователи разрабатывают альтернативные пути лечения: например, применение нейротрофических факторов [3]. Еще один способ восполнить утраченное — получить нейроны путем превращения в них других клеток, иными словами, репрограммированием. Именно так поступили главные герои этой статьи — ученые, которым удалось получить нейроны из клеток глии в живом мозге мыши! Как исследователи совершили этот шаг? И, самое главное, помог ли он восстановиться мышкам, у которых воспроизвели симптоматику болезни Паркинсона? Ответы в статье перед вами, написанной по мотивам Reversing a model of Parkinson’s disease with in situ converted nigral neurons [4].
Глава 1. ВКультуре
В качестве материала для армии новых нейронов американские и китайские исследователи выбрали астроциты — клетки глии и вспомогательные клетки-помощники по отношению к нервным клеткам. Количество астроцитов в мозге велико, и оно легко восстанавливается даже после травмы, что вместе с высокой пластичностью сделало эти клетки подходящим объектом для репрограммирования [5].
Один шаг отделял астроцит от превращения в нейрон: было необходимо снизить экспрессию гена, кодирующего РНК-связывающий белок PTB1. Это усиливало образование его нейронного брата-белка nPTB1 и впоследствии приводило к изменению активности генов, обусловливающих созревание нервных клеток [6].
Совершать такие манипуляции непосредственно в мозге живого организма рискованно, поэтому ученые опробовали разработанную методику на культуре мышиных и человеческих астроцитов. В них подавили выработку белка PTB1, что пробудило гены, активность которых характерна для нервных клеток. Через месяц после воздействия 50–80% клеток в этой культуре преобразились в нейроны как по внешним признакам, так и по внутренним: в них обнаружили характерные белки-маркеры (MAP2, NSE и другие), а также зарегистрировали работу Na- и К-каналов, то есть электрическую активность.
Глава 2. ВМозге мыши
Этап проверки прошел успешно, и исследователи перешли к работе на клетках мозга живой мыши. К слову, мыши были не совсем обычными: ученые работали с трансгенными мышами, астроциты которых синтезировали cre-рекомбиназу. Этот фермент выступил в качестве «маячка» для вектора, сконструированного для репрограммирования астроцитов в головном мозге. Исследователи собрали вектор на основе аденовирусной молекулы ДНК: в нее встроили ген блокатора PTB1 и ген красного флуоресцентного белка, который активировался в клетках с cre-рекомбиназой (рис. 1). Вектор ввели в черную субстанцию, и спустя некоторое время в ней обнаружили астроциты с красными метками. Через 3 недели после внедрения вектора с блокатором PTB1 20% этих клеток, а через 10 недель уже 80% обладали маркерами зрелых нейронов. Около 35% клеток несли маркеры дофаминергических нейронов, чья электрическая активность соответствовала таковой у зрелого нейрона, выделяющего дофамин в качестве медиатора.
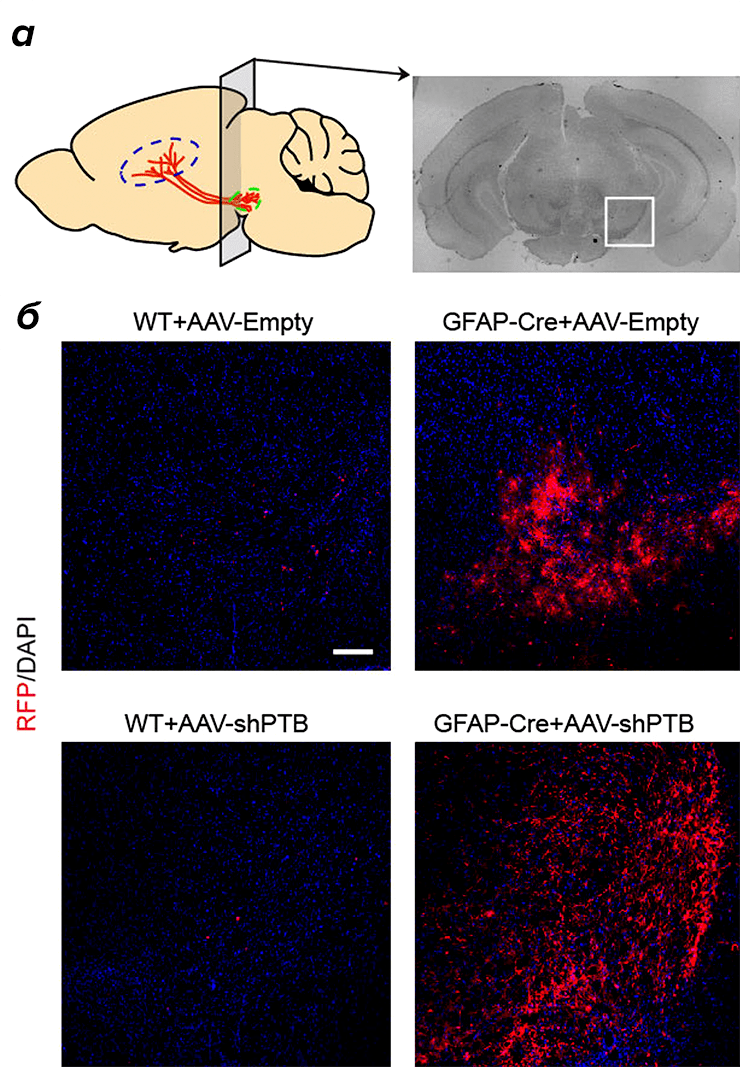
Рисунок 1. а — Схематичное изображение (слева) и срез (справа) области черной субстанции, в которую вводили вектор. б — Красный флуоресцентный белок активен в астроцитах трансгенных мышей (справа), но не мышей дикого типа (слева).
На среднем мозге, в котором находится черная субстанция, ученые не остановились и дополнительно ввели вектор в кору и нижележащие структуры — стриатум (рис. 2). Метод репрограммирования через подавление белка PTB1 показал свою эффективность и в этих областях мозга. Одновременно с этим исследователи обратили внимание на различие в наборе маркеров у нейронов, образовавшихся в среднем мозге, стриатуме и коре (рис. 3, верх). Активность генов в астроцитах областей мозга, выбранных для введения вектора, изначально могла быть разной. Также вероятно, что вклад микроокружения клеток оказался более существенным, ведь более эффективно превращение в дофаминергические нейроны протекало в среднем мозге мыши, нежели в культуре отдельных клеток: 35% против 10%.
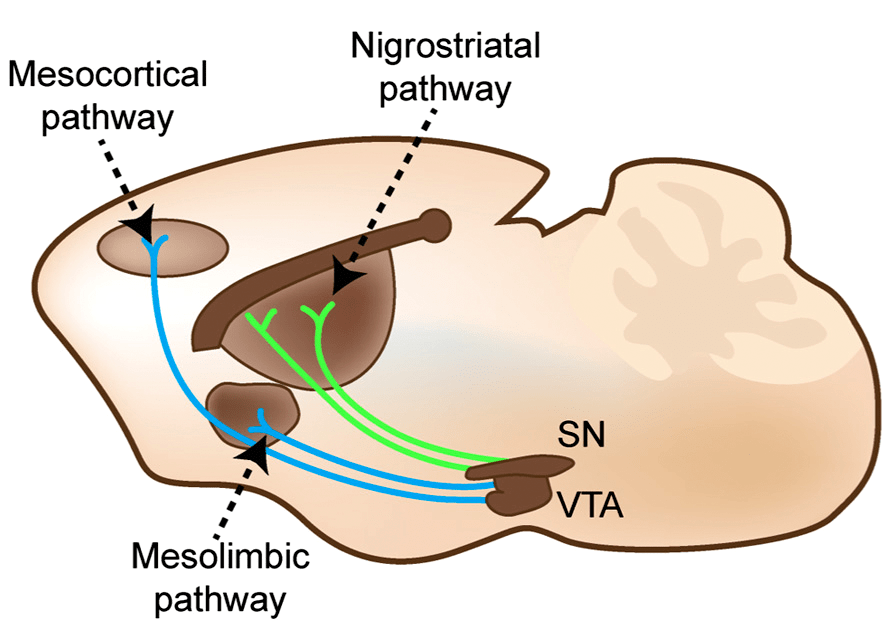
Рисунок 2. Волокна нейронов черной субстанции (SN) достигают стриатума и образуют нигростриарный путь (nigrostriatal pathway). Дофаминергические нейроны обнаружены и в другой структуре среднего мозга — вентральной тегментальной области (VTA). Их волокна протягиваются в лимбические структуры и кору и образуют мезолимбический (mesolimbic) и мезокортикальный (mesocortical) пути соответственно [2]. На рисунке показан мозг мыши.
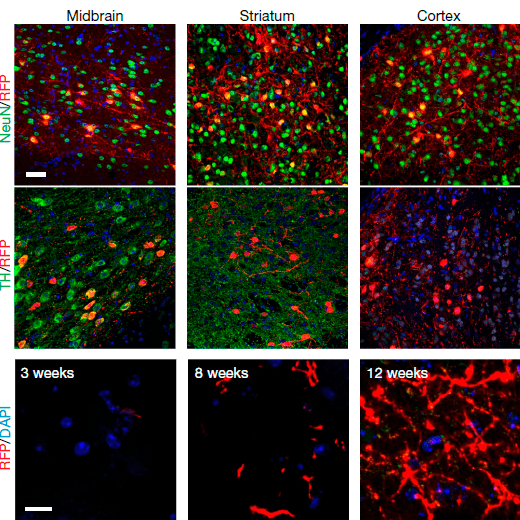
Рисунок 3. Сверху — новоиспеченные нейроны в разных областях мозга несут разные маркеры (NeuN, TH) — окрашены зеленым цветом. Нижний ряд — красным окрашены волокна нейронов, прорастающие к стриатуму.
Однако нейроны-новобранцы были тепло приняты в живом мозге и успешно встроились в его структуры. Ученые отследили путь и плотность волокон подкрашенных дофаминергических клеток среднего мозга. Количество волокон возросло, и они достигли подкорковых ядер (стриатума) — скорлупы и прилежащего ядра, а также структур лимбической системы — септальных ядер и обонятельного бугорка (рис. 3, низ). Более того, через день после введения в клетки скорлупы гранулы с зеленым красителем обнаружили в новых нейронах черной субстанции, что стало еще одним свидетельством интеграции образовавшихся дофаминергических нейронов в живой мозг мыши.
Глава 3. ВМозге мыши: борьба с болезнью Паркинсона
Поможет ли репрограммирование астроцитов восполнить утрату нейронов, происходящую при болезни Паркинсона, и окажет ли восстанавливающий эффект? Интрига сохранялась. Чтобы получить ответ на эти вопросы, исследователи применили на мышах модель, при которой симптомы болезни вызывают введением 6-гидроксидофамина — токсичного аналога дофамина, провоцирующего гибель дофаминергических нейронов. Через месяц после локальной инъекции этого вещества число нейронов в черной субстанции сократилось на 90%: от около 3000 до 266–300 клеток. Введение спасительного вектора с блокатором PTB1 восстановило 600 с лишним нейронов, восполнив 30% от их первоначального количества (рис. 4). Аналогичные процентные пропорции были обнаружены и в отношении динамики волокон.
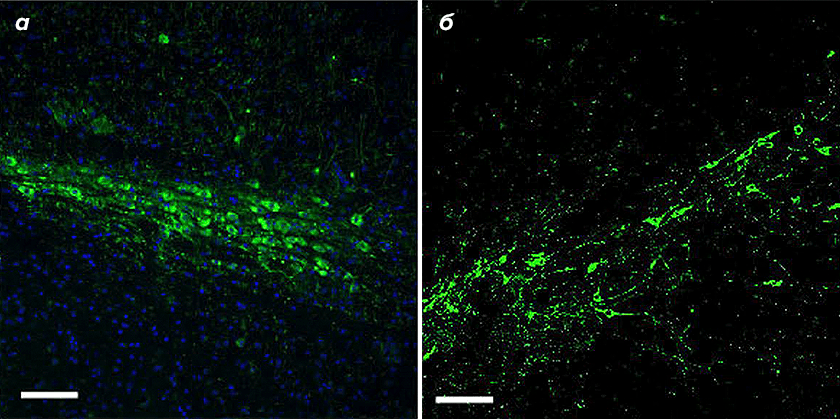
Рисунок 4. Дофаминергические нейроны черной субстанции в неповрежденном мозге (а) и в поврежденном мозге после введения вектора с блокатором PTB1 (б)
Еще один эффект введения токсичного аналога заключался в снижении на три четверти уровня дофамина, который замеряли в стриатуме. Введение вектора и дальнейшее репрограммирование астроцитов привело к заметному повышению уровня до 65% от такового в неповрежденном мозге.
И, наконец, блокировка PTB1 и формирование совокупности новых нейронов из астроцитов восстановило двигательную функцию. Гибель нейронов из-за инъекции 6-гидроксидофамина носила унилатеральный характер, то есть затронула области мозга только с одной стороны. Это привело к тому, что мыши предпочитали использовать лапки одной стороны для прикосновения к предметам. И вы наверняка догадались, что репрограммирование астроцитов устранило это предпочтение и позволило животным использовать лапки каждой стороны в равной мере. Схожие результаты были получены в наблюдении за двигательной активностью, вызванной введением наркотических веществ.
Эпилог. Это вылечит людей?
Как отмечают исследователи, есть несколько препятствий на пути применения данной методики для терапии людей с болезнью Паркинсона. Одним из них выступает побочный эффект от случайного репрограммирования нецелевых астроцитов. Истощение числа этих клеток также может нести неблагоприятные последствия. Второй важный аспект, который необходимо учитывать, заключается в возрастных ограничениях для подобных превращений клеток. Установлено, что у людей пожилого возраста астроциты менее пластичны, что может снизить эффективность репрограммирования их в нейроны.
Еще одна проблема заключается в самой модели болезни Паркинсона, которую исследователи воспроизвели на мышах. Схожее в модели и болезни — дегенерация нейронов в черной субстанции и истощение дофамина в стриатуме. Однако другие особенности патогенеза болезни Паркинсона в модели не учтены. Например, гибель нейронов после введения токсичного аналога дофамина происходит однократно и не прогрессирует со временем.
Несмотря на описанные выше трудности, методика репрограммирования клеток в живом мозге имеет большое значение. Она позволяет по-новому взглянуть на терапию болезни Паркинсона и других нейродегенеративных заболеваний, а также предоставляет один из инструментов (или его прообраз) для успешной победы над недугом.
Литература
- Болезнь Паркинсона: что изучать? как изучать?;
- Дофаминовые болезни;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Hao Qian, Xinjiang Kang, Jing Hu, Dongyang Zhang, Zhengyu Liang, et. al.. (2020). Reversing a model of Parkinson’s disease with in situ converted nigral neurons. Nature. 582, 550-556;
- Xinzhu Yu, Jun Nagai, Baljit S. Khakh. (2020). Improved tools to study astrocytes. Nat Rev Neurosci. 21, 121-138;
- Yuanchao Xue, Hao Qian, Jing Hu, Bing Zhou, Yu Zhou, et. al.. (2016). Sequential regulatory loops as key gatekeepers for neuronal reprogramming in human cells. Nat Neurosci. 19, 807-815;
- Kelli M. Money, Gregg D. Stanwood. (2013). Developmental origins of brain disorders: roles for dopamine. Front. Cell. Neurosci.. 7;
- Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний.