
Тайная жизнь митохондрий
02 марта 2022
Тайная жизнь митохондрий
- 9138
- 1
- 15
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы знаем, что митохондрии — это энергетические станции клеток, которые производят энергию для нашей жизнедеятельности, а также мышления и творчества. И мы часто представляем митохондрии как на рисунке в учебнике — как некие неподвижные структуры в клетке, занимающиеся своим делом. Но на самом деле митохондрии — это очень подвижные, своенравные органеллы, они многое умеют и часто действуют независимо от клетки, в которой находятся, при этом общаясь с ней и оказывая на нее большое влияние. В этой статье мы рассмотрим как раз эту тайную жизнь митохондрий и проследим, как знания о функционировании митохондрий вдохновляют ученых на разработку лекарств.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Скачать комикс в pdf
Митохондрии — энергетические станции
Все мы дышим и едим. Оба этих неотъемлемых атрибута нашей жизнедеятельности обусловлены наличием в наших клетках микроскопических органелл — митохондрий . Потребляя белки, жиры и углеводы, мы снабжаем наши митохондрии необходимыми субстратами для производства молекул АТФ — универсальной энергетической валюты всех живых клеток. За счет энергии АТФ в клетках нашего организма происходят практически все биохимические процессы, необходимые для жизнедеятельности, движения и мышления. Кислород является обязательным условием для работы митохондрий, без него уже в течение нескольких минут клетки начинают погибать.
Организмы, не имеющие митохондрий, могут вовсе не нуждаться в питании органикой и дыхании кислородом. Например, некоторые бактерии-хемосинтетики живут в бескислородной среде и получают всю необходимую энергию за счет энергии химических связей (сероводорода, сульфидов, железа и т.д.), а в качестве источника углерода эти организмы используют не органические соединения, а углекислый газ.
Помимо производства универсальной энергии, митохондрии влияют на многие аспекты жизни клеток, в чем мы убедимся по ходу статьи. Но начнем повествование именно с энергетической функции митохондрий. Разумеется, если она нарушена, то последствия катастрофические: нарушение работы митохондрий приводит к огромном количеству заболеваний. В первую очередь, сердечной, почечной недостаточности и неврологическим нарушениям, потому что именно мозг, сердце и почки тратят больше всего энергии, но могут возникать и многие другие проблемы [1], [2].

Рисунок 1. (а), (б) — просвечивающая электронная микрофотография среза сердца крысы.
(б), (в) — желтым цветом обведены контуры мембран митохондрии, стрелками обозначены внутренние структуры: матрикс, межмембранное пространство (ММП) и кристы
фотография автора на просвечивающем электронном микроскопе JEM-1011 в ЦКП МГУ
Чтобы разобраться в производстве энергии, давайте посмотрим на митохондрию поближе (рис. 1). Митохондрия — это двумембранная органелла. У нее есть гладкая внешняя мембрана, а внутренняя мембрана образует многочисленные впячивания — кристы. Внутреннее пространство митохондрий называется матрикс. И именно на границе двух мембран происходит самое интересное [3].
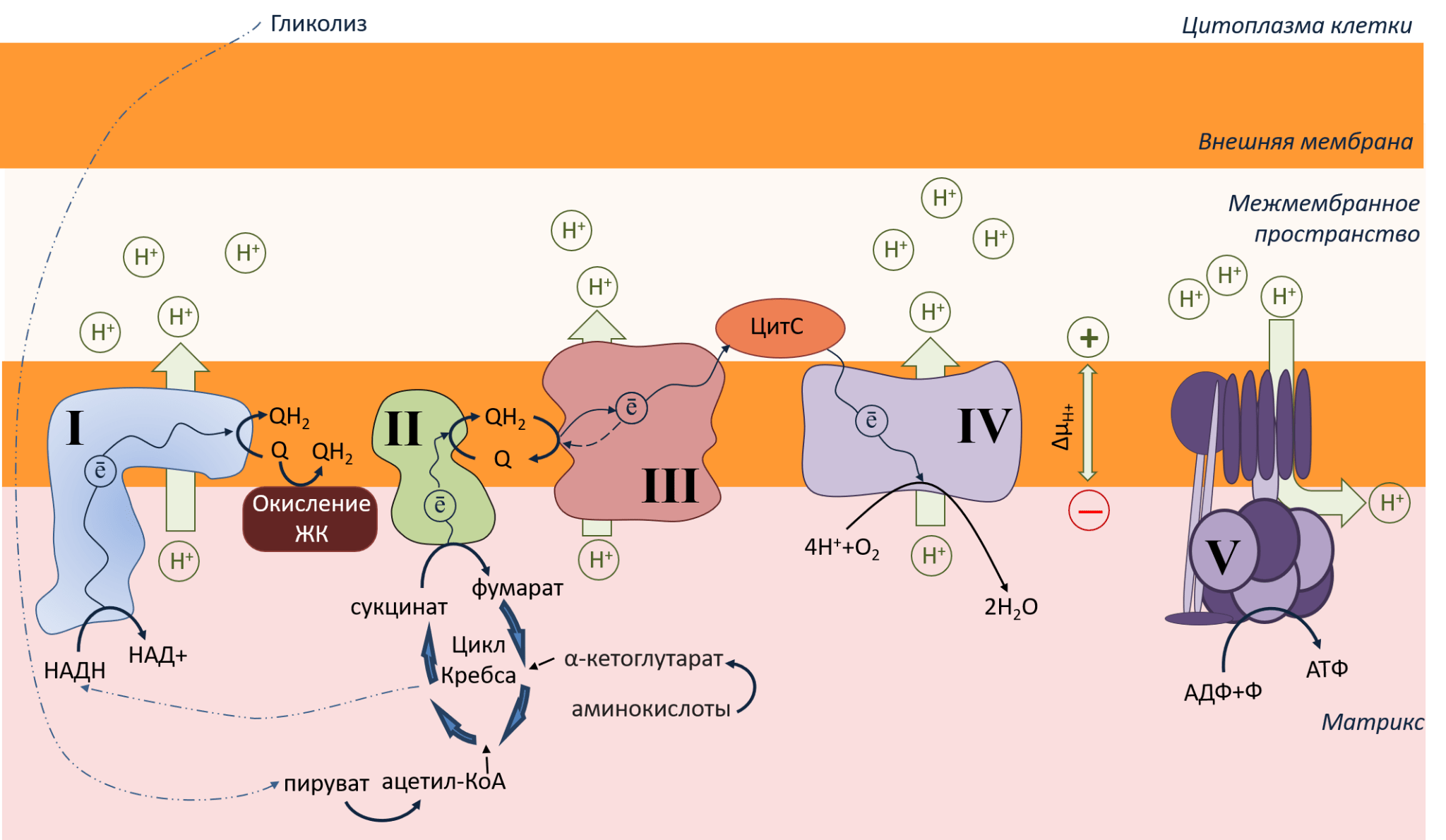
Рисунок 2. Схематичное изображение небольшого участка митохондрии: внутренняя, внешняя мембрана, межмембранное пространство. Темно-синими стрелками показан путь электрона вдоль мембраны. Зелеными стрелками показано движение протонов через мембрану. Описание в тексте.
рисунок автора, адаптирован из [3]
Рассмотрим рисунок 2. На внутренней мембране расположены крупные белковые комплексы. Это электрон-транспортная цепь (ЭТЦ), или дыхательная цепь митохондрий. Почему она так называется? По этой ЭТЦ от I и II до IV комплекса бегут электроны, как ток по проводам (путь электронов — ē — показан темно-синими стрелками). Внутри комплексов ЭТЦ находятся особые молекулы — кофакторы (железосерные кластеры, флавины, цитохромы), расположенные в таком порядке, чтобы электроны легко перебегали по ним в нужном направлении .
Строго говоря, направление движение электронов по ЭТЦ обеспечивается редокс-потенциалами (или окислительно-восстановительными потенциалами) кофакторов комплексов ЭТЦ: электроны перемещаются от молекул с донорными свойствами (с низким редокс-потенциалом), то есть легко отдающим электрон, к молекулам с акцепторными свойствами (с высоким редокс-потенциалом), легко принимающим электрон. При перемещении электрона донор окисляется, а акцептор восстанавливается. Наиболее подробно этот процесс описан в классических учебниках по биохимии Ленинджера (глава 19) и по биоэнергетике Николлса (глава 3) или Скулачева с соавт. (глава 4).
Откуда ЭТЦ берет электроны? В цитоплазме клетки происходит гликолиз — окисление глюкозы до пирувата, который попадает в матрикс митохондрий, где участвует в цикле Кребса . В результате этого процесса образуются две важные молекулы: НАДН и сукцинат. Эти молекулы и служат донорами электронов в ЭТЦ. Они отдают свои электроны комплексу I и комплексу II, окисляясь до НАД+ и фумарата. С этих комплексов электроны поступают на молекулы убихинонов (коферменты Q) — единственных подвижных жирорастворимых переносчиков электронов в ЭТЦ. Также коферменты Q получают электроны от окисления жирных кислот (ЖК). Убихиноны с электронами (то есть в восстановленном состоянии) называются убихинолы. Они доплывают до комплекса III, передавая электрон на цитохромы типа В.
Не только углеводы являются поставщиками субстратов для цикла Кребса. Еще это делают белки в результате так называемых анаплеротических (то есть дополнительных) реакций.
Далее путь электронов раздваивается: один электрон возвращается на хинон, а второй — поступает на цитохром С (ЦитС) — единственный мобильный водорастворимый переносчик электронов, который плавает в межмембранном пространстве и «довозит» электрон до IV комплекса. Это финальная точка ЭТЦ. Электроны, добежавшие до конца, выполнили свою задачу и уже больше никому не нужны. Они утилизируются с помощью кислорода (О2). Кислород работает чем-то вроде мусорной корзины для электронов, забирая их из ЭТЦ, и, соединяясь с протонами, превращается в воду (Н2О).
В процессе переноса электронов I, III и IV комплексы ЭТЦ активно закачивают протоны (Н+) из матрикса в межмембранное пространство (на рисунке пути протонов показаны большими зелеными стрелками). В результате этого на внутренней мембране митохондрий образуется протонный градиент (или мембранный потенциал, ΔμН+) : со стороны межмембранного пространства накапливаются протоны и положительный заряд, а со стороны матрикса протонов намного меньше, и заряд становится отрицательным. Что происходит дальше? Накопившиеся в межмембранном пространстве протоны Н+ из-за разности в заряде с двух сторон мембраны стремятся в матрикс, где заряд более отрицательный (как мы знаем, противоположности притягиваются). Но липидная мембрана их не пускает. Удобный для протонов способ выбраться наружу — через каналы особого фермента АТФ-синтазы (V комплекса). АТФ-синтаза использует движение протонов для синтеза АТФ — энергетической валюты всего живого. АТФ (аденозинТРИфосфат) образуется за счет присоединения фосфата к молекуле АДФ (аденозинДИфосфата), что происходит внутри АТФ-синтазы. Подробнее о производстве АТФ читайте в спецпроекте и статье на «Биомолекуле» [4].
Протонный градиент ΔμН+ имеет 2 компонента: концентрационную (pH) и зарядовую (ΔΨ), причем зарядовая является наиболее значимой, поэтому в дальнейшем повествовании мы будем оперировать в первую очередь ей. Желающим досконально разобраться в этом вопросе могу посоветовать главу 3.4 книги Николлса Bioenergetics [5].
Как правило, причины нарушений в работе ЭТЦ, приводящие к митохондриальным заболеваниям, кроются в мутациях комплексов ЭТЦ. В этом случае заболевание является наследственным, передающимся по материнской линии (так как все митохондрии мы получаем от матери) [1]. Однако на работу ЭТЦ влияют и многие другие факторы, которые могут изменяться и без каких-либо мутаций. Например, мы исследуем системные заболевания (в первую очередь, гипертонию), которые хоть и косвенно, но значительно влияют на работу митохондрий. По ходу статьи мы убедимся, как много аспектов функционирования митохондрий нужно учитывать, чтобы понять причины развития тех или иных патологий и подобрать правильное лечение.
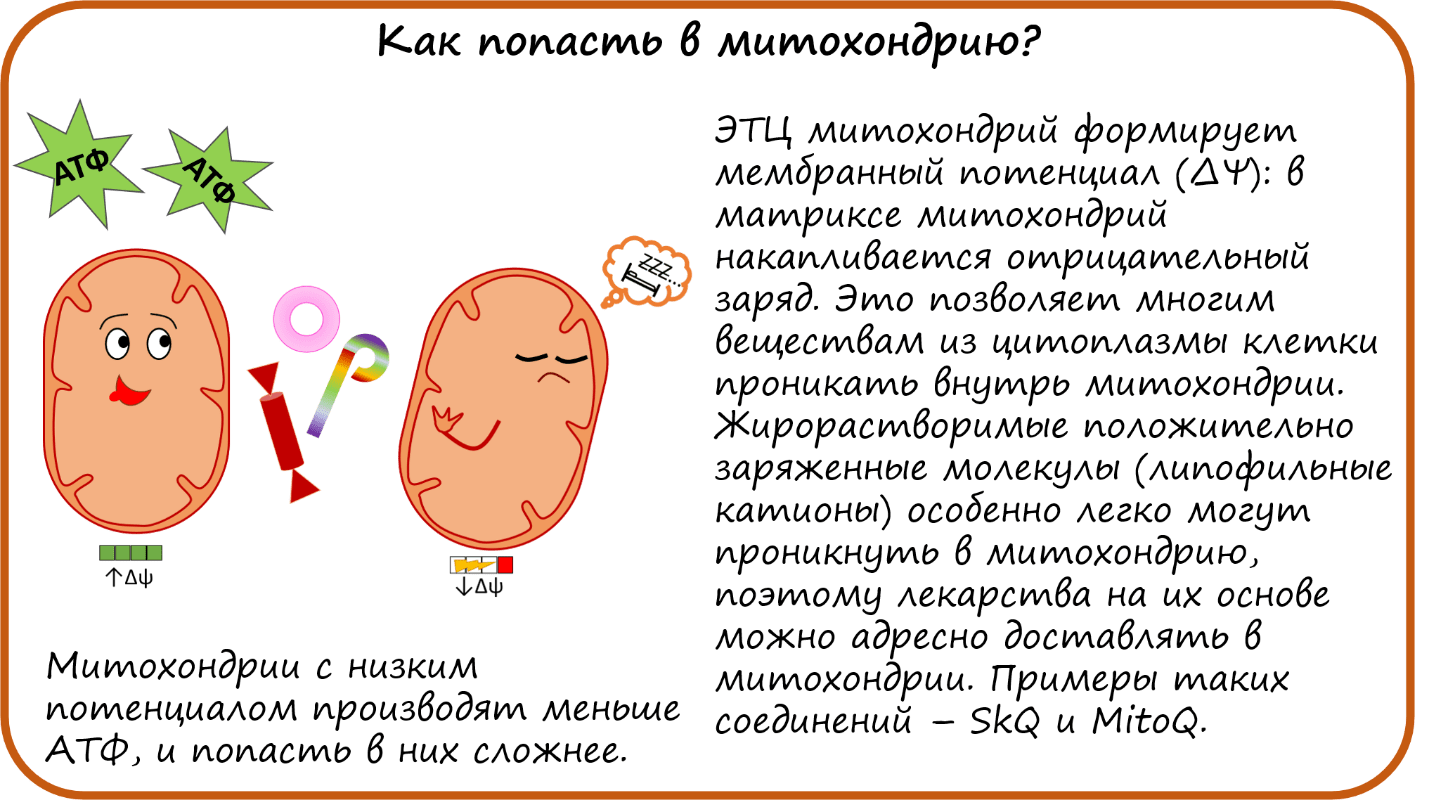
Как попасть в митохондрию?
Так как нарушение функционирования митохондрий приводит к огромному числу заболеваний, не остается сомнений в важности разработки лекарств, которые бы устраняли проблемы непосредственно в митохондриях. Но как лекарства могут попасть в митохондрию? Адресная доставка лекарств в определенные органы — и так непростое дело, а попасть еще и в определенные органеллы внутри клетки — задача со звездочкой. На помощь приходят свойства самих митохондрий, в первую очередь мембранный потенциал (ΔΨ). Важно, что на внутренней мембране митохондрий со стороны матрикса (то есть внутреннего пространства митохондрий) заряд оказывается отрицательным. В норме разность потенциалов используется ферментом АТФ-синтазой для синтеза АТФ, но этим его применение не ограничивается (рис. 3). Разность потенциалов на мембране — это очень важный энергетический ресурс, который используется другими ферментами и каналами для транспорта веществ из цитоплазмы в митохондрию и из митохондрии в цитоплазму [5].
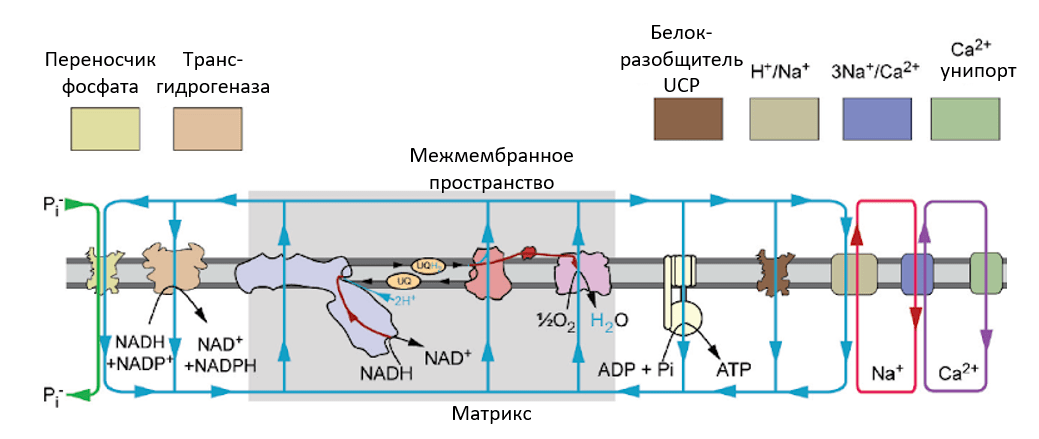
Рисунок 3. «Потребители» потенциала митохондрий: перенос ионов (фосфата, кальция и натрия) между матриксом и межмембранным пространством (а затем и цитоплазмой клеток) обеспечивается рядом белковых транспортеров за счет энергии мембранного потенциала. Кроме этого, мембранный потенциал необходим для транспорта образовавшихся в матриксе митохондрий молекул АТФ в цитоплазму клеток, для создания восстановительного эквивалента НАДФН из НАДН и для многих других процессов.
рисунок переведен из [5]
Мембранный потенциал также можно использовать и для доставки лекарств в митохондрии . Одним из первых об этом задумался наш соотечественник Владимир Петрович Скулачев. Он разработал первое проникающее в митохондрию вещество — трифенилфосфоний (ТФФ) [6]. Сейчас уже есть целая группа похожих соединений [7], [8]. В результате работы ЭТЦ в матриксе митохондрий образуется отрицательный заряд, а значит, положительно заряженным молекулам проникнуть туда будет проще. Но матрикс митохондрий отгорожен от цитоплазмы 2 липидными мембранами. Это значит, чтобы проникнуть внутрь митохондрии, молекулы-кандидаты должны уметь перемещаться внутри липидного слоя, то есть быть липофильными (жирорастворимыми). ТФФ как раз является такой подходящей молекулой! Благодаря этим свойствам ТФФ и его аналоги получили название «липофильные катионы» (то есть жирорастворимые молекулы с положительным зарядом). В настоящее время разрабатывается ряд препаратов на основе липофильных катионов [7], [9]. Огромный плюс таких молекул (помимо плюс-заряда) — избирательное проникновение только в митохондрии, но не в другие органеллы клетки. К тому же при некоторых видах рака мембранный потенциал митохондрий выше, чем в митохондриях нормальных клеток, а значит, такие препараты будут легче проникать в митохондрии опухолевых клеток. Но есть и минус: если в митохондрии снижен мембранный потенциал, что наблюдается при некоторых заболеваниях (о чем мы поговорим в дальнейшем), то такие соединения в митохондрии с маленьким потенциалом не проникнут.
Конечно, есть и альтернативные способы попасть внутрь митохондрии, например, использовать специальный пептид — сигнал локализации в митохондриях (mitochondria localization signal — MLS, или mitochondria targeting signal — MTS). Принцип работы лекарства с MTS заключается в том, что к лекарству (пептиду или пептидомиметику) присоединяют короткий пептид, который, как адрес на конверте, указывает клетке отправить лекарство в митохондрии [10]. Впрочем, для эффективной доставки положительный заряд и липофильность лекарственных молекул все равно важны.
Чего боится митохондрия?
Итак, мы разобрались, как митохондрии производят АТФ. Причем количество АТФ должно очень тонко регулироваться клеткой. Если потребности в АТФ выросли, его надо произвести больше. Например, при активной мышечной или умственной работе требуется больше АТФ. И наоборот, если клетка в спокойном состоянии, то и не надо тратить ресурсы понапрасну. Но как митохондрия понимает, когда простимулировать работу ЭТЦ, а когда — притормозить?
Оказывается, митохондрия «чувствует» соотношение АТФ к АДФ и АМФ, то есть аденозинТРИфосфата к аденозинДИ- и МОНОфосфату. Если АТФ много, надо остановиться, а если много АМФ — ускориться. У многих митохондриальных белков есть даже сайты связывания с этими молекулами. Именно из-за этих свойств молекула АМФ служит маркером клеточного голода. Один из способов обмануть митохондрию и получить от нее больше АТФ — использовать вещества, похожие на АМФ, так называемые миметики АМФ. Один из таких миметиков — соединение AICAR (5-аминоимидазол-4-карбоксамид рибонуклеотид): оно оказалось так эффективно, что было признано допингом и запрещено в профессиональном спорте [11].
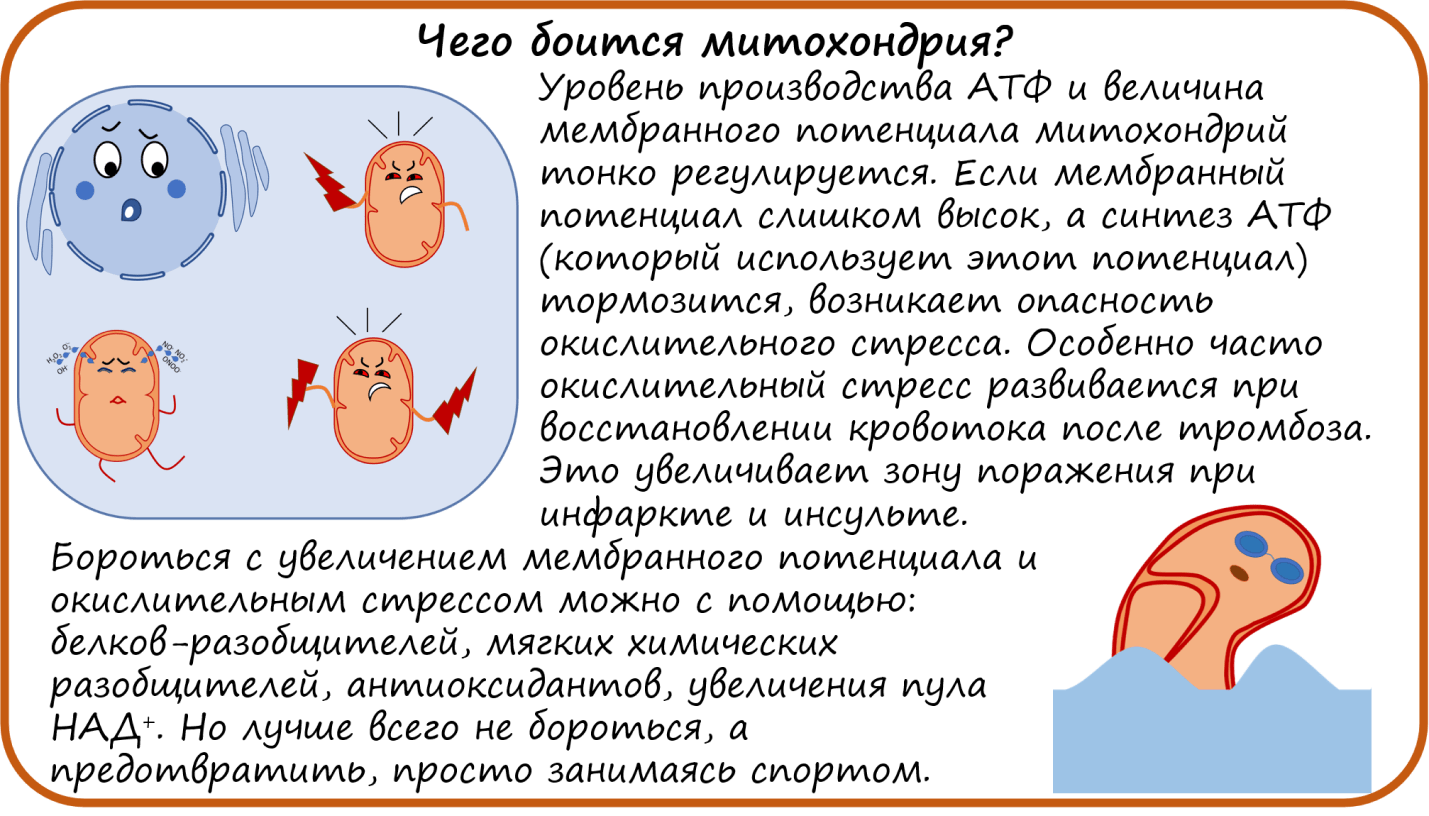
Поддерживать работу ЭТЦ на определенном уровне важно еще и потому, что ЭТЦ обеспечивает постоянство мембранного потенциала. Если мембранный потенциал слишком низкий, в митохондрии нарушается транспорт веществ. Но и слишком большой потенциал — это тоже плохо. Это значит, что в межмембранном пространстве митохондрий накопилось слишком много протонов. Перенос каждого следующего протона оказывается сильно затруднен. А перенос электронов, как мы помним, сопровождается закачкой протонов в межмембранное пространство. Без движения протонов через мембрану не будет и движения электронов вдоль мембраны. Поэтому электроны оказываются на долгое время «заперты» в своих комплексах ЭТЦ. И там-то их может схватить кислород. В таком случае образуется не безобидная вода, а активные формы кислорода (АФК, или кислородные радикалы), которые разрушают все на своем пути. В первую очередь, это супероксид-анион радикал (О2*—) и перекись водорода (Н2О2). Накопление таких агрессивных соединений провоцирует окислительный стресс — губительное состояние для тканей.
Другой процесс, приводящий к окислительному стрессу, — ишемия-реперфузия. Приведем пример. При инсульте мозга или инфаркте миокарда тромб перекрывает просвет кровеносного сосуда, питающего участок сердца или мозга. Кислорода нет, то есть нет «мусорной корзины» для электронов, значит, электроны в ЭТЦ некуда девать. И они вынужденно копятся в ЭТЦ, пока их не станет так много, что они сами не полезут из всех щелей. Работа дыхательной цепи при этом тормозится. Увеличивается количество сукцината [12], [13]. И вот тромб срочно удаляют. В ткань, которая временно осталась без кислорода, вновь устремляется кровь, богатая кислородом. И этот кислород захватывает все электроны откуда попало, в первую очередь — из I и III комплексов ЭТЦ (рис. 3а) с образованием опасных АФК. Это приводит к окислительному стрессу и увеличению зоны поражения после оказания экстренной медицинской помощи.
С этим надо как-то бороться. И тут есть разные стратегии. Первое, что можно сделать, — снизить потенциал на мембране, который вносит вклад в образование АФК. В митохондриях есть собственные белки, которые это уже умеют. Это группа белков-разобщителей, или uncoupling proteins (UCPs) (рис. 4) [14]. Самый известный из них — термогенин, ответственный за выработку тепла. Логично, что подобные соединения было бы здорово использовать в терапии. Но не все так просто. Известен пример с динитрофенолом — разобщителем ЭТЦ и синтеза АТФ, которым хотели лечить ожирение. Но он приводил к летальной гипертермии (люди умирали от перегрева!), из-за чего был отозван FDA как особо опасный [15]. Не хотелось бы умереть в попытках похудеть...
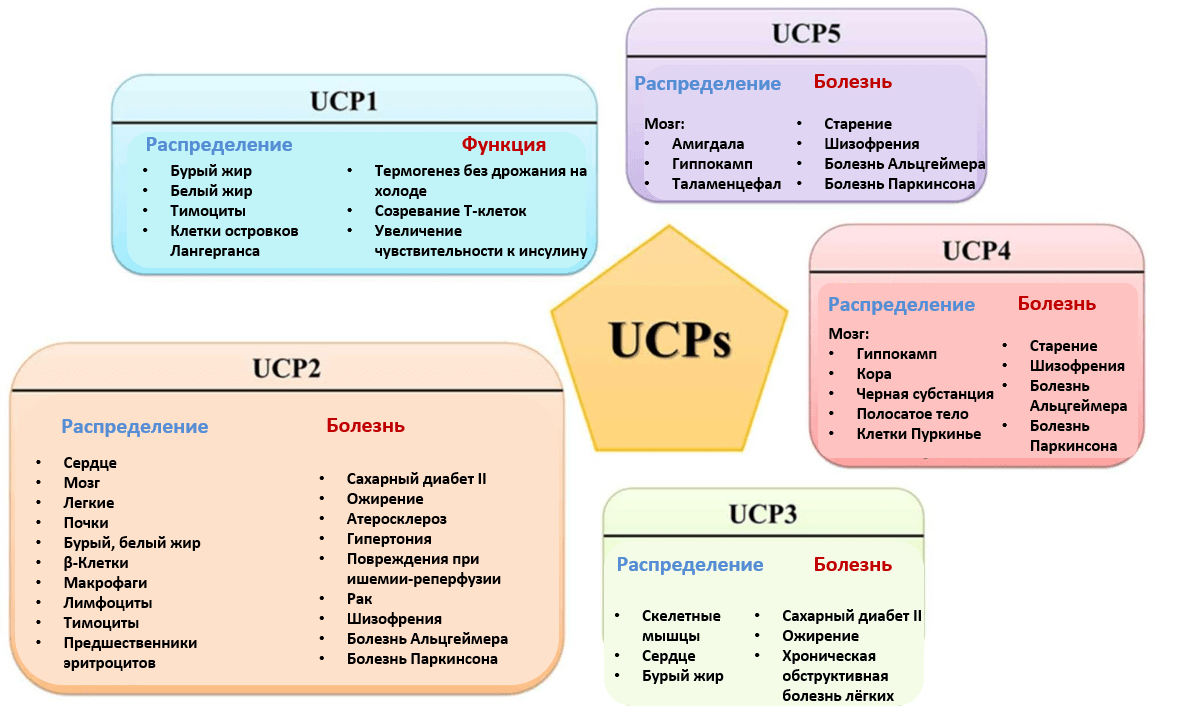
Рисунок 4. Семейство белков-разобщителей электронного транспорта и синтеза АТФ (UCPs — uncoupling proteins).
рисунок переведен из [14]
В нашей лаборатории мы и сами работаем с такими разобщителями. И это очень непростое дело. Мы много раз замечали, что если добавить совсем немного разобщителя, то активность митохондрий увеличивается, но если даже чуть-чуть переборщить — то все, митохондрии перестают работать. Будет ли продолжаться поиск мягкого разобщителя ЭТЦ для улучшения прогноза при инфарктах и инсультах, сказать сложно [11], [16].
Другой способ снизить потенциал на мембране митохондрий — это увеличить пул НАД+. Как это работает? Комплекс I ЭТЦ окисляет НАДН (то есть отбирает у него электроны), в результате чего электроны поступают в ЭТЦ для создания мембранного потенциала и производства АТФ, а НАДН превращается в НАД+. Однако, комплекс I «чувствует» баланс НАД+/НАДН, и при нарушении баланса, в данном случае — увеличении количества НАД+, комплекс I перестает окислять НАДН. Без притока электронов с молекул НАДН протоны не закачиваются в межмембранное пространство, и мембранный потенциал митохондрий снижается.
Соединения, увеличивающие пул НАД+, например, никотинмононуклеотид, сейчас начали проходить клинические испытания [17].
И наконец, самый очевидный способ борьбы с АФК — это просто их убрать с помощью антиоксидантов, способных переводить опасные АФК в безопасные продукты (например, в воду) . Несколько лет назад был просто антиоксидантный бум. АФК обвинили во всех грехах — и в болезнях, и в старении, — а антиоксиданты объявили панацеей от всего [18—20]. Но тут сразу обнаружилось много проблем. Во-первых, антиоксиданты имеют системный эффект, и в слишком больших дозах могут быть токсичны . Во-вторых, АФК не просто так образуются в митохондриях. Это очень важные сигнальные молекулы, благодаря которым клетка понимает, что находится в опасности, на которую надо реагировать[21], [22]. В ответ на оксиданты клетка запускает собственные механизмы защиты, собственные антиоксидантные системы [23]. А если мы добавляем искусственные антиоксиданты, то нарушаем эту тонкую регуляцию. Тем не менее, идея эта никуда не делась. АФК есть, и с ними действительно надо бороться в случае инфаркта и инсульта. И сейчас наблюдается тренд на создание препаратов с минимальным системным действием, которые бы проникали только в митохондрии и работали бы только локально. Как правило, к таким антиоксидантам пришивают уже известные нам липофильные катионы (рис. 5). Один из таких примеров — уже упомянутый ион Скулачева SkQ1 [19], [24].
В клетках существуют собственные антиоксидантные системы. Например, фермент супероксиддисмутаза преобразует опасный супероксидный анион радикал (О2*—) в кислород и пероксид водорода. Пероксид водорода тоже считается АФК, которая может вызвать окислительный стресс. Для его утилизации работает фермент каталаза, разлагающий пероксид водорода до воды и кислорода.
Например, описано несколько случаев тяжелого отравления витамином А [25]. Для других антиоксидантов также были показаны побочные эффекты [26].
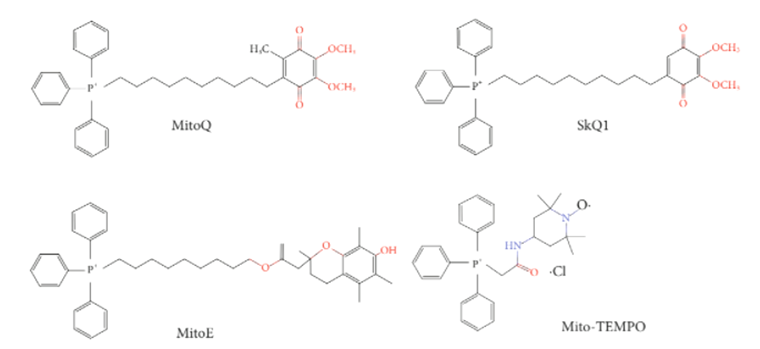
Рисунок 5. Антиоксиданты, соединенные с липофильными катионами.
Самое интересное в этой истории, что к окислительному стрессу можно подготовиться, если тренироваться! Сейчас огромное количество исследований ([27–30] — это только микроскопическая часть!) посвящена так называемому прекондиционированию, или гипоксической тренировке. В нашей лаборатории даже проводился такой эксперимент. Если изолированное сердце немного, буквально 5 минут, подержать в гипоксии без кислорода, а потом снова добавить кислород, повторить пару раз и таким образом потренировать, а потом устроить уже длительную гипоксию минут на 30, то у такого сердца будет намного меньше повреждений, чем у сердца без предварительной тренировки. И так можно натренировать целый организм, просто занимаясь спортом. Очень хороший пример — это плавание с погружением под воду, где нужно задерживать дыхание. Но и любая другая нагрузка может подойти, потому что во время тренировки мышцы активно тратят кислород и создается локальная гипоксия в мышце. Такая тренировка мышц помогает адаптироваться не только им самим, но одновременно защищает мозг или сердце от обширных повреждений при инсульте или инфаркте.
Итак, мы рассмотрели, как устроена ЭТЦ митохондрий, как производится АТФ, зачем нам нужен кислород. Но в жизни все не так просто, как на картинке. Комплексы ЭТЦ могут еще и объединяться в суперкомплексы — так называемые респирасомы (рис. 6).
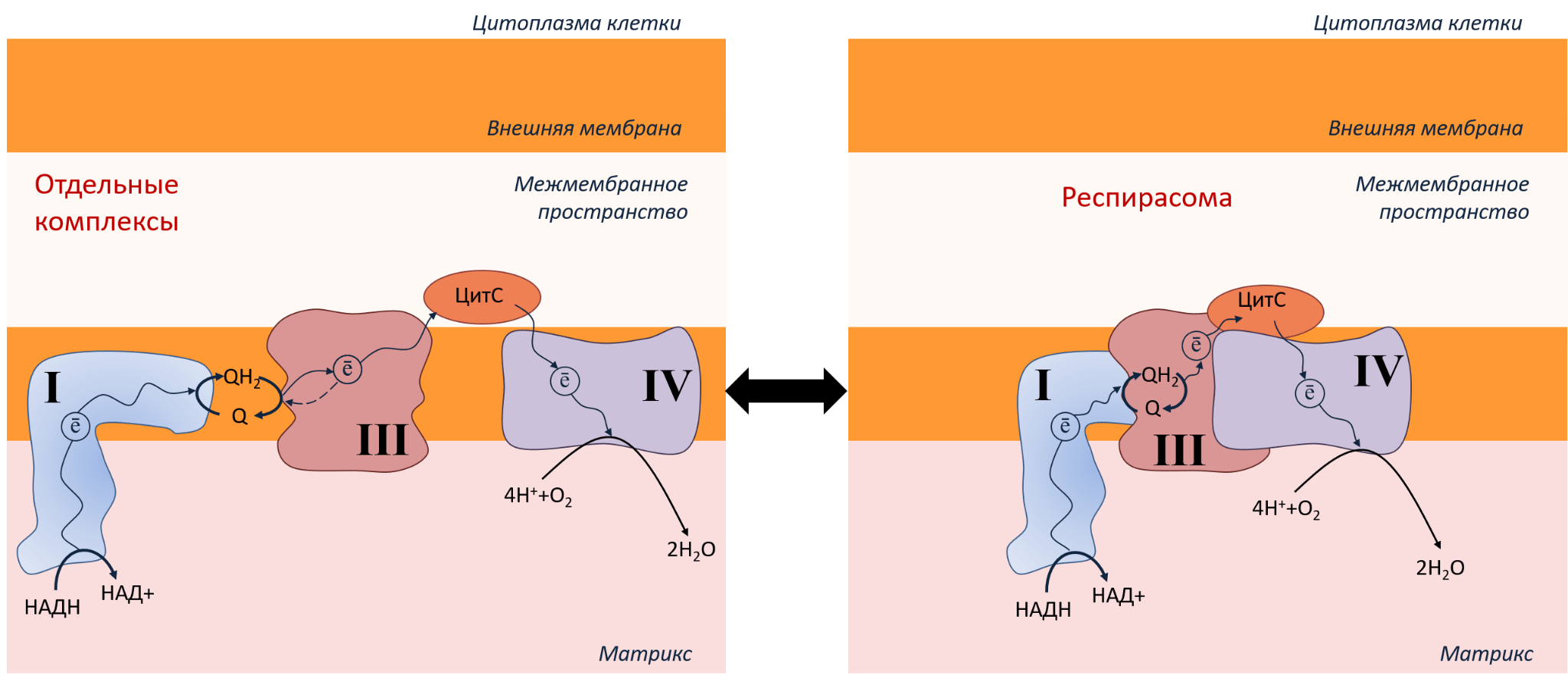
Рисунок 6. ЭТЦ в митохондриях может быть организована в виде отдельных комплексов (слева) или в виде респирасомы (справа). Переход из одного состояния в другое зависит от типов клеток и условий.
Респирасомы повышают эффективность переноса электрона по комплексам ЭТЦ, что ускоряет производство АТФ и снижает энергетические потери. Белки держатся внутри комплекса благодаря нескольким механизмам:
- за счет электростатических взаимодействий: если на поверхности одного комплекса расположены аминокислоты с положительным зарядом, а на поверхности другого комплекса — аминокислоты с отрицательным зарядом, то такие комплексы лучше удерживаются вместе;
- с помощью специальных белков, работающих как двусторонний скотч, приклеивая комплексы друг к другу (хотя этот момент все еще обсуждается. Например, SCAFI [31], который соединяет комплексы III и IV, похоже, все-таки не участвует в формировании респирасомы [32], [33]);
- при участии особого липида, который есть только во внутренней мембране митохондрий — кардиолипина (несмотря на название, он есть не только в сердце, но и во всех митохондриях, а также у бактерий). Рассмотрим его роль подробнее.
Кардиолипин замечателен тем, что у него на отрицательно заряженную голову с фосфатом приходится целых четыре жирнокислотных хвоста, тогда как у большинства других фосфолипидов — только два (рис. 7). Этот важный липид участвует и в сборке суперкомплексов, и вообще поддерживает правильную структуру крист митохондрий. Если кардиолипин окисляется, то в митохондрии образуется много АФК и запускается программа запрограммированной клеточной гибели — апоптоз. Для нормальной работы он должен дозреть (приобрести необходимую химическую структуру), в этом ему помогает фермент тафаззин. Когда работа фермента нарушена, кардиолипин не созревает правильно — так происходит при особом заболевании — синдроме Барта [34], [35]. Хорошая новость состоит в том, что сейчас разрабатывается препарат, избирательно взаимодействующий с кардиолипином и восстанавливающий его функцию — эламипретид. Сейчас он проходит клинические испытания, и разработчики связывают с ним большие надежды.
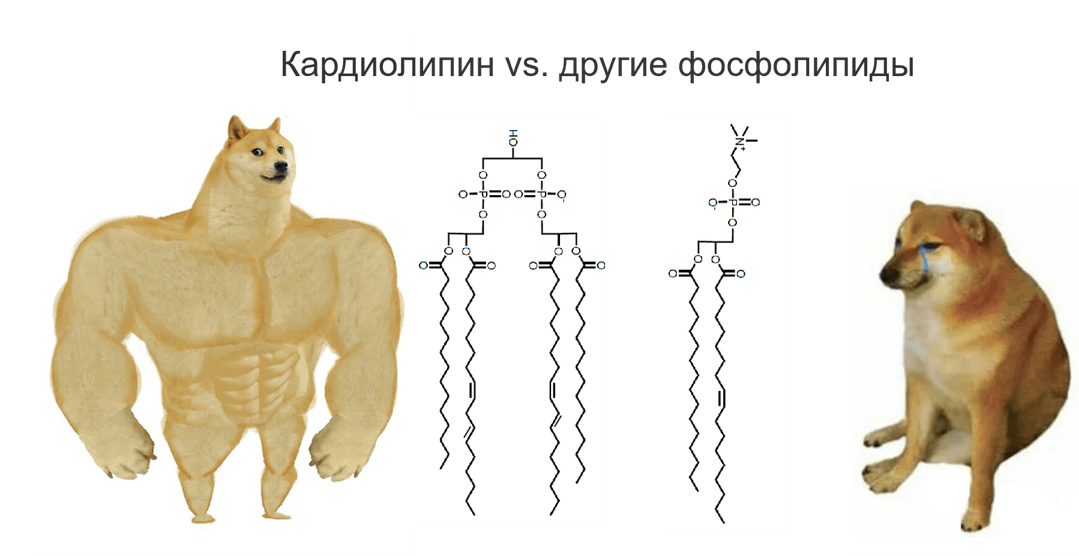
Рисунок 7. Принцип строения кардиолипина и других фосфолипидов.
рисунок автора
Как митохондрии управляют судьбой клетки?
Мы уже несколько раз упоминали апоптоз — запрограммированную клеточную гибель [36]. Это важный процесс, избавляющий нас от старых или поврежденных клеток. И этот процесс тоже контролируется митохондриями. В ответ на стресс клетка начинает производить специальные проапоптотические белки (Bcl-2-белки — Bax и Bak), работающие как особые сигналы для митохондрий. При получении таких сигналов митохондрии набухают, в них образуется специальная пора. Из нее наружу выходят молекулы: цитохром С, флавопротеины, АФК, митохондриальная ДНК (мтДНК), которые, попадая в цитоплазму, служат сигналами уже для самой клетки и запускают ее гибель. Это настолько важный фундаментальный процесс, что его, конечно, хотелось бы «приручить». Причем в некоторых случаях нам надо предотвратить апоптоз, например, при пересадке органов (чтобы трансплантат прижился и не начал отмирать), в других, наоборот, запустить — например, при раковых заболеваниях. Одно из соединений, способное блокировать открытие поры, — циклоспорин А [37]. Но у него есть дополнительное системное действие на организм — он блокирует Т-клетки, вызывая иммуносупрессию. Его уже используют при трансплантации тканей, чтобы собственные иммунные клетки не начали атаковать пересаженный орган, но вообще он умеет и апоптоз предотвращать. Некоторые другие соединения, блокирующие апоптоз, сейчас проходят клинические испытания.
С другой стороны, иногда нужно индуцировать апоптоз, например, в онкологии. Уже одобренный и используемый препарат венетоклакс как раз воздействует на сигналы апоптоза [38]. Еще один интересный подход — использование прооксидантов, запускающих окислительный стресс и апоптоз, в терапии рака [39]. Сейчас разрабатываются специальные препараты, которые бы убивали клетки протистов — наших паразитов (лямблии, трихомонады, амебы и др.), но при этом не вредили бы клеткам человека [2].
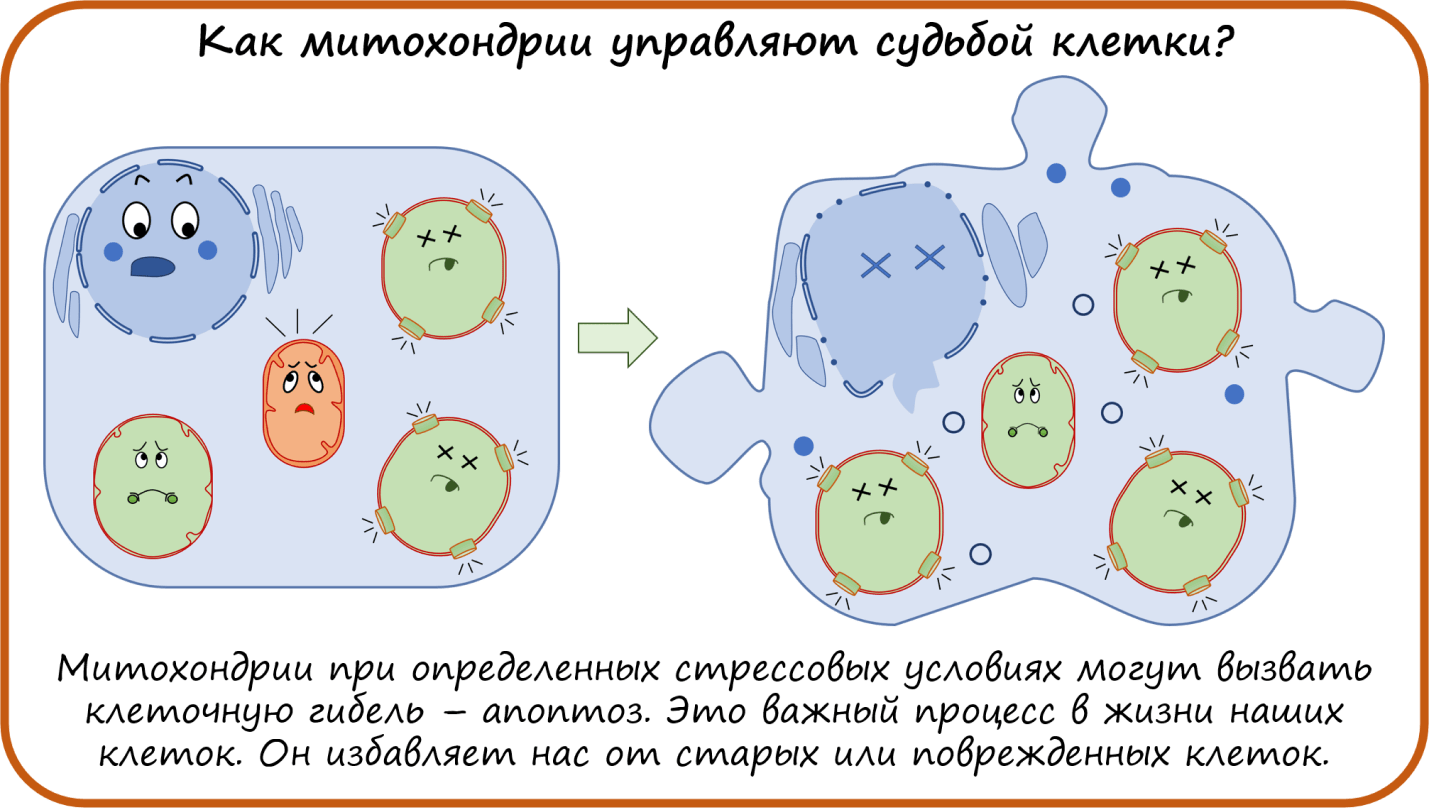
Вот мы и рассмотрели функции митохондрии как источника энергии и самонаводящейся ракеты при индукции апоптоза. Но кроме этого, митохондрии еще участвуют в синтезе белков, кофакторов, гормонов, нуклеотидов, что делает их еще более важными и ценными.
Чем занимаются митохондрии?
Как митохондрии размножаются?
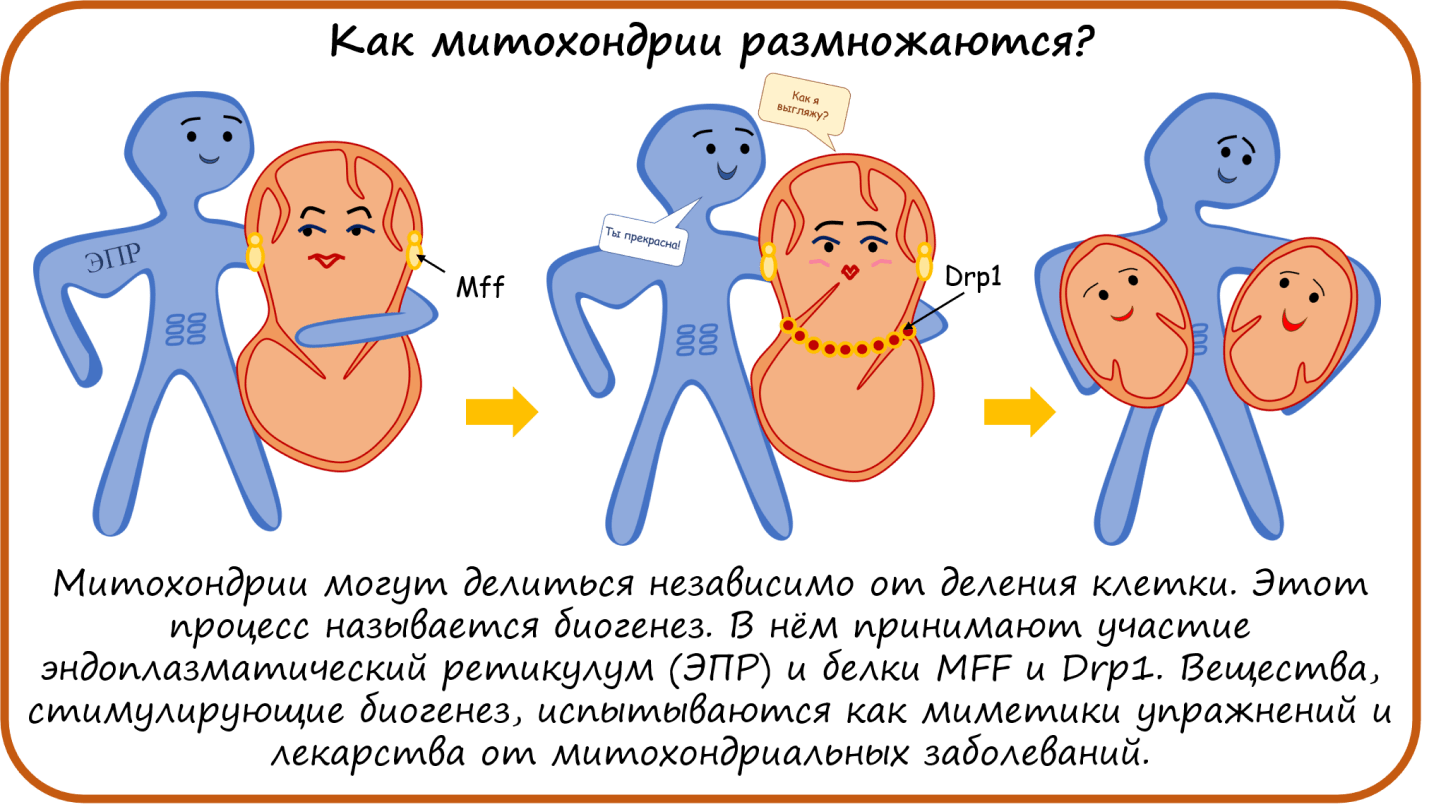
Итак, мы переходим к тому, чем живут митохондрии, пока мы их не видим. Во-первых, митохондрии умеют размножаться независимо от клетки! Этот процесс называется биогенез. Он связан с бактериальным прошлым митохондрий (рис. 8). На заре жизни на Земле, когда цианобактерии начали активно производить кислород, повергнув в шок только что зародившуюся жизнь , одна архея решила обзавестись симбионтом, который этот кислород умел выгодно использовать [40], [41]. Этим симбионтом стала альфапротеобактерия, впоследствии ставшая митохондрией. И хотя этому слиянию уже около 2 млрд лет, и митохондрия не может выжить вне клетки больше нескольких часов, все же многие автономные черты она сохранила. Например, собственную ДНК, кодирующую 13 белков и несколько пептидов, и способность делиться.
До «кислородной катастрофы» жизнь на Земле была анаэробной. Первые жители Земли, археи и бактерии, использовали аноксигенный (то есть бескислородный) фото- или хемосинтез для получения энергии. Все изменилось около 2,8 млрд лет назад с появлением цианобактерий, которые «создали» ЭТЦ, умеющую разлагать воду для получения электронов. Побочным продуктом этого процесса оказался кислород — яд для всех анаэробных обитателей нашей доисторической планеты. Появление аэробных бактерий, способных использовать кислород как конечный акцептор электронов в ЭТЦ, стало настоящим эволюционным прорывом. Именно эти бактерии стали прародительницами митохондрий. Подробнее читайте на «Биомолекуле» [40].
Большинство митохондриальных генов в процессе эволюции переместилось в клеточную ДНК, и только небольшая часть осталась в митохондриальном геноме.

Рисунок 8. Полет фантазии на тему происхождения митохондрий по мотивам «Рождения Венеры» Сандро Боттичелли.
рисунок автора
Один из вариантов деления митохондрии — это деление пополам. И в этом митохондрии помогает эндоплазматический ретикулум (ЭПР) и способствует белок MFF. Готовую разделиться митохондрию как бусы опоясывают белки Drp-1, к ним присоединяется пояс из белков динаминов (Dyn2) (хотя, возможно, это необязательно), и наконец из одной митохондрии образуются две независимые митохондрии [42], [43].
Как использовать эти знания на практике? Как нетрудно догадаться, чем больше митохондрий — тем больше вырабатывается энергии в виде АТФ! Поэтому сейчас активно разрабатываются вещества, стимулирующие биогенез митохондрий. Некоторые такие вещества уже известны, например, Пиоглитазон и Росиглитазон, применяемые для лечения диабета, показали себя с новой стороны — они способны увеличивать количество митохондрий. И допинг AICAR, который мимикрирует под АМФ, тоже приводит к биогенезу митохондрий. Некоторые растительные экстракты обладают схожим действием, например, ресвератрол. Сейчас он очень активно исследуется, но продается пока только как БАД. Также на биогенез митохондрий влияет витамин В3 [2].
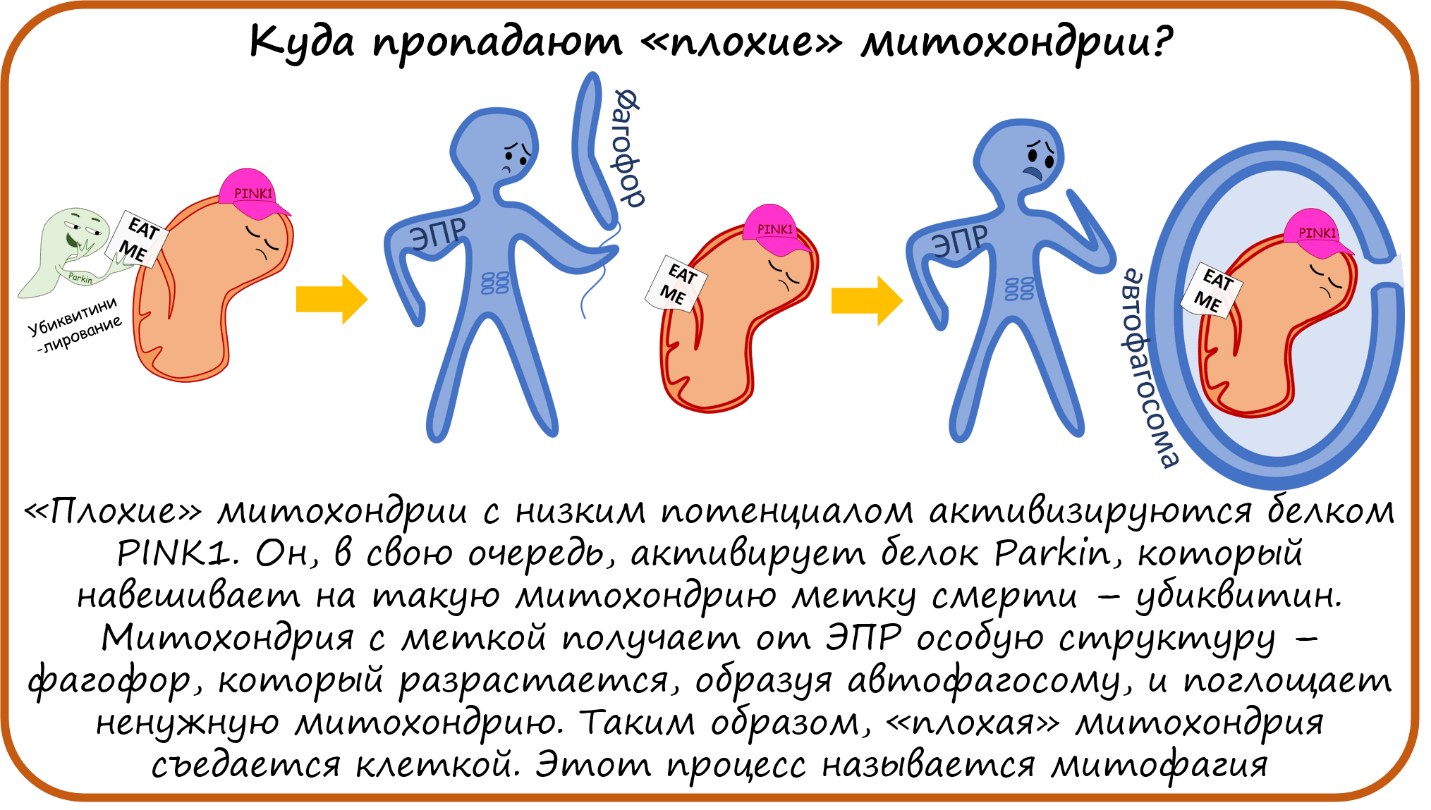
Куда пропадают «плохие» митохондрии?
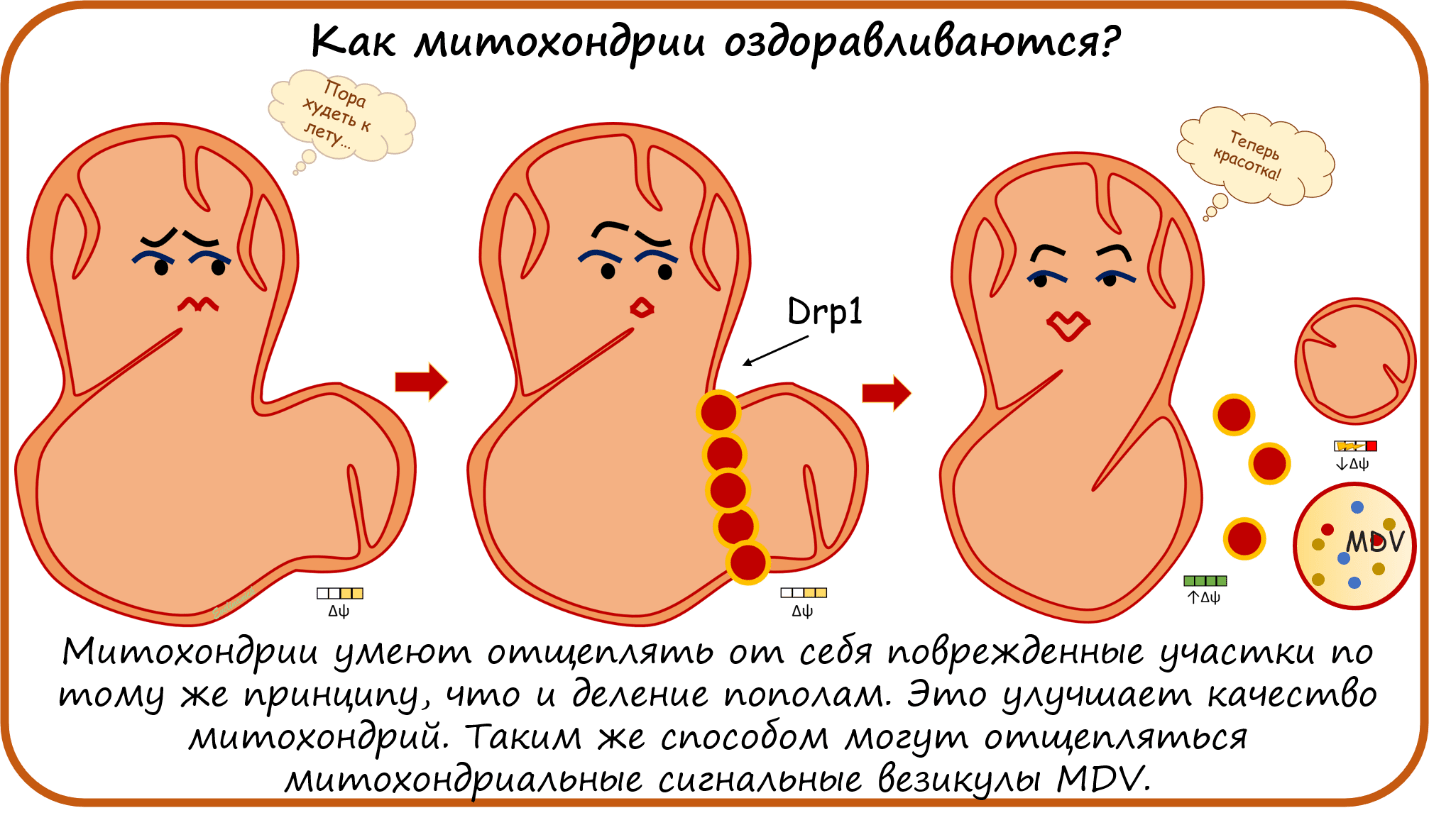
Мы обсуждали, что мембранный потенциал — это очень важный параметр благополучия митохондрий, от которого зависит и выработка АТФ, и генерация АФК, и стимуляция апоптоза. И клетки чувствуют, какие митохондрии здоровы — т.е. с нормальным потенциалом, — а с какими дело плохо. А так как митохондрии используют потенциал, чтобы пропускать в себя нужные соединения, в том числе субстраты ЭТЦ, то снижение потенциала ослабляет и эту способность. Получается порочный круг: доноры электронов, увеличивающие потенциал, не могут попасть в митохондрию, если ее потенциал недостаточно высок. Такие отработанные бесполезные митохондрии с низким потенциалом активизируются белком PINK1. Он, в свою очередь, активирует белок Parkin, который навешивает на такую митохондрию метку смерти — полиубиквитин. Митохондрия с меткой получает особую структуру — фагофор — от ЭПР, который разрастается, образуя автофагосому, и поглощает ненужную митохондрию. Таким образом старая или поломанная митохондрия съедается клеткой. Этот процесс называется митофагия [44], [45].
Конечно, большую митохондрию клетке сложно поглотить целиком. Обычно все происходит немного по-другому. В какой-то митохондрии повреждается небольшой кусочек. И на помощь приходят те же белки Drp1, участвующие в делении митохондрий. Они окружают этот кусочек и отщепляют его от митохондрии. В итоге оставшаяся митохондрия становится лучше и краше, а маленький проблемный кусочек подвергается митофагии. Но от митохондрии может отщепиться не только кусочек внешней и внутренней мембраны, такая вот мини-митохондрия, но и принципиально другая везикула, которая называется Mitochondria-Derived Vesicle (MDV) (рис. 9) [46], [47]. Митохондриальные везикулы чаще всего разрушаются клетками в процессе митофагии, но могут и выбираться из клеток наружу. Так как митохондрия имеет бактериальное происхождение, то белки на поверхности митохондрий вне клеток воспринимаются иммунной системой как чужеродные.
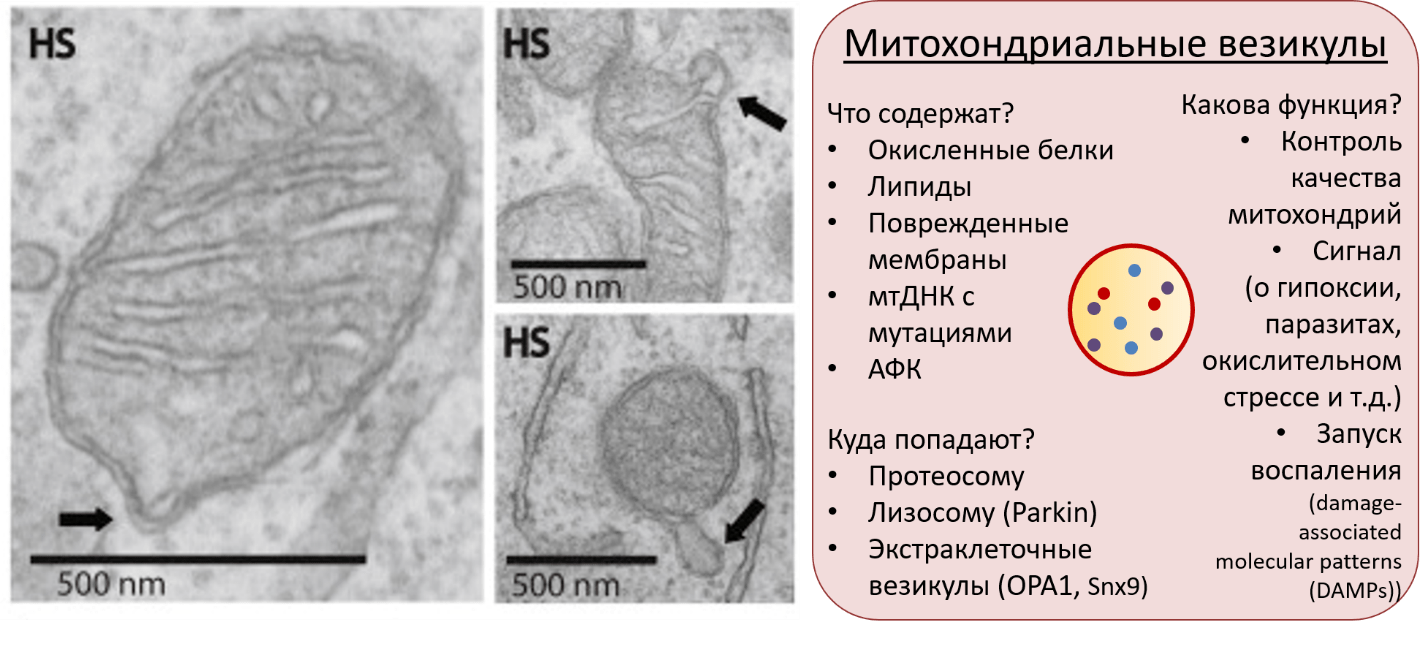
Рисунок 9. Слева — просвечивающие электронные микрофотографии митохондриальных везикул (mitochondria-derived vesicle, MDV). Справа — основные свойства MDV.
Мы помним, что митофагию регулирует белок Parkin. Это название говорит само за себя: этот белок ассоциирован с болезнью Паркинсона. Что происходит, если нарушается работа этого белка? Нарушается митофагия → увеличивается количество MDV, они появляются на поверхности клеток → иммунные Т-клетки воспринимают митохондриальные белки на поверхности клеток, в первую очередь нейронов, как чужеродные, и атакуют нейроны → нейроны отмирают. Это один из механизмов развития паркинсонизма [46], [47]. Разумеется, на эту систему пытаются воздействовать разными препаратами. Один из них, Уролитин А, уже доступен в виде БАД, но пока как лекарство он не зарегистрирован, ведутся клинические испытания [48], [49].
Как митохондрии сливаются?
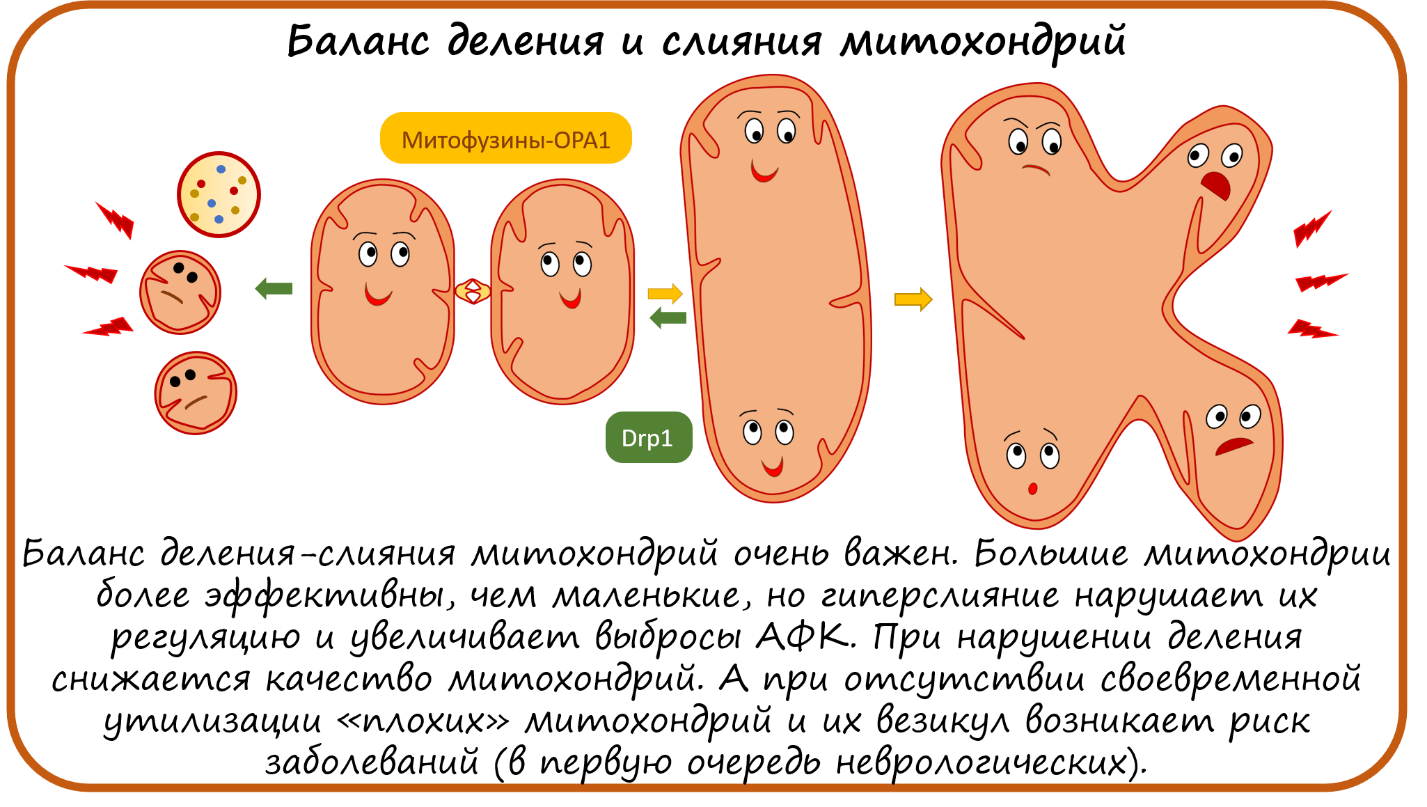
Что еще могут сделать митохондрии? Митохондрии могут сливаться! Причем поговорка «одна голова хорошо, а две — лучше» в этом случае оправдана. Слитая митохондрия действительно работает эффективнее. Управляют слиянием митохондрий белки Митофузины и ОРА1. Нарушение работы белка ОРА1, ответственного за слияние митохондрий, приводит к наследственной слепоте, отсюда и его название — оно происходит от optical atrophy (переводится как «оптическая нейропатия Кьера» — это доминантная атрофия зрительного нерва). Кроме того, появились данные, что ОРА1 также участвует в образовании суперкомплексов [50].
Как и во всем, для благополучия клетки очень важен баланс деления—слияния митохондрий. При слишком интенсивном делении и несвоевременной деградации маленьких плохо работающих кусочков митохондрий и их везикул развивается воспаление, аутоиммунный ответ, нейродегенерация, характерная для болезней Паркинсона и Альгеймера [45–47]. И наоборот, сейчас появляется все больше данных, что гиперслияние — это тоже плохо. Гигантская слитая митохондрия менее чувствительна к сигналам клетки и образует больше АФК [51].
Более того, баланс слияния и деления важен для иммунитета. Есть даже такое понятие как MAVS — митохондриальный противовирусный сигнальный путь, запускающий выработку интерферонов и провоспалительных цитокинов. Когда в клетку проникают паразиты, митохондрии могут это почувствовать и сами стимулируют выработку в клетке провоспалительных факторов, противовирусных интерферонов и т.д. Но некоторые бактерии и вирусы умеют перепрограммировать митохондрии, чтобы они не сообщали клетке о проблеме. И нарушают при этом слияние или деление митохондрий. Например, коронавирусы вызывают гиперслияние митохондрий, что подавляет выработку противовирусных интерферонов [18], [52]. Так, РНК всем известного вируса SARS-CoV-2, вызывающего COVID-19, способна проникать в митохондрию и подавлять «хороший» иммунный ответ посредством MAVS. При этом вирус подавляет митофагию, тем самым увеличивая долю неактивных митохондрий, которые генерируют АФК, самопроизвольно разрушаются, выбрасывая мтДНК в цитоплазму, что гиперстимулирует неспецифический иммунный ответ [53], [54].
Все ли митохондрии одинаковы?
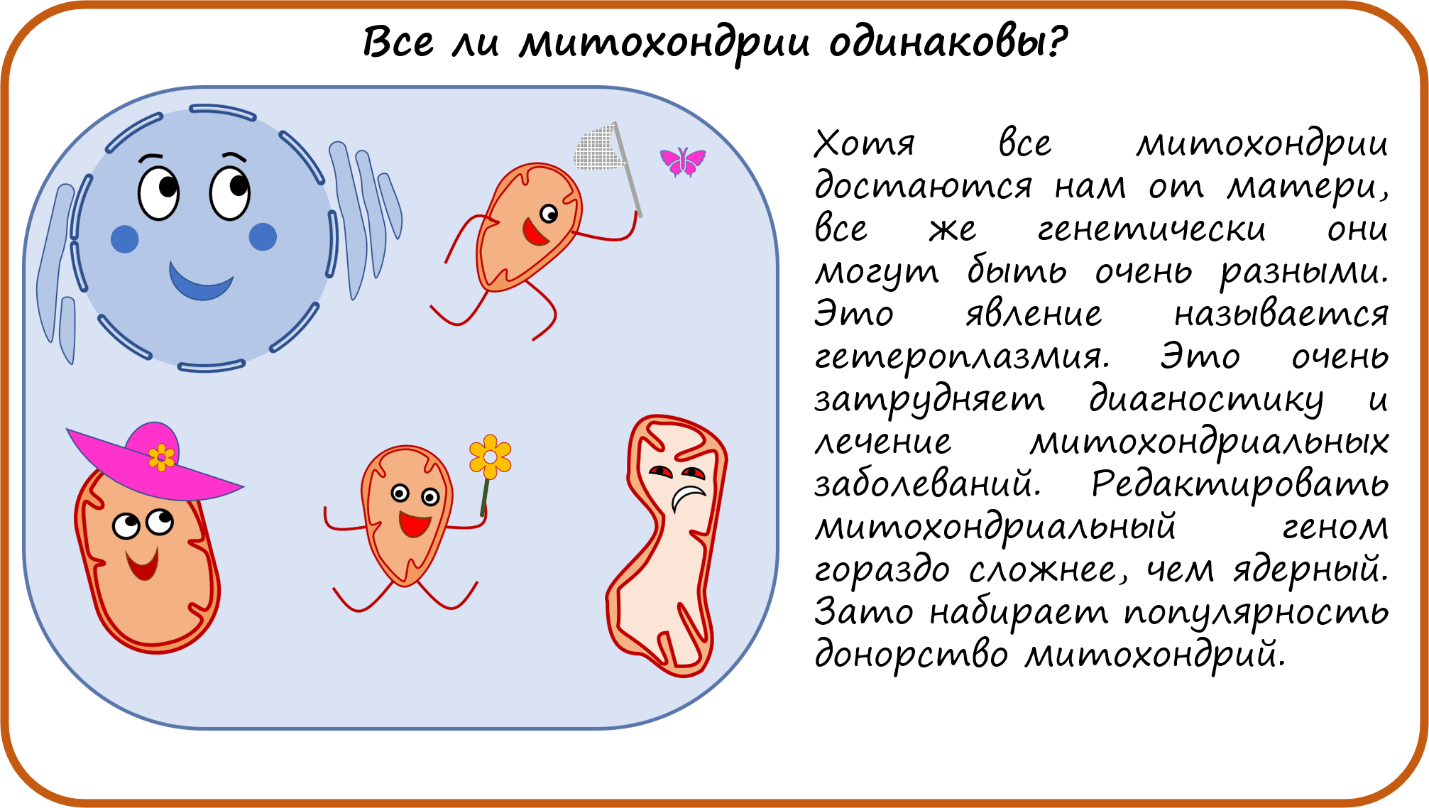
Итак, мы обсудили типичное поведение митохондрий, но все ли митохондрии в клетке одинаковы? Все свои митохондрии мы получаем только от матери! Но, в отличие от генетического материала ядра, митохондрии в клетках могут немного отличаться. Это явление называется гетероплазмия. И это боль всех врачей, которые лечат митохондриальные заболевания. Из-за того, что у разных пациентов может быть разное соотношение хороших и плохих митохондрий, митохондриальные заболевания проявляются очень по-разному: от легкого чувства усталости до тяжелых нейро- и кардиопатий и пренатальной гибели. Причины митохондриальных заболеваний, как правило, кроются в мтДНК. В нынешнюю эру редактирования генома это был бы лакомый кусочек для исследователей, но, к сожалению, редактировать митохондриальную ДНК оказалось сложнее, чем эукариотическую. В митохондрию намного сложнее проникнуть. Знаменитая CRISPR-Cas система там работает с ограничениями, и пока очень мало исследований, в которых бы эти ограничения обходили. Тем не менее, работы в этом направлении продолжаются [55].
А вот в чем достигнут немалый прогресс за последние пару лет — так это в донорстве митохондрий [56]. В 2015 году Великобритания разрешила донорство митохондрий для ЭКО. И с тех пор родилось уже немало детей от «3 родителей», когда ядро зиготы содержит материнские и отцовские гены, а митохондрии дети получают от другой женщины-донора. Эта технология позволила женщинам с митохондриальными заболеваниями родить совершенно здоровых детей. Пока мало стран, которые легализовали эту процедуру, но есть надежда на то, что она станет рутинной, как классическое ЭКО.
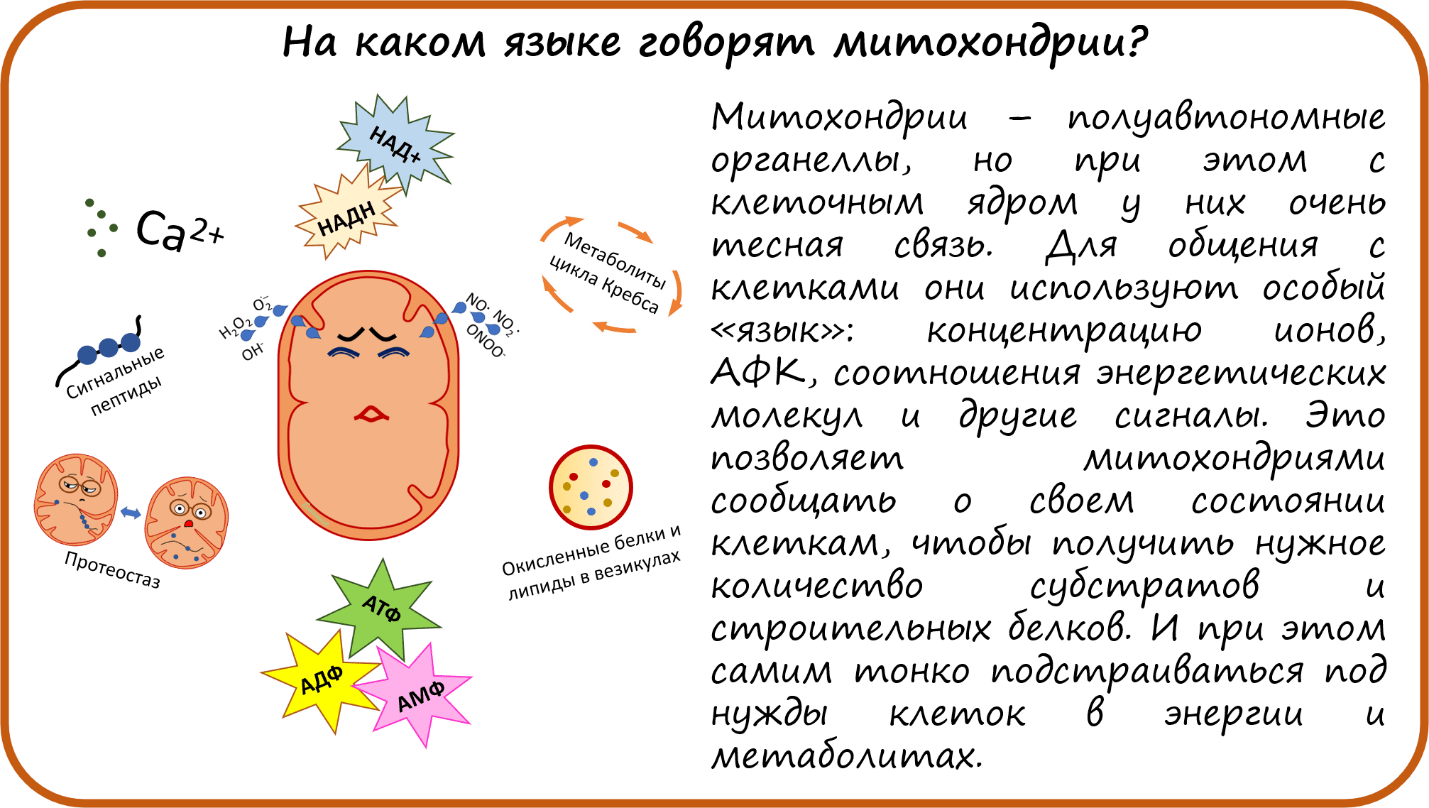
На каком языке говорят митохондрии?
Митохондрии — полуавтономные органеллы, которые живут в нашей клетке своей собственной жизнью, но при этом с клеткой у них очень тесная связь [57], [58]. Для общения с клетками (crosstalk) они используют особый язык. Что это за язык? Во-первых, митохондрии используют АФК как сигнальные молекулы, пул АТФ и соотношения АТФ/(АДФ+АМФ), соотношение НАДН/ НАД+, концентрацию ионов (в первую очередь кальция), метаболиты цикла Кребса, сигнальные пептиды (пока известен только один, но не исключено, что их много) [59]; еще одна необычная форма взаимодействия — везикулы с окисленными белками [46], [47]. Кроме того, клетка чувствительна к такому явлению как протеостаз — баланс синтеза и распада белков в митохондриях [18]. Все это позволяет митохондриями сообщать о своем состоянии клеткам, чтобы получить нужные метаболиты и белки, ведь именно в ядерном геноме закодирована большая часть митохондриальных белков. И наоборот, митохондрии «прислушиваются» к сигналам клеток, чтобы своевременно отвечать на ее потребности в энергии и метаболитах.
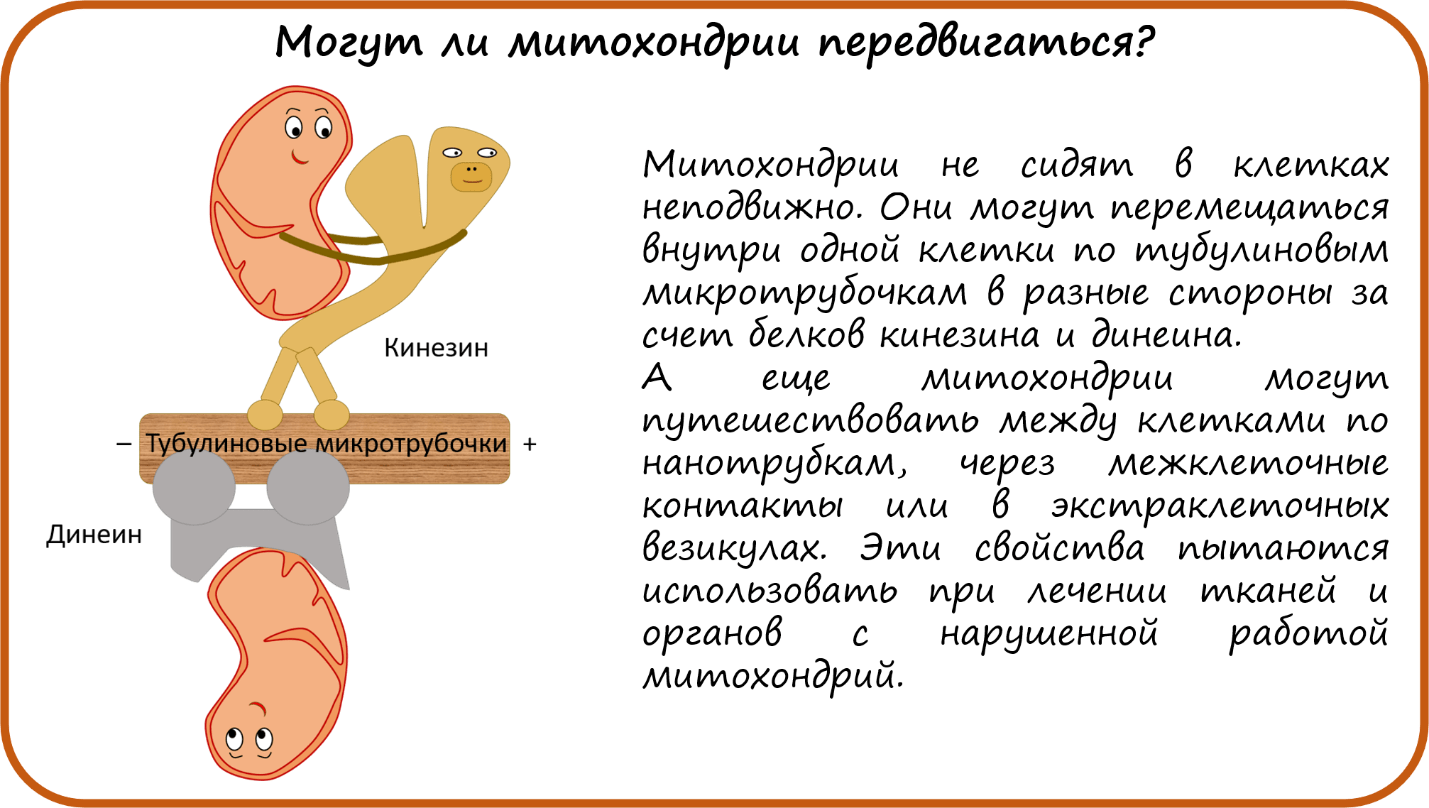
Могут ли митохондрии передвигаться?
Митохондрии не сидят в клетке на одном и том же месте всю жизнь. Они могут перемещаться, двигаясь по тубулиновым микротрубочкам с помощью белков кинезина и динеина, так же, как другие органеллы, например, эндосомы [60], [61]. Самый известный пример такого движения митохондрий — по аксону в нервной клетке. Митохондрии изначально содержатся только в соме клетки, возле ядра, но многие энергозатратные процессы в нейроне идут именно в синапсе, где происходит выброс и захват медиаторов. Поэтому митохондрии из сомы вынуждены путешествовать по микротрубочкам к синапсу. Причем они останавливаются при повышении концентрации кальция, а дополнительно их можно зафиксировать с помощью особого белка синафилина, который работает как знак «СТОП» [62].
Более того, митохондрии могут перемещаться от клетки к клетке! И даже по разным механизмам: по нанотрубкам, через межклеточные контакты или в экстраклеточных везикулах [60]. Последний способ часто встречается у раковых клеток, которые легко захватывают митохондрии из окружения. Это свойство митохондрий недавно использовали во время операции на открытом сердце новорожденных детей с дефектом в определенной области сердца [62]. Им ввели суспензию здоровых митохондрий из собственной здоровой мышцы, и это сработало! Врачам удалось полностью восстановить функцию сердечной мышцы.
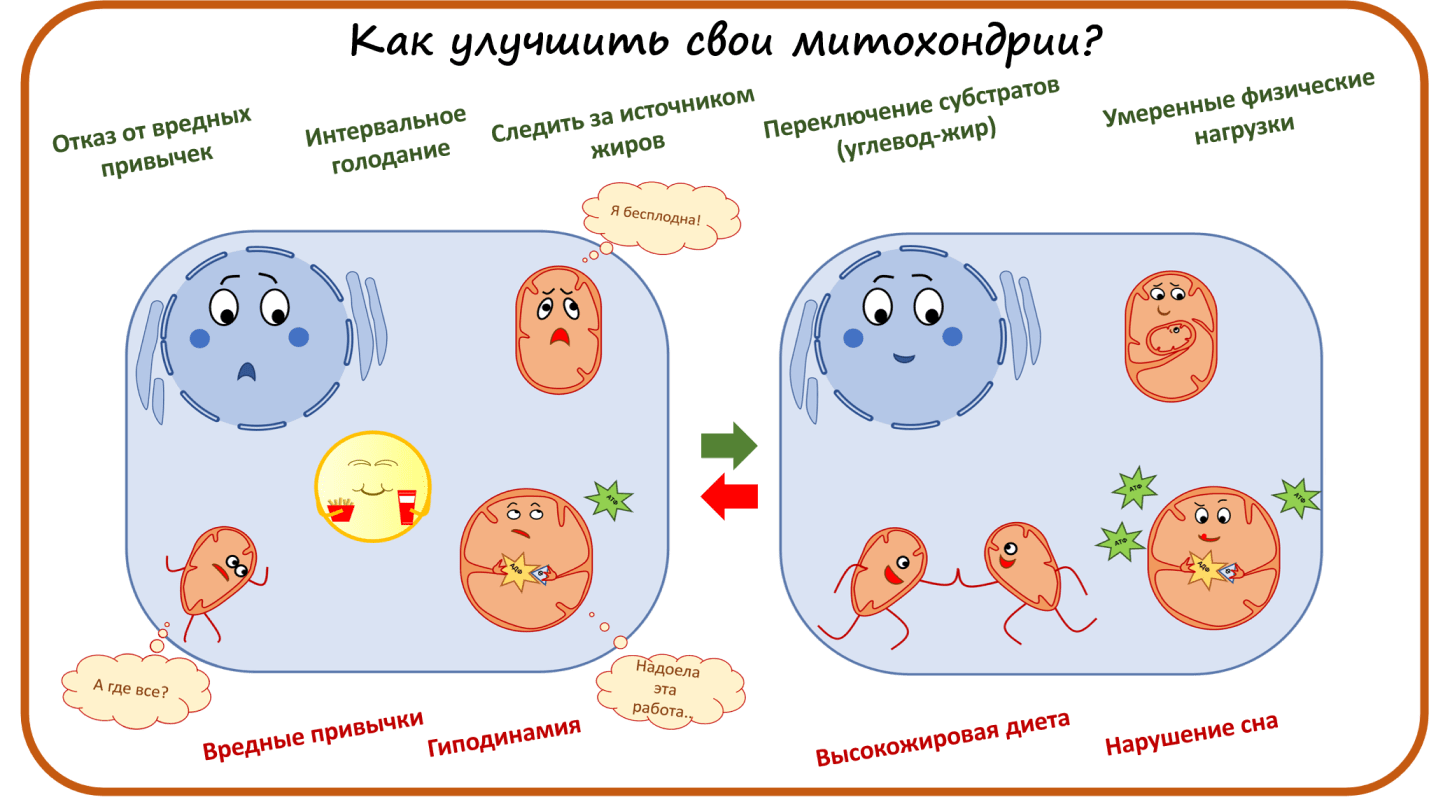
Как улучшить свои митохондрии?
Итак, мы рассмотрели все, что известно о жизни митохондрий в наших клетках. Как они производят энергию, делятся, сливаются, умирают, поглощаются клетками. И рассмотрели несколько примеров стратегий разработки митохондриальных препаратов, воздействующих на эти аспекты жизни митохондрий. На сегодняшний день зарегистрированных митохондриальных препаратов пока нет, но идет множество клинических и доклинических испытаний, и, я надеюсь, в самом ближайшем будущем митохондриальные препараты будут доступны для пациентов с митохондриальными заболеваниями. Несмотря на достижения науки, позволяющие воздействовать точечно на какие-то конкретные процессы в митохондриях, все же многие метаболические нарушения имеют комплексное воздействие на митохондрии [18], [29], [64], [65]. Например, высокожировая диета, гиподинамия, депривация сна, вредные привычки приводят как к уменьшению количества митохондрий в клетках и нарушению их биогенеза, так и к появлению «плохих» митохондрий, которые хуже вырабатывают АТФ. Это, в свою очередь, приводит к накоплению липидов в клетке, которые сами по себе могут быть токсичными . Такой эффект лежит в основе сахарного диабета второго типа.
Патологическое накопление липидов в нежировых клетках приводит к такому синдрому, как липотоксичность, вследствие которой развиваются серьезные нарушения функционирования органов. Хотя до конца это явление не изучено, однако считается, что оно приводит к нарушению работы митохондрий, развитию хронического воспаления и инсулиновой резистентности [66], [67]. В частности, мы показали, что накопление липидов в липидных каплях скелетных мышц пациентов с ожирением приводит к заметному изменению состояния цитохромов ЭТЦ митохондрий.
Но есть и обратный путь. Изменяя образ жизни, можно улучшить свои митохондрии без особых сложностей. Наиболее важными являются три аспекта образа жизни, за которыми стоит следить: 1 — питание, 2 — физическая активность, 3 — вредные привычки. Например, интервальное голодание в течение 8–10 часов оказывает положительный эффект на состояние митохондрий. То есть, фактически, если не есть ночью, этого вполне достаточно, чтобы немного улучшить собственные митохондрии [68]. Источник жиров — еще один немаловажный аспект, который следует учитывать. Например, насыщенные жиры, характерные для фастфуда, и полиненасыщенные жиры из рыбы или нерафинированного оливкового масла совершенно по-разному влияют на работу митохондрий (выбор очевиден) [69–71]. Неожиданный эффект дает «переключение субстратов» (с углеводов на жиры и обратно), потому что развивает так называемую метаболическую пластичность митохондрий [72], [73].
Мы обсуждали, что физические упражнения способствуют созданию локальной гипоксии, которая прекрасно тренирует органы нашего организма к стрессовым условиям [27–30]. Особо заметные результаты показали высокоинтенсивные интервальные тренировки, увеличивающие число митохондрий и улучшающие их качество [74] даже у людей старшего возраста [75] или с метаболическими заболеваниями [76]. Впрочем, умеренные физические нагрузки тоже дают значимый эффект [77].
Влияние вредных привычек, таких как курение и чрезмерное употребление алкоголя, на состояние митохондрий было изучено еще в прошлом веке [78], [79]. Сейчас фокус исследователей больше направлен на разработку препаратов, противостоящих этим нарушениям [80], [81], однако волшебной пилюли пока ждать не приходится.
В заключение хотелось бы сказать, что, хотя сейчас и разрабатывается множество перспективных препаратов, все же пока самый лучший способ держать митохондрии в тонусе — спорт, сбалансированное питание и отказ от вредных привычек!
Желаю, чтобы ваши митохондрии были здоровы и счастливы!

Видеолекцию автора можно посмотреть на YouTube.
Работа автора поддержана фондом РНФ (грант 21-74-00026)
Литература
- Oliver M. Russell, Gráinne S. Gorman, Robert N. Lightowlers, Doug M. Turnbull. (2020). Mitochondrial Diseases: Hope for the Future. Cell. 181, 168-188;
- Michael P. Murphy, Richard C. Hartley. (2018). Mitochondria as a therapeutic target for common pathologies. Nat Rev Drug Discov. 17, 865-886;
- Nadezda A. Brazhe, Evelina I. Nikelshparg, Adil A. Baizhumanov, Vera G. Grivennikova, Anna A. Semenova, et. al. (2021). SERS uncovers the link between conformation of cytochrome c heme and mitochondrial membrane potential — Cold Spring Harbor Laboratory;
- Как раскрыть секреты цитохрома с;
- Nicholls D. G. Bioenergetics, 4th edition. Academic Press, 2013, — 419 p.;
- E. A. LIBERMAN, V. P. TOPALY, L. M. TSOFINA, A. A. JASAITIS, V. P. SKULACHEV. (1969). Mechanism of Coupling of Oxidative Phosphorylation and the Membrane Potential of Mitochondria. Nature. 222, 1076-1078;
- Balaraman Kalyanaraman, Gang Cheng, Micael Hardy, Olivier Ouari, Marcos Lopez, et. al.. (2018). A review of the basics of mitochondrial bioenergetics, metabolism, and related signaling pathways in cancer cells: Therapeutic targeting of tumor mitochondria with lipophilic cationic compounds. Redox Biology. 14, 316-327;
- Xuechen Li, Yuping Zhao, Junling Yin, Weiying Lin. (2020). Organic fluorescent probes for detecting mitochondrial membrane potential. Coordination Chemistry Reviews. 420, 213419;
- Roman A. Zinovkin, Andrey A. Zamyatnin. (2019). Mitochondria-Targeted Drugs. CMP. 12, 202-214;
- Soyoung Kim, Ho Yeon Nam, Jiyoun Lee, Jiwon Seo. (2020). Mitochondrion-Targeting Peptides and Peptidomimetics: Recent Progress and Design Principles. Biochemistry. 59, 270-284;
- Davide Guerrieri, Hyo Youl Moon, Henriette van Praag. (2017). Exercise in a Pill: The Latest on Exercise-Mimetics. BPL. 2, 153-169;
- Giancarlo Solaini, Alessandra Baracca, Giorgio Lenaz, Gianluca Sgarbi. (2010). Hypoxia and mitochondrial oxidative metabolism. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1797, 1171-1177;
- Edward T. Chouchani, Victoria R. Pell, Edoardo Gaude, Dunja Aksentijević, Stephanie Y. Sundier, et. al.. (2014). Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS. Nature. 515, 431-435;
- Ru‑Zhou Zhao, Shuai Jiang, Lin Zhang, Zhi‑Bin Yu. (2019). Mitochondrial electron transport chain, ROS generation and uncoupling (Review). Int J Mol Med;
- Johann Grundlingh, Paul I. Dargan, Marwa El-Zanfaly, David M. Wood. (2011). 2,4-Dinitrophenol (DNP): A Weight Loss Agent with Significant Acute Toxicity and Risk of Death. J. Med. Toxicol.. 7, 205-212;
- Sérgio Teixeira Ferreira, Fernanda Guarino De Felice. (2007). Neuroprotective actions of 2,4-dinitrophenol: Friend or foe?. Dement. neuropsychol.. 1, 334-338;
- Weiqi Hong, Fei Mo, Ziqi Zhang, Mengyuan Huang, Xiawei Wei. (2020). Nicotinamide Mononucleotide: A Promising Molecule for Therapy of Diverse Diseases by Targeting NAD+ Metabolism. Front. Cell Dev. Biol.. 8;
- Молодость в энергии;
- Старение: остановить нельзя смириться;
- Антиоксиданты против пиелонефрита;
- Helmut Sies, Dean P. Jones. (2020). Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat Rev Mol Cell Biol. 21, 363-383;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Сказка-комикс о великой битве между радикалами и антиоксидантами;
- Qian Jiang, Jie Yin, Jiashun Chen, Xiaokang Ma, Miaomiao Wu, et. al.. (2020). Mitochondria-Targeted Antioxidants: A Step towards Disease Treatment. Oxidative Medicine and Cellular Longevity. 2020, 1-18;
- Olson J.M., Ameer M.A., Goyal A. (2021). Vitamin A Toxicity. StatPearls Publishing. 1;
- Aalt Bast, Guido R.M.M Haenen. (2002). The toxicity of antioxidants and their metabolites. Environmental Toxicology and Pharmacology. 11, 251-258;
- Oleg G. Deryagin, Svetlana A. Gavrilova, Khalil L. Gainutdinov, Anna V. Golubeva, Vyatcheslav V. Andrianov, et. al.. (2017). Molecular Bases of Brain Preconditioning. Front. Neurosci.. 11;
- Dick H. J. Thijssen, Andrew Redington, Keith P. George, Maria T. E. Hopman, Helen Jones. (2018). Association of Exercise Preconditioning With Immediate Cardioprotection. JAMA Cardiol. 3, 169;
- Jesus R. Huertas, Rafael A. Casuso, Pablo Hernansanz Agustín, Sara Cogliati. (2019). Stay Fit, Stay Young: Mitochondria in Movement: The Role of Exercise in the New Mitochondrial Paradigm. Oxidative Medicine and Cellular Longevity. 2019, 1-18;
- Scott K. Powers, Matthew Bomkamp, Mustafa Ozdemir, Hayden Hyatt. (2020). Mechanisms of exercise-induced preconditioning in skeletal muscles. Redox Biology. 35, 101462;
- Элементы: «Наличие суперкомплексов в дыхательной цепи переноса электронов обеспечивается белком SCAFI»;
- Pablo Hernansanz-Agustín, José Antonio Enríquez. (2021). Functional segmentation of CoQ and cyt c pools by respiratory complex superassembly. Free Radical Biology and Medicine. 167, 232-242;
- Ixchel Ramírez-Camacho, Oscar Flores-Herrera, Cecilia Zazueta. (2019). The relevance of the supramolecular arrangements of the respiratory chain complexes in human diseases and aging. Mitochondrion. 47, 266-272;
- Hana M. Zegallai, Grant M. Hatch. (2021). Barth syndrome: cardiolipin, cellular pathophysiology, management, and novel therapeutic targets. Mol Cell Biochem. 476, 1605-1629;
- Edoardo Bertero, Ilona Kutschka, Christoph Maack, Jan Dudek. (2020). Cardiolipin remodeling in Barth syndrome and other hereditary cardiomyopathies. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1866, 165803;
- Апоптоз, или Путь самурая;
- Cory Trankle, Clinton J. Thurber, Stefano Toldo, Antonio Abbate. (2016). Mitochondrial Membrane Permeability Inhibitors in Acute Myocardial Infarction. JACC: Basic to Translational Science. 1, 524-535;
- Jana Mihalyova, Tomas Jelinek, Katerina Growkova, Matous Hrdinka, Michal Simicek, Roman Hajek. (2018). Venetoclax: A new wave in hematooncology. Experimental Hematology. 61, 10-25;
- Shalini Mani, Geeta Swargiary, Stephen J. Ralph. (2022). Targeting the redox imbalance in mitochondria: A novel mode for cancer therapy. Mitochondrion. 62, 50-73;
- Как появились митохондрии (рассказ, похожий на сказку);
- Ястребов С. От атомов к древу. Введение в современную науку о жизни. М.: «Альпина нон-фикшн», 2018. — 704 с.;
- Tatjana Kleele, Timo Rey, Julius Winter, Sofia Zaganelli, Dora Mahecic, et. al.. (2021). Distinct fission signatures predict mitochondrial degradation or biogenesis. Nature. 593, 435-439;
- Rong Yu, Urban Lendahl, Monica Nistér, Jian Zhao. (2020). Regulation of Mammalian Mitochondrial Dynamics: Opportunities and Challenges. Front. Endocrinol.. 11;
- Konstantinos Palikaras, Eirini Lionaki, Nektarios Tavernarakis. (2018). Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nat Cell Biol. 20, 1013-1022;
- Vojo Deretic. (2015). Autophagosomes and lipid droplets: no longer just chewing the fat. EMBO J. 34, 2111-2113;
- Diana Matheoud, Ayumu Sugiura, Angélique Bellemare-Pelletier, Annie Laplante, Christiane Rondeau, et. al.. (2016). Parkinson’s Disease-Related Proteins PINK1 and Parkin Repress Mitochondrial Antigen Presentation. Cell. 166, 314-327;
- Kiran Todkar, Lilia Chikhi, Véronique Desjardins, Firas El-Mortada, Geneviève Pépin, Marc Germain. (2021). Selective packaging of mitochondrial proteins into extracellular vesicles prevents the release of mitochondrial DAMPs. Nat Commun. 12;
- Davide D’Amico, Pénélope A. Andreux, Pamela Valdés, Anurag Singh, Chris Rinsch, Johan Auwerx. (2021). Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine. 27, 687-699;
- Pénélope A. Andreux, William Blanco-Bose, Dongryeol Ryu, Frédéric Burdet, Mark Ibberson, et. al.. (2019). The mitophagy activator urolithin A is safe and induces a molecular signature of improved mitochondrial and cellular health in humans. Nat Metab. 1, 595-603;
- Sehwan Jang, Sabzali Javadov. (2020). OPA1 regulates respiratory supercomplexes assembly: The role of mitochondrial swelling. Mitochondrion. 51, 30-39;
- Rajdeep Das, Oishee Chakrabarti. (2020). Mitochondrial hyperfusion: a friend or a foe. Biochemical Society Transactions. 48, 631-644;
- Varnesh Tiku, Man-Wah Tan, Ivan Dikic. (2020). Mitochondrial Functions in Infection and Immunity. Trends in Cell Biology. 30, 263-275;
- Pankaj Prasun. (2021). COVID-19: A Mitochondrial Perspective. DNA and Cell Biology. 40, 713-719;
- Keshav K. Singh, Gyaneshwer Chaubey, Jake Y. Chen, Prashanth Suravajhala. (2020). Decoding SARS-CoV-2 hijacking of host mitochondria in COVID-19 pathogenesis. American Journal of Physiology-Cell Physiology. 319, C258-C267;
- Beverly Y. Mok, Marcos H. de Moraes, Jun Zeng, Dustin E. Bosch, Anna V. Kotrys, et. al.. (2020). A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature. 583, 631-637;
- Трое в лодке: о легализации замены митохондрий;
- Ana Victoria Lechuga‐Vieco, Raquel Justo‐Méndez, José Antonio Enríquez. (2021). Not all mitochondrial DNAs are made equal and the nucleus knows it. IUBMB Life. 73, 511-529;
- Umut Cagin, José Antonio Enriquez. (2015). The complex crosstalk between mitochondria and the nucleus: What goes in between?. The International Journal of Biochemistry & Cell Biology. 63, 10-15;
- У млекопитающих найден белок, перемещающийся из митохондрий в ядро;
- Santhanam Shanmughapriya, Dianne Langford, Kalimuthusamy Natarajaseenivasan. (2020). Inter and Intracellular mitochondrial trafficking in health and disease. Ageing Research Reviews. 62, 101128;
- Белковые моторы: на службе у человека и нанотехнологий;
- Nobutaka Hirokawa, Shinsuke Niwa, Yosuke Tanaka. (2010). Molecular Motors in Neurons: Transport Mechanisms and Roles in Brain Function, Development, and Disease. Neuron. 68, 610-638;
- Edoardo Bertero, Christoph Maack, Brian O’Rourke. (2018). Mitochondrial transplantation in humans: “magical” cure or cause for concern?. Journal of Clinical Investigation. 128, 5191-5194;
- Carlos López-Otín, Lorenzo Galluzzi, José M.P. Freije, Frank Madeo, Guido Kroemer. (2016). Metabolic Control of Longevity. Cell. 166, 802-821;
- Aleksandra Kaliszewska, Joseph Allison, Matteo Martini, Natalia Arias. (2021). The Interaction of Diet and Mitochondrial Dysfunction in Aging and Cognition. IJMS. 22, 3574;
- Haejin Yoon, Jillian L. Shaw, Marcia C. Haigis, Anna Greka. (2021). Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Molecular Cell. 81, 3708-3730;
- Hiroshi Nishi, Takaaki Higashihara, Reiko Inagi. (2019). Lipotoxicity in Kidney, Heart, and Skeletal Muscle Dysfunction. Nutrients. 11, 1664;
- Paul Goede, Rob C. I. Wüst, Bauke V. Schomakers, Simone Denis, Frédéric M. Vaz, et. al.. (2022). Time‐restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. The FASEB Journal. 36;
- Amanda R. Martins, Amanda R. Crisma, Laureane N. Masi, Catia L. Amaral, Gabriel N. Marzuca-Nassr, et. al.. (2018). Attenuation of obesity and insulin resistance by fish oil supplementation is associated with improved skeletal muscle mitochondrial function in mice fed a high-fat diet. The Journal of Nutritional Biochemistry. 55, 76-88;
- Rosalba Putti, Vincenzo Migliaccio, Raffaella Sica, Lillà Lionetti. (2016). Skeletal Muscle Mitochondrial Bioenergetics and Morphology in High Fat Diet Induced Obesity and Insulin Resistance: Focus on Dietary Fat Source. Front. Physiol.. 6;
- Domenico Sergi, Nenad Naumovski, Leonie Kaye Heilbronn, Mahinda Abeywardena, Nathan O’Callaghan, et. al.. (2019). Mitochondrial (Dys)function and Insulin Resistance: From Pathophysiological Molecular Mechanisms to the Impact of Diet. Front. Physiol.. 10;
- Kristofor A. Olson, John C. Schell, Jared Rutter. (2016). Pyruvate and Metabolic Flexibility: Illuminating a Path Toward Selective Cancer Therapies. Trends in Biochemical Sciences. 41, 219-230;
- Reuben L Smith, Maarten R Soeters, Rob C I Wüst, Riekelt H Houtkooper. (2018). Metabolic Flexibility as an Adaptation to Energy Resources and Requirements in Health and Disease. Endocrine Reviews. 39, 489-517;
- Grace Vincent, Séverine Lamon, Nicholas Gant, Peter J. Vincent, Julia R. MacDonald, et. al.. (2015). Changes in mitochondrial function and mitochondria associated protein expression in response to 2-weeks of high intensity interval training. Front. Physiol.. 6;
- Karoline Maise Chrøis, Tine Lovsø Dohlmann, Ditte Søgaard, Camilla Vestergaard Hansen, Flemming Dela, et. al.. (2020). Mitochondrial adaptations to high intensity interval training in older females and males. European Journal of Sport Science. 20, 135-145;
- Jonathan P. Little, Jenna B. Gillen, Michael E. Percival, Adeel Safdar, Mark A. Tarnopolsky, et. al.. (2011). Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes. Journal of Applied Physiology. 111, 1554-1560;
- D. Hansen, P. Dendale, R. A. M. Jonkers, M. Beelen, R. J. F. Manders, et. al.. (2009). Continuous low- to moderate-intensity exercise training is as effective as moderate- to high-intensity exercise training at lowering blood HbA1c in obese type 2 diabetes patients. Diabetologia. 52, 1789-1797;
- A GVOZDJAKOVA, V BADA, L SANY, J KUCHARSKA, F KRUTY, et. al.. (1984). Smoke cardiomyopathy: disturbance of oxidative processes in myocardial mitochondria. Cardiovascular Research. 18, 229-232;
- Emanuel Rubin, Charles S. Lieber. (1967). Early Fine Structural Changes in the Human Liver Induced by Alcohol. Gastroenterology. 52, 1-13;
- Krishna Prahlad Maremanda, Isaac Kirubakaran Sundar, Irfan Rahman. (2021). Role of inner mitochondrial protein OPA1 in mitochondrial dysfunction by tobacco smoking and in the pathogenesis of COPD. Redox Biology. 45, 102055;
- Liuyi Hao, Qian Sun, Wei Zhong, Wenliang Zhang, Xinguo Sun, Zhanxiang Zhou. (2018). Mitochondria-targeted ubiquinone (MitoQ) enhances acetaldehyde clearance by reversing alcohol-induced posttranslational modification of aldehyde dehydrogenase 2: A molecular mechanism of protection against alcoholic liver disease. Redox Biology. 14, 626-636.








