Битва века: CRISPR vs ВИЧ
11 октября 2016
Битва века: CRISPR vs ВИЧ
- 3882
- 2
- 16
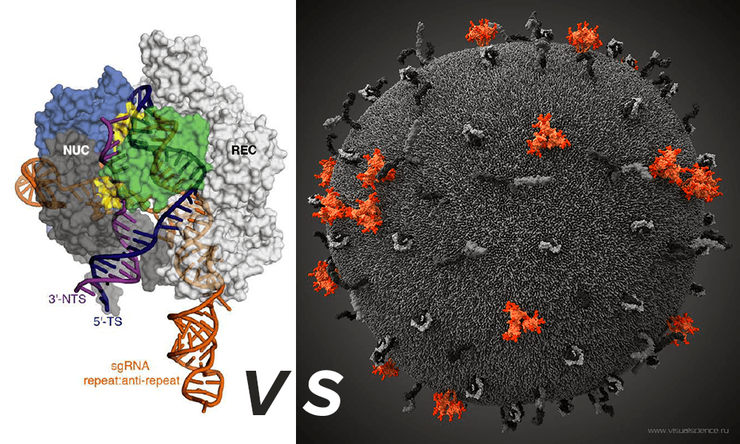
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.
сайты rna.berkeley.edu и visual-science.com
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: На сегодняшний день СПИД все еще остается неизлечимым заболеванием. В 2014 году около полутора миллионов человек умерло из-за заражения и осложнений, связанных с ним; при этом число зараженных людей — около 37 миллионов. Как известно, организм погибает не из-за самого вируса иммунодефицита (ВИЧ), а из-за различных бактериальных, грибковых и вирусных заболеваний, с которыми организм легко справился бы в обычных условиях (оппортунистические заболевания). В настоящее время существуют различные способы облегчить протекание болезни, но полностью излечить ВИЧ-инфицированных пока еще не удавалось. Помощь пришла, откуда ее не ждали. Система редактирования геномов CRISPR/Cas9 была впервые успешно использована для полного удаления вируса из зараженной культуры клеток человека.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Вирус иммунодефицита человека впервые был описан в 1981 году в США, куда он попал предположительно из Западной Африки. Передаваясь через кровь, в основном, при незащищенных половых актах и при многоразовом использовании шприцов в среде наркоманов, вирус быстро распространился преимущественно в странах третьего мира. Так каков же механизм действия вируса на иммунитет человека? Для понимания этого необходимо сначала разобраться с системой иммунитета человека, клетки которой поражает этот «генетический паразит».
В какой-то мере Т-хелперы участвуют в активации всех «активных» клеток приобретенного иммунитета: они стимулируют выработку антител В-лимфоцитами, активируют макрофаги и NK-клетки, участвуют в созревании Т-киллеров. И именно в Т-хелперах происходит размножение ВИЧ.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).
Оказывается, более 250 (!) человеческих белков так или иначе участвует в жизненном цикле ВИЧ: «Подножка для вируса СПИДа» [10]. — Ред.
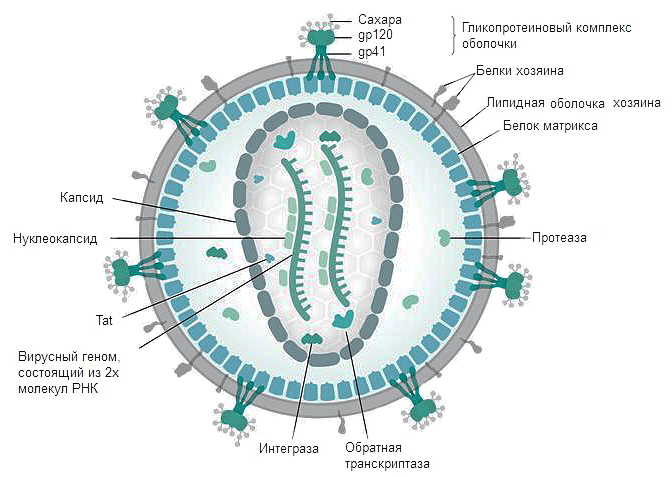
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
В природе система CRISPR/Cas является системой адаптивного иммунитета бактерий и предотвращает вирусную или плазмидную инвазию. Для лучшего понимания того, как можно «одомашнить» даже не бактерию, а ее иммунную систему, надо рассмотреть механизм работы этого комплекса.
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Интересно то, что в названии делается акцент именно на палиндромные повторы, хотя гораздо важнее то, что находится между этими повторами. А между ними находятся так называемые спейсеры (spacers) — уникальные последовательности, бывшие некогда частью генома вируса или плазмиды, этакая «коллекция уродцев».
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.
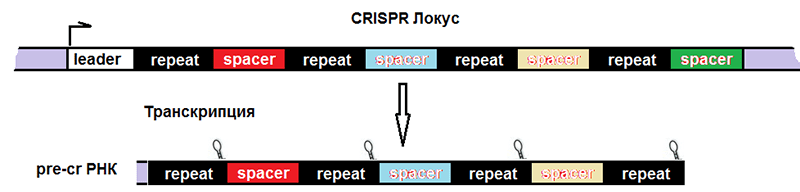
Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
сайт biosyn.com
На этом первая часть заканчивается — бактерия «запомнила» вирус и внесла его в уже имеющуюся библиотеку спейсеров. Пока ее можно сравнить с коллекционером, собирающим части ДНК вирусов и плазмид.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).
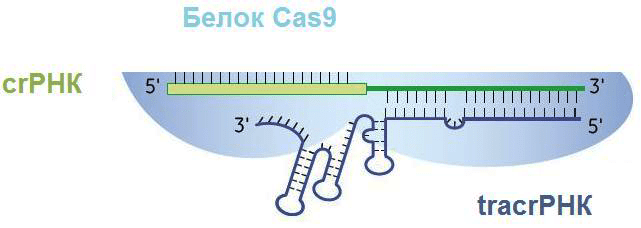
Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
Завершающий этап — внесение двунитевого разрыва в чужеродную ДНК, вторично внедрившуюся в клетку. Здесь, как и в иммунной системе позвоночных, для «уничтожения врага» требуется выполнение двух условий:
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.
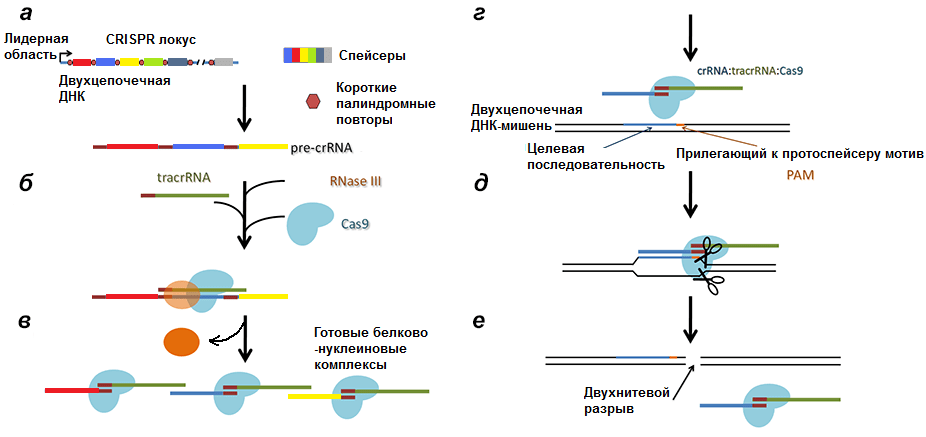
Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
сайт addgene.org
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.
Единственное отличие «одомашненной» CRISPR-системы состоит в том, что вместо двух молекул РНК (crРНК и tracrРНК) используется одна объединенная — sgРНК (single guide, единая направляющая, иногда называемая guideRNA) . Гораздо проще задать одну последовательность нуклеотидов, содержащую спейсер, чем две, которые должны быть транскрибированы и комплементарно сшиты.
Об удивительном процессе мутагенной цепной реакции, осуществляемом комплексом Cas9 с РНК-гидом, подробно рассказано в статье «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [14]. — Ред.
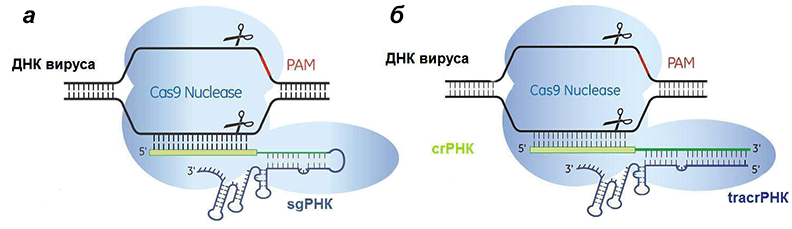
Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Известно, что для встраивания кДНК ВИЧ в хромосомы необходимы длинные концевые повторы (Long Terminal Repeat, LTR) — краевые последовательности нуклеотидов, повторенные сотни или тысячи раз. Такие повторы присутствуют у обеих молекул РНК ВИЧ, и если «нацелить» Cas9 на них, то удастся создать разрыв и вырезать вирус. Но группа под руководством Рафаля Камински создала не просто sgРНК к LTR. Ученые учли быструю скорость мутационного процесса вирусов и поместили в sgРНК наиболее консервативную область LTR, присутствующую у всех изолятов вируса.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Литература
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Элементы: «Сложная иммунная система развилась независимо в двух эволюционных линиях позвоночных животных»;
- Элементы: «Мутагенез в лимфоцитах — результат целенаправленного изменения ДНК и последующей «неточной починки»;
- Моноклональные антитела;
- Пластиковые антитела;
- Своими руками: человек против ВИЧ;
- Структуры рецепторов GPCR «в копилку»;
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Подножка для вируса СПИДа;
- Barrangou R. and Horvath P. (2009). The CRISPR system protects microbes against phages, plasmids. Microbe. 4, 224–230;
- CRISPR-системы: иммунизация прокариот;
- Немудрый А.А., Валетдинова К.Р., Медведев С.П., Закиян С.М. (2014). Системы редактирования геномов TALEN и CRISPR/Cas — инструменты открытий. Acta Naturae. 6, 20–42;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Как «вырезать» вирус?;
- Sarkar I., Hauber I., Hauber J., Buchholz F. (2007). HIV-1 proviral DNA excision using an evolved recombinase. Science. 316, 1912–1915;
- Kaminski R., Chen Y., Fischer T., Tedaldi E., Napoli A., Zhang Y. et al. (2016). Elimination of HIV-1 genomes from human T-lymphoid cells by CRISPR/Cas9 gene editing. Sci. Rep. 6, 22555.