
Зачем биологам кометы?
27 ноября 2016
Зачем биологам кометы?
- 2069
- 1
- 1
Как видят кометы астрономы и биологи.
рисунок слева с сайта dreamworlds.ru, справа — фотография автора
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Вы знаете, что изучением комет занимаются не только астрономы, но и молекулярные биологи? Их работа связана с космосом лишь косвенно. На кометы они смотрят в микроскоп. Звездным небом служит гель-слайд — микроскопическое предметное стекло, покрытое агарозой с исследуемыми клетками. Такое стало возможным благодаря открытию в 1984 году способа анализа ДНК, названного методом ДНК-комет.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
О популярности в цифрах
Сегодня метод ДНК-комет является одним из самых популярных в биологических исследованиях, направленных на изучение воздействия факторов разной природы на молекулу ДНК — хранительницу генетической информации организма.
В базе данных PubMed рост популярности метода можно отследить по увеличению количества статей, в которых встречается сочетание слов «comet assay» (рис. 1). На гистограмме отражена динамика изменения количества публикаций с 1990 по 2016 годы: если в 1990 г. опубликовано 2 статьи, в которых встречается указанное выше словосочетание, то в 2015 г. — в 391 раз больше (782 публикации). Про количество статей в PubMed, посвященных методу ДНК-комет, можно сказать следующее: к марту 2008 г. в базе насчитывалось 3575 публикаций [1], а к августу 2016 г., т.е. практически через 8 лет, их число увеличилось в 2,7 раз (9535 статей). 2016 год еще не закончился, поэтому количество материалов будет непрерывно расти!
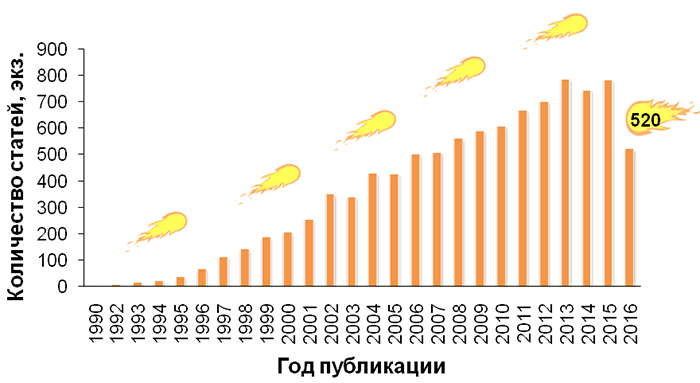
Рисунок 1. Гистограмма количества статей (экз.), в которых встречается словосочетание «comet assay», в базе данных PubMed за период 1990–2016 гг.
рисунок кометы с сайта colourbox.com
Вывод напрашивается один: «охотников» за кометами с каждым годом становится все больше, а кометы, «пойманные за хвост», уже невозможно сосчитать. О том, как все-таки кометы помогают биологам в исследованиях, и почему именно кометы, будет рассказано в следующих главах.
Вы знали, что ДНК всегда находится в опасности?
Дезоксирибонуклеиновая кислота (ДНК) — самая важная и незаменимая молекула, хранящая в себе генетическую информацию о живых организмах. ДНК — структура сложная, включающая в себя четыре азотистых основания: два пуриновых — аденин (А) и гуанин (G), два пиримидиновых — цитозин (C) и тимин (T), сахар дезоксирибозу и остаток фосфорной кислоты [2]. Эти составляющие расположены в молекуле в определенном порядке. Одно азотистое основание, одна дезоксирибоза и один остаток фосфорной кислоты составляют нуклеотид. Таких нуклеотидов могут быть десятки тысяч в одной молекуле, они выстроены в цепочку. При этом каждая молекула ДНК состоит из двух длинных цепочек, связанных друг с другом.
Целостность дезоксирибонуклеиновой кислоты постоянно находится под угрозой. В напряжении и опасности ДНК держат «преступники» окружающей среды — генотоксиканты разной природы, которые могут действовать в одиночку (ионизирующее излучение, к примеру) или же, объединяясь в «преступные группировки» (например, радионуклиды и тяжелые металлы, которые в среде, как правило, неразлучны и работают только в «банде»).
Не только среда оказывает давление на геном, но и сам организм, а точнее, продукты нормальной клеточной жизнедеятельности (активные формы кислорода, азота, карбонильные группы, продукты перекисного окисления липидов), — постоянный источник повреждения. Они «обижают» ДНК, нанося ей «удары», которые могут привести к повреждениям: одной (однонитевые разрывы), а то и обеих нитей (двунитевые разрывы) [3], связей в пуриновом или пиримидиновом основании (повреждение основания), связей, не принимающих участие в построении скелета молекулы (повреждение нуклеотида) [4]; появлению нестабильных участков в ДНК, которые в щелочных условиях преобразуются в однонитевые повреждения (щелочно-лабильные сайты) [3]; образованию связей между нитями (межнитевая поперечная сшивка), внутри нити ДНК (внутринитевая сшивка), между ДНК и белком (сшивка ДНК-белок) [4] (рис. 2).
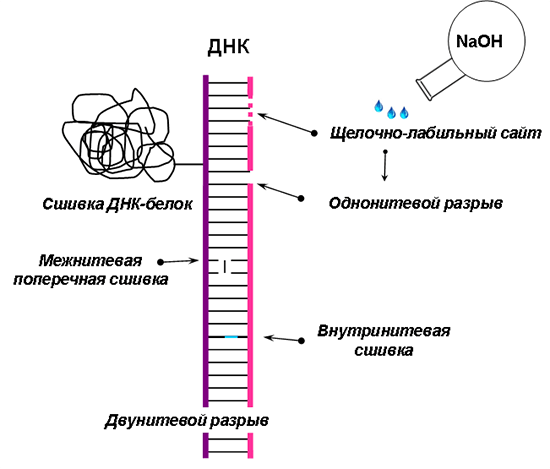
Рисунок 2. Примеры повреждений ДНК, возникающих в результате действия факторов разной природы
Как видите, «разбойники» могут совершить огромный спектр «преступлений» и нанести существенный урон целостности ДНК. Однако в клетке на страже безопасности ДНК стоят системы репарации, «лекари», которые исправляют повреждения молекулы с помощью специальных «медикаментов» — ферментов, способных «залатать раны», нанесенные генотоксикантами. Ферментов репарации великое множество. На сегодняшний момент известно, что в эксцизионной репарации повреждений ДНК, т.е. в операциях, когда участок сначала вырезается, а потом собирается вновь, принимает участие 13 ферментов [4]!
Однако не все так гладко, как кажется на первый взгляд. Операции в «отделении репарации» не всегда завершаются благополучно, т.е. восстановлением исходной молекулы ДНК. Итогом работы восстановительных систем могут стать и новые повреждения. Причина тому — весьма плотная упаковка нитей ДНК в ядре [4].
А что же ученые? Они выступают в роли «полицейских», которым нужно выявить «состав преступления», т.е. найти «преступника» и его «сообщников» (определить генотоксиканты, их дозы и концентрации) и установить тяжесть «преступления» (выявить степени повреждений ДНК). Именно в таких ситуациях помогает метод ДНК-комет.
Родом из Швеции
Попытки, направленные на изучение ядерных структур клетки и количественное определение нитевых повреждений ДНК в одиночных клетках организмов, были предприняты еще в 80-х гг. XX века такими учеными, как Кук и Бразелл [5], Ридберг и Йохансон [6]. Однако лишь в 1984 г. шведские исследователи Остлинг и Йохансон развили новый метод определения повреждений ДНК [7]. Именно они заметили, что изображения фрагментов ДНК, мигрировавших в электрическом поле, напоминали астрономические кометы. Сходство было налицо. «Кометы», полученные учеными из Швеции, обладали главными характеристиками космических «собратьев»: они имели «голову» и «хвост» [1]. Отсюда и пошло такое романтическое название — метод ДНК-комет.
У метода есть еще ряд наименований — гель-электрофорез одиночных (изолированных) клеток и электрофорез в микрогеле [8]. Первое название некорректно отражает суть анализа. Электрофорез проводится не в одиночных клетках, а в агарозном геле, где от одного полюса к другому движется ДНК, выделенная из этих самых клеток. Второе — верное, т.к. электрофорез осуществляется в агарозном геле, нанесенном на слайды. Но и этот термин не прижился. Указанные названия не пользуются большой популярностью и используются редко, в отличие от «метода ДНК-комет».
Заклинание для получения «комет»

Рисунок 3. Строение «кометы».
фото автора статьи
Лабораторные «кометы» — объекты интересные. Их облик напрямую зависит от факторов воздействия, их силы и условий проведения анализа. Информация о «кометах» не тайна, покрытая мраком, поэтому про их состав, строение и образование известно практически все.
В публикации 1984 г. шведы Остлинг и Йохансон назвали ДНК, которая мигрировала, — «хвост», а оставшуюся в полости ДНК — «центр» [7]. Сейчас же практически ничего не изменилось: у «кометы» условно выделяют «голову» и «хвост» (рис. 3).
Надо четко представлять, что «комета» образуется не из клетки живого организма, а именно из ее ДНК. Помещенная в агарозный слой суспензия клеток образует полости, которые в процессе лизиса занимает ДНК этих клеток. Все дальнейшие манипуляции в методе ДНК-комет осуществляются именно с ДНК.
«Кометы» образуются в процессе миграции (перемещения) ДНК в электрическом поле (когда есть ток и напряжение). Что же происходит во время лизиса и электрофореза? Более маленькие биомолекулы, входящие в состав клетки, «убегают» в лизирующий раствор в процессе диффузии, в отличие от ДНК, которая из-за своего чрезвычайно большого размера не может сдвинуться с места . Когда же слайды с ДНК подвергают электрофорезу, неповрежденная ДНК формирует «голову кометы», а поврежденные части молекул начинают «пробежки» по направлению к положительно заряженному источнику тока — аноду (т.к. ДНК заряжена отрицательно), образуя «хвост». Чтобы увидеть получившиеся «кометы», их окрашивают флуоресцентными красителями (бромистый этидий, акридиновый оранжевый и др.), а затем визуализируют с помощью флуоресцентного микроскопа на большом увеличении [9] (рис. 4).
Остлинг и Йохансон пишут следующее: «Когда клетка встраивается в гель, она формирует углубление в нем. После лизиса клетки ее ДНК занимает это углубление. Большинство других биомолекул легко диффундирует по агарозному гелю. Таким образом, практически все они выходят из углубления, оставленного клеткой, в лизирующий раствор. Единственное исключение составляет ДНК, которая за счет своей большой молекулярной массы остается в геле» [7]. — Ред.
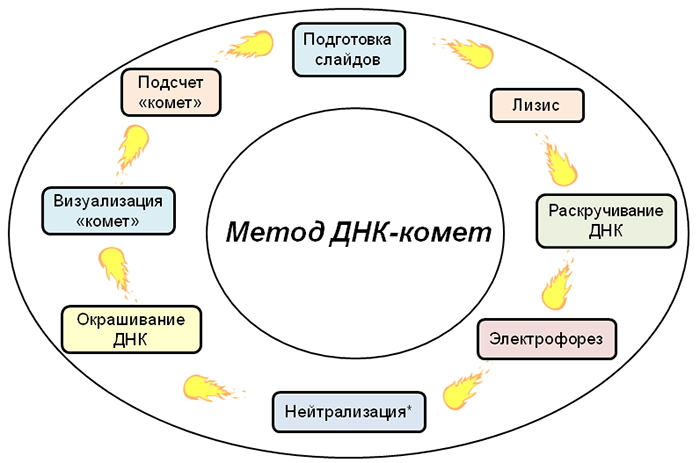
Рисунок 4. Последовательность этапов метода ДНК-комет (начиная сверху по часовой стрелке). * — Этап необходим только в щелочной версии метода (рН > 13,0), чтобы нейтрализовать щелочь NaOH.
Чем сильнее повреждения ДНК (а степень повреждения зависит от дозы мутагена), тем более выражен «хвост кометы». Как вы уже поняли, длинный «хвост» — это не очень хорошо.
Универсальный солдат
Метод ДНК-комет — инструмент широкого профиля. С его помощью ученые «раскрывают преступления», связанные с покушением на здоровье человека и безопасность окружающей среды (конечно же, все это через исследование поврежденной ДНК). Метод приобрел такую популярность благодаря привлекательным характеристикам — простоте, скорости, экономичности и достаточно высокой чувствительности, которая позволяет выявлять повреждения ДНК, вызванные даже факторами низкой интенсивности (например, малыми дозами радиации). Среди множества способов оценки повреждений ДНК метод ДНК-комет является одним из самых подходящих в этой области. Помимо указанных выше преимуществ, он выигрывает, например, у широко известных цитогенетических методов (ана-телофазный, метафазный анализы, микроядерный тест), еще и по другим веским причинам [10].
Метод ДНК-комет позволяет работать с любыми содержащими ДНК клетками, в отличие от микроядерного теста, в котором чаще всего задействуют клетки крови или костного мозга. Если же ана-телофазный и метафазный методы ограничены в перечне определяемых хромосомных аберраций, то метод ДНК-комет предоставляет широкий спектр своих модификаций, благодаря которым исследователь может выявить самые разные повреждения ДНК: одиночные, двойные повреждения, щелочно-лабильные сайты, апоптоз и другие. Именно такие возможности делают его «универсальным солдатом» и прокладывают методу дороги в разные области научных исследований [10], [11]:
- экологический мониторинг — оценка состояния окружающей среды по степени повреждения ДНК организмов, обитающих на исследуемой территории (как правило, сравнивают уровни повреждения ДНК особей с загрязненной и контрольной территорий);
- биологический мониторинг — изучение влияния питания и других внешних факторов среды на организм по степени повреждения ДНК, накоплению повреждений и репарации;
- генотоксические исследования фармакологических препаратов, новых и уже имеющихся химических веществ (бытовая химия, пестициды и др.);
- клинические исследования, направленные на дородовую диагностику на стадии внутриутробного развития, выявление предрасположенности к заболеваниям;
- оценка эффективности терапий при онкологических заболеваниях и ее контроль.
Изменения познаются в сравнении
Наблюдение за состоянием окружающей среды, т.н. экологический мониторинг, помогает исследователям выявлять происходящие в среде изменения и вовремя бить тревогу (особенно в аварийных ситуациях, например, на Чернобыльской АЭС в 1986 г. или на АЭС «Фукусима Дайичи» в 2011 г.). При загрязнениях среды метод ДНК-комет в сочетании с организмами-индикаторами приходится как нельзя кстати. Списки организмов, характерных для разных сред обитания и наиболее чувствительных к изменениям состояния среды, достаточно обширны и включают виды, начиная с бактерий Escherichia coli и водорослей рода Chlamydomonas и заканчивая высшими растениями (Lemna minor, Pinus sylvestris), млекопитающими (Microtus oeconomus) и, конечно же, человеком (рис. 5). В методе ДНК-комет задействуют, как правило, не организмы целиком, а их «составные части» — клетки, особенно чувствительные к изменениям факторов внешней среды, или ткани, из которых эти клетки можно получить. У животных обычно берут клетки крови: эритроциты и лимфоциты, гемоциты (аналоги эритроцитов у беспозвоночных), целомоциты (клетки, выполняющие иммунную функцию у дождевых червей); у растений — клетки меристемы, интенсивно делящейся ткани.

Рисунок 5. Примеры организмов-индикаторов, используемых для оценки состояния окружающей среды с помощью метода ДНК-комет.
сайты scuola-cucina.com, photosflowery.ru, 4pics.ru, kharkov-fish.ru.gg, 10-themes.com, worldartsme.com, sms.si.edu, wulovef.com, qygjxz.com, hdimagegallery.net, nhm.ac.uk, picstopin.com, functionalecology.org, akva-world.ru, moskvapark.naidich.ru, botany.natur.cuni.cz, rusrep.ru, animalsfoto.com, go-that.appspot.com, hdimagelib.com
Как метод ДНК-комет работает в данном случае? Ученые сравнивают степени повреждения ДНК организмов-индикаторов, обитающих на исследуемой (загрязненной) и контрольной (незагрязненной) территориях: подвергаемых воздействию загрязненной почвы, воды и др., и таких же, но живущих в обычных контрольных условиях, т.е. когда отсутствует воздействие изучаемого фактора либо оно незначительно. Оценку степени повреждения ДНК проводят и в лабораториях, в строго контролируемых условиях, когда есть выборка организмов, подвергнутая воздействию исследуемого фактора или группы факторов (радиации, металлов, пестицидов), и обязательно контрольная группа (не испытывающая этого воздействия).
Сценарии могут быть разными. Степень повреждения ДНК в клетках может повышаться, снижаться или же оставаться неизменной. Повышенная степень повреждения ДНК у организмов с загрязненной территории может свидетельствовать о внутренних изменениях в функционировании клеток, которые приводят к многочисленным «поломкам» ДНК.
Снижение степени повреждения ДНК или отсутствие различий наталкивает на мысль, что организмы справились с «гнетом» генотоксикантов и приспособились к жизни в этих неблагоприятных условиях. Такое приспособление носит название адаптации. Но это совсем другая история.
Наследственность — страшная сила
Слышали о таких заболеваниях, как синдром хромосомных поломок (синдром неймегеновского повреждения), пигментная ксеродерма и трихотиодистрофия? Они проявляются только тогда, когда оба родителя — носители дефектного гена (рис. 6).
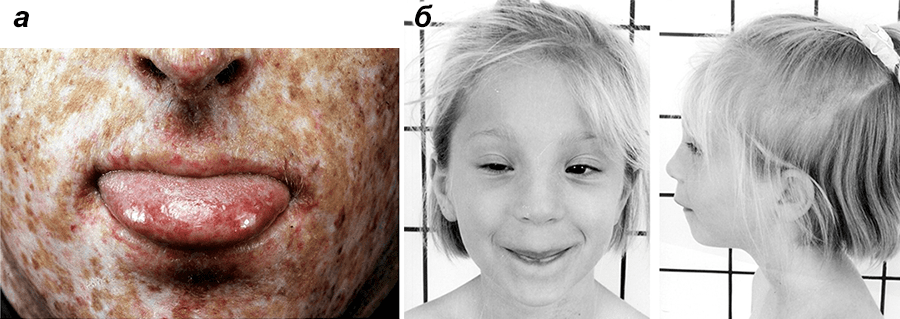
Рисунок 6. Пигментная ксеродерма (а) и синдром неймегеновского повреждения (б).
сайты faculty.ksu.edu.sa и dxline.info
В литературе есть данные о возможности применения метода ДНК-комет в диагностике этих наследственных заболеваний, что особенно важно на пренатальной стадии, т.е. при беременности.
Синдром неймегенского повреждения (Nijmegen breakage syndrome, NBS) — заболевание, связанное с постоянными нарушениями целостности ДНК. Проблема заключается в том, что в гене NBS1 происходит мутация, которая «выключает» нибрин — белок, контролирующий восстановление парных разрывов ДНК, индуцируемых радиацией. Именно поэтому люди, страдающие этим синдромом, являются чрезвычайно радиочувствительными [14]. Божена Новотна из пражского Института экспериментальной медицины в своем исследовании утверждает, что метод ДНК-комет отлично помогает выявить гетерозиготных носителей гена NBS1 по аномально высокому уровню повреждений нитей ДНК в «кометах» лимфоцитов [11].
Не менее опасными являются пигментная ксеродерма и трихотиодистрофия. Это серьезные заболевания человека, передающиеся по наследству. В первом случае при непродолжительном нахождении на солнце у детей на открытых участках кожи (кистях рук, шее, лице) сначала появляются красные пятна, которые впоследствии переходят в выраженную пигментацию вплоть до образования опухолей. Второе заболевание выражается в ломкости волос и ногтей, задержке в умственном развитии и аномалиях в строении черепа.
Эти заболевания объединяет нарушение в работе эксцизионной репарации нуклеотидов. По успешности эксцизионной репарации нуклеотидов в клетках плода с помощью метода ДНК-комет можно выявить, будет ли ребенок страдать этими заболеваниями. В литературе описаны случаи такой диагностики [15].
Промышленность — враг здоровья человека
Здоровье людей, работающих на промышленных объектах или проживающих в экологически неблагоприятных районах, каждый день подвергается риску. Опасность заключается не только в ежедневном тесном контакте организма с генотоксикантами (ионизирующим излучением, тяжелыми металлами и другими химикатами), но и в вероятности аварийных ситуаций (примеры см. выше), последствия которых могут быть катастрофичны для организмов. Изменения состояния организма могут быть самыми разными, начиная с легких недомоганий вроде головной боли и заканчивая раковыми заболеваниями.
Метод ДНК-комет можно применять в качестве перспективного инструмента первичной оценки состояния генома людей, работающих или проживающих в экологически неблагоприятных условиях. Это означает, что ДНК-кометы можно использовать не только в перечисленных сферах исследований, но и применять в будущем в других областях, расширять варианты применения метода в клинических исследованиях, медицине и многом другом.
Есть и некоторые трудности
Чтобы правильно использовать метод ДНК-комет, нужно «знать в лицо» не только его возможности и достоинства перед другими методами, но и, конечно же, недостатки, ограничения и трудности, с которыми нужно быть начеку. Метод требует оптимизации лизиса, электрофореза и других условий в зависимости от типа клеток, которые использует ученый, и целей исследования.
Из первой трудности вытекает второе неудобство: адаптация метода к задачам анализа может быть очень трудоемким процессом (хотя сама методика проста и понятна), особенно если с объектом вашего исследования никто не работал по методу ДНК-комет. Бывает, «настройка» методики в таком случае требует очень много времени.
Иногда возникают сложности в интерпретации результатов, полученных по степени повреждения ДНК, поскольку степень повреждения не всегда удается соотнести с дозой фактора воздействия.
Одной из самых главных трудностей можно назвать сопоставление результатов, полученных с помощью метода ДНК-комет разными учеными в разных лабораториях и научно-исследовательских институтах. Для оценки повреждения ДНК используют методики с модификациями и абсолютно разные показатели (например, процент ДНК в «хвосте кометы» или длину «хвоста»).
Активно предпринимаются попытки стандартизировать применение метода ДНК-комет, что поможет сравнивать полученные учеными результаты. Например, в генотоксических исследованиях разработаны протоколы [9] и методические рекомендации [18].
Заключение
«Кто вооружен, тот защищен» — таков девиз работы с методом ДНК-комет. Знание достоинств и трудностей применения данного способа оценки повреждения ДНК позволяет мастерски манипулировать ходом работы, избегать «подводных камней» и получать корректные результаты.
Метод ДНК-комет играет роль «палочки-выручалочки» в оценке общего состояния организма, как правило, на ранних этапах воздействия неблагоприятных факторов среды. На начальном этапе именно повреждения ДНК являются самым быстрым и поэтому единственно доступным для измерения ответом организма на неблагоприятное воздействие еще задолго до появления изменений на физиологическом уровне.
Теперь вы знаете, как биологи получают «кометы» в лабораториях и зачем они им так нужны.
Литература
- Liao W., McNutt M.A., Zhu W.-G. (2009). The comet assay: A sensitive method for detecting DNA damage in individual cells. Methods. 48, 46–53;
- Инге-Вечтомов С.Г. Генетика с основами селекции: учебник для студентов высших учебных заведений (3-е издание, перераб. и доп.). СПб.: Н-Л, 2015. — 720 с.;
- Piperakis S.M. (2009). Comet assay: a brief history. Cell Biol. Toxicol. 25, 1–3;
- Ярмоненко С.П. Радиобиология человека и животных. М.: Высш. шк., 2004. — 549 с.;
- Cook P.R. and Brazell I.A. (1976). Characterization of nuclear structures containing superhelical DNA. J. Cell Sci. 22, 303–324;
- Rydberg B. and Johanson K.J. Estimation of single strand breaks in single mammalian cells. In: DNA repair mechanisms / ed. by Hanawalt P.C, Friedberg E.C, Fox C.F. NY: Academic, 1978. P. 465–468;
- Ostling O. and Johanson K.J. (1984). Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem. Biophys. Res. Commun. 123, 291–298;
- Cotelle S. and Ferard J.F. (1999). Comet assay in genetic ecotoxicology: a review. Environ. Mol. Mutagen. 34, 246–255;
- Tice R.R., Agurell E., Anderson D., Burlinson B., Hartmann A., Kobayashi H. et al. (2000). Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ. Mol. Mutagen. 35, 206–221;
- Филиппов Э.В. (2014). Использование метода «ДНК-комет» для детекции и оценки степени повреждений ДНК клеток организмов растений, животных и человека, вызванных факторами окружающей среды (обзор). Наука и образование. 2, 72–78;
- Collins A.R. (2004). The comet assay for DNA damage and repair: principles, applications, and limitations. Mol. Biotechnol. 26, 249–261;
- Fujita Y., Yoshihara Y., Sato I., Sato S. (2014). Environmental radioactivity damages the DNA of earthworms of Fukushima Prefecture, Japan. Eur. J. Wildl. Res. 60, 145–148;
- Barillet S., Buet A., Adam C., Devaux A. (2005). Does uranium exposure induce genotoxicity in the teleostean Danio rerio? First experimental results. Radioprotection. 40, 175–181;
- Каган М.Ю., Шулакова Н.С., Тумирова Р.А., Злодеева Е.А., Резник Н.В. (2012). Синдром Ниймеген (клиническое наблюдение). Педиатрическая фармакология. 3, 102–105;
- Alapetite C., Benoit A., Moustacchi E., Sarasin A. (1997). The comet assay as a repair test for prenatal diagnosis of Xeroderma pigmentosum and trichothiodystrophy. J. Invest. Dermatol. 108, 154–159;
- Palus J., Rydzynski K., Dziubaltowska E., Wyszynska K., Natarajan A.T., Nilsson R. (2003). Genotoxic effects of occupational exposure to lead and cadmium. Mutat. Res. 540, 19–28;
- Томилин Н.В., Петров А.Н., Филько О.А., Храброва А.В., Соловьева Н.Е., Иванова Т.М. и др. (2015). Оценка степени повреждения ядерной ДНК в клетках периферической крови людей, профессионально связанных с действием тяжелых металлов. Организация здравоохранения. 16, 383–392;
- Оценка генотоксических свойств методом ДНК-комет in vitro: Методические рекомендации. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.— 16 с.







