
Рецепторы в активной форме
02 октября 2008
Рецепторы в активной форме
- 2456
- 3
- 6
Родопсин — рецептор, реагирующий на свет, — часто называют прототипом всего семейства рецепторов, передающих сигналы с помощью G-белков [3]
-
Автор
-
Редакторы
Животные воспринимают свет и реагируют на различные физические и химические сигналы с помощью интегральных белков клеточной мембраны, принадлежащих к семейству G-белоксопряжённыхрецепторов. Под действием этих сигналов рецептор «переключается» из неактивной формы в активированную, способную связывать G-белок и инициализировать внутриклеточные биохимические каскады. Менее десяти лет назад учёным удалось расшифровать пространственное строение одного из таких рецепторов — родопсина, — однако эта структура соответствовала неактивной форме белкá и не могла дать информации об активации рецептора. Недавно, после массы затраченных усилий, учёным удалось получить структуру активной формы родопсина и приблизиться, наконец, к пониманию молекулярных основ перехода рецепторов в активную форму.
Плазматическая мембрана многоклеточных животных — от млекопитающих до морских звёзд, насекомых и плоских червей — содержит множество рецепторов, объединяемых в семейство так называемых G-белоксопряжённых рецепторов. Другое часто используемое название — 7ТМ-рецепторы — связано с общей чертой их строения: их белковая цепь семь раз пронизывает мембрану в виде α-спиралей. Составляя изрядную часть генома животных (1–2%), эти рецепторы реагируют на множество различных сигналов: от света и запаха до гормонов белковой природы, низкомолекулярных соединений и ионов [1]. Активное изучение этих рецепторов, и, в первую очередь, интерес к их структурной организации и конформационным перестройкам, сопровождающим реакцию на внешние стимулы и активацию, обусловлены ещё и тем, что важнейшей областью применения этих знаний является молекулярная медицина, поскольку с неправильной работой GPCR-рецепторов связывают сотни заболеваний. Понимание механизмов взаимодействия этих рецепторов с сигнальными молекулами и последующих конформационных перестроек позволило бы усовершенствовать методики, применяемые при дизайне лекарственных препаратов [2], а значит, вылечить многие болезни.
До недавнего времени было известно строение только неактивных форм GPCR-рецепторов — родопсина [3], β2- [4], а затем и β1-адренорецепторов [5], зрительного родопсина кальмара [6] и опсина [7] — формы родопсина, не содержащей ковалентно связанного светочувствительного кофактора ретиналя (подробнее о роли ретиналя в зрении см. в [3]). Дело, по-видимому, в том, что неактивная форма рецептора, обычно стабилизированная антагонистом, конформационно менее подвижна и легче позволяет получить кристаллы, дающие чёткую дифракционную картину. (Как известно, кристаллизация мембранных белков — один из наиболее технически и концептуально сложных моментов, сдерживающих развитие структурной биологии этих интересных и важных биологических объектов.) Так, неактивная форма родопсина содержит ковалентно связанный внутри трансмембранной части белка 11-цис ретиналь, являющийся антагонистом, а при получении структур β-адренорецепторов изучали комплексы с антагонистом каразололом. Мало того: эти структуры дополнительно стабилизировали, вводя в них генно-инженерные модификации или увеличивая число полярных кристаллографических контактов при помощи добавления моноклональных антител.
И вот теперь учёным удалось получить структуру активной формы GPCR-рецептора — опсина в комплексе с фрагментом Gα-субъединицы G-белка (рис. 1) [8], [9]. Исследователи применили аналогичный приём по стабилизации структуры белка, но только вместо антагониста, стабилизирующего неактивную форму рецептора, они взяли избыток C-концевого фрагмента Gα-белка (GαCT), предположительно взаимодействующего с активированной формой рецептора и, следовательно, стабилизирующего её. Несмотря на многие попытки, учёным не удалось получить хороших кристаллов родопсина в комплексе с агонистом — полностью-транс ретиналем — из-за того, что тот слишком быстро диссоциировал от активированной молекулы. Однако считается, что опсин (Ops) значительно бóльшую часть времени проводит в активной форме (Ops*), что и позволило получить комплекс с участком G-белка (Ops*–GαCT). Последнее наблюдение подтверждается и сравнением со структурой «чистого» опсина [7] — она оказалась чрезвычайно близка к структуре Ops*–GαCT, подтверждая, что опсин удалось «поймать» именно в активной форме (Ops*). (Естественно, структура «чистого» опсина не может дать информации о деталях взаимодействия с G-белком.)
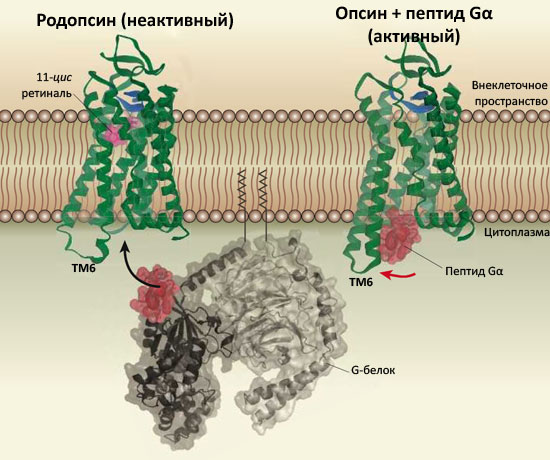
Рисунок 1. Активация G-белоксопряжённых рецепторов. Слева показана неактивная, или темновая, форма родопсина — фоторецептора светочувствительных клеток сетчатки глаза. Родопсин состоит из белка (показан зелёным) и светочувствительного кофактора ретиналя в неактивной форме (розовым). При поглощении кванта света ретиналь изомеризуется в полностью-транс форму, что приводит к активации родопсина и способности взаимодействовать с Gα-субъединицей G-белка трансдуцина, запускающего внутриклеточные биохимические каскады, в итоге формирующие зрение (связываемый участок показан красным). (Подробнее см. в статье «Зрительный родопсин — рецептор, реагирующий на свет» [3].)
Справа приведена структура активного опсина (Ops*) в комплексе с пептидом C-концевой части Gα-субъединицы трансдуцина [8]. Опсин не содержит кофактора-антагониста, что приводит к смещению равновесия Ops↔Ops* вправо и делает возможным взаимодействие с пептидом (показан красным). Наиболее значительная разница по сравнению с «темновой» формой — конформация шестой трансмембранной α-спирали (ТМ6), цитоплазматическая половина которой существенно отклонена во внешнюю сторону, что и формирует сайт связывания Gα-пептида. Направление, в котором отклоняется ТМ6, показано красной стрелкой.
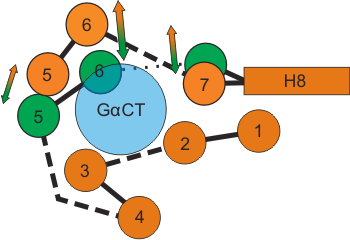
Рисунок 2. Схема конформационных перестроек, сопровождающих активацию родопсина (вид со стороны цитоплазмы). На схеме показано взаиморасположение трансмембранных α-спиралей активированного опсина (Ops*–GαCT, показан оранжевым) и темновой формы родопсина (зелёным) на уровне сайта связывания пептида Gα (голубым).
Наиболее заметное отличие активированной формы опсина от «темновой» — это существенный изгиб шестой α-спирали (ТМ6) во внешнюю по отношению ко всей молекуле сторону, что приводит к формированию сайта связывания Gα-белка (рис. 2). Такой механизм конформационной перестройки при активации полностью согласуется с более ранними биофизическими работами, в которых использовали фотоаффинное или спиновое мечение отдельных участков белка, чтобы пронаблюдать за процессом активации. Получается, что данная работа подтвердила предполагавшийся ранее механизм активации с масштабным сдвигом и поворотом ТМ6, несмотря на то, что недавняя кристаллографическая структура «активированного светом» родопсина [10] не указывала на эти характерные перестройки — не исключено, что на ту структуру не лучшим образом повлиял подбор условий кристаллизации.
Полученная структура будет хорошим подспорьем для изучения взаимодействия всех 7ТМ-рецепторов с их G-белками, селективность которых к рецепторам определяется пятью C-концевыми остатками α-субъединиц. Со стороны же рецептора во взаимодействии участвует, например, консервативный во всём подсемействе А GPCR-рецепторов (семейство родопсина) остаток аргинина на цитоплазматическом конце ТМ3-спирали рецептора, в «темновой» форме стабилизирующий рецептор путём образования солевого мостика, а в активированной — взаимодействуя с G-белком. Другое дело, что у GPCR-рецепторов семейства B (рецепторы секретина, кальцитонина, соматомедина и других пептидных гормонов) взаимодействие может осуществляться по другому принципу: в этих рецепторах отсутствуют аналогичные консервативные остатки.
Хотя из новой структуры мы видим значительные перестройки в «нижней» части рецептора, участки, образующие сайт связывания лиганда, изменились совсем немного. Это, впрочем, может быть отличительной чертой родопсина, у которого сайт связывания ретиналя с внеклеточной стороны прикрыт «крышкой» из нескольких β-листов, предотвращающих излишнюю подвижность трансмембранного домена. У других рецепторов всё может быть устроено иначе: у β-адренорецепторов, например, на аналогичном участке расположена α-спираль, не препятствующая диффузии лигандов в сайт связывания. Однако чтобы вникнуть в такие подробности, потребуется получить ещё не одну структуру — образующую комплекс не только с G-белком, но и низкомолекулярным агонистом, и лучше всего — уже не для такого «вдоль и поперёк» исследованного рецептора, как родопсин.
Литература
- Kristen L. Pierce, Richard T. Premont, Robert J. Lefkowitz. (2002). Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Tony Warne, Maria J. Serrano-Vega, Jillian G. Baker, Rouslan Moukhametzianov, Patricia C. Edwards, et. al.. (2008). Structure of a β1-adrenergic G-protein-coupled receptor. Nature. 454, 486-491;
- Как кальмары реагируют на поляризованный свет?;
- Jung Hee Park, Patrick Scheerer, Klaus Peter Hofmann, Hui-Woog Choe, Oliver Peter Ernst. (2008). Crystal structure of the ligand-free G-protein-coupled receptor opsin. Nature. 454, 183-187;
- Patrick Scheerer, Jung Hee Park, Peter W. Hildebrand, Yong Ju Kim, Norbert Krauß, et. al.. (2008). Crystal structure of opsin in its G-protein-interacting conformation. Nature. 455, 497-502;
- Thue W. Schwartz, Wayne L. Hubbell. (2008). A moving story of receptors. Nature. 455, 473-474;
- D. Salom, D. T. Lodowski, R. E. Stenkamp, I. L. Trong, M. Golczak, et. al.. (2006). Crystal structure of a photoactivated deprotonated intermediate of rhodopsin. Proceedings of the National Academy of Sciences. 103, 16123-16128.





