Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
19 февраля 2021
Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
- 8323
- 0
- 5
Антибиотикорезистентные бактерии одолевают один препарат за другим и неконтролируемо распространяются
www.shutterstock.com
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Устойчивость бактерий к антибиотикам — серьезная угроза здоровью людей. Из-за распространения резистентности с каждым годом подобрать эффективное лечение становится все сложнее. Человечество использует антибиотики повсеместно и тем самым только ускоряет процесс. К сожалению, резистентные штаммы могут передаваться от одного человека к другому, и масштаб проблемы до сих пор известен не до конца. Может ли, например, высокий уровень потребления антибиотиков в одной стране ухудшить эпидемиологическую обстановку в другой, где правительство регулирует использование противомикробных препаратов? Недавнее исследование, о котором мы расскажем в первой части статьи, утверждает, что да, может. А значит, опасность еще серьезнее, чем мы думали. Поэтому необходимо искать препараты, ломающие сам механизм устойчивости, так как уже сейчас существуют бактерии, которые невозможно остановить практически ни одним антибиотиком. Во второй части статьи мы расскажем об исследовании, открывшем новые свойства уже известных препаратов, как об одном из способов «отключить» резистентность и тем самым спасти миллионы жизней.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вступление
С тех пор как Александр Флеминг впервые выделил пенициллин, жить стало значительно веселее: теперь можно было не умирать от остеомиелита, родильной горячки, гангрены или сифилиса. За последующие девяносто лет человечество успело обзавестись внушительным арсеналом противомикробных препаратов и начать их активно использовать везде: от медицины до сельского хозяйства. И все бы хорошо, если бы не одно но: со временем антибиотики, которые призваны убивать бактерии или останавливать их рост, предотвращая развитие болезни, перестают работать. Некоторые микроорганизмы выживают после применения того или иного лекарства. Они мутируют и продолжают расти и размножаться, уже не встречая конкуренции со стороны других штаммов. К таким «суперзлодеям» от мира бактерий относятся, например, метициллинрезистентный золотистый стафилококк (рис. 1) или микобактерии туберкулеза со множественной лекарственной устойчивостью.
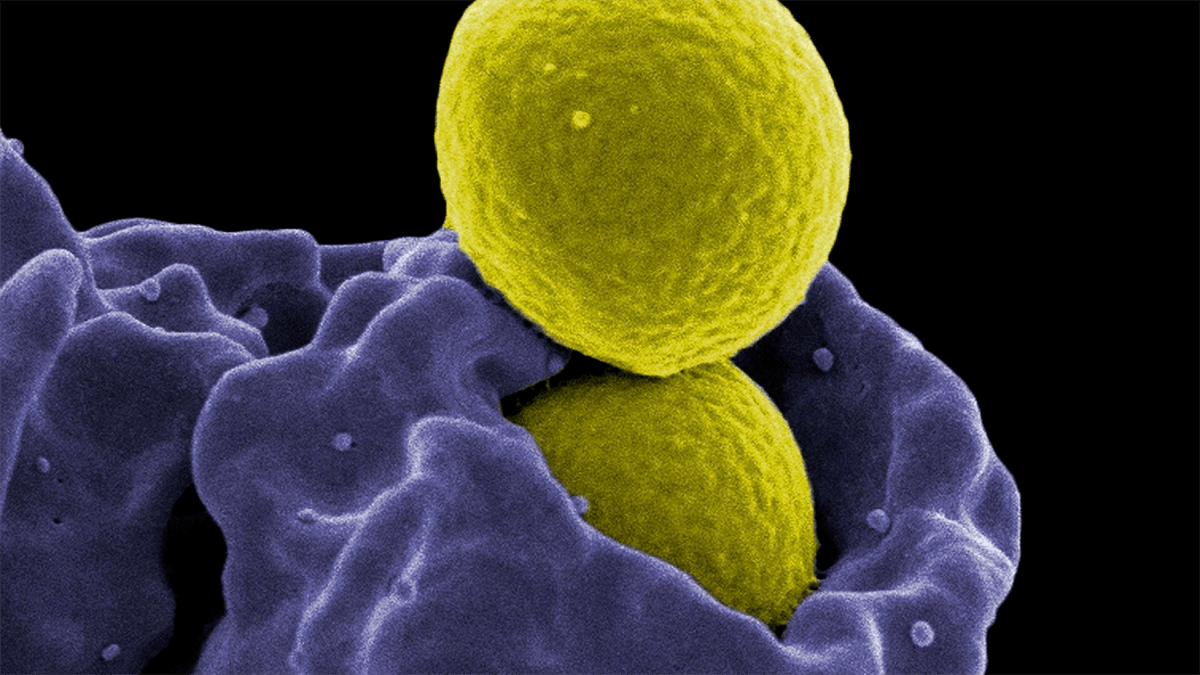
Рисунок 1. Нейтрофил обезвреживает метициллин-резистентную бактерию Staphylococcus aureus, фагоцитируя ее. Фото конфокального микроскопа, цвета условны. Подробнее о конфокальной микроскопии можно прочесть в материале «12 методов в картинках: микроскопия» [1].
По данным комиссии, собранной британским министерством здравоохранения в 2014–2016 гг., ежегодно около 700 000 человек по всему миру умирает от бактериальных инфекций, которые вызваны невосприимчивыми к действию антибиотиков патогенами. К 2050-му эта цифра может вырасти до 10 миллионов человек в год [2]. А по данным за 2019 год, только в США и европейских странах суммарно от болезней, вызванных резистентными бактериями, умирает около 68 000 человек в год (рис. 2) [3], [4].
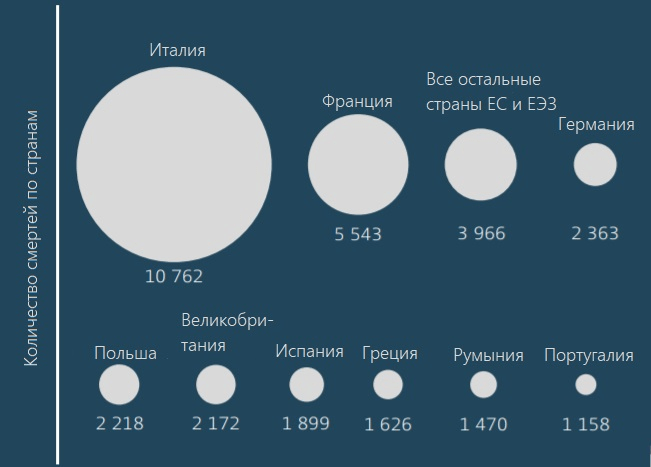
Рисунок 2. Количество смертей от болезней, вызванных резистентными к антибиотикам бактериями, в европейских странах по данным за 2015 год
[4], рисунок адаптирован
Если у нас закончатся эффективные противомикробные лекарства , то мы также не сможем безопасно проводить хирургические операции или использовать методы лечения, угнетающие иммунную систему, такие как химиотерапия, которая применяется для лечения онкологических заболеваний. Пострадают в первую очередь развивающиеся страны за счет плохой доступности медицины, проблем с гигиеной и слаборазвитой инфраструктуры [2].
О механизмах резистентности и ее передаче можно подробнее почитать в материалах [5] и [6].
Распространение резистентности: связь с уровнем потребления антибиотиков и влияние окружения
Многие исследования говорят в пользу существования прямой зависимости между увеличением потребления антибиотиков и распространением устойчивости бактерий к их действию [2–4], [7]. Помимо прямого влияния, когда из-за малых доз или недостаточно долгого применения лекарства бактерии быстро адаптируются к враждебной среде, существуют и косвенные «преимущества», которые дает устойчивым штаммам прием противомикробных препаратов: такие как устранение конкурентов в лице восприимчивых штаммов или подавление полезной микрофлоры, которая помогает организму справляться с инфекционной нагрузкой.
Иногда случается так, что потребление антибиотиков сокращается, а уровень устойчивости наоборот, только растет. Например, так произошло в Исландии 20 лет назад. В 2002 году было опубликовано исследование [8], согласно которому, несмотря на сокращение потребления противомикробных препаратов с 1,5 до 1,1 курса в год на одного ребенка (возрастом от одного года до шести лет), за пять лет распространенность устойчивых к пенициллину пневмококков выросла в двух наиболее удаленных от столицы регионах в четыре и в десять раз. Причем в десять раз она выросла там, где сокращение потребления антибиотиков было самым значительным по стране. Хотя в среднем за этот период уровень резистентности в Исландии действительно сократился: на 5%. Авторы исследования предположили, что из-за слабого коллективного иммунитета жители сельских регионов (рис. 3, 4) оказываются более уязвимыми к новым патогенам, которые сначала распространяются в крупных городах и только спустя время доходят до деревень. Можно было бы предположить, что свою роль сыграли и маленькие дозы лекарства или некорректная длительность терапии, однако, по данным исследования, все дети получали адекватное лечение.
Тем не менее исландский кейс остается скорее частным примером того, как на резистентность могут влиять и другие факторы, помимо объема потребления противомикробных препаратов. В целом же, прием антибиотиков остается одной из главных причин распространения устойчивости в мире [2–4].
К сожалению, даже если человек никогда не злоупотреблял антибиотиками, он может получить резистентную микрофлору от кого-то из своего непосредственного окружения, например, от родственников.
Исследование [9] на основе данных, полученных в 1998 году в двух деревнях штата Юта (рис. 5), показало, что вероятность получить как устойчивые, так и чувствительные штаммы растет с увеличением количества детей в семье. А прием антибиотиков ребенком увеличивает количество именно устойчивых бактерий у братьев и сестер.

Рисунок 5. Билборд на въезде в штат Юта со слоганом штата: Life Elevated («Возвышенная жизнь»)
В 2019 году израильские ученые показали, что прием матерями фторхинолонов (противомикробных лекарств широкого действия) повышал риск заражения резистентными штаммами не принимавших эти лекарства детей на 50% [10].
Бактерии распространяются не только в семьях, но и в других небольших сообществах, где люди тесно взаимодействуют, например в больницах. Так, в 2001 году другой исследовательский коллектив из Израиля подтвердил, что прием цефалоспоринов и амикацина (полусинтетического антибиотика группы аминогликозидов) в шести отделениях больницы был связан с повышенным риском заражения устойчивыми патогенами в течение последующих месяцев, в том числе и у пациентов, не принимавших эти антибиотики в течение предыдущего года. Причем у принимавших этот риск был выше 1,5–3 раза [11].
Распространение резистентности в больших сообществах
Второго ноября было опубликовано исследование [12] ученых Гарвардского университета, которое показало, что на степень распространения резистентности к антибиотикам среди населения одного региона существенно влияет уровень их потребления в соседних — точнее, в тех, которые интенсивнее всего с этим регионом взаимодействуют: например, если люди активно перемещаются между ними. Для описания таких ситуаций авторы статьи используют термин «спилловер-эффект» (от англ. to spill over — «выходить за пределы чего-либо, распространяться на другие области»; существительное spillover обозначает соответствующий процесс «распространения»).
Исследователи рассматривали данные о потреблении антибиотиков и распространенности устойчивости к ним в американских штатах и европейских странах. Они предположили, что чем два штата или две страны теснее взаимодействуют, тем меньше между ними разница в уровне резистентности к антибиотикам, и непосредственное влияние объема потребления антибиотиков на устойчивость будет ниже, чем в идеальной ситуации, когда регион полностью изолирован от других.
Чтобы проверить гипотезу, ученые сначала использовали математические модели, с помощью которых они делали численные предсказания того, насколько спилловер-эффект увеличится от усиления интенсивности взаимодействия сообществ. А затем они обратились к эмпирическим данным и соотнесли разницу в уровне резистентности внутри регионов с интенсивностью их взаимодействия друг с другом. Степень интенсивности определяли по данным о перелетах американскими и европейскими авиалиниями — ученые предположили, что чем меньше рейсов между регионами, тем слабее эти регионы взаимодействуют (рис. 6).
Рисунок 6. Карта авиаперелетов
planefinder.net
В результате две математические модели, применявшиеся в исследовании, — WHN и D-type (см. «Расшифровки» в конце статьи), — подтвердили предположение, что у активно взаимодействующих между собой сообществ разница в уровне устойчивости ниже, чем у тех, которые взаимодействуют меньше. Конкретные величины зависят от выбора модели, однако согласно обеим, достаточно, чтобы было всего на 1% больше взаимодействий между сообществами, для сокращения разницы в уровне резистентности между ними на треть, а то и на 50% — опять же, зависит от выбора модели.
После попарного сравнения регионов, связь между интенсивностью взаимодействия и снижением зависимости уровня резистентности от объема потребления антибиотиков оказалась статистически значимой в четырех из шести датасетов. Иными словами, чем активнее люди перемещались между сообществами, тем меньшее влияние на распространенность устойчивости оказывал уровень потребления антибиотиков внутри каждого из них — значительную роль начинали играть соседи.
Ученые также сгруппировали все сообщества по парам и ранжировали список по степени интенсивности взаимодействия. Затем они сравнили первые 10% пар из начала с 10% пар с конца и выяснили, что для пар в начале рейтинга связь между объемом потребления антибиотиков и резистентностью в среднем на 50% слабее, чем для пар, которые взаимодействовали меньше всего.
О чем говорят эти данные? В первую очередь о том, что спилловер-эффект оказывает значимое влияние на распространение устойчивости бактерий к антибиотикам на уровне США и европейских стран. Из этого наблюдения следуют несколько важных выводов. Во-первых, бессмысленно проводить какую бы то ни было политику по сокращению потребления антибиотиков с целью снизить уровень резистентности, не учитывая ситуацию в соседних регионах. Во-вторых, куда эффективнее любые меры принимать не на уровне отдельной страны или штата, а на уровне более крупных регионов: США или Евросоюза целиком. В-третьих, массовые испытания антибиотиков могут привести к росту устойчивости внутри всей контрольной популяции (если она не полностью изолирована от испытуемых) за счет все того же спилловер-эффекта.
Однако на распространение устойчивости влияют не только потребление антибиотиков или путешествия между регионами. Свою роль могут играть и другие факторы. Так, исследование 2017 года показало, что устойчивость бактерий к антибиотикам растет с повышением среднегодовой температуры на 2–4% [13]. А согласно другому исследованию, уже 2018 года, на распространение резистентности влияют и социально-экономические факторы (рис. 7): чем лучше развита инфраструктура и выше расходы государства на здравоохранение, тем ниже уровень распространения устойчивости к антибиотикам [14]. Поэтому не исключено, что схожесть в уровне резистентности у тесно взаимодействующих регионов может быть связана с их схожестью в плане географии или на экономическом уровне. Также, различия в образе жизни между разными социальными группами (разделенными по гендерному, этническому или экономическому признакам) может оказаться очень высокой — возможно, сравнение между собой административных единиц не совсем корректно, и куда эффективнее было бы сравнивать разные социальных слои [15], [16]. Кроме того, в исследовании не учитывались другие способы передвижения между регионами, помимо авиаперелетов. Кажется, что на близкие расстояния люди могут чаще перемещаться наземным транспортом: поездами или автомобилями, поэтому небольшое количество рейсов между двумя регионами еще не говорит об их слабом взаимодействии. Поэтому для получения адекватной картины происходящего необходимо принимать во внимание даже такие «мелочи», как дорожная инфраструктура региона или стоимость перемещения разными видами транспорта.
Рисунок 7. Разница в уровне доходов у американского населения по штатам. Экономическое неравенство сказывается и на сфере здравоохранения: у людей с высоким и низким доходом разные условия проживания, неравный доступ к медицине и др. Это может быть релевантно при анализе эпидемиологической обстановки региона.
CNBC, рисунок адаптирован
К тому же, чтобы упростить себе задачу, в рамках исследования ученые исходили из того, что связь между объемом потребления антибиотиков и уровнем резистентности неоспорима, а изменения в распространенности устойчивости следуют за изменениями в объеме потребления антибиотиков в течение какого-то относительно небольшого и обозримого отрезка времени, хотя оба эти положения являются предметом активного изучения. Попарное сравнение сообществ также существенно упрощает задачу построения математической модели и обработки данных. Однако надо понимать, что на деле регионы взаимодействуют между собой одновременно, и это взаимодействие может иметь сезонный характер, или его интенсивность может меняться в зависимости от каких-то социальных, политических или экологических процессов. Так что теоретические выкладки, полученные исследователями, довольно грубы и позволяют составить только беглое представление о проблеме.
Борьба с резистентностью: поиск новых решений
Итак, мы выяснили: устойчивость к антибиотикам страшна не только тем, что ее уровень растет по мере того, как увеличиваются объемы потребления антибиотиков, но и своей способностью распространяться внутри сообществ любого размера: от семей до государств. Особенное беспокойство вызывает распространение мультилекарственной резистентности некоторых патогенов — защищенности сразу от нескольких групп препаратов. Борьба с угрозой идет в основном по двум фронтам: во-первых, человечество создает все новые и новые препараты, способные эффективно подавлять устойчивые микроорганизмы, а во-вторых, придумывает способы замедлить распространение резистентности (как правило, за счет снижения объемов потребления антибиотиков) и выиграть время. Однако эта гонка бесконечна (см. обзор [17]). Как долго мы сможем «убегать»?
Хорошо бы научиться «отключать» резистентность, чтобы уже известные антибиотики заново стали эффективным «оружием». Для этого нужно проанализировать механизмы передачи, хранения и реализации устойчивости к антибиотикам. О некоторых из уже существующих способов борьбы с мультилекарственной резистентностью можно почитать в материалах [6] и [18].

Рисунок 8. Инфографика по карбапенем-резистентным энтеробактериям из доклада Департамента здравоохранения и социальных служб США. Согласно ей, в 2017 году насчитывалось 13 100 случаев госпитализации пациентов с инфекциями, вызванными карбапенем-резистентными энтеробактериями, в том числе и 1100 случаев летального исхода, а соответствующие затраты на здравоохранение в Америке составили 130 миллионов долларов США. Карбапанем-резистентные энтеробактерии представляют серьезную проблему для пациентов медицинских учреждений: некоторые штаммы развили устойчивости почти ко всем распространенным антибиотикам, что вынуждает врачей прибегать к более токсичным или менее эффективным препаратам.
[3], рисунок адаптирован
А здесь мы рассмотрим, как может решаться проблема мультилекарственной резистентности, на примере карбапенем-резистентных энтеробактерий (CRE, от Сarbapenem-Resistant Enterobacteriaceae). CRE могут поражать органы мочеполовой системы, кровь или легкие, но главная их опасность заключается в устойчивости к самым серьезным препаратам, направленным против них (рис. 8). Карбапенемы — антибиотики «последней надежды», то есть средства, которые применяются лишь в крайних ситуациях, когда ничто больше не помогает. Часто CRE устойчивы не только к карбапенемам, но и ко многим другим классам антибиотиков, что делает лечение от них чрезвычайно тяжелым [19]. В 2019 году Центр по контролю и профилактике заболеваний США поместил карбапенем-резистентных энтеробактерий среди пяти групп микроорганизмов, защиту от которых из-за угрозы здравоохранению необходимо разрабатывать в первую очередь [3].
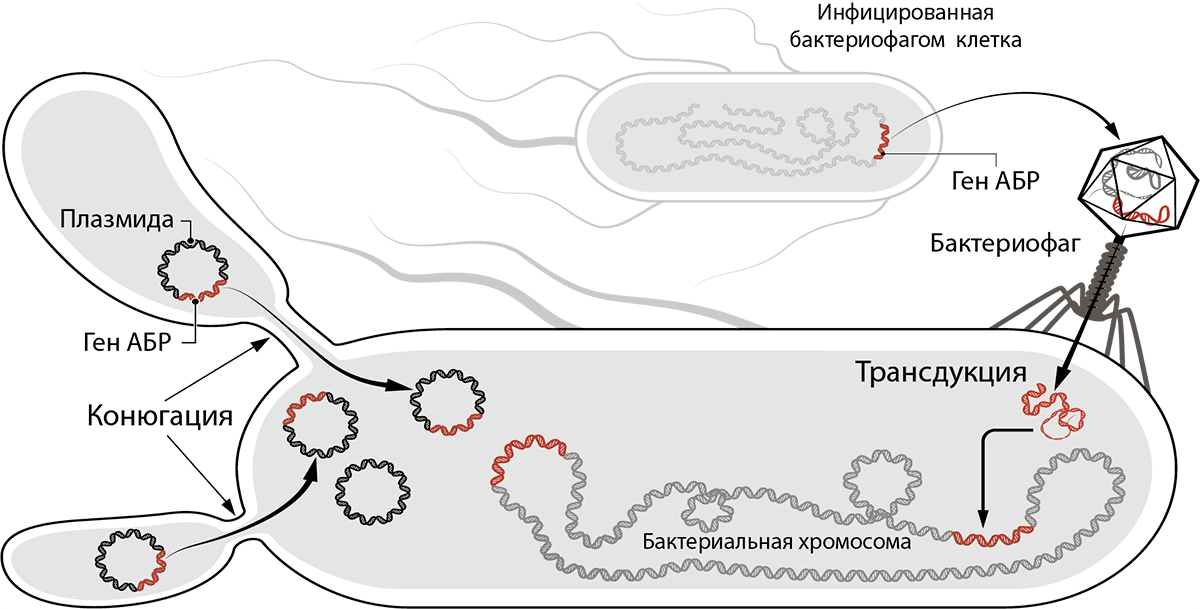
Рисунок 9. Как последовательности ДНК, ответственные за резистентность, попадают в клетку бактерии и хранятся в ней? Последовательности ДНК, кодирующие ферменты, которые обеспечивают резистентность, могут находиться в плазмидах — кольцевых ДНК внутри клеток бактерий, — передаваться в составе плазмид потомкам и родственникам при коньюгации. Еще такие последовательности ДНК могут передаваться из ДНК одной бактерии в ДНК другой путем трансдукции — переноса внутри вируса.
Устойчивость CRE работает по проверенной механике Докинза: резистентность переносится плазмидами устойчивости CRE (pCRE, CRE resistance plasmids), которые так и хочется назвать эгоистичными (рис. 9). Ведь карбапенем-резистентные энтеробактерии платят высокую цену за свою неуязвимость: если клетка утрачивает pCRE, то она погибает из-за токсина, который был закодирован в плазмиде и остался в клетке [20]. (До утраты pCRE с нее синтезировался неустойчивый антидот, блокирующий действие токсина.) pCRE очень большие, поэтому количество их копий в одной клетке CRE можно сосчитать по пальцам. Чтобы не потеряться во время деления, в pCRE закодирован механизм распределения по дочерним клеткам, как и множество ферментов, «обслуживающих» плазмиду, в которой заложено всё для ее распространения и выживания ее носителя, в том числе карбапенемаза — фермент, расщепляющий не только карбапенемы, но и многие другие β-лактамные антибиотики (рис. 10) [21]. Фермент, закодированный в плазмиде, «защищает» ее носителя. То есть в первую очередь опасность представляют не бактерии, а плазмида, поэтому методы борьбы должны быть направлены главным образом против нее.
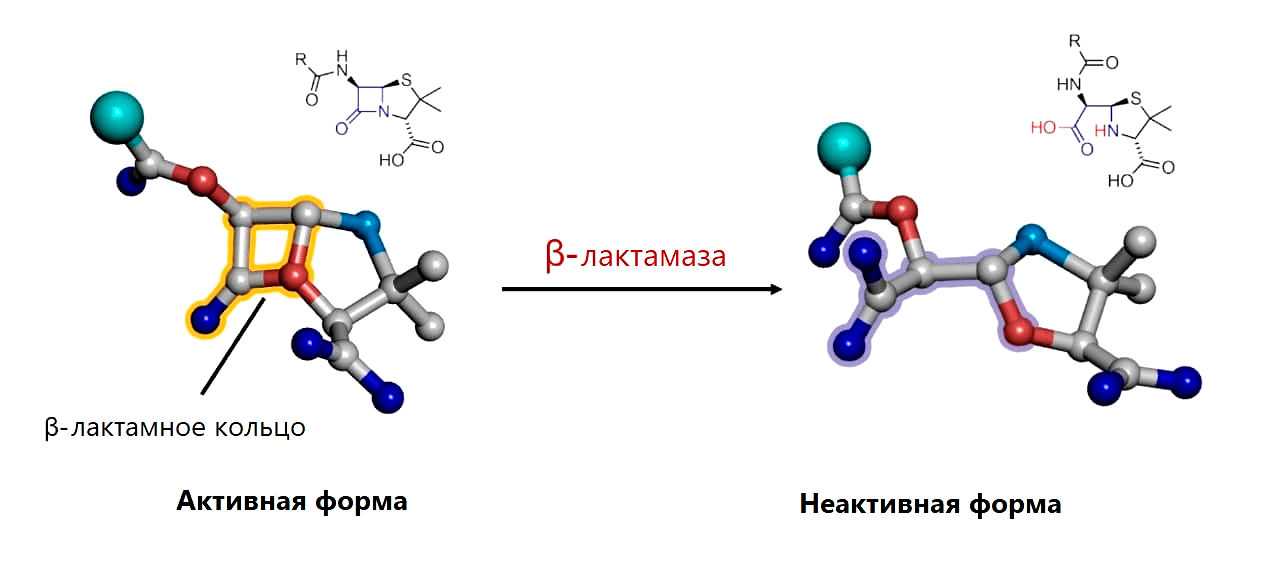
Рисунок 10. Разрушение β-лактамного кольца β-лактамазой путем гидролиза связи между атомами углерода (серыми) и азота (голубыми)
2019.igem.org, рисунок адаптирован
Кэйтлин Зулауфа и Джеймс Кирби из Гарвардской медицинской школы нашли подходящие для вмешательства в работу плазмиды препараты среди тех, которые уже используются, но в иных целях, и попробовали объяснить их эффективность в борьбе с резистентными штаммами [22]. Это исследование кажется нам важным, поэтому ниже мы расскажем об экспериментах, проведенных коллегами-учеными, и данных, говорящих в пользу их открытия.
В результате скрининга более 12 000 биоактивных соединений исследователи выделили три, после воздействия которых копии pCRE не распространялись в культуре бактерий при делениях, что делало последующие поколения восприимчивыми к карбапенемам.
Наш первый кандидат — касугамицин — аминогликозидный антибиотик, который, судя по данным исследователей, мешает процессу синтеза белка RepE, играющего ключевую роль в размножении pCRE путем репликации (удвоения) [23]. То есть без RepE плазмида, скорее всего, не передастся новым поколениям бактерий. После воздействия касугамицина в течение 24 часов репликация pCRE случалась реже более чем в 10 раз (рис. 11), по сравнению с необработанными бактериями (более 90% потомков бактерий, резистентных еще сутки назад, утратили защиту). Однако даже во время применения максимальной в этом исследовании дозы касугамицина плазмиды все же размножались (их становилось больше на два порядка). Зафиксируем, что касугамицин не блокирует репликацию полностью, а лишь сильно замедляет ее.
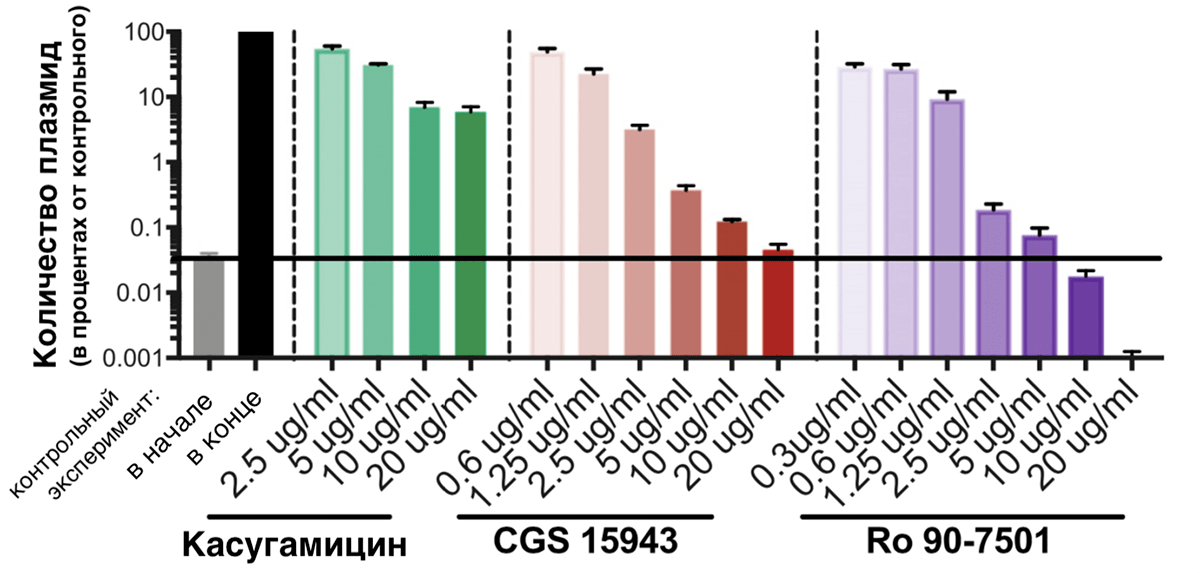
Рисунок 11. Зависимость активности размножения плазмид в растущей бактериальной культуре от воздействия препаратов. По вертикальной шкале — количество плазмид бактерий после инкубирования при разных концентрациях препаратов, выраженное в процентах от количества плазмид в посевах в обычных условиях. Первые два столбца — контрольный эксперимент (без воздействия препаратов): серый столбец — количество в начале контрольного эксперимента; черный — в бактериях после обычных условий культивирования. Зеленые столбики — после культивирования при разных концентрациях касугамицина; красные столбики — после культивирования при разных концентрациях CGS 15943; фиолетовые столбики — после культивирования при разных концентрациях Ro 90-7501.
[22], рисунок адаптирован
Наш второй кандидат — CGS 15943 (см. «Расшифровки» в конце статьи) — возможно, нарушает считывание последовательности RepE. В любом случае, он мешает репликации плазмид настолько, что их количество при максимальной дозе CGS 15943 почти не увеличилось (рис. 11). Отметим, что CGS 15943 способен почти полностью останавливать репликацию pCRE.
Третий кандидат — Ro 90-7501 (см. «Расшифровки» в конце статьи) — имеет самые впечатляющие результаты. Взглянув на рисунок 11, хочется назвать его «убийцей» pCRE. Дело в том, что Ro 90-7501 — интеркалятор ДНК, то есть соединение, которое встраивается между цепями ДНК, «ломая» ее структуру и мешая репликации. Только начиная исследование, ученые не хотели использовать интеркаляторы, потому что для человека целостность собственной ДНК не менее важна, чем для плазмиды целостность своей. Например, зафиксировано воздействие этого же Ro 90-7501 на клетки млекопитающих: он влияет на сборку фибрилл амилоида β42 (связанного с болезнью Альцгеймера) [24], на активность врожденного иммунитета [25] и ингибирует протеинфосфатазу 5 — фермент, важный в регуляции ключевых событий жизни клетки [26], [27]. Однако Ro 90-7501 оказался селективным к pCRE, и ученые изучили его особенно тщательно. Оговорив, что концентрация Ro 90-7501, при которой достигается максимальный антиплазмидный эффект, ниже токсичной для клеток млекопитающих почти в 30 раз [28].
Сравним препараты: CGS 15943 не имеет известных побочных эффектов для клеток человека, однако он и не истребляет плазмиды так, как это делает Ro 90-7501. То есть после окончания курса CGS 15943 резистентные патогены могут выжить и размножиться опять. Возможно, получится изменить последовательность Ro 90-7501 так, чтобы он перестал воздействовать на процессы в клетках млекопитающих. Однако обоим препаратам стоит «поучиться» у касугамицина проникать в клетки грамотрицательных бактерий (к которым относятся и энтеробактерии), видимо, для их применения в реальных условиях нужно разработать подходящий способ проникновения молекул препарата внутрь клетки.
Таким образом, использование каких-то из этих препаратов может привести нас к победе над опасными карбапенем-резистентными энтеробактериями. Ученым предстоит долгая и кропотливая работа по поиску или синтезу веществ, которые окажутся действенными в устранении описанного нами механизма резистентности.
Исследования, подобные этому, внушают надежду на то, что нам удастся не просто вечно бежать на шаг впереди, создавая препараты, к которым у бактерий еще не выработалась устойчивость, но и «поворачивать время вспять» — сопротивляться уже существующим механизмам резистентности, придумывая способы для непосредственной остановки их действия. И тогда пугающая цифра в 10 миллионов смертей в год никогда не станет реальностью.
Литература
- 12 методов в картинках: микроскопия;
- O’Neill J. (2016). Tackling drug-resistant infections globally: Final report and recommendations. Review on Antimicrobial Resistance;
- Antibiotic Resistance Threats in the United States, 2019. (2019). CDC;
- Antimicrobial Resistance. Tackling the Burden in the European Union. (2019). European Network for Safer Healthcare;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Marc Lipsitch, Matthew H. Samore. (2002). Antimicrobial Use and Antimicrobial Resistance: A Population Perspective. Emerg. Infect. Dis.. 8, 347-354;
- Vilhjalmur A. Arason, Adalsteinn Gunnlaugsson, Johann A. Sigurdsson, Helga Erlendsdottir, Sigurdur Gudmundsson, Karl G. Kristinsson. (2002). Clonal Spread of Resistant Pneumococci Despite Diminished Antimicrobial Use. Microbial Drug Resistance. 8, 187-192;
- M. H. Samore, M. K. Magill, S. C. Alder, E. Severina, L. Morrison-de Boer, et. al.. (2001). High Rates of Multiple Antibiotic Resistance in Streptococcus pneumoniae From Healthy Children Living in Isolated Rural Communities: Association With Cephalosporin Use and Intrafamilial Transmission. PEDIATRICS. 108, 856-865;
- Bat-Sheva Gottesman, Marcelo Low, Ronit Almog, Michal Chowers. (2020). Quinolone Consumption by Mothers Increases Their Children’s Risk of Acquiring Quinolone-Resistant Bacteriuria. Clinical Infectious Diseases. 71, 532-538;
- L. Leibovici. (2001). Departmental consumption of antibiotic drugs and subsequent resistance: a quantitative link. Journal of Antimicrobial Chemotherapy. 48, 535-540;
- Scott W. Olesen, Marc Lipsitch, Yonatan H. Grad. (2020). The role of “spillover” in antibiotic resistance. Proc Natl Acad Sci USA. 117, 29063-29068;
- Derek R. MacFadden, Sarah F. McGough, David Fisman, Mauricio Santillana, John S. Brownstein. (2018). Antibiotic resistance increases with local temperature. Nature Clim Change. 8, 510-514;
- Peter Collignon, John J Beggs, Timothy R Walsh, Sumanth Gandra, Ramanan Laxminarayan. (2018). Anthropological and socioeconomic factors contributing to global antimicrobial resistance: a univariate and multivariable analysis. The Lancet Planetary Health. 2, e398-e405;
- Joël Mossong, Niel Hens, Mark Jit, Philippe Beutels, Kari Auranen, et. al.. (2008). Social Contacts and Mixing Patterns Relevant to the Spread of Infectious Diseases. PLoS Med. 5, e74;
- Scott W. Olesen, Yonatan H. Grad. (2018). Racial/Ethnic Disparities in Antimicrobial Drug Use, United States, 2014–2015. Emerg. Infect. Dis.. 24, 2126-2128;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Alessandra Carattoli. (2009). Resistance Plasmid Families in Enterobacteriaceae. AAC. 53, 2227-2238;
- Manjistha Sengupta, Stuart Austin. (2011). Prevalence and Significance of Plasmid Maintenance Functions in the Virulence Plasmids of Pathogenic Bacteria. Infect. Immun.. 79, 2502-2509;
- Anne Marie Queenan, Karen Bush. (2007). Carbapenemases: the Versatile β-Lactamases. CMR. 20, 440-458;
- Katelyn E. Zulauf, James E. Kirby. (2020). Discovery of small-molecule inhibitors of multidrug-resistance plasmid maintenance using a high-throughput screening approach. Proc Natl Acad Sci USA. 117, 29839-29850;
- Bruce C. Kline. (1985). A review of mini-F plasmid maintenance. Plasmid. 14, 1-16;
- Bernd Bohrmann, Marc Adrian, Jacques Dubochet, Pascal Kuner, Francis Müller, et. al.. (2000). Self-Assembly of β-Amyloid 42 Is Retarded by Small Molecular Ligands at the Stage of Structural Intermediates. Journal of Structural Biology. 130, 232-246;
- Fang Guo, Jennifer Mead, Nishat Aliya, Lijuan Wang, Andrea Cuconati, et. al.. (2012). RO 90-7501 Enhances TLR3 and RLR Agonist Induced Antiviral Response. PLoS ONE. 7, e42583;
- Tae-Joon Hong, Kwanghyun Park, Eun-Wook Choi, Ji-Sook Hahn. (2017). Ro 90-7501 inhibits PP5 through a novel, TPR-dependent mechanism. Biochemical and Biophysical Research Communications. 482, 215-220;
- Terry D. Hinds Jr., Edwin R. Sánchez. (2008). Protein phosphatase 5. The International Journal of Biochemistry & Cell Biology. 40, 2358-2362;
- Fang Guo, Jennifer Mead, Nishat Aliya, Lijuan Wang, Andrea Cuconati, et. al.. (2012). RO 90-7501 Enhances TLR3 and RLR Agonist Induced Antiviral Response. PLoS ONE. 7, e42583;
- Nicholas G. Davies, Stefan Flasche, Mark Jit, Katherine E. Atkins. (2019). Within-host dynamics shape antibiotic resistance in commensal bacteria. Nat Ecol Evol. 3, 440-449;
- Sonja Lehtinen, François Blanquart, Nicholas J. Croucher, Paul Turner, Marc Lipsitch, Christophe Fraser. (2017). Evolution of antibiotic resistance is linked to any genetic mechanism affecting bacterial duration of carriage. Proc Natl Acad Sci USA. 114, 1075-1080;
- Céline Pulcini, Karen Bush, William A. Craig, Niels Frimodt-Møller, M. Lindsay Grayson, et. al.. (2012). Forgotten Antibiotics: An Inventory in Europe, the United States, Canada, and Australia. Clinical Infectious Diseases. 54, 268-274;
- Ghai G., Francis J.E., Williams M., Dotson R.A., Hopkins M.F., Cote D.T. et al. (1987). Pharmacological characterization of CGS 15943A: a novel nonxanthine adenosine antagonist. J. Pharmacol. Exp. Ther. 3, 784–790.