
Развитие и эпигенетика, или История о Минотавре
04 ноября 2013
Развитие и эпигенетика, или История о Минотавре
- 7045
- 1
- 8
Влияние среды и генотипа на первых стадиях развития определяют наше будущее
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Все мы знаем сказания о минотаврах, фавнах, кентаврах, русалках, — одним словом, полулюдях-полуживотных. Биологам больше скажет история о жирафе Ламарка, что, вытягивая свою шею в поисках листвы, тренирует ее и дает потомство с более длинной шеей. Да, речь пойдет о развитии многоклеточных организмов и том, насколько же предопределенным является наш фенотип; действительно ли генетический аппарат — царь и бог в мире клеток и определяет всю судьбу нашего развития, как когда-то Большой взрыв заложил все законы и импульсы частиц нашей необъятной Вселенной. Именно поэтому я упомянул о полулюдях, — вы ведь хотите узнать, какова вероятность родить весельчака-фавна, съев на первых неделях беременности рожок клубничного мороженого?
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Была одна, а стало много
Не одно поколение людей интересует проблема эмбрионального развития животных, и особенное внимание, конечно, уделяют человеку. Со школьной скамьи мы знаем о том, что происходит после оплодотворения. Известно, что за слиянием яйцеклетки и сперматозоида происходит множественное дробление зиготы; на стадии 32-х клеток образуется бластоциста, состоящая из трофобласта и эмбриобласта; далее происходит имплантация — своеобразное врастание образовавшегося полого шаровидного многоклеточного зародыша в стенку матки (рис. 1).
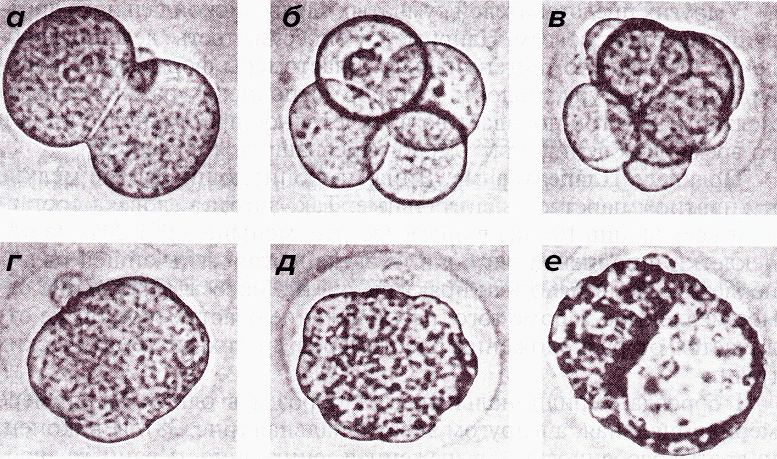
Рисунок 1. Дробление зародыша мыши in vitro. а — 2-клеточная; б — 4-клеточная; в — ранняя 8-клеточная; г — компактная 8-клеточная стадии; д — морула; е — бластоциста.
Однако после этого происходит то, что до сих пор не объяснено на 100%: начинается образование зародышевых листков — первичная дифференциация клеток. Здесь, на седьмые сутки от оплодотворения, мы сталкиваемся с тайной, сравнимой с секретом появления Вселенной. Однако о дифференциации стволовых клеток речь пойдет в следующих частях статьи; здесь же мы скажем, что во время имплантации зародыша начинается процесс разделения зародышевых листков и их интенсивного развития. Образуются две первичных ткани — экто- и эндодерма, — на границе которых в последующем закладывается третий зародышевый листок — мезодерма. В дальнейшем темпы роста и дифференцировки клеток зародыша только возрастают: эктодерма дает начало нервной системе и покровам; мезодерма продуцирует опорно-двигательную, кровеносную, выделительную и половую системы; кишечная трубка, поджелудочная железа, печень и легкие являются продуктом внутреннего зародышевого листка — эндодермы. Описанные закономерности были сформированы еще в XIX веке Мечниковым и Ковалевским [32].
Конечно эти сроки видоспецифичны, так что не стоит примерять эту информацию ко всем плацентарным.
Матриархат на молекулярном уровне?
Итак, как уже было сказано, стадия имплантации является определяющей для развития зародыша млекопитающего. Именно на этом сроке бластомеры эмбриобласта приобретают различия, которые пока не заметны даже для глаза опытного гистолога, вооруженного электронным микроскопом. Тем не менее происходит выключение некоторых генов, а спустя n-ное количество делений происходит первичный гистогенез: образуются зародышевые листки. Более того, бластоциста уже имеет дифференцированные клетки, — например клетки трофобласта, которые дают начало внезародышевым тканям. Так какова же суть этого механизма и почему из двух половых клеток, являющихся высокодифференцированными, образуется организм, число типов клеток которого приближается к двумстам? Почему, как верно сказал Н.В. Тимофеев-Ресовский, «...в процессе развития Metabiota в должное время в должном месте происходит должное?».
Ну что ж, вооружившись наиболее признанной теорией дифференцировки клеток в эмбриогенезе, а именно — теорией дифференциальной экспрессии генов — попытаемся прояснить ряд моментов в нашем развитии. Известно, что тип клетки определяется главным образом белками, однако белки не появляются «из воздуха». Для их создания не запускается могучий аппарат «небесной канцелярии»: для этого «всего лишь» активизируются определенные гены, только вот об этом «всего лишь» до сих пор и спорят ученые (рис. 2).
Рисунок 2. Бог, решающий в какую клетку организма разовьется данная
И правда, как решается, в какой клетке какие гены должны быть включены? Грубо говоря, когда клетке передается информация о том, что необходимо синтезировать какой-то определенный белок, в дело вступают целые каскады сигнальных молекул, приводящие в итоге к «включению» определенного гена, с которого через синтез мРНК производится белок. (Дело в том, что гены у нас работают не всегда — часто они «выключены».) Однако же откуда бластомеры получают сигнал, откуда у них упомянутые сигнальные молекулы, если ни один ген клеток зародыша до определенного момента не экспрессируется?
А дело в том, что в цитоплазме еще не оплодотворенной яйцеклетки уже имеются все необходимые на первых этапах развития зародыша сигнальные молекулы. Такие молекулы, отвечающие за образование и развитие органов, систем и частей тела и тканей, назвали морфогенами. Многие морфогены способны подавлять или подстегивать активность строго определенных генов. Эти молекулы совершенно специфическим образом распределяются по цитоплазме зиготы, в результате чего при делении Первой клетки организма дочерние клетки — бластомеры — приобретают разный набор морфогенов и, более того, разную их концентрацию. Таким образом, морфогены влияют на активность разных генов, и соответственно, на дальнейшую судьбу клетки [10], [11], [13], [14], [32].
Гены и векторы
Хм, а неужели на каждый ген из тысяч, имеющихся в каждой нашей клетке, влияет свой собственный морфоген? Как оказалось, морфогены влияют, главным образом, на активность так называемых gap и pair-rule генов и генов сегментарной полярности , продукт работы которых влияет на экспрессию гомеозисных генов. В статье «Гены, от которых вырастают крылья. И ноги. И всё остальное» [30] на «биомолекуле» вы встретите прекрасное описание функций, происхождения и истории открытия этих загадочных генов, а также парочку интересных и показательных случаев нарушения их работы. Я же, в свою очередь, приведу наиболее важную информацию о гомеозисных генах в контексте данной статьи. Итак, под действием продуктов работы gap и pair-rule генов гомеозисные гены запускают каскад реакций, приводящих к появлению в клетке определенных белков и, следовательно, ее дифференциации. Данные гены крайне консервативны — например, вы можете проделать простой опыт: пересадите такой ген, взятый у навозного жука, в яйцеклетку своей любимой кошечки и вы не увидите каких-либо отклонений в развитии. Однако консервативность этих генов имеет пределы, и для понимания этого достаточно сравнить число гомеозисных генов гребневиков (4) и млекопитающих (48). Гомеозисные гены относятся к группе транскрипционных факторов, регулирующих работу других генов. Результатом их работы будет своеобразная, не видимая глазу разметка зародыша в соответствии с планом, который был «написан» морфогенами (рис. 3).
Данные гены выделяют у сегментарных животных, однако у позвоночных есть их гомологи, например ген SHH («звуковой еж») человека, неправильная работа которого приводит к циклопии, нарушениям симметрии тела, голопрозенцефалии.
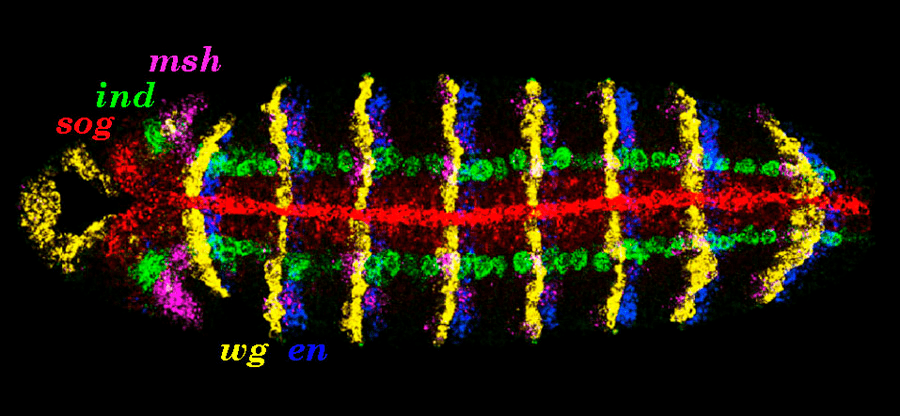
Рисунок 3. Разметка зародыша. Цвет обозначает эксперссию разных генов в эмбрионе дрозофилы, полоски — ряды клеток.
Потому мутации в таких генах приводят к серьезным нарушениям в развитии и даже смерти. Широко известны описания гомеозисных мутаций, составленные Э. Льюисом в 1940-х годах, — например, мутация гена Antennapedia у дрозофилы, которая приводит к формированию лапок на голове вместо антенн (рис. 4).

Рисунок 4. Мутация в гене Antennapedia. Слева — нормальная муха (дикий тип), справа — мутант.
F.R. Turner, Indiana University
Интересно, что гомеозисные гены располагаются в геноме не хаотично, как большинство других генов, а образуют кластер. Они расположены в строгой последовательности и экспрессируются так же — друг за другом. Например, первый ген в этом кластере будет отвечать за реакции, приводящие к формированию передней части организма на месте клеток, в которых этот ген работает, а ген, расположенный с противоположного конца последовательности, будет ответственен за развитие задней части организма. Так, гомеозисные гены обладают коллинеарностью.
Кроме того, пожалуй, стоит упомянуть о немалой роли белков семейства Wnt. Эти белки до сих пор ошеломляют исследователей, а открыты они были еще в начале 1980-х годов как маркеры многих раковых заболеваний. Однако в дальнейшем оказалось, что эти сигнальные молекулы имеют большое влияние на процессы пролиферации (деления) и дифференциации клеток: они играют «первую скрипку» в ансамбле развивающегося организма. Сейчас используется термин Wnt-путь, — то есть, сигнальный путь, который начинается со связывания Wnt-гликопротеина с мембранным рецептором клетки-мишени, а заканчивается регуляцией работы генетического аппарата клетки с участием белков TCF/LEF [4].
Первые шаги
Уже со стадии восьми бластомеров экспериментальным путем удается выявить функциональные различия клеток зародыша. До этого этапа любая клетка может дать начало полноценному организму, что используется исследователями для получения ранних стволовых клеток; то же показывает и появление однояйцевых близнецов. Более подробное описание данного феномена, а также его практическое медицинское применение (и противоборство этики и науки) можно найти в статьях «„За экстракорпоральное оплодотворение“ — это не тост, а Нобелевская премия!» [22] и «Щадящие стволовые клетки» [25].
Между тем, при образовании первичных тканей материнские морфогены уже перестают играть лидирующую роль в определении судьбы той или иной клетки. Каскады реакций уже запущены, и в силу вступает явление эмбриональной индукции, основанное на том, что клетки одного типа влияют на клетки другого типа благодаря межклеточным контактам и выделению различных веществ-сигналов. В результате такого влияния происходит образование нового типа клеток. Например, мезодерма не образуется, если нет контакта экто- и эндодермы. Этот эффект был назван законом эмбриональной индукции и сформулирован Г. Шпеманом, который в 1935 году был награжден Нобелевской премией по физиологии и медицине.
Со временем основой дифференциации становятся собственные сигнальные молекулы зародыша (как оказалось, нкРНК играют большую роль в этом процессе [28]), которые действуют все более локально. Так, если на начальных этапах развития определяется брюшная и спинная сторона будущего организма, а также его передняя и задняя часть, то при достижении определенного числа клеток эти самые клетки снова выбирают свой путь, — например, потомки одной из соседствующих клеток брюшной стороны зародыша войдут в состав пищевода, а другая даст популяцию остеоцитов. Подобный выбор пути происходит множество раз, при этом «увеличение» все больше и больше. Именно благодаря этому свойству запоминать свои предыдущие состояния на месте поврежденной кожи никогда не вырастит вторая голова, или, упаси бог, зубы.
Это интереснейшее свойство может быть продемонстрировано, например, при ампутации конечности хвостатой амфибии аксолотля. Поврежденная часть конечности быстро затягивается эпителием, под которым формируется пласт недифференцированных клеток — бластема. При этом данный пласт, будучи отделенным от конечности, отращивает только ту часть ее, что была утрачена. Более того, как показала группа исследователей из США и Германии, клетки бластемы не совсем однородны. Клетки, бывшие мышечными, по мере роста конечности становятся только мышечными клетками; то же верно и для других типов клеток, кроме тех, что были клетками кожи: они в дальнейшем могут дать начало клеткам хрящей, сухожилий, ну и, конечно, кожи [1]. Этот эксперимент (рис. 5) показывает наличие у клеток своеобразной памяти, а также пугает возможностью ее отсутствия. Ну право, кто знает, как бы мы выглядели, если бы не наши мудрые клетки?
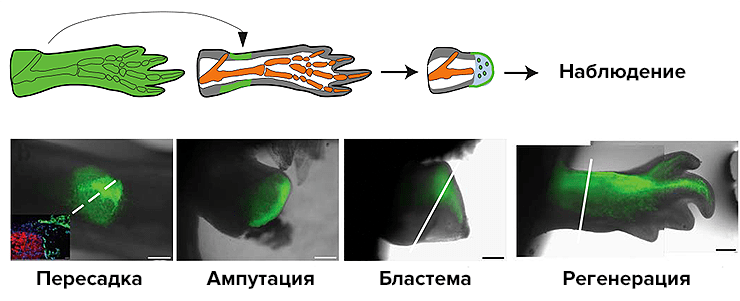
Рисунок 5. Схема эксперимента: определенный тип клеток, маркированных флуоресцентным белком, пересаживают обычному животному, у которого потом ампутируют конечность. После стадии бластемы можно наблюдать, в какие типы клеток превратились пересаженные.
И тут мы обнаруживаем, что одна клетка зародыша настолько разумна, что способна сама организоваться в полноценный организм, и это при том, что с каждым последующим делением клетки приобретают все больше самостоятельности. Страшно подумать, сколько хаоса вносит в окружающий мир эта самоорганизующаяся система.
Также немалое влияние на развитие оказывают внешние физические условия — гравитация, излучения электромагнитной природы, температура. В частности, изоляция от гравитационных полей и электромагнитного излучения приводит к нарушениям в развитии организма.
Старое—новое
В XVII–XVIII веках под влиянием общего скачка в развитии биологии (а особенно клеточной биологии) были сформированы два диаметрально противоположных взгляда на проблему эмбриогенеза и размножения. Эти два течения именовались преформизм и эпигенез. Преформисты считали, что в гаметах уже есть маленький зародыш; эпигенетики же говорили, что в онтогенезе происходит новообразование органов и тканей из однородной, неоформленной массы. Сейчас каждый из нас скажет «Оба взгляда по-своему верны». Однако сейчас можно отчасти согласиться и с Ламарком, хотя совсем недавно это было бы антинаучно, и тут мы сразу заметим нависающий лик товарища Лысенко. Но где все-таки граница, что такое эпигенетика и насколько она, в современном понимании, имеет право на жизнь, а также целесообразно ли применять термин «эпигеном»?
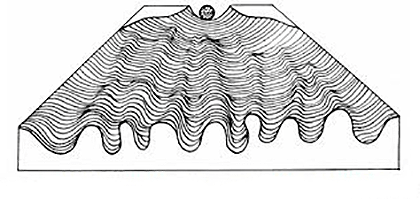
Рисунок 6. Эпигенетический ландшафт Уоддингтона
Пожалуй, впервые об эпигенетике заговорил Конрад Уоддингтон — еще в 1942 году, — а уже через 15 лет он сформулировал концепцию эпигенетического ландшафта, согласно которой, клетки, начиная от зиготы, множество раз выбирают тот или иной путь под воздействием генетических и негенетических факторов — так же, как шарик на рисунке 6 скатывается в какую-либо ложбину.
Эпигенетика — область генетики, изучающая модификации генной экспрессии, обусловленные наследственными, но потенциально обратимыми изменениями в структуре хроматина и/или метилированием ДНК, без изменения первичной последовательности нуклеотидов. Сейчас выделяют такие основные пути эпигенетической модификации генома как:
- Метилирование нуклеотидов;
- Ферментативная модификация гистонов;
- РНК-интерференция.
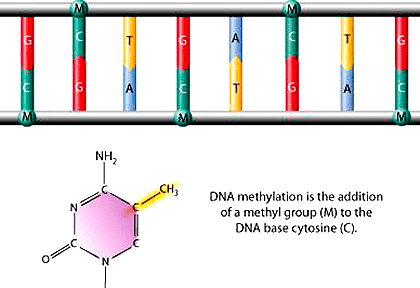
Рисунок 7. Метилирование цитозина
Метилирование представляет собой ферментативный процесс присоединения группы —CH3 к нуклеотидам — у млекопитающих это, в основном, цитозин (рис. 7). Стоит отметить, что метилирование цитозина происходит только в составе мотива CpG (цитозин—гуанин). В качестве донора метильной группы выступает S-аденозилметионин; фермент, который участвует в метилировании, называют метилазой или метилтрансферазой (DNMT). Метилирование ДНК — это модификация, отключающая гены. Это и есть та самая «память», которая имеется у дифференцированных клеток и не дает им подняться на вершину «уоддингтоновского ландшафта». Из этого следует, что метилирование тканеспецифично, а также участвует в обеспечении целостности нашего генома, защите ДНК.
Гистоны — это белки, на которые как бы накручивается нить ДНК при ее упаковке в составе хромосом. При этом гистоны сильно влияют на возможность «считать» с ДНК информацию, а модификации гистонов могут приводить как к активации ДНК, так и к подавлению активности определенных генов. Интересным фактом является способность некоторых модификаций гистонов повышать вероятность метилирования близлежащей ДНК. Модификации гистонов происходят быстро и часто; они представляют собой инструмент для тонкой регуляции активности генов.
И наконец, третий эпигенетический «товарищ» — РНК-интерференция, за открытие которой в 2006 году была присуждена очередная Нобелевская премия (рис. 8). Суть действия этого фундаментального механизма регуляции синтеза белка заключается в разрушении мРНК, и работе генов как бы «вхолостую». Эндрю Файр и Крейг Мэллоу открыли новые горизонты для изучения функций отдельных генов и белков, влиянии мутаций, лучшего понимания механизмов работы клеточных систем, а также использования данного механизма в лечении наследственных заболеваний и рака [19]. Некодирующие РНК [19–21], [28] проявили себя и в процессе, известном как инактивация Х-хромосомы. Удивительнейшим образом в этом процессе задействована некодирующая РНК Xist, «ползающая» по X-хромосоме и способствующая ее «выключению»: см. «Загадочное путешествие некодирующей РНК Xist по X-хромосоме» [29]. Происходит это на ранних стадиях эмбрионального развития; при этом в разных клетках инактивируются разные Х-хромосомы (так объясняется, например, черепаховая окраска у кошек). Иногда репрессия «неправильной» Х-хромосомы ведет к сложным психоневрологическим заболеваниям, — например синдрому Ретта.

Рисунок 8. Лауреаты Нобелевской премии по физиологии или медицине 2006 года Эндрю Файр и Крейг Меллоу рядом с бюстом Нобеля
Все эти виды РНК интересны еще и тем, что они присутствуют в зрелой яйцеклетке, то есть, способны влиять на развитие организма и наследственность. Несомненна роль РНК-интерференции в защите клетки от вирусов и мобильных элементов генома.
Итак, в свете того, что многие лаборатории мира занимаются поиском эпигенетических маркеров при разных болезнях у различных организмов (иначе говоря, устанавливают эпигеном), можно считать эпигенетику прочно вошедшей в мир биологических наук. Более того: данная область знания повторяет путь науки генетики в XX веке, а значит, скоро нас ждут новые фундаментальные знания о работе клетки и организма в целом [3], [9], [15].
Сексизм и клетки
Одним из самых распространенных и интересных случаев эпигенетического наследования является геномный импринтинг — тканеспецифичный процесс, при котором активность определенных аллелей гена зависит от пола родителя, предоставившего этот аллель. Разберем это явление на примере синдромов Прадера-Вилли (СПВ) и Ангельмана (СА). Первое заболевание ведет к низкорослости, сильному ожирению, умственной отсталости, неразвитости половых желез. Второе характеризуется также умственной отсталостью, неуместным смехом, нарушениями речи [27].
Причиной этих двух наследственных заболеваний является делеция участка 15-й хромосомы либо однородительская дисомия (обе гомологичные хромосомы наследуются от одного родителя). При этом, если делеция унаследована от отца или обе 15-е хромосомы от матери — развивается синдром Прадера-Вилли. Другой синдром, связанный с аномалиями хромосомы 15, — синдром Ангельмана — в 70% случаев обусловлен делецией участка 15q11—q13 материнской хромосомы (рис. 9). Сейчас существует несколько кандидатов на роль генов, ответственных за развитие этих заболеваний. Например, за развитие синдрома Ангельмана может отвечать ген UBE3A, белковый продукт которого участвует в системе деградации белков. В мозге данный ген экспрессируется только с материнской хромосомы, а у больных СА — не активен. За развитие СПВ ответственность может нести ген SNRPN, который, напротив, активен только на отцовской хромосоме. К сожалению, эффективного лечения этих заболеваний нет.
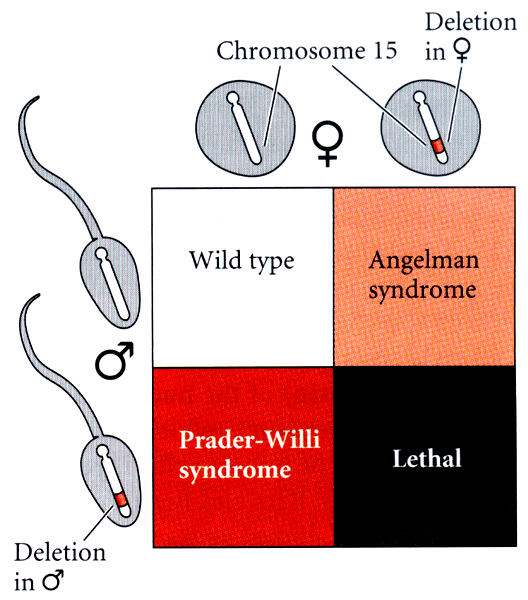
Рисунок 9. Схема наследования синдромов Ангельмана и Прадера-Вилли
презентация М.К. Ивановой «Метилирование ДНК и его роль в регуляции экспрессии генов»
Маленький метил меняет жизнь
Один из наиболее известных экспериментов, проведенных на наших братьях меньших — мышах, — был проведен Рэнди Джиртлом и Робертом Уотерлэндом. Они кормили беременных самок-носителей мутации гена агути веществами, богатыми метильными группами (рис. 10). В результате на свет появлялось вполне здоровое потомство с нормальными весом и окрасом шерсти были. Видимо, метил, содержащийся в пище родителей, помог выключить дефектный ген [27].
При такой мутации мыши имеют характерный ярко-желтый окрас шерсти, страдают диабетом, раком и ожирением.

Рисунок 10. Экспериментальные мыши. Слева — мышь с мутацией по гену агути, справа — норма.
Вирус и хозяин — любовь на века
Метилирование ДНК у бактерий лежит в основе явления так называемой хозяйской рестрикции-модификации. Бактериофаг, выращенный в клетках того или иного штамма бактерии, приобретает хозяйскую специфичность: он способен заражать только клетки этого штамма, поскольку ДНК бактериофага обработана ДНК-метилазами бактерии-хозяина и тем самым защищена от расщепления хозяйскими ферментами-эндонуклеазами. Было выяснено, что метилирование адениновых остатков у бактериофага Т2 и его хозяина E. coli идёт в одних и тех же последовательностях; следовательно, модификация с большой вероятностью вносилась одной и той же метилазой. Также была выявлена специфичность метилирования ДНК у различных штаммов бактерий.
Эпигенетика и медицина, а также чему дети учат взрослых
Неизвестно когда впервые в голову нашего смертного предка пришла мысль о вечной жизни, однако упоминания о различных эликсирах бессмертия встречаются и до нашей эры (в основном, он фигурирует там как напиток богов). Примерно с XII века в Европе набирает обороты искусство алхимии, и как венец ее достижений упоминается все тот же эликсир долголетия. С начала XX века геронтология как наука о старении и способах его преодоления завладевает умами все большего количества исследователей. Причина такого яркого интереса вроде бы ясна, однако дело ведь не в желании жить вечно, — причиной являются новые знания об устройстве нашего организма.
Итак, проведем краткий экскурс в мир без морщин. Сейчас о стволовых клетках можно услышать где угодно; впервые же о них упомянул русский гистолог А.А. Максимов, изучавший восстановление популяций форменных элементов крови [5]. А с тех пор, как в 1988 Элиан Глюкман успешно использовала для лечения анемии гемопоэтические стволовые клетки пуповинной крови, их стали считать универсальным лекарством от любых болезней, и, конечно же, самой старушки-смерти. Однако если забыть об этической стороне подобного лечения — ведь изначально стволовые клетки получали из эмбрионов [5], [25], — то остается сторона материальная, ведь достать подходящие стволовые клетки (СК) — это вам не за хлебом сходить.
И тут на помощь снова приходит метил, который, как мы помним, является теми нулями и единицами, с помощью которых записан в клетке ее путь по ландшафту Уоддингтона — тому самому, по которому проходит любая клетка от зиготы до дефинитивной клетки организма. Значит, чтобы получить СК, больше не нужно «проливать» кровь младенцев, нужно лишь «загнать» любую дифференцированную клетку в начало пути, сделать ее стволовой, стереть те эпигенетические маркеры, которые не дают клетке стать таковой. Также мы знаем, что свойства клеток — это ее белки; таким образом, должны существовать особые белки «стволовости». Именно этими соображениями руководствовался выдающийся цитолог нашего века Шинъя Яманака, когда начал свои исследования по поиску факторов, превращающих соматическую клетку организма в стволовую.
В 2006 году такие факторы были найдены, и было их всего четыре — Oct4, Klf4, Sox2¸ c-Myc (Исчерпывающий обзор на эту тему можно найти в статье «Была клетка простая, стала стволовая» [7].) Использование первых индуцированных плюрипотентных стволовых клеток (ИПСК) было связано с большим риском развития опухолей, а также малой продуктивностью, однако позднее методика перепрограммирования была значительно улучшена [5], [31]. Эта работа по получению ИПСК без использования эмбрионального материала была признана журналом Science наиболее важным открытием 2007 года [23], [24]. В 2012 году Яманака и Джон Гардон получили Нобелевскую премию по физиологии и медицине «за открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние» [2].
Сейчас, когда нам становится ясна роль эпигенетических модификаций (в частности, метилирования) в старении, опухолеобразовании, дифференцировке и развитии, прогрессивная медицина возлагает определенные надежды на достижения эпигенетики. Ведется множество исследований по поиску связи различных заболеваний, рака и эпигенетических маркеров. Сейчас разрабатывается порядка десяти лекарственных препаратов, для создания которых использовались последние достижения эпигенетиков; более того, четыре препарата уже давно используются при лечении опухолей. Также, в статье «Пилюли для эпигенома» [18] упоминается о природных «лекарствах», действие которых обусловлено влиянием на эпигенетические модификации.
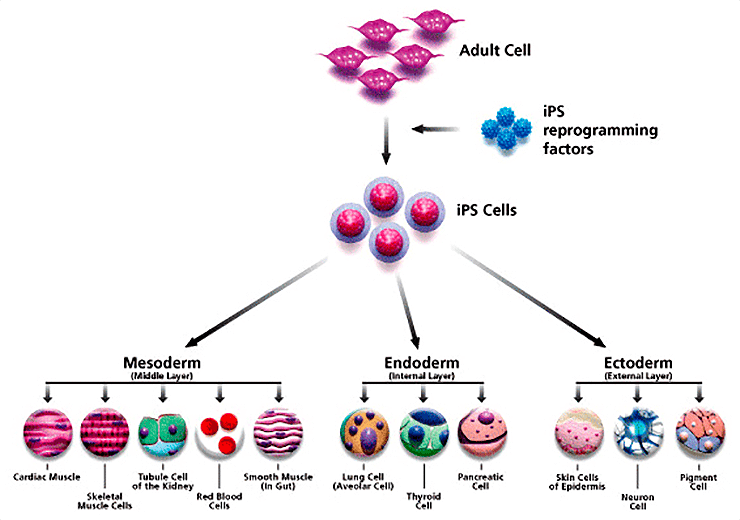
Рисунок 11. Дифференцировка ИПСК
Однако пока что вмешательство в эпигенотип еще более чревато, чем в генотип. Во-первых, потому что такое вмешательство невозможно сделать точечным, хотя РНК-интерференция и дает надежду на подобную терапию (например, уже известны случаи применения малых РНК для подавления роста опухоли). Во-вторых, система хорошо продублирована и устроена по принципу положительной-отрицательной обратной связи. Как и в гормональной системе, здесь даже небольшое вмешательство может повлечь долгоиграющие и плохо просчитываемые последствия.
Эпигенетика вкладывает в наши руки инструмент сродни операционной системе компьютера — ведь даже самое мощное «железо» не работает без программного обеспечения. Таким образом, эпигенетические маркеры дают нам надежду на избавление от многих болезней и, в перспективе, от самой главной — смерти.
В конце XX века Ричард Докинз опубликовал книгу «Эгоистичный ген», сформулировав идею о живом существе как марионетке генов [8]. А Питер Медавар в ответ сказал, что «генетика предполагает, а эпигенетика — располагает» [6].
Выражаю благодарность моим друзьям А. Омельяненко и М. Гарбуз за помощь в работе над статьей.
Литература
- Martin Kragl, Dunja Knapp, Eugen Nacu, Shahryar Khattak, Malcolm Maden, et. al.. (2009). Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460, 60-65;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Вайсерман А. (2009). Эпигенетика. «Мой компас»;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Ствол и ветки: стволовые клетки;
- Eva Jablonka, Gal Raz. (2009). Transgenerational Epigenetic Inheritance: Prevalence, Mechanisms, and Implications for the Study of Heredity and Evolution. The Quarterly Review of Biology. 84, 131-176;
- Была клетка простая, стала стволовая;
- Докинз Ч. Эгоистичный ген. М.: Corpus, 2013. — 512 с.;
- Колесникова Т. и Иванов М. (2012). Эпигенетические механизмы регуляции экспрессии генов.;
- Баранов В. и Кузнецова Т. Цитогенетика эмбрионального развития человека. Санкт-Петербург: «Н-Л», 2007;
- Высоцкая М. Биология размножения и развития: учебно-методический комплекс. Горно-Алтайск: РИО ГАГУ, 2007. — 62 с.;
- Уотерс Э. (2007). Эпигенетика. GEO. 112, 129–142;
- Ptashne M. A genetic switch. Gene control and phage λ. Cell Press & Blackwell Scientific Publications, 1986. — 128 p.;
- Патрушев Л. Экспрессия генов. М.: «Наука», 2000;
- Ванюшин Б.Ф. (2004). Материализация эпигенетики, или небольшие изменения с большими последствиями. «Химия и жизнь». 2, 32–37;
- Mulnard J. (1967). Microcinematographic analysis of the mouse egg development from stage 2 to the blastocyst. Arch. Biol. 1, 107–139;
- Graceyim. (2004). Human cloning: science fiction or reality? The Science Creative Quarterly;
- Пилюли для эпигенома;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Как избавиться от РНК за несколько минут;
- Allen Brain Atlas: транскриптом мозга;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- Элементы: «Год человеческих геномов»;
- Special Online Collection: Breakthrough of the Year 2007. (2007). Science. 318;
- Щадящие стволовые клетки;
- Induced pluripotent stem cell differentiation protocols. Merck;
- Кэри Н. Эпигенетика: как современная биология переписывает наши представления о генетике, заболеваниях и наследственности. Ростов-на-Дону: «Феникс», 2012;
- Mitchell Guttman, Julie Donaghey, Bryce W. Carey, Manuel Garber, Jennifer K. Grenier, et. al.. (2011). lincRNAs act in the circuitry controlling pluripotency and differentiation. Nature. 477, 295-300;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Masato Nakagawa, Michiyo Koyanagi, Koji Tanabe, Kazutoshi Takahashi, Tomoko Ichisaka, et. al.. (2008). Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nat Biotechnol. 26, 101-106;
- Серов О.Л. Генетика развития. Новосибирск: НГУ, 1998.







