
Белок, который помогает восстанавливать нейронные связи после спячки, полезен в борьбе с заболеваниями нервной системы
29 января 2015
Белок, который помогает восстанавливать нейронные связи после спячки, полезен в борьбе с заболеваниями нервной системы
- 1698
- 0
- 3
Сонно, холодно, целебно...
Рисунок в полном размере.
-
Автор
-
Редактор
Во время спячки некоторые связи между нервными клетками разрушаются, а затем полностью восстанавливаются, когда приходит время возвращаться к активному образу жизни. Белок RBM3, который обеспечивает восстановление связей между нервными клетками после спячки, помогает и в борьбе с нейродегенеративными заболеваниями, замедляя скорость разрушения нейронов, улучшая память и продлевая жизнь подопытным животным.
Спячка — удивительное состояние организма, в котором замедлены процессы обмена веществ, снижена потребность в питательных веществах и повышена устойчивость к заболеваниям [1]. Кроме того, спячка влияет на состояние мозга животного — под действием холода нейроны изменяют форму, а количество связей между ними уменьшается [2–4]. По-видимому, это связано с необходимостью экономить энергию, ведь поддержание синапсов «дорого» обходится организму. Этот эффект обратим — при повышении температуры структура связей между нейронами восстанавливается. В похожее на спячку состояние можно ввести и многих животных, которые в природе в нее не впадают. Как правило, для этого важны не только охлаждение, но и темнота, а также отсутствие питания.
Недавно был открыт новый способ введения животных в спячку — для этого применяют инъекции аденозин-5’-монофосфата (5’-AMP) [5]. Большое количество этих молекул «говорит» организму о том, что у него недостаточно питания, и при этом даже животные, для которых в природе спячка не характерна, могут войти в подобное ей состояние. Температура их тела снижается, поэтому такую искусственную спячку называют гипотермией. На гипотермию, вызванную 5’-AMP, возлагаются большие надежды, так как она могла бы стать идеальным наркозом во время операций, а также могла бы пригодиться в будущем во время долгих космических перелетов [6], [7]. Кроме того, у гипотермии обнаружили полезный нейропротективный эффект, связанный с необходимостью быстро восстанавливать нейронные связи после спячки. Оказывается, этот эффект может пригодиться и в борьбе с заболеваниями нервной системы.
Группа ученых из Англии искусственным образом вводила мышей в состояние гипотермии, понижая их температуру тела до
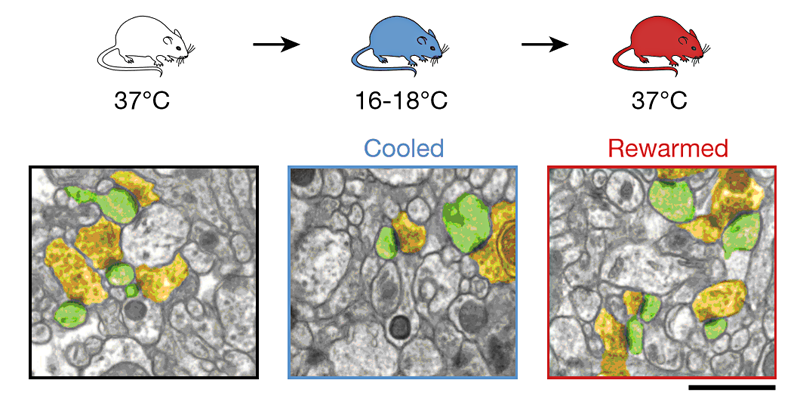
Рисунок 1. Уменьшение числа синапсов при охлаждении и восстановление их числа после нормализации температуры тела. Желтым выделены пресинаптические компартменты, а зеленым — постсинаптические. Там, где соприкасаются желтая и зеленая структуры, находится синапс — место контакта нейронов. Масштабная линейка — 1 микрометр.
При охлаждении организма процессы синтеза в нем подавляются. Однако есть и исключения — к примеру, белок холодового шока RBM3 (RNA-binding motif protein 3), синтез которого с уменьшением температуры, наоборот, усиливается. Количество этого белка увеличивалось при охлаждении и у здоровых мышей, и у мышей с начальными проявлениями болезни. Однако с развитием заболеваний нервной системы мыши постепенно теряли способность усиливать наработку этого белка при снижении температуры. А вскоре после этого пластичность их нейронов ухудшалась (то есть разрушенные при охлаждении связи между нервными клетками больше не восстанавливались с повышением температуры). Ученые решили проверить, не обеспечивает ли именно белок RBM3 способность восстанавливать структуру нейронных связей. Уже было известно, что он может защищать нейроны от гибели, а также усиливать синтез белков [9]. Может быть, он способен улучшить процессы регенерации при заболеваниях нервной системы? Чтобы проверить это, ученые решили с помощью холода активировать синтез этого белка у мышей, у которых только началось развитие заболеваний нервной системы и которые пока не утратили способность реагировать увеличением синтеза этого белка на снижение температуры.
Оказалось, что однократное охлаждение мышей на начальных стадиях болезни до
Негативные эффекты прионных заболеваний и болезни Альцгеймера связаны в том числе и с утратой синапсов . Она объясняется, по крайней мере отчасти, нарушениями процесса восстановления синапсов, который может быть полезен не только для того, чтобы «приходить в себя» после спячки, но и для того, чтобы бороться с заболеваниями нервной системы. Теперь мы знаем, что белок RBM3 может помочь восстановлению синапсов и при нейродегенеративных заболеваниях. Дальнейшие исследования природных восстановительных способностей живых организмов могут принести нам еще много важных и полезных открытий.
О нарушениях синаптической передачи при похожем, но лучше изученном, нейродегенеративном недуге — болезни Хантингтона — читайте в статье «Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона)» [10]. Кстати: белки-антифризы, которые не дают воде в клетках замерзнуть, — это тоже тема: «Установлен механизм действия “белков-антифризов”» [11]. — Ред.
Литература
- Karin Arinell, Berolla Sahdo, Alina L. Evans, Jon M. Arnemo, Ulrik Baandrup, Ole Fröbert. (2012). Brown Bears (Ursus arctos) Seem Resistant to Atherosclerosis Despite Highly Elevated Plasma Lipids during Hibernation and Active State. Clinical Translational Sci. 5, 269-272;
- V.I. Popov, N.I. Medvedev, I.V. Patrushev, D.A. Ignat’ev, E.D. Morenkov, M.G. Stewart. (2007). Reversible reduction in dendritic spines in CA1 of rat and ground squirrel subjected to hypothermia–normothermia in vivo: A three-dimensional electron microscope study. Neuroscience. 149, 549-560;
- Ana María Magariños, Bruce S. McEwen, Michel Saboureau, Paul Pevet. (2006). Rapid and reversible changes in intrahippocampal connectivity during the course of hibernation in European hamsters. Proc. Natl. Acad. Sci. U.S.A.. 103, 18775-18780;
- V.I. Popov, L.S. Bocharova. (1992). Hibernation-induced structural changes in synaptic contacts between mossy fibres and hippocampal pyramidal neurons. Neuroscience. 48, 53-62;
- Jianfa Zhang, Krista Kaasik, Michael R. Blackburn, Cheng Chi Lee. (2006). Constant darkness is a circadian metabolic signal in mammals. Nature. 439, 340-343;
- Cheng Chi Lee. (2008). Is Human Hibernation Possible?. Annu. Rev. Med.. 59, 177-186;
- Андреева О. и Тарасевич Г. «Почему мы не суслики». (2009). Русский репортер. 41;
- Diego Peretti, Amandine Bastide, Helois Radford, Nicholas Verity, Colin Molloy, et. al.. (2015). RBM3 mediates structural plasticity and protective effects of cooling in neurodegeneration. Nature. 518, 236-239;
- Sophorn Chip, Andrea Zelmer, Omolara O. Ogunshola, Ursula Felderhoff-Mueser, Cordula Nitsch, et. al.. (2011). The RNA-binding protein RBM3 is involved in hypothermia induced neuroprotection. Neurobiology of Disease. 43, 388-396;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Установлен механизм действия «белков-антифризов».





