-
157Статья на конкурс «Био/Мол/Текст»: Генная терапия Casgevy стала событием, которое еще недавно казалось научной фантастикой. Впервые технология CRISPR/Cas9 вышла за пределы лабораторий и доказала свою способность менять судьбы людей с тяжелыми наследственными заболеваниями. В центре статьи — история Виктории Грей, чья жизнь десятилетиями была подчинена боли, и научный прорыв, позволивший «перезагрузить» работу крови на генетическом уровне. Материал объясняет, как активация фетального гемоглобина позволяет остановить разрушительное действие серповидноклеточной болезни, приводит ключевые результаты клинических исследований и поднимает неизбежные вопросы о цене прогресса, доступности высоких технологий и будущем медицины. Casgevy здесь — не просто препарат, а символ новой эры, в которой генетические ошибки перестают быть приговором.
-
149Статья на конкурс «Био/Мол/Текст»: Науку и бизнес часто разводят по разным берегам: прикладные исследования есть, но прямой маршрут от открытия к инвестициям редок. Есть ли исключения? Можно ли превратить научное исследование в бизнес? Истории таких компаний, как Constructive.Bio, перепрограммировавшей геном прокариот; Colossal Biosciences, работающей над воссозданием видов; и ISMO Bio-Photonics, смоделировавшей легкие на микрочипе, показывают, что можно. О том, на основе каких идей удалось построить эти стартапы и на какие научные концепции они опирались, читайте в этой статье.
-
2890Мы продолжаем увлекательное путешествие в мир инструментов для «генных правок». Если в предыдущей статье спецпроекта «Генная и клеточная терапии» мы познакомились с основами модификации генома животных, то теперь перейдем к самой интригующей части истории — изменению человеческой ДНК в медицинских целях. Теоретически уже сейчас можно переписывать «код жизни», превращая ранее неизлечимые недуги в поддающиеся коррекции. Но насколько далеко простираются границы этих возможностей? Что реально достижимо уже сегодня? Наше воображение будоражат соблазнительные картины: мы могли бы изменять врожденный цвет глаз, длину конечностей, уже с пеленок наделять детей исключительными способностями... Однако на практике передовые разработки сосредоточены на закрытии по-настоящему неудовлетворенных потребностей: исправлении ошибок природы, ведущих к тяжелым наследственным заболеваниям. Эта статья станет проводником в удивительный мир генной инженерии; раскроет секреты технологий, подаривших инструменты редактирования генома; подробно расскажет, как они появились и функционируют, какие перспективы открывают в науке и медицине; а также какие трудности стоят на пути ученых, и почему изменения в генах способны перевернуть представления человечества о здоровье и лечении.
-
479Статья на конкурс «Био/Мол/Текст»: Эра гаражных стартапов, которую когда-то начали IT-предприниматели, получает неожиданное продолжение в мире биотехнологий. Современные биоинженеры, вооружившись технологией редактирования генома CRISPR/Cas9, создают инновационные проекты по модификации пивных дрожжей. В статье мы рассмотрим практическое применение генного редактирования в пищевой промышленности и обсудим, как технология CRISPR меняет наше представление о создании генно-модифицированных продуктов — от пива до ферментированных продуктов.
-
Третья статья спецпроекта «Животноводство и ветеринария» посвящена современным трендам в свиноводстве. В центре нашего внимания будут методы селекции, здоровье репродуктивной системы, инфекционные заболевания у свиней и способы их лечения и профилактики. А в качестве бонуса — рассказ о том, как именно изучение свиней помогает в лечении болезней человека и как органы свиней помогут спасти тысячи человеческих жизней.
-
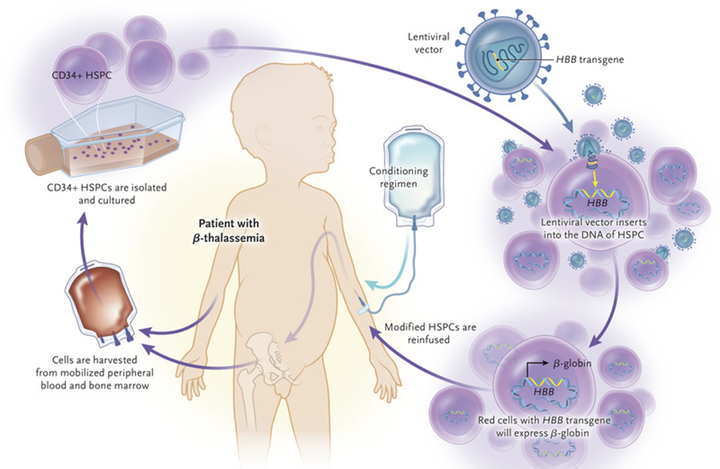
1026Статья на конкурс «Био/Мол/Текст»: Мы знаем, как сделать операцию на разные органы и исправить какие-то недостатки в них. Но как исправить то, что находится в каждой клетке нашего организма — наши гены? Этим и занимается генная терапия стволовых клеток, к которым и относятся гемопоэтические стволовые клетки (ГСК).
-
813Статья на конкурс «Био/Мол/Текст»: В последние годы биотехнологическая отрасль переживает своеобразный «бум», в особенности в сфере питания. Наблюдается значительный прогресс в производстве и разработке инновационных продуктов. Позвольте мне пригласить вас в будущее — в мир стартапов, которые революционизировали пищевые технологии. В рамках этого путешествия длиной в восемь глав мы будем собирать идеальный завтрак будущего. Начнем с кофе без кофеина, погрузившись в мир инноваций. Затем познакомимся с веганской кулинарией, где яичный белок производится с помощью грибной культуры. Откроем для себя острые томаты и вкуснейшие неострые листья горчицы. Также мы изучим процесс получения пищи из воздуха, сможем распечатать лосося на 3D-принтере и, наконец, обнаружим мамонта в кулинарном мире. Приготовьтесь к путешествию!
-
548Айзексон делает ставку на биотехнологии, поэтому главным героем его новой биографии стала Дженнифер Даудна. Читателя ждет история одной из главных героинь CRISPR-эпопеи, которая разработала эту методику редактирования генома, а также подробное погружение в область, знакомство со множеством известных ученых и их вкладом в развитие науки.
-
Диагностика орфанных заболеваний — дело непростое, но после верного диагноза необходимо и подходящее лечение. Продолжая Спецпроект об орфанных заболеваниях, мы поговорим о болезнях, для которых диагностика все еще проблематична, но зато терапия уже появилась. Начнем с транстиретинового семейного амилоидоза, способного запросто сбить врачей с толку своими симптомами. Как его распознать и чем лечить? Читайте статью!
-
933Статья на конкурс «Био/Мол/Текст»: До недавних пор любые организмы-вредители, паразиты или другие неугодные человечеству создания неизбежно подлежали истреблению тем или иным способом. Однако у таких методов полно недостатков: они плохо управляемые, негуманные, недостаточно эффективные или, наоборот, чересчур радикальные и приводящие к еще большим катастрофам. К счастью, человечество умеет постепенно превращать даже самые грубые системы в изящные и легко управляемые механизмы. Этот обзор посвящен свежим идеям, которые только обсуждаются, а также новым готовым методам в сфере ограничения и контроля опасных или вредных популяций.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин