-
233Статья на конкурс «Био/Мол/Текст»: Представь: редкие генетические синдромы, которые годами остаются нераспознанными врачами, теперь диагностируются с помощью одного фото. Исследуй роль ИИ в анализе генома, с акцентом на синдроме Кабуки — названном в честь японского театра кабуки из-за поразительного сходства черт лица с драматическим гримом кумадори. Узнай, как нейросеть DeepGestalt, обученная на тысячах снимков, с точностью 91% распознает мутации в генах KMT2D или KDM6A, помогая установить диагноз на основе симптомов. Открой синергию биологии, математики, программирования и медицины в инструментах вроде Face2Gene, которые ускоряют поиск, облегчают жизнь пациентам и ведут к эре персонализированной медицины. А впереди? ИИ, прогнозирующий болезни, оценивающий риски и подбирающий терапию под каждого — это уже реальность!
-
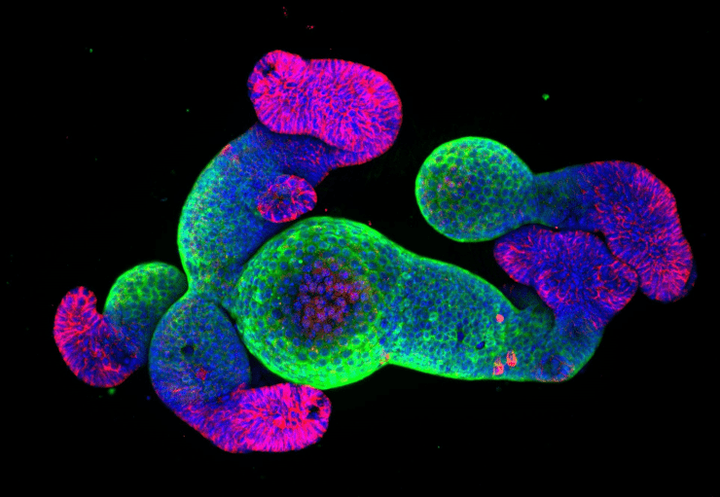
426Органоиды — трехмерные клеточные структуры, моделирующие функции человеческих органов, стали ключевым прорывом современной биологии и медицины. Эти «мини-органы», созданные из стволовых клеток взрослого человека, предоставляют уникальные возможности во многих областях: от регенеративной медицины и до тестирования лекарств. В этой статье мы разберем историю успеха органоидов и проанализируем, как технологии их создания превратились из исключительно академического инструмента в перспективный рынок.
-
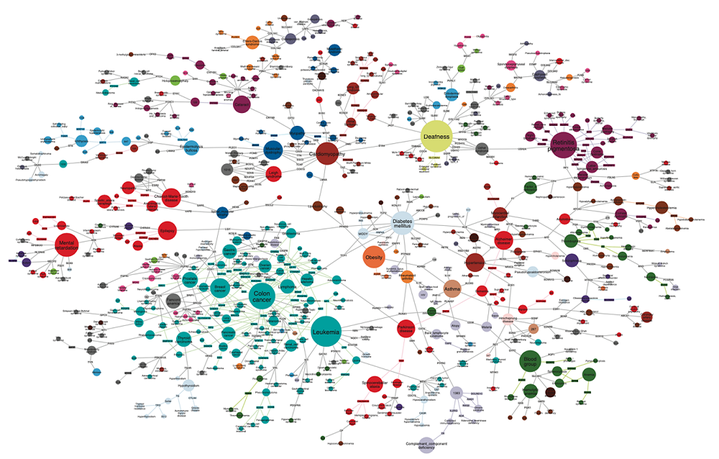
449Статья на конкурс «Био/Мол/Текст»: Сетевая медицина — это новая парадигма в исследовании и лечении заболеваний, которая соединяет молекулярную биологию, математическое моделирование и клиническую практику. В этой статье представлены ключевые принципы сетевого анализа, позволяющие заглянуть в скрытые механизмы сложных заболеваний, от нейродегенеративных расстройств до онкологии. Читатель узнает, как сетевая медицина уже меняет наше понимание болезней: от идентификации новых мишеней для лекарств и перепрофилирования известных препаратов до диагностики и прогнозирования на основе индивидуальных молекулярных данных. Также рассмотрены перспективы персонализированной медицины и профилактики заболеваний через анализ молекулярных взаимодействий. Эта статья открывает двери в будущее, где медицина становится точной, персонализированной и проактивной, прокладывая путь к здоровому долголетию.
-
Две с половиной тысячи лет назад люди вырезали искусственные зубы из бычьих костей, чтобы заполнить пробелы в своей ослепительной улыбке. С тех пор человечество немного шагнуло вперед и научилось пересобирать человека из собственных частей. Ну, хотя бы в теории. Так когда же настанет тот самый киберпанк с гардеробом из органов на каждый день? Поговорим об этом сегодня в продолжении спецпроекта «Регенеративная медицина».
-
2513У каждого живого существа есть способность к регенерации, но не у всех она выражена в одинаковой степени. На фоне многих других живых существ человек в данном отношении мало чем может похвастаться. Но то, чего не дала нам природа, мы пытаемся восполнить с помощью науки и технологий. В первой статье спецпроекта, посвященного регенеративной медицине, мы поговорим о том, как она возникла, какие сейчас в ней есть направления и какие сложности еще предстоит преодолеть.
-
457Бактериофагам давно прочат роль главной альтернативы антибиотикам. Но с их применением в медицине есть немало сложностей. Например, фаготерапию нужно подбирать индивидуально для каждого пациента, но не существует простого и быстрого способа проверить чувствительность бактерий к вирусам. К тому же коллекции фагов разбросаны по разным организациям и нет единой централизованной системы. Поэтому учёным сложно быстро обмениваться образцами тех или иных фагов. Решение этих проблем предложили канадские исследователи из Макмастерского университета и университета Лаваля. Они «упаковали» фаги вместе с некоторыми реагентами в таблетки и поместили в планшеты размером с книгу. Эти «карманные хранилища» не сильно требовательны к условиям хранения и транспортировки и позволяют проанализировать чувствительность патогенных бактерий к фагам за 30–120 минут. О своей разработке ученые рассказали в июльском выпуске Nature Communications.
-
Геном человека кодирует около 20 тысяч белков, количество же активных молекул РНК, судя по всему, еще в несколько раз больше. О большинстве этих молекул не известно почти ничего. Роль других в норме и при онкологических заболеваниях постепенно проясняется. Но и в «старых» и, казалось бы, хорошо изученных биомолекулах порой открываются новые важные черты.
-
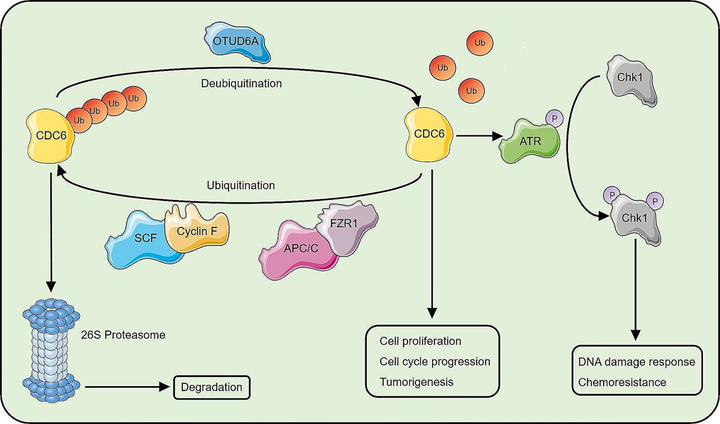
Одна из стратегий борьбы с онкологическими заболеваниями — сломать в раковых клетках всё так, чтобы они уже точно не смогли дальше расти и размножаться. И тут начинается гонка вооружений. Ученые находят белок, который надо ингибировать — раковые клетки находят способ не реагировать на ингибитор. Теперь для одного из ингибиторов ученые поняли, что именно позволяет игнорировать терапию. Это уже шах или просто ход конем?
-
В мире, где люди в среднем живут всё дольше и население быстро стареет, растет и бремя ассоциированных с возрастом («старческих») болезней. Тот, кто раньше умер бы от инфекции, травмы или заболевания сердца в молодом возрасте, сейчас имеет растущий шанс вместо этого попасть в пугающие «объятия» болезни Альцгеймера, Паркинсона или других нейродегенераций. Проблема становится всё злободневней, усилия ученых по поиску лекарств не прекращаются, но и не приносят успеха. Как и прежде, нейродегенеративные болезни неизлечимы и, по сути, такой диагноз подобен приговору. В этом тексте мы разбираемся, как устроен запутанный клубок патогенеза таких заболеваний и как нам наконец его распутать и решить проблему нейродегенерации.
-
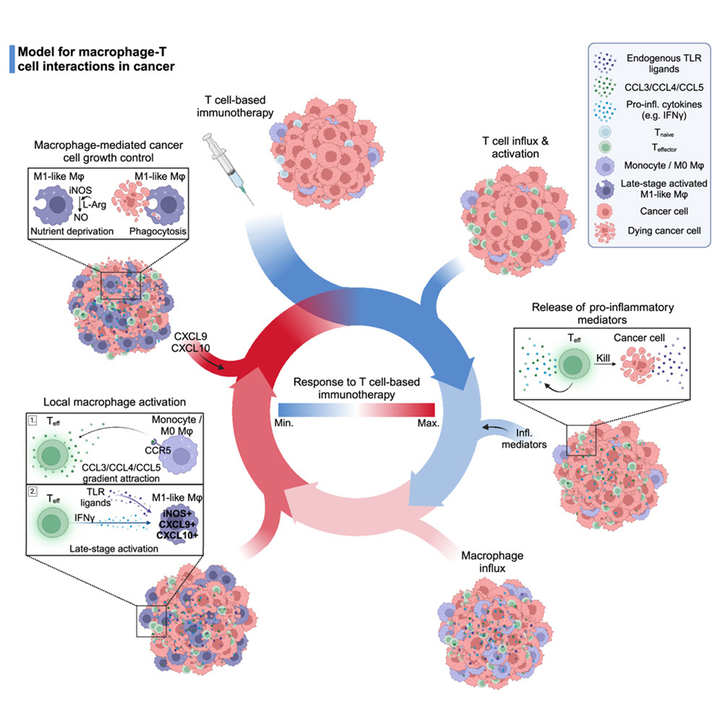
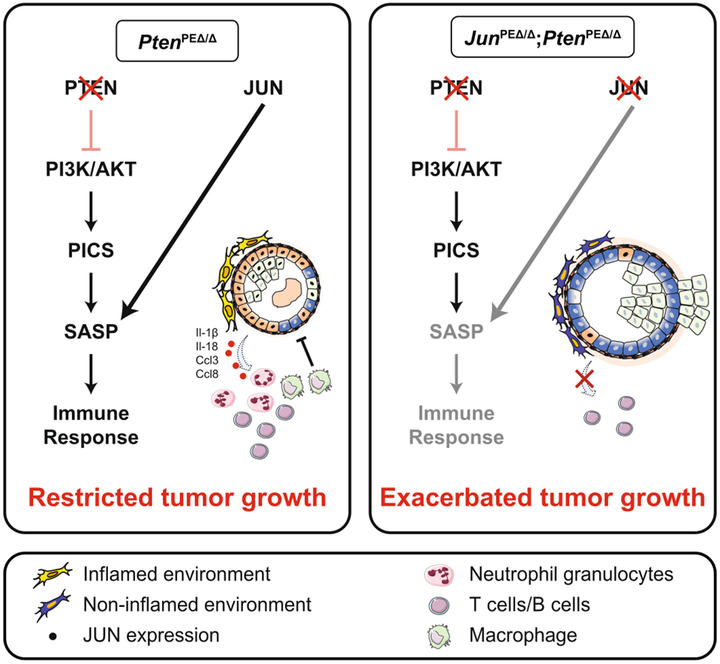
Разнообразие исследований в онкологии отражает многоликость этой группы заболеваний — ежемесячно выходят десятки работ, в которых злокачественные опухоли исследуются на всех уровнях, от молекулярного до популяционного. Мы предлагаем вашему вниманию дайджест наиболее интересных исследований из самых уважаемых научных журналов мира, чтобы ориентироваться в море новой информации.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин