
Клеточный SASPенс: как стареющие клетки общаются через SMS с молодыми и к чему это может привести?
12 февраля 2025
Клеточный SASPенс: как стареющие клетки общаются через SMS с молодыми и к чему это может привести?
- 790
- 0
- 4
сгенерировано нейросетью
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Наше тело состоит примерно из 30 триллионов клеток, которые, работая сообща, поддерживают правильное функционирование организма. В процессе межклеточной коммуникации клетки посылают и принимают сигналы, словно люди обмениваются сообщениями. Но с возрастом некоторые из них начинают отправлять «враждебные» молекулы, искажающие нормальные процессы общения. Эти стареющие клетки, сохраняя способность к коммуникации, могут инициировать массовую рассылку негативных сообщений, создавая метаболический «спам» в организме. Тем не менее, восприятие поступающих сигналов, как и в реальном общении, сильно зависит от контекста.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Многоклеточность как способ существования живых организмов — выгодная и эффективная стратегия выживания, поскольку задачи разделены между различными типами клеток. Однако, если одна клетка выходит из строя, это может поставить под угрозу весь организм. Одним из способов борьбы с подобной проблемой является клеточное старение, позволяющее предотвратить перерождение поврежденных клеток в раковые. Ключевая идея здесь проста: выживание и благополучие всего многоклеточного организма важнее функционирования одной отдельно взятой клетки. Тем не менее, не всегда все идет по плану и порой благие намерения приводят к трагическим последствиям.
Клеточное старение — палка о двух концах
Клеточное старение, или сенесценция (от лат. senex — «старый»), определяется как состояние необратимой остановки клеточного цикла в ответ на различные стрессовые воздействия. В результате этого процесса клетки полностью теряют одну из своих самых важных способностей — способность к делению. Тем не менее, стареющие клетки продолжают оставаться метаболически активными, выделяя в микроокружение различные сигнальные молекулы и сохраняя за собой место в межклеточной коммуникации (рис. 1).
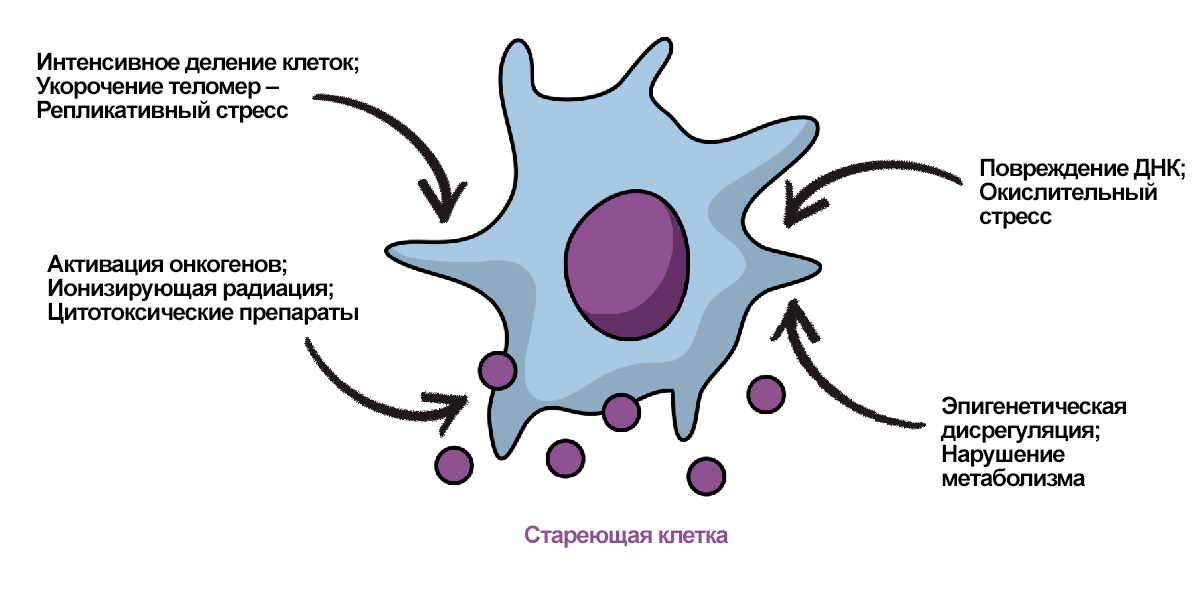
Рисунок 1. Индукторы клеточного старения.
иллюстрация автора с использованием векторных изображений от Mind the Graph
Исторически считалось, что клеточное старение — это эволюционный защитный механизм, направленный на предотвращение развития опухолей и других патологий. В этом плане сенесценцию можно сравнить с апоптозом, так как оба процесса запускаются в ответ на схожие триггеры и играют важную роль в механизме подавления неоплазий (патологических изменений, связанных с ненормальным ростом клеток), останавливая или устраняя потенциально опасные клетки в организме. Впрочем, позже выяснилось, что сенесценция по своей природе предельно двояка. Ошеломляющим стало открытие, что в период эмбриогенеза некоторые клетки стареют! Оказалось, что клеточное старение происходит в различных местах эмбриона млекопитающих в процессе его развития и отвечает за устранение нежелательных клеток, а также за ремоделирование тканей по мере их формирования [1], [2]. Более того, за правильную регенерацию мы тоже обязаны клеточному старению. Например, если у рыбки данио-рерио ампутировали плавник, то в месте повреждения скапливались стареющие клетки, и через 30 дней ткани успешно регенерировались. Однако, если стареющие клетки удалялись, это приводило к нарушению регенерации и неполному восстановлению плавника [3].
С другой стороны, клеточное старение может выступать в качестве патологического процесса. Негативное воздействие стареющих клеток распространяется на окружающую микросреду через различные механизмы. Хотя они обычно удаляются иммунной системой, в некоторых случаях стареющие клетки способы избежать этой участи. Их накопление с возрастом подтверждено как фактор, приводящий к снижению функциональности тканей и прогрессированию старения. Более того, известно, что клеточное старение связано с развитием широкого спектра возраст-ассоциированных заболеваний [4], [5].
Таким образом, клеточное старение представляет собой вариант межклеточного взаимодействия между стареющими и молодыми клетками организма, полный тайн и неопределенностей. Как подмечено в определении, несмотря на остановку клеточного цикла, стареющие клетки сохраняют способность секретировать множество молекул. В этой сохраненной функции таится одна из ключевых загадок старения — феномен, известный как секреторный фенотип, ассоциированный со старением (Senescence-Associated Secretory Phenotype, SASP), или как его еще называют — секретóм стареющих клеток (Senescence-messaging secretome, SMS).
Senescence-Associated Secretory Phenotype (SASP)
Секретóрный фенотип, ассоциированный со старением, или коротко SASP, включает в себя широкий спектр провоспалительных молекул, способствующих инициированию и поддержанию воспалительного статуса в организме (табл. 1).
|
Класс |
Компонент |
|---|---|
|
Интерлейкины |
IL-6; IL-7; IL-1; IL-1β; IL-13; IL-15 |
|
Хемокины |
IL-8; GRO-a, -b, -g; MCP-2; MCP-4; MIP-1a; MIP-3a; HCC-4; эотаксины; эотаксин-3; TECK; ENA-78; I-309; I-TAC |
|
Другие воспалительные молекулы |
TGFβ; GM-CSE; G-CSE; IFN-γ; BLC; MIF |
|
Факторы роста и их регуляторы |
Амфирегулин; эпирегулин; херегулин; EGF; bFGF; HGF; KGF (FGF7); VEGF; ангиогенин; SCF; SDF-1; PIGF; NGF; IGFBP-2, -3, -4, -6, -7 |
|
Протеазы и их регуляторы |
MMP-1, -3, -10, -12, -13, -14; TIMP-1; TIMP-2; PAI-1, -2; tPA; uPA; катепсин B |
|
Рецепторы и их лиганды |
ICAM-1, -3; OPG; sTNFRI; sTNFRII; TRAIL-R3; Fas; uPAR; SGP130; EGF-R |
|
Небелковые молекулы |
PGE2; оксид азота (NO); активные формы кислорода (АФК) |
|
Нерастворимые факторы |
Фибронектин; коллагены; ламинин |
SASP был открыт в 2008 году Джудит Кампизи и ее группой, которые определили его как отличительный признак клеточного старения, наделяющий клетки неавтономными паракринными функциями (рис. 2) [7]. Спустя 16 лет стало окончательно ясно, что стареющие клетки не просто «молчаливые свидетели» старения, а активные участники этого процесса, которые влияют на свое микроокружение через SASP. В действительности SASP была отведена важная роль в организме. Его факторы могут служить «сигналами опасности», информирующими о повреждении тканей и необходимости их регенерации, а также об уничтожении слабо функциональных клеток. Впрочем, здесь кроется и подводный камень: если секреторная активность стареющих клеток продолжается бесконтрольно долго, это может привести к нарушению клеточного гомеостаза и вызвать серьезные последствия для организма [8], [9].

Рисунок 2. Джудит Кампизи (1948–2024) — профессор Института исследований старения Бака, член Консультативного совета исследовательского фонда SENS и советник Lifeboat Foundation. Она была выдающимся ученым в области биологии старения, внесшим значительный вклад в изучение механизмов клеточного старения и раскрытие сложных отношений между сенесценцией, старением организма и канцерогенезом.
На сегодняшний день мы еще не знаем всех компонентов, входящих в состав секреторного фенотипа, но значительным прорывом стало исследование, проведенное Басистым и его коллегами, в рамках которого был создан атлас SASP (доступен на сайте www.SASPAtlas.com) [10]. В результате их работы факторы SASP были разделены на две основные группы: sSASP (растворимый SASP) и eSASP (внеклеточный везикулярный SASP). sSASP включает растворимые молекулы, которые стареющие клетки секретируют непосредственно в окружающую микросреду. В то время как eSASP связан с выделением внеклеточных везикул, которые могут распространяться по всему организму.
Ранее внеклеточные везикулы считались «мусорными» молекулами, но теперь они признаны активными участниками межклеточной коммуникации. Обычно их подразделяют на два наиболее изучаемых типа: экзосомы, образующиеся внутри клетки и покидающие ее, и микровезикулы, которые отделяются с поверхности клетки. Эти внеклеточные везикулы несут в себе разнообразный «груз» — от цитокинов до метаболитов и микроРНК, что делает их настоящими «почтальонами» в нашем организме. [11]. Басистый обнаружил еще одну любопытную вещь: стареющие клетки выделяют значительно больше экзосом, чем молодые. Это открытие подчеркивает значимость внеклеточных везикул в проявлении и распространении SASP и открывает новые горизонты для понимания взаимодействия стареющих клеток с молодыми.
Остается вопрос: к чему все это может привести? Эксперименты с трансплантацией стареющих клеток молодым реципиентам приоткрыли завесу этой тайны. Гипотеза проста: стареющие клетки посредством SASP могут распространять клеточное старение как на соседние клетки, так и на отдаленные клетки организма, тем самым ускоряя системные процессы старения. Команда Франко провела интересное исследование, трансплантировав сенесцентные фибробласты молодым мышам. Спустя пять месяцев они оценили эффекты и обнаружили, что трансплантация стареющих клеток привела к увеличению экспрессии нескольких факторов SASP как вблизи, так и вдали от места инъекции [12]. Другие эксперименты, такие как трансплантация целых старых органов, также подтвердили, что появление стареющих клеток в молодом организме провоцирует распространение клеточного старения и ускоряет функциональный спад молодых реципиентов, что обычно ассоциируется с преклонным возрастом [13].
Регуляцию SASP можно сравнить с настоящей симфонией: она сложна и многогранна. В этом процессе участвуют как транскрипционные факторы, так и сигнальные пути, такие как NF-kB (запускающий экспрессию различных провоспалительных генов) и mTOR (контролирующий клеточный рост посредством синтеза белка). Когда эта регуляция нарушается, мы наблюдаем эффекты, которые фиксировались в экспериментах по трансплантации — паракринным способом факторы SASP начинают инициировать клеточное старение по всему организму [8]. Учитывая, что большинство известных факторов SASP обладают провоспалительной активностью, их продолжительное высвобождение в окружающую среду может способствовать развитию хронического воспаления (рис. 3). Эта особенность сделала SASP одним из ключевых составляющих теории инфламейджинга (от англ. inflammation — «воспаление» и aging — «старение»), утверждающей, что именно воспаление служит причиной старения [14]. Считается, что NF-κB, упомянутый ранее, является центральным регулятором, который опосредует воспалительное старение. В действительности, этот путь представляет собой целое семейство белков, участвующих в ответной реакции на стресс, что приводит к активации генов, отвечающих за синтез множества провоспалительных молекул. Действуя как иммуномодуляторы, эти молекулы привлекают клетки иммунитета для уничтожения дисфункциональных клеток, что согласуется с защитной функцией SASP, о которой мы говорили ранее. Однако при неконтролируемой экспрессии они могут стать зачинщиками хронического воспаления и привести к инфламейджингу [15], [16].
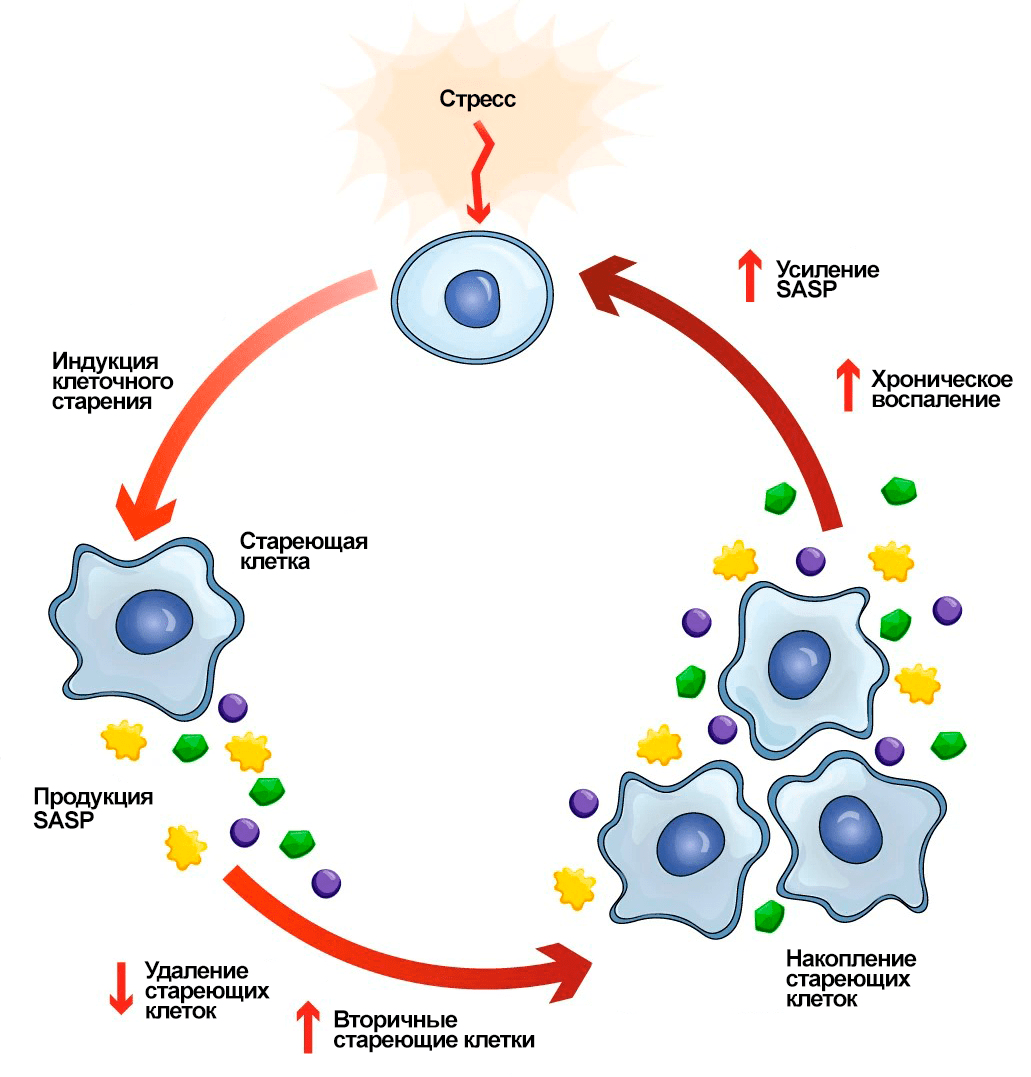
Рисунок 3. Порочный круг клеточного старения и SASP. Когда клеточное старение запускается в ответ на стрессовое воздействие, стареющая клетка начинает продуцировать факторы SASP, которые сигнализируют иммунной системе о необходимости ее уничтожения. Это, казалось бы, защитный механизм, направленный на поддержание здорового функционирования тканей. Однако, с другой стороны, высвобождение компонентов SASP приводит к образованию вторичных стареющих клеток. Эти новые сенесцентные клетки, в свою очередь, начинают выделять собственные факторы SASP, создавая замкнутый круг. В конечном итоге накопление пула стареющих клеток приводит к хроническому воспалению и еще большему усилению SASP.
Все это приводит к тому, что SASP висит как дамоклов меч над организмом, неся в себе потенциальную угрозу в случае потери контроля. С одной стороны все здорово, факторы SASP помогают организму реагировать на повреждения и смягчать проявление дисфункционального фенотипа, а с другой — если действие SASP не регулируется должным образом, он может выйти из-под контроля и привести к серьезным последствиям, включая преждевременное старение. Таким образом, понимание гетерогенности SASP открывает новые перспективы в борьбе со старением. Это знание позволяет ученым манипулировать межклеточной коммуникацией и замедлять возрастные процессы. Но как именно это работает и какие возможности открываются перед нами? Давайте разберемся.
Как сеноморфики меняют правила игры
Если стареющие клетки действительно способствуют развитию возрастных заболеваний и ухудшению здоровья, то логично предположить, что их следует уничтожать. Эта идея, простая и привлекательная, привела к разработке сенолитиков — веществ, нацеленных на удаление клеток, которые утратили свою функциональность. Однако в последние годы внимание ученых стало сосредоточено на более тонких подходах, таких как сеноморфики. Сеноморфики действуют иначе: вместо того чтобы уничтожать стареющие клетки, они опосредованно блокируют проявление SASP.
Сеноморфики нацелены на различные сигнальные каскады, участвующие в регуляции SASP, включая те, о которых мы говорили — NF-κB и mTOR. Модулируя эти пути, сеноморфики способны подавлять провоспалительный SASP, не вызывая гибели стареющих клеток [18], [19]. Одним из самых известных сеноморфиков на сегодняшний день является рапамицин — ингибитор mTOR. Впрочем, другим перспективным сеноморфиком стал метформин. Этот препарат, получаемый из французской сирени, используется в клинической практике уже более 60 лет и хорошо изучен. Метформин был одобрен Американской диабетической ассоциацией (ADA) и считается препаратом первой линии для лечения сахарного диабета 2 типа. Сообщается, что метформин способен негативно регулировать воспаление, подавляя провоспалительные цитокины и ингибируя путь NF-κB. Помимо прямого подавления воспалительного процесса, метформин также способствует снижению массы тела, улучшению метаболизма и чувствительности к инсулину, что косвенно снижает системное воспаление. Дополнительно, метформин оказывает стабилизирующее влияние на протеостаз за счет усиления аутофагии и подавления синтеза белков через ингибирование сигнализации mTOR [20], [21].
В связи с многофункциональностью метформина не удивительно, что он привлек внимание исследователей в контексте старения. Этот препарат стал центральным элементом крупного клинического исследования под названием Targeting Aging with Metformin (TAME). Нир Барзилай, руководитель проекта TAME, еще в 2016 году высказал идею проверить метформин в качестве вещества, замедляющего старение (рис. 4) [22]. Вместе со своей научной группой он планирует провести плацебо-контролируемое исследование с участием 3000 пожилых людей, чтобы выяснить, может ли метформин замедлить развитие различных возрастных заболеваний, включая рак и деменцию. Общая стоимость эксперимента составляет 75 миллионов долларов, и вокруг него уже возникло значительное внимание в СМИ. Ситуация осложнилась в 2020 году, когда Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) потребовало отозвать метформин у некоторых производителей из-за повышенного содержания канцерогенной примеси N-нитрозодиметиламина (NDMA) [23]. Судьба проекта TAME остается неопределенной, но по последним данным, он получил необходимое финансирование, а запуск клинических испытаний планируется до 2026 года.
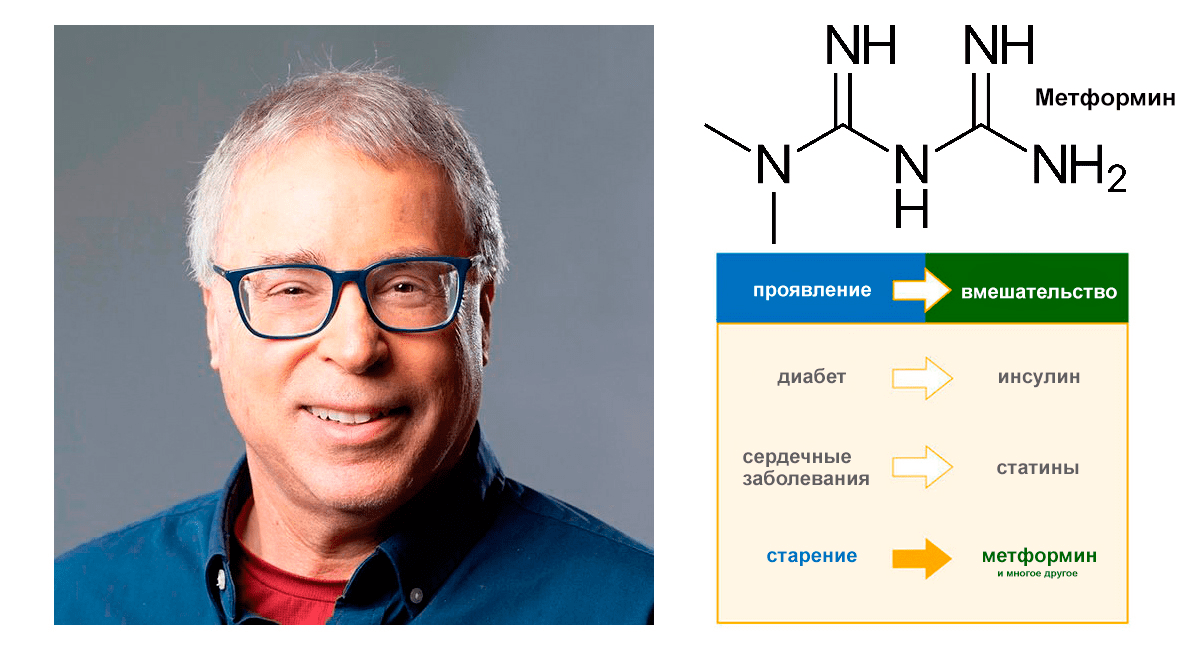
Рисунок 4. Идея воздействия метформином на процессы старения (TAME). Слева — доктор Нир Барзилай, директор Института исследований старения Медицинского колледжа Альберта Эйнштейна, член правления Американской федерации исследований старения (AFAR) и руководитель проекта TAME.
Nir Barzilai — XPRIZE Foundation, Metformin — «Википедия», Targeting Aging with Metformin — American Federation for Aging Research, рисунок адаптирован
Сеноморфная терапия представляет собой многообещающий подход в борьбе со старением, хотя на сегодняшний день она все еще мало изучена. Тем не менее, углубленное понимание механизмов действия сеноморфиков и разработка новых препаратов в этой области могут привести к созданию более целенаправленных и безопасных методов лечения возрастных заболеваний. Это, в свою очередь, поможет нам более эффективно справляться с вызовами, которые ставит перед нами время.
Кровь, которая возвращает молодость
В мире науки не перестают удивлять необычные эксперименты, способные бросить вызов нашим представлениям о жизни и старении. Одним из таких экспериментов является гетерохронный парабиоз — метод, который звучит как сюжет фантастического романа, но основан на реальных научных открытиях. Представьте себе: старые мыши, соединенные с молодыми, обмениваются кровью, и в результате этого невероятного взаимодействия стареющие организмы начинают демонстрировать признаки восстановления. Исследования показывают, что молодая кровь может не только замедлить старение, но и даже вернуть утраченные функции.
Парабиоз (от др.-греч. para — «рядом» и βιος — «жизнь») — это методика, существующая уже не одну сотню лет, которая имитирует естественные случаи общего кровоснабжения, как, например, у сиамских близнецов. Самый ранний зарегистрированный эксперимент по парабиозу провел физиолог Пол Берт в 1864 году, используя белых крыс-альбиносов [24]. Тогда техника заключалась в коротком разрезе кожи на боку двух крыс и их сшивании (рис. 5). В результате естественных процессов заживления капилляры восстановились на пересечении, и Берт обнаружил, что жидкость, введенная в вену одной крысы, беспрепятственно переходила в другую. С течением времени техника парабиоза значительно развилась, однако в конце 20 века она вышла из употребления на фоне бурного развития более современных методов биологии. Тем не менее, в последние годы парабиоз вновь стал актуален в научных исследованиях, особенно в контексте изучения механизмов старения, и принял форму «гетерохронного парабиоза».
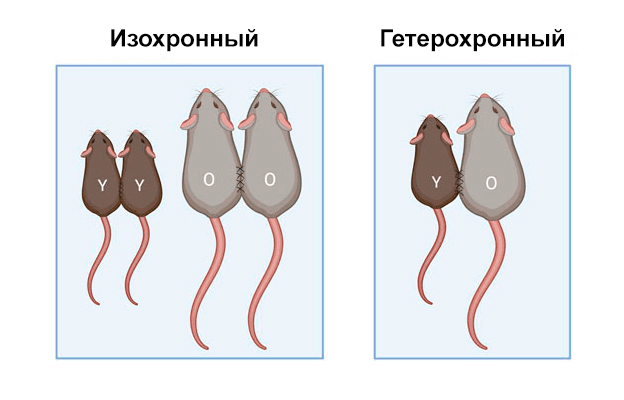
Рисунок 5. Схема техники парабиоза. Разделяют два вида парабиоза: изохронный и гетерохронный. Изохронный парабиоз предполагает сшивание животных одного возраста (YY или OO, где Y — молодая особь, O — старая особь). Гетерохронный парабиоз, напротив, подразумевает соединение кровеносных систем молодого и старого животного (YO), что позволяет исследовать влияние молодой среды на стареющий организм и наоборот.
[25], рисунок адаптирован
В недавней статье в журнале Nature Aging были представлены результаты эксперимента по долгосрочному гетерохронному парабиозу, где молодых и старых мышей объединили в пары на три месяца [26]. Удивительно, но оказалось, что пожилые мыши действительно жили дольше, а их эпигенетический возраст был обращен вспять, даже после того, как пары были разделены. Одним из ключевых эффектов стало улучшение воспалительного профиля гетерохронных двадцатимесячных мышей, а также значительное снижение активности генов, связанных с SASP. Эти результаты в совокупности стали свидетельством того, что долгосрочный гетерохронный парабиоз вызывает глубокие транскриптомные и эпигенетические изменения на уровне генов, связанных с долголетием и омоложением.
И все же ключевой вопрос гетерохронного парабиоза продолжает оставаться открытым: как воздействие молодой крови может служить источником омоложения для старых животных? Логично предположить, что поскольку гетерохронный парабиоз включает смешивание крови молодых и старых животных, это указывает на наличие некоего неуловимого «омолаживающего» фактора, циркулирующего в юной кровеносной системе. Что это за фактор, сколько их существует, и может ли эта схема работать в обратную сторону — то есть могут ли циркулирующие прогеронические факторы (факторы, способные ускорять процессы старения) от старых мышей вызывать старение у молодых — это уже другие вопросы.
Чтобы найти ответы, китайские ученые провели эксперимент, в котором старым мышам вводили очищенные из молодой плазмы внеклеточные везикулы [27]. Результаты оказались впечатляющими: еженедельные инъекции этих везикул продлевали жизнь старым мышам. При этом они выглядели гораздо здоровее по сравнению с контрольными мышами того же возраста, которым вводили фосфатно-солевой буфер (PBS). В то время как у последних появлялась седеющая шерстка и образовывались участки выпадения волос, инъекция молодых везикул значительно предотвратила этот процесс у старых мышей, благодаря чему их шерсть оставалась черной и блестящей (рис. 6). В целом, приведенные в статье данные свидетельствовали о том, что молодые внеклеточные везикулы обладали способностью восстанавливать структуру и функции старых тканей, улучшая их состояние и замедляя возрастные изменения. Долгосрочное введение этих везикул имело высокую эффективность в ингибировании клеточного старения и изменении протеома, что привело к общему омоложению тканей.
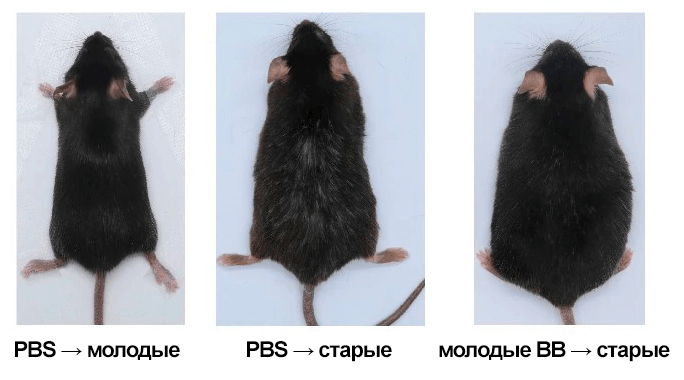
Рисунок 6. Репрезентативные изображения мышей в каждой группе были сделаны спустя 7 месяцев с момента начала проведения эксперимента. Молодым мышам в возрасте 2 месяцев проводили инъекцию с PBS (слева), в то время как старым мышам в возрасте 20 месяцев внутривенно вводили либо PBS (посередине), либо молодые внеклеточные везикулы (справа).
[27], рисунок адаптирован
Но если молодые внеклеточные везикулы действительно способны омолаживать как на физиологическом, так и на поведенческом уровне, возникает вопрос: могут ли старые везикулы оказывать противоположные эффекты и потенциально ускорять процесс старения? Чтобы проверить это, исследователи изменили протокол и начали вводить выделенные из плазмы крови старых мышей внеклеточные везикулы молодым животным. Результаты продемонстрировали, что инъекции старыми везикулами приводили к быстрому снижению памяти и выносливости у молодых мышей. В заключении, анализ груза везикул показал, что молодые и старые внеклеточные везикулы содержат множество отличительных микроРНК, которые, вероятно, и опосредуют омолаживающие и стареющие эффекты соответственно.
Исследуя ключевые молекулы, участвующие в гетерохронном парабиозе, Юсефзаде и его коллеги обратили внимание на циркулирующие факторы, связанные с SASP [28]. Они обнаружили, что при гетерохронном сшивании в ряде органов старых особей значительно снизилась экспрессия хемокина MCP-1, способствующего прогрессированию старения. Интересно, что уровень белка MCP-1 был значительно снижен у старых гетерохронных мышей, но повышен у молодых. Также у старых мышей из гетерохронной пары было отмечено снижение уровня циркулирующих провоспалительных цитокинов во всех исследуемых тканях. В то же время у молодых гетерохронных мышей напротив наблюдалось неравномерное увеличение этих цитокинов в тканях по сравнению с молодыми изохронными контрольными мышами. Эти результаты указывают на то, что одно из благоприятных воздействий молодой системы кровообращения, вероятно, связано со снижением фенотипа клеточного старения. В противоположность этому, взаимодействие со старой кровеносной системой усиливает клеточное старение у молодых гетерохронных мышей через модуляцию факторов SASP.
Тем не менее, продолжаются дискуссии о реальной эффективности методики гетерохронного парабиоза в замедлении процессов старения. Некоторые исследователи выражают более осторожный подход к подобным заявлениям. Есть мнение, что, хотя факторы из молодой крови могут способствовать восстановлению поврежденных тканей, они не превращают старые клетки в молодые. Вместо этого они помогают улучшить функции тканей, что может быть полезно, например, для восстановления после операций или лечения заболеваний, связанных со старением. Поэтому, хотя перспективы использования таких факторов выглядят многообещающе, важно помнить, что на данный момент это скорее шаг к пониманию механизмов старения, чем окончательное решение проблемы.
В завершение, стоит отметить, что SASP представляет собой увлекательный объект исследования, о котором мы узнали немало за последние годы, хотя знаний все еще недостаточно. Борьба с SASP как перспектива против старения кажется многообещающей, но необходимо учитывать и его положительную роль в функционировании организма. Поэтому вопрос, где найти золотую середину, становится ключевым. SASP — это не просто враг старения, но и потенциальный союзник, и именно в этом двойственном характере кроется множество возможностей для будущих открытий в области геронтологии.
Литература
- Daniel Muñoz-Espín, Marta Cañamero, Antonio Maraver, Gonzalo Gómez-López, Julio Contreras, et. al. (2013). Programmed Cell Senescence during Mammalian Embryonic Development. Cell. 155, 1104-1118;
- Mekayla Storer, Alba Mas, Alexandre Robert-Moreno, Matteo Pecoraro, M. Carmen Ortells, et. al. (2013). Senescence Is a Developmental Mechanism that Contributes to Embryonic Growth and Patterning. Cell. 155, 1119-1130;
- Sabela Da Silva‐Álvarez, Jorge Guerra‐Varela, Daniel Sobrido‐Cameán, Ana Quelle, Antón Barreiro‐Iglesias, et. al. (2020). Cell senescence contributes to tissue regeneration in zebrafish. Aging Cell. 19;
- Weijun Huang, LaTonya J. Hickson, Alfonso Eirin, James L. Kirkland, Lilach O. Lerman. (2022). Cellular senescence: the good, the bad and the unknown. Nat Rev Nephrol. 18, 611-627;
- Roula Khalil, Mona Diab-Assaf, Jean-Marc Lemaitre. (2023). Emerging Therapeutic Approaches to Target the Dark Side of Senescent Cells: New Hopes to Treat Aging as a Disease and to Delay Age-Related Pathologies. Cells. 12, 915;
- Vassilis Gorgoulis, Peter D. Adams, Andrea Alimonti, Dorothy C. Bennett, Oliver Bischof, et. al. (2019). Cellular Senescence: Defining a Path Forward. Cell. 179, 813-827;
- Jean-Philippe Coppé, Christopher K Patil, Francis Rodier, Yu Sun, Denise P Muñoz, et. al. (2008). Senescence-Associated Secretory Phenotypes Reveal Cell-Nonautonomous Functions of Oncogenic RAS and the p53 Tumor Suppressor. PLoS Biol. 6, e301;
- Utkarsh Tripathi, Avanish Misra, Tamar Tchkonia, James L. Kirkland. (2021). Impact of Senescent Cell Subtypes on Tissue Dysfunction and Repair: Importance and Research Questions. Mechanisms of Ageing and Development. 198, 111548;
- Nicolas Malaquin, Aurélie Martinez, Francis Rodier. (2016). Keeping the senescence secretome under control: Molecular reins on the senescence-associated secretory phenotype. Experimental Gerontology. 82, 39-49;
- Nathan Basisty, Abhijit Kale, Ok Hee Jeon, Chisaka Kuehnemann, Therese Payne, et. al. (2020). A proteomic atlas of senescence-associated secretomes for aging biomarker development. PLoS Biol. 18, e3000599;
- Greg Berumen Sánchez, Kaitlyn E. Bunn, Heather H. Pua, Marjan Rafat. (2021). Extracellular vesicles: mediators of intercellular communication in tissue injury and disease. Cell Commun Signal. 19;
- Ana Catarina Franco, Helene Martini, Stella Victorelli, Anthony B. Lagnado, Saranya P. Wyles, et. al. (2025). Senescent cell transplantation into the skin induces age‐related peripheral dysfunction and cognitive decline. Aging Cell. 24;
- Jasper Iske, Maximilian J. Roesel, Friederike Martin, Andreas Schroeter, Tomohisa Matsunaga, et. al. (2024). Transplanting old organs promotes senescence in young recipients. American Journal of Transplantation. 24, 391-405;
- Justyna Pająk, Danuta Nowicka, Jacek C. Szepietowski. (2023). Inflammaging and Immunosenescence as Part of Skin Aging—A Narrative Review. IJMS. 24, 7784;
- Glyn Nelson, Olena Kucheryavenko, James Wordsworth, Thomas von Zglinicki. (2018). The senescent bystander effect is caused by ROS-activated NF-κB signalling. Mechanisms of Ageing and Development. 170, 30-36;
- Preeyaporn Songkiatisak, Shah Md Toufiqur Rahman, Mohammad Aqdas, Myong-Hee Sung. (2022). NF-κB, a culprit of both inflamm-ageing and declining immunity?. Immun Ageing. 19;
- Nathan S. Gasek, George A. Kuchel, James L. Kirkland, Ming Xu. (2021). Strategies for targeting senescent cells in human disease. Nat Aging. 1, 870-879;
- Lei Zhang, Louise E. Pitcher, Vaishali Prahalad, Laura J. Niedernhofer, Paul D. Robbins. (2023). Targeting cellular senescence with senotherapeutics: senolytics and senomorphics. The FEBS Journal. 290, 1362-1383;
- Jooho Park, Dong Wook Shin. (2022). Senotherapeutics and Their Molecular Mechanism for Improving Aging. Biomol Ther (Seoul). 30, 490-500;
- Ameya S. Kulkarni, Sriram Gubbi, Nir Barzilai. (2020). Benefits of Metformin in Attenuating the Hallmarks of Aging. Cell Metabolism. 32, 15-30;
- Sam Amin, Andrew Lux, Finbar O'Callaghan. (2019). The journey of metformin from glycaemic control to mTOR inhibition and the suppression of tumour growth. Brit J Clinical Pharma. 85, 37-46;
- Nir Barzilai, Jill P. Crandall, Stephen B. Kritchevsky, Mark A. Espeland. (2016). Metformin as a Tool to Target Aging. Cell Metabolism. 23, 1060-1065;
- Sathish Dharani, Eman M. Mohamed, Ziyaur Rahman, Mansoor A. Khan. (2024). Patient In-Use Stability Testing of FDA-Approved Metformin Combination Products for N-Nitrosamine Impurity. AAPS PharmSciTech. 25;
- Bert P. Expériences et Considérations Sur La Greffe Animale. Éditeur Inconnu, 1864. — 18 p.;
- Sonia L. Rodriguez, Chase M. Carver, Andrew J. Dosch, Derek M. Huffman, Felicia D. Duke Boynton, et. al. (2022). An optimized mouse parabiosis protocol for investigation of aging and rejuvenative mechanisms. Front. Aging. 3;
- Bohan Zhang, David E. Lee, Alexandre Trapp, Alexander Tyshkovskiy, Ake T. Lu, et. al. (2023). Multi-omic rejuvenation and lifespan extension on exposure to youthful circulation. Nat Aging. 3, 948-964;
- Xiaorui Chen, Yang Luo, Qing Zhu, Jingzi Zhang, Huan Huang, et. al. (2024). Small extracellular vesicles from young plasma reverse age-related functional declines by improving mitochondrial energy metabolism. Nat Aging. 4, 814-838;
- Matthew J. Yousefzadeh, John E. Wilkinson, Brian Hughes, Namrata Gadela, Warren C. Ladiges, et. al. (2020). Heterochronic parabiosis regulates the extent of cellular senescence in multiple tissues. GeroScience. 42, 951-961.







