Немного о железе. Практика
24 марта 2022
Немного о железе. Практика
- 2807
- 1
- 10
Мем о злободневности работы врачей.
автор, кадры из к/ф «Легенда»
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Никто не будет спорить, что профессия врача — не самое простое призвание. И никто точно не скажет, что это неинтересная работа. Местами она похожа на запутанное детективное расследование с гипотезами, уликами и постоянно всплывающими подробностями происходящего в организме пациента. Следствие кончается заключением и наказанием, а осмотр врача — диагнозом и лечением.
Конкурс «Био/Мол/Текст»-2021/2022
 Эта работа заняла первое место в номинации «Школьная» конкурса «Био/Мол/Текст»-2021/2022.
Эта работа заняла первое место в номинации «Школьная» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — некоммерческая школа-пансион «Летово».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как вы помните, предыдущая часть статьи была посвящена теоретической информации о физиологии железа в человеческом организме. Мы смогли вполне подробно разобраться во всех фундаментальных процессах в человеческом теле, так или иначе связанных с этим химическим элементом. В этой же части речь пойдет о более прикладных вещах. Мы посмотрим на железо не через призму сухих фактов учебника по физиологии, а глазами врача, разберем тот комплекс знаний, с которым он ассоциирует этот микроэлемент. Речь пойдет о способах измерения его содержания в организме, о патогенезе железосвязанных заболеваний и, что самое главное, о методах их правильной диагностики.
Первое, с чем сталкивается врач, — анализы. Для того чтобы с головой погрузиться в заболевания, связанные с железом, стоит разобраться с физиологией методов измерения его содержания. Только понимая эти основы, можно верно подойти к диагностике, использовать нужные данные и в нужном сочетании и, в конце концов, правильно поставить диагноз и назначить лечение.
Определение состояния железа
Существует много способов количественно и качественно определить состояние железа в организме человека. Эти измерения проводятся через косвенные показатели — биомаркеры. Нормальной практикой считается использование нескольких биомаркеров для минимизирования погрешности и человеческого фактора. Кроме того, благодаря разной физиологии этих индикаторов врач может создать более объемную картину патогенеза. Давайте обсудим самые важные и популярные из них.
1. Биопсия костного мозга (золотой стандарт)
Биопсия — это метод диагностики, при котором проводится прижизненное взятие биоматериала определенного органа (получение биоптата).
После взятия биоптата (см. рис. 1) врач оценивает окраску образца и делает вывод о состоянии железного фона у пациента. Главное достоинство этого биомаркера в том, что его результаты хорошо коррелируют с другими индикаторами и имеют самую простую и надежную физиологическую основу, так как цвет биоптата напрямую зависит от концентрации железа в красном костном мозге. По этим причинам метод признан эталонным и используется для контроля в различных исследованиях, тестирующих, например, новые биомаркеры или изучающих железосвязанные заболевания.
Метод прекрасно подходит для выявления дефицита железа или полного отсутствия его запасов в организме, однако он является полуколичественным и весьма субъективным [2] из-за определения цвета образца «на глаз» самим врачом. Кроме того, способ требует инвазивного вмешательства, поэтому может не подойти некоторым пациентам [3].
Рисунок 1. Иглы для проведения биопсии костного мозга.
За местной анестезией следует прокол мягких тканей и костной поверхности чаще всего в области грудины или подвздошной кости. После забора биоптата на место прокола накладывается повязка.
2. Концентрация растворимых трансферриновых рецепторов
Основной потребитель трансферринового железа — красный костный мозг в связи с его эритропоэтической функцией, поэтому среди всех клеток тела человека развивающиеся эритроциты имеют наибольшую плотность трансферриновых рецепторов и содержат 80% от их общей суммы [4], [5]. Регулируя количество рецепторов, клетка контролирует и количество поступающего железа [6]. После созревания красных кровяных телец внеклеточная часть рецептора или рецептор целиком отщепляется (см. рис. 2) и попадает в кровоток в связанном с молекулой трансферрина виде [5], [7]. Эта внеклеточная часть, путешествующая в кровотоке, называется растворимым, или сывороточным, трансферриновым рецептором — sTfR (soluble/serum transferrin receptor). Логично, что концентрация sTfR в крови прямо пропорционально зависит от скорости эритропоэза и косвенно указывает на общее состояние железа в организме. По этой причине концентрация трансферриновых рецепторов может служить более быстрым показателем, например, эффективности лечения, чем другие биомаркеры.
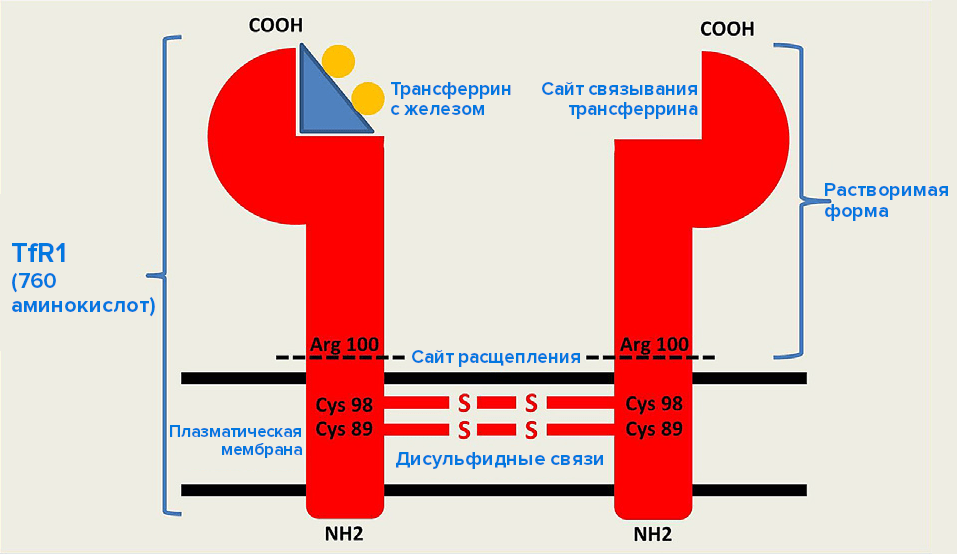
Рисунок 2. Строение мембранного трансферринового рецептора первого типа.
Рецептор может расщепляться на 2 части по сотой аминокислоте — аргинину. Одна из частей остается в мембране в качестве интегрального белка, а вторая уходит в кровоток как молекула sTfR.
адаптировано из [8]
Однако существуют некоторые неочевидные особенности, обусловленные физиологией этого метода, которые стоит учитывать при его использовании:
- Первый нелогичный момент заключается в очень странной зависимости sTfR от содержания накопленного железа в теле человека. Уменьшение его запасов никак не влияет на уровень рецепторов [9] до тех пор, пока резервы микроэлемента не кончатся полностью: только в этом случае уровень sTfR резко возрастет [10].
-
Такие факторы, как, например, диета, бедная железом, или низкое содержание в крови некоторых белков, свидетельствующих об истощенности запасов железа, тоже не влияют напрямую на концентрацию sTfR [11].
Из первых двух пунктов можно сделать вывод о том, что определение концентрации sTfR может помочь при быстром диагностировании наличия уже развитых заболеваний, но не для определения истощенности запасов или точной концентрации железа в организме человека [11].
Также концентрация sTfR никак не изменяется под влиянием воспалений [12], поэтому данный показатель может быть решающим при установлении диагноза: для различия железодефицитной анемии и анемии хронических заболеваний (см. таблицу 1) [13], [14] или при определении железодефицитной анемии (ЖДА) у пациента с воспалением [9]. Биомаркер может быть полезным при диагностировании различных видов микроцитарной анемии [5]. Об этих и других заболеваниях мы поговорим чуть позже. - В предыдущей части статьи уже упоминалось, что уровень сывороточных трансферриновых рецепторов зависит от интенсивности эритропоэза. Поэтому заболевания, влияющие на эритропоэз, будут влиять и на уровень sTfR. В случае повышенной интенсивности созревания и образования эритроцитов (талассемия) или при уменьшении их средней продолжительности жизни (гемолитическая анемия) уровень рецепторов в крови будет повышен. Обратный эффект наблюдается в случае гипоплазии (недоразвитости тканей) костного мозга, апластической анемии (угнетение эритропоэза), ряда наследственных заболеваний или в результате перенесенной химиотерапии [5], [10]. В описанных ситуациях изменения уровня sTfR не связаны напрямую с содержанием железа в организме и вызваны заболеваниями, затрагивающими физиологическую основу метода. Конечно, если подойти с умом, то можно использовать эти данные для уточнения картины патогенеза, но в общем случае эти некорректные измерения только мешают врачу. Именно такие особенности биомаркеров зачастую приводят к неправильной диагностике.
Как мы видим, уровень sTfR способен изменяться под влиянием ряда факторов и неточно отражать физиологическое состояние железа в организме. Каждый метод имеет такие нюансы, поэтому обычно индикаторы используют вместе для покрытия минусов друг друга. Об одном удачном и достаточно популярном примере речь пойдет чуть ниже.
Диагностика
Некоторые авторы исследований принимают за норму концентрацию рецепторов в плазме равной 5,6 ± 1,4 мг/л, но всемирной установленный нормы, как и для большинства других биомаркеров железа, не существует [14]. Повышенный уровень рецепторов — 18 ± 11,4 мг/л, свидетельствует о наличии ЖДА у пациента [14]. Концентрация не имеет никакой привязки к полу или возрасту для основной возрастной группы, то есть в интервале от 18 до 80 лет [15].
Рецепторно-ферритиновый индекс
Как уже было сказано, растворимые трансферриновые рецепторы не могут быть единственным биомаркером состояния железа при диагностировании заболеваний из-за сильной зависимости от скорости эритропоэза. Для того чтобы убедиться, что повышенный уровень содержания рецепторов связан, например с развитием ЖДА, а не с заболеваниями костного мозга, в котором происходит эритропоэз, при диагностике используют дополнительный биомаркер. Зачастую измеряют показатели сывороточного ферритина, подтверждающие отсутствие запасов железа в организме [9].
В современной медицине используют специальный рецепторно-ферритиновый (sTfR-F) индекс [16], учитывающий оба показателя. Он вычисляется по формуле sTfR/log(Ferritin) (отношение между концентрацией растворимых трансферриновых рецепторов и логарифмом от концентрации сывороточного ферритина). Индекс позволяет установить отсутствие запасов железа в организме и правильно диагностировать заболевание [17]. Значение этого показателя у здорового человека находится в интервале от 0,16 до 1,8 [18].
В современной медицине sTfR-F индекс набирает все большую популярность, так как его использование позволяет точнее определить заболевание с помощью показателей двух легкодоступных кровяных показателей [17].
3. Концентрация и насыщение сывороточного трансферрина
Из предыдущей части статьи вы знаете, что после поступления в кровоток молекулы железа сразу связываются со специальным транспортным белком плазмы — трансферрином. Сывороточная концентрация трансферрина напрямую говорит о насыщенности крови железом, поэтому бывает полезна при диагностике заболеваний.
Диагностика
Нормальная концентрация варьирует в промежутке от 2 до 3,6 г/л [19]. Однако кроме измерения концентрации молекул трансферрина в крови можно определять и их насыщенность, то есть устанавливать процент связанных с железом молекул трансферрина. В норме апотрансферрин также присутствует в кровотоке, поэтому сайтов связывания железа достаточно для того, чтобы насыщение не было равно 100%.
Всемирная Организация Здоровья (ВОЗ) считает, что насыщение трансферрина менее 15–16% не позволяет эритропоэзу [3] протекать нормально [20]. Многие другие авторы утверждают, что процент насыщения менее 20 уже свидетельствует о дефиците железа в организме человека [24], однако, опять же всемирной нормы не существует.
Принято считать, что насыщение трансферрина ≥ 45%свидетельствует о возможном наличии перегрузки железом организма [22]. С этим согласна и ВОЗ [3]. Об их причинах мы поговорим чуть позже при обсуждении железосвязанных заболеваний.
4. Концентрация сывороточного ферритина
Ферритин — сложный железопротеин, служащий для запасания избыточного железа в организме и хранящийся в основном в макрофагах печени, селезенки и красного костного мозга. Но все же небольшая его часть попадает в кровоток и напрямую говорит о состоянии железного фона у пациента. На этой физиологической основе строится корреляция: концентрация ферритина в крови прямо пропорциональна содержанию железа в организме [23].
Диагностика
Логично предположить, что концентрация ферритина в сыворотке крови коррелирует именно с запасами железа в печени. Действительно, так оно и есть. Исследования показывают четкую взаимосвязь между количественным содержанием ферритина в кровотоке и физиологическими процессами, связанными с железом печени: при концентрации 25–40 мкг/л начинается затрудненный железодефицитный эритропоэз [26], а концентрация менее 12 мкг/л свидетельствует о полном отсутствии запасов железа в печени [27].
Концентрация сывороточного ферритина является наиболее распространенным и эффективным методом измерения запасов железа в организме. Данный показатель необходим при диагностировании наличия и развития ряда заболеваний.
ВОЗ и многие ученые определяют нижнюю допустимую границу как 15 мкг/л, после которой у пациента вероятно наличие ЖДА [3], [23], [27]. Однако стоит учитывать возможное присутствие ряда других заболеваний, например рака поджелудочной железы или легких, гепатомы и нейробластомы, острой лейкемии, а также различных воспалений и метастаз, которые увеличивают уровень сывороточного ферритина [3].
Если же у пациента точно отсутствует воспаление и наблюдаются высокие показатели ферритина, то стоит рассмотреть вариант перегруженности организма железом [28]. Верхняя граница диапазона нормальной концентрации по данным ВОЗ — 200 мкг/л для мужчин и 150 мкг/л для женщин [29]. Однако эти значения не универсальны по всему миру, и во многих странах используются другие пределы. Объясняется это в том числе и тем, что уровень ферритина может варьировать в зависимости от лабораторных условий и принятых способов измерения. Многие авторы определяют верхнюю границу как 300 мкг/л для мужчин и 200 мкг/л для женщин. Да и сама ВОЗ в современных работах отдельно указывает верхнюю границу, например, для Великобритании [3]. Поэтому точно можно говорить только о том, что симптомы перегрузки организма железом проявляются при превышении границы в 800–1000 мкг/л [30], [31].
Связь с заболеваниями
По ферритину можно диагностировать дефицит железа и отсутствие его запасов в организме до начала развития ЖДА. Недостаток метода заключается в его неточности: в разных лабораториях аналитическая изменчивость измерений составляет более пятнадцати процентов, что может сильно повлиять на результат исследований [32]. Кроме того, уровень ферритина зависит от возраста и других факторов. Например, он уменьшается при переливании крови и увеличивается с приемом алкоголя [3], [33], [34].
5. Концентрация гемоглобина в крови
Один из самых распространенных способов определения уровня железа в теле человека и диагностирования железодефицитных заболеваний состоит в определении кровяной концентрации гемоглобина. Так как большая часть железа в организме уходит на синтез этого белка, измерение его уровня в крови будет говорить напрямую о состоянии железного фона у пациента.
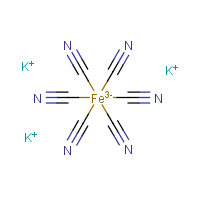
Рисунок 4. Феррицианид калия.
Основной медицинский способ измерения сывороточной концентрации гемоглобина состоит в определении в обработанной сыворотке крови уровня гемиглобинцианида — вещества, образующегося из гемоглобина в 2 стадии: сначала железо в геме окисляется феррицианидом калия (см. рис. 4) до трехвалентного состояния (образуется метгемоглобин), после чего получившееся вещество связывается с цианидом калия и переходит в искомый гемиглобинцианид, который имеет максимум поглощения при длине волны в 540 нм [35]. С помощью метода спектрофотометрии и приготовления ряда стандартных разведений можно вычислить начальную концентрацию гемоглобина в крови.
Диагностика
ВОЗ считает нормальной концентрацию гемоглобина в крови выше 120 г/л для женщин и 130 г/л для мужчин [3], [36]. Однако эта норма не универсальна для всех людей и зависит от пола, этнической принадлежности, беременности и даже от наличия вредных привычек, например, курения [34], [43]. Поэтому существуют региональные нормы. Рекомендуемый нижний предел нормальной концентрации гемоглобина в крови для большинства жителей РФ в возрасте 20–59 лет составляет 137 г/л для мужчин и 122 г/л для женщин [37], [38].
Кроме этого, уровень гемоглобина может снижаться под влиянием анемий: железодефицитной, B12-дефицитной, хронических заболеваний и других. Поэтому часто для точного диагностирования ЖДА используют показатели и других биомаркеров.
Старение
Возрастные изменения концентрации незначительны [39], но измеримы. По этой причине гемоглобин в крови — удобный биомаркер старения, так как его концентрация с возрастом снижается относительно постоянно и равномерно. Наблюдение за несколькими тысячами пожилых пациентов из Швеции в течение 18 лет (с 70 до 88 лет) с регулярными (раз в 1–5 лет) замерами гемоглобина в крови, в среднем показали ежегодное снижение на ~ 0,7 г/л/год у мужчин и ~ 0,06 г/л/год у женщин [34]. Одной из причин этого может быть корреляция между уровнем гемоглобина в крови и развитием мускулатуры тела. Как известно, мышечная масса с возрастом уменьшается, поэтому люди с лучшим физическим развитием имеют меньше шансов приобрести железодефицитные заболевания [40].
О биомаркерах
Итак, мы рассмотрели пять самых известных и популярных биомаркеров железа, которые используются в современной медицине. Каждый из них в силу своей физиологии говорит о состоянии железа по-разному, поэтому и используют их в разных ситуациях. Важно понимать, что указанные методы не являются синонимичными, каждый из них обладает своими плюсами и минусами. Например, сывороточный уровень трансферриновых рецепторов не укажет на уменьшение запасов железа в печени, как это может сделать концентрация ферритина, но в отличие от последнего концентрация sTfR будет равнодушна к наличию у пациента воспалений. Каждый случай индивидуален, каждое заболевание имеет свой патогенез, поэтому все биомаркеры важны, все биомаркеры нужны. В особенности, когда они используются одновременно и могут покрыть минусы друг друга, как в уже описанном выше примере рецепторно-ферритинового индекса.
Железосвязанные заболевания
Теперь, после обсуждения методов измерения содержания железа, стоит перейти к логическому продолжению — к диагностированию заболеваний, связанных с железом. Однако перед этим нельзя не упомянуть один важный момент: подобные заболевания не появляются у пациента внезапно и развиваются на протяжении долгих месяцев и даже лет. Почему?
Ну, во-первых, организм с помощью регуляторных систем сам хорошо контролирует метаболизм железа: он умеет запасать его в печени, потом тратить эти запасы, а также увеличивать или уменьшать абсорбцию в кишечнике. Во-вторых, само развитие заболеваний, связанных с дисбалансом железа, — это сигнал, за которым следует регуляционный ответ организма. И в норме, например при отсутствии наследственных заболеваний, мы хорошо справляемся с подобными нештатными ситуациями [41]. В-третьих, здоровый человек даже в случае несбалансированной диеты усваивает именно то количество железа, которое ему требуется. Конечно, существуют и уникальные случаи, например сильный переизбыток или нехватка железа в рационе пищи, которые уже могут инициировать развитие железосвязанных заболеваний. Именно поэтому нужно следить за тем, чтобы отклонения от нормальной диеты не были частыми и долгосрочными [42].
Железодефицитная анемия
Железодефицитная анемия, или ЖДА, — самая распространенная форма анемии [43], которая так часто упоминалась в обзоре. Этим заболеванием поражена примерно треть всего населения Земли. В основном от ЖДА страдают дети и женщины [44]. Болезнь возникает из-за нарушения баланса между поступлением, хранением и выведением железа. Как можно догадаться из названия, ЖДА в первую очередь характеризуется дефицитом железа, то есть его пониженным содержанием в организме. Наиболее распространенные симптомы этого заболевания включают в себя усталость, тахикардию, отсутствие выносливости и даже пикацизм (употребление в пищу несъедобных вещей) по отношению к глине и льду [45].
Все клетки организма требуют небольшого количества железа, за исключением предшественников эритроцитов, которые поглощают его значительно больше. Следовательно, дефицит железа в первую очередь проявляется в виде анемии (см. рис. 5). Действительно, физиологически ЖДА проявляется в уменьшении количества эритроцитов в крови и замедлении эритропоэза вследствие ухудшения синтеза гемоглобина [43], [46].
Диагностируют ЖДА в основном по содержанию гемоглобина в крови. Концентрация менее 130 г/л свидетельствует о возможном наличии болезни, однако для менструального периода и беременности существуют свои нормы [47]. Измерить содержание гемоглобина очень просто и дешево, но существует одна проблема. Значительное снижение его концентрации, которое можно регистрировать с учетом погрешности, нельзя заметить до последней стадии анемии. В связи с этим при подозрении на ЖДА у пациента врач обычно использует дополнительные индикаторы содержания железа, например регистрирующие скорость эритропоэза.
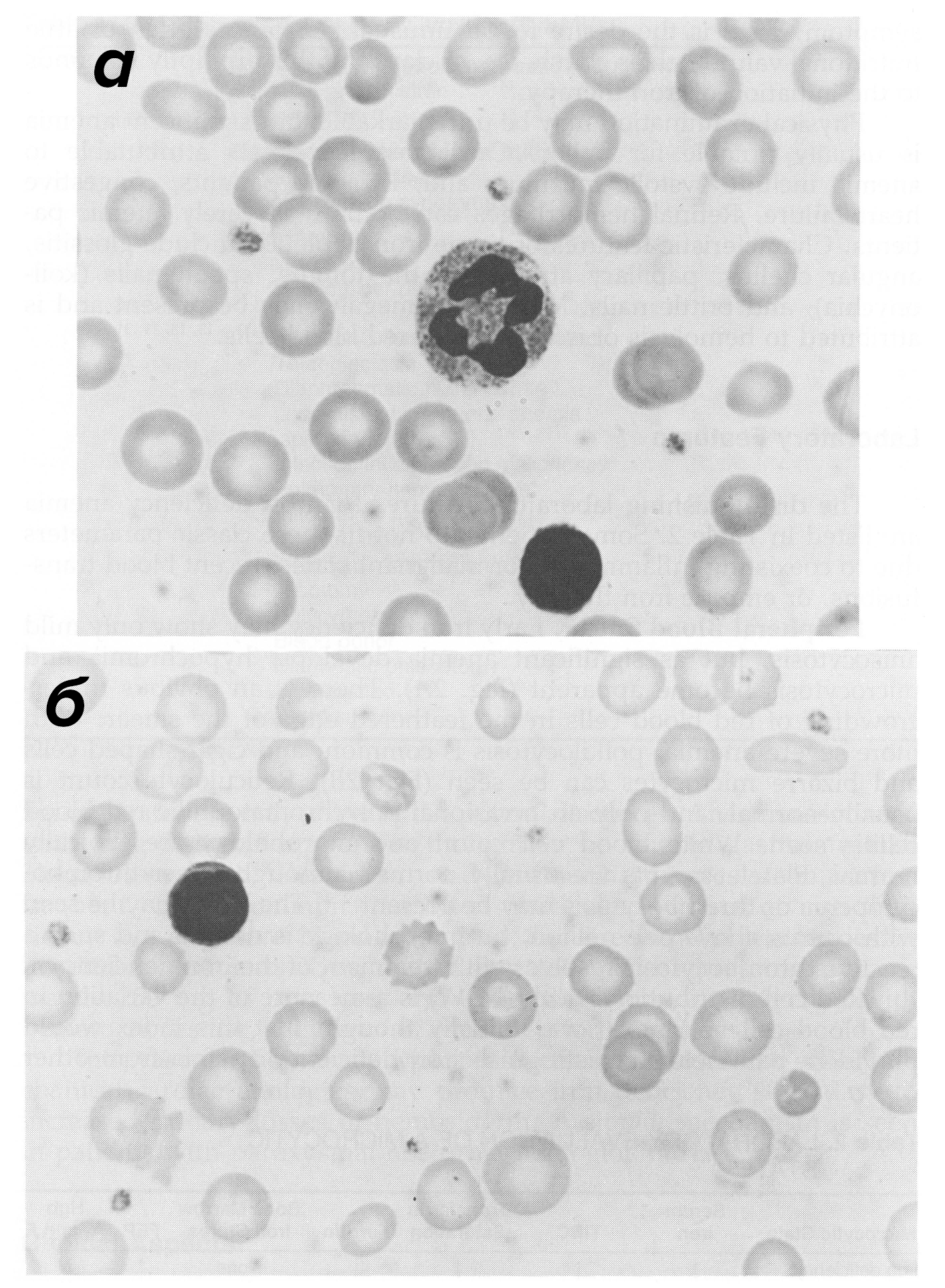
Рисунок 5. Мазки крови больного ЖДА. Эритроциты микроцитного типа. У здорового человека они примерно равны ядрам лимфоцитов (также присутствуют на мазках), в данном же случае клетки несколько меньше. Кроме этого, эритроциты гипохромны, так как по краю клеток виден темноватый ободок гемоглобина, который в норме зрительно должен заполнять две трети от диаметра эритроцита.
а — Легкая и средняя степень тяжести болезни. Центральная бледность увеличена, некоторые клетки неправильной овальной формы.
б — Тяжелая степень болезни. Гипохромия сильно выражена, многие клетки принимают разные неправильные формы.
На молекулярном уровне ЖДА связана с низкой загруженностью железом сывороточного трансферрина, что может быть следствием дефицита доступного железа. Из-за чего может возникнуть подобная нехватка железа? Есть несколько причин:
-
Большие кровопотери вследствие частых физических повреждений или внутренних кровотечений.
Вместе с кровью из организма уходит и железосодержащий гемоглобин в эритроцитах. В норме здоровый человек теряет некоторое количество крови со стулом и в менструальный период, но эти не очень большие затраты компенсируются вновь поступающим железом из кишечника.
Однако кровопотери могут увеличиться из-за частых кожных повреждений, язв, злокачественных новообразований и заболеваний внутренних органов, в частности органов желудочно-кишечного тракта (ЖКТ), например в случае гастро-энтеральной ангиодисплазии [38], [49–51].
Болезнь характеризуется прерывистыми кровотечениями, которые могут быть спонтанными либо вызваны физической нагрузкой. Диагностируют заболевание эндоскопией, а лечат эндоскопической терапией. В тяжелых случаях заболевание может угрожать жизни пациента из-за больших потерь крови. По этой причине эндоскопия, в частности колоноскопия, является частью стандартного обследования пожилых пациентов с железодефицитной анемией [51], [52].
Частые кровопотери могут быть актуальны именно для кишечника, так как многие облигатные паразиты вызывают повреждения его стенок. -
Повышенная частота разрушения эритроцитов
Уменьшение средней продолжительности жизни эритроцитов может быть следствием некоторых заболеваний, например хронической почечной недостаточности [53], а также просто старения. При увеличении возраста человека увеличивается и скорость кровообращения, но уменьшается продолжительность жизни красных кровяных телец. Хоть этот фактор не способен инициировать развитие анемии, но может быть стимулом в совокупности с другими. Эритроциты пожилых людей изначально частично повреждены и менее функциональны, что приводит к их раннему разрушению [54].
-
Потребление малого количества железа вследствие неправильной диеты и нарушение абсорбции железа в кишечнике.
Неправильная диета редко бывает единственной причиной развития ЖДА, но иногда, например, в случае быстрого роста у детей и во время пременопаузы у женщин, организму не хватает железа, поступающего из пищи, что уже может являться стимулом к развитию ЖДА [43], [49].
Некоторые инфекции ЖКТ могут привести к уменьшению абсорбции железа организмом. Очень распространенный паразит человека бактерия Helicobacter pylori инфицирует различные области желудка и двенадцатиперстной кишки, повреждает их выстилку и вызывает кровоизлияния [38].
Лечение
Главная причина развития ЖДА — малое содержание железа в организме. При лечении в первую очередь избавляются от сопутствующих заболеваний, которые как-то влияют на физиологию железа. После этого врач обычно назначает коррекцию диеты или пероральный прием БАДов. Однако, если эти способы оказываются неэффективными или имеются противопоказания, то прибегают к внутривенному введению железа [51].
Всегда стоит помнить о том, что любая болезнь развивается не в вакууме, а в организме конкретного человека. Пациент может иметь сопутствующие заболевания, которые могут как-то влиять на патогенез исследуемой болезни. Почечная недостаточность, постоянные воспаления, генетически обоснованный гемохроматоз, миелодисплазия и другие отклонения, о которых мы подробнее поговорим ниже, могут индуцировать развитие дефицитного состояния железа в организме.
ЖДА и старение
Статистические данные говорят нам о том, что распространенность ЖДА, как и некоторых других типов анемий, увеличивается с возрастом [55], [56]. Кроме перечисленных выше причин снижения количества железа в организме существует и другие ситуации, стимулирующие развитие этого заболевания, свойственные в основном пожилым людям. Наверное, первая отличительная черта людей в возрасте, которая приходит в голову, — это прием лекарств. К сожалению, многие из них имеют побочные действия, влияющие на метаболизм железа. И речь идет не только о каких-то супер специфичных узконаправленных медикаментах: даже обычный аспирин оказывает влияние на физиологию железа [56]. Еще одна проблема, которая, скорее, больше связана с материальным положением человека, чем с возрастом, — это питание. Недоедание и однотипная диета, которые часто наблюдаются в высоких возрастных группах, способствуют развитию анемии, но не являются обязательным ее условием и не могут быть единственным ее стимулом [55], [56]. Кроме этого, пожилым людям свойственно снижение уровня физической активности и общего тонуса организма. Эти факторы тоже косвенно влияют на развитие железосвязанных заболеваний [56].
Анемия хронических заболеваний
У этого типа анемии много причин возникновения, так как она сопутствует основным хроническим заболеваниям пациента. Болезнь не только отягощает симптомы уже присутствующего воспаления, но и оказывает свое влияние на организм [57]. Из-за того что хронические воспаления включают в характеристику процесса старения, данный тип анемии можно считать возрастным [58]. По этой причине, анемия широко представлена в мире и находится на втором месте по распространенности после ЖДА [59]. Теперь поговорим о том, почему анемия вообще появляется. Болезнь развивается только при наличии у пациента хронических воспалений, которые обычно сопутствуют хроническим инфекциям, различным видам рака, почечной недостаточности и аутоиммунным заболеваниям [60]. Развитие анемии представляет из себя своеобразную новую стратегию организма по борьбе с долгосрочным заболеванием. Простыми словами, организм специально вызывает анемию для возбуждения дефицита по такому необходимому фактору роста как железо, который негативно сказывается на развитии всех клеток, в том числе и опухолевых [61]. Так как эти клетки часто делятся, то и железа требуют больше, следовательно, дефицит будет оказывать на них более серьезное негативное влияние, чем на нормальные клетки организма.
Как это происходит? В первую очередь изменяется выброс эритропоэтина (гормона, контролирующего эритропоэз), сокращается время жизни эритроцитов и нарушается процесс деления их клеток-предшественников. Результатом становится нормоцитарная анемия (см. рис. 6), при которой эритроциты остаются в нормальном состоянии, но в меньшем количестве. В то же время железо, которое должно было тратиться на синтез гемоглобина, уходит в ткани и запасается в ретикулоэндотелиальных клетках, или тканевых макрофагах, вызывая тем самым перегруженность организма железом [62].
В одном исследовании, проведенном в 2013 году, была взята популяция крыс, особи которой были заражены бактерией Vibrio vulnificus. После этого у части выборки стимулировали перегрузку железом путем увеличения содержания железа в пище, а у другой вызвали истощение запасов железа также диетарным способом. Было выяснено, что смертность группы с перегруженностью превышала смертность железодефицитной группы [63]. Это исследование показывает, что перегрузка организма железом имеет даже большее негативное воздействие, чем его жесткий дефицит.
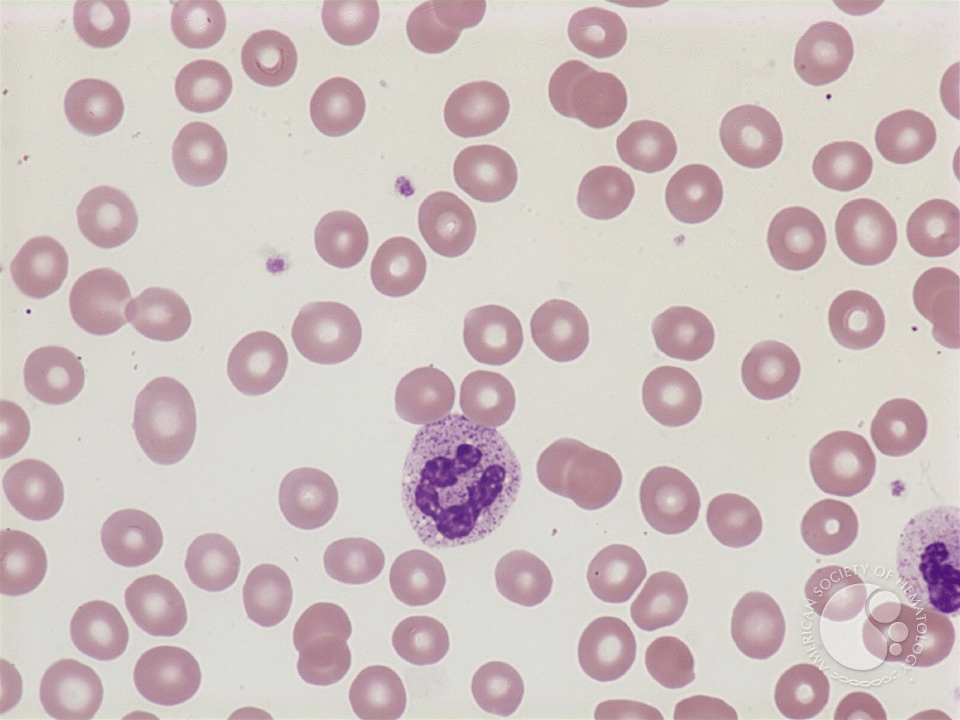
Рисунок 6. Мазок крови больного анемией хронических заболеваний.
Анемия хронических заболеваний является самым популярным видом нормоцитарной анемии [59]. Как видно на мазке крови, эритроциты стандартного размера. При развитии анемии появляется гипохромность и микроцитарность. Кровяная концентрация гемоглобина варьирует в интервале 8–9,5 г/децилитр. В особо тяжелых ситуациях падает до 6 г/децилитр [64].
Все вышеперечисленное можно объяснить длительным повышением уровня синтеза печенью специального регуляторного пептида — гепсидина. Напомним, что гепсидин связывается с главным экспортным белком — ферропортином, приводя к ингибированию экспрессии железа в кровоток, тем самым ограничивая клетки организма доступом к железу. Стимулом к такому безостановочному синтезу гепсидина служит постоянно увеличенная кровяная концентрация воспалительных цитокинов, которая вызвана хроническими воспалительными процессами, на фоне которых и развивается анемия [57].
Лечение
Главным способом лечения заболевания является борьба с основным воспалительным заболеванием и переливание крови в особо тяжких случаях. В ситуациях с возможным летальным исходом используются антагонисты гепсидина [62].
Так как существуют и другие заболевания, сопровождающиеся гипохромной микроцитарной анемией, например все та же ЖДА, то существует потребность в разграничении этих двух заболеваний при обследовании пациента.
Это можно сделать двумя способами. Первый подразумевает более подробное изучение мазка крови с поиском следов тромбоцитоза, с анализом гранулярности и сегментированности клеток. Второй же — немного проще, он основан на лабораторном анализе крови (см. таблицу 1).
| Показатель | Анемия хронических заболеваний | Железодефицитная анемия | Наличие двух видов анемии одновременно |
|---|---|---|---|
| Железо в организме | Снижен | Снижен | Снижен |
| Сывороточный трансферрин | Снижен | Снижен | Снижен |
| Насыщение трансферрина | Снижен | Снижен | Снижен |
| Ферритин | Норма/увеличен | Снижен | Снижен/норма |
| sTfR | Норма | Увеличен | Норма/увеличен |
| sTfR-F индекс | < 1 | > 2 | > 2 |
| Гепсидин-25 | Увеличен | Снижен | Увеличен |
| Запасы железа в красном костном мозге | Присутствуют | Отсутствуют | Отсутствуют |
Наследственный гемохроматоз (гемохроматоз 1 типа)
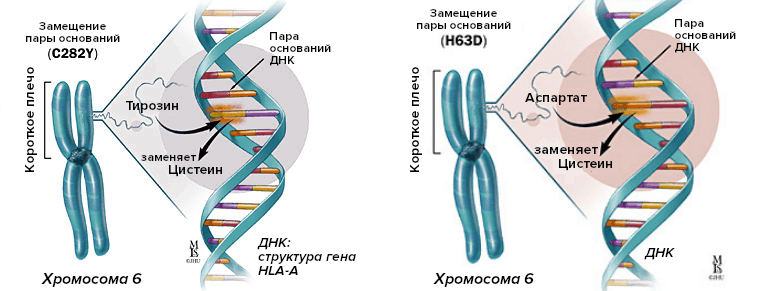
Как следует из названия, наследственный гемохроматоз — заболевание генетическое: аутосомное и рецессивное. Оно может быть вызвано поломкой гена любого белка, лимитирующего проникновение или транспорт железа в кровотоке, однако самым распространенным случаем является поломка гена HFE, одноименный мембранный белок которого отвечает за регуляцию взаимодействия трансферриновых рецеторов с трансферрином (см. рис. 7) [66].
Гемохроматоз связан с перегруженностью организма железом и вытекающими негативными последствиями для органов и тканей из-за его токсичности [30], [67]. Для болезни характерен нормальный эритропоэз при повышенной интенсивности абсорбции железа. Как следствие, излишнее железо не уходит на синтез гемоглобина и запасается в паренхимных клетках печени, сердца и эндокринных желез [68].
Существуют и другие ситуации, вызывающие перегруженность организма железом. Такое состояние может быть связано с частыми переливаниями крови, в случае ряда наследственных заболеваний, таких как талассемия и серповидноклеточная анемия, и кроветворных заболеваний, например белокровия и апластической анемии. Следовательно, гемохроматоз нельзя диагностировать только по симптомам перегрузки железом, поэтому врач использует показатели биомаркеров состояния железа.
Данным видом гемохроматоза обычно страдают мужчины в возрасте от 40 до 50 лет. У избыточного накопления железа есть много негативных последствий на организм, оно вызывает цирроз печени, бронзовую болезнь, диабет и другие эндокринные заболевания. Концентрация сывороточного ферритина более 300 мкг/л для мужчин и более 200 мкг/л для женщин и насыщение трансферрина ≥ 45% может говорить о наличии гемохроматоза, а концентрацией ферритина более 1000 мг/л — и о фиброзе печени [22], [68].
Вредное железо
При насыщении трансферрина более 60% в кровотоке появляются молекулы несвязанного железа [22], которое, как мы уже обсуждали в первой части статьи, токсично для клеток организма. Теперь стоит разобраться почему. Дело в том, что его большие концентрации запускают реакцию Фентона, которая проходит в 2 ступени: восстановление Fe3+ в Fe2+ и его последующая реакция с пероксидом водорода, в результате которой высвобождается токсичный для клетки гидроксильный радикал, способный повреждать структуру ДНК [72]. Такие агрессивные молекулы вызывают клеточную смерть. Если это явление массовое, то есть если умирает большая часть органа, то запускается процесс фиброза. Фиброз подразумевает разрастание на органе рубцов из соединительной ткани для его реконструкции. Фиброзная часть менее функциональна, поэтому орган хуже справляется со своими обязанностями, и уже из-за этого могут возникнуть различные заболеваний. Например обильные отложения железа в печени увеличивают шанс возникновения гепатоцеллюлярной карциномы (рака печени), в сердце — кардиомипатию, в железах — эндокринопатию [49].
Лечение
По очевидным причинам заболевание неизлечимо, однако существует способ предотвращать последствия от перегрузки организма железом и убирать его симптомы. Для этого используют регулярную флеботомию в течение всей жизни больного. Операция состоит в заборе венозной крови пациента в определенном объеме. После потери крови организм вынужден тратить железо для восстановления исходного количества эритроцитов в кровотоке, тем самым сокращая скопившееся тканевые запасы микроэлемента.
Пару слов
Как вы поняли, медицина на практике куда сложнее красивых схемок в учебниках. Обилие нюансов и неоднозначных ситуаций, возникающих в работе любого врача, делает эту работу одной из самых сложных среди всех существующих профессий. Гнетущее чувство ответственности за состояние, а иногда и за жизнь пациента вкупе с ограниченным набором данных может заставить ошибиться даже самого опытного специалиста. К счастью, наука никогда не стоит на месте и даже в в такой, казалось бы, затертой до дыр области как физиология микроэлементов есть место открытиям и переосмыслениям, которые упрощают жизнь и врачам, и их пациентам. Повсеместное распространение генетических тестов поставило тысячам людей точный диагноз наследственных заболеваний, который позволил им грамотно расписать свое лечение и планирование семьи. Еще век назад это было бы попросту невозможно, и человек остался бы в неведении до конца жизни. Набирающий в последнее время популярность рецепторно-ферритиновый индекс, который по сути является продуктом переосмысления уже известных методов, напрямую позволяет разграничить некоторые трудноопределимые заболевания. Индекс основан на легко получаемых в любой лаборатории данных, поэтому может использоваться огромным числом врачей прямо сейчас без каких-либо дополнительных затрат.
Наука развивается и дает медикам все больше возможностей точно диагностировать болезни без додумываний и гадания по симптомам. Но для этого, конечно, необходимо досконально понимать как работу человеческого организма, так и тонкости прикладных аспектов медицины этой области. Надеюсь, эта статья как-то помогла вам с этим, дала информацию, которую вы искали, и структурировала уже имеющуюся.
Литература
- Немного о железе. Теория;
- Ferritin. (2010). Ilex Medical;
- Assessing the Iron Status of populations. (2007). WHO;
- Fillet G. and Beguin Y. (2001). Monitoring of erythropoiesis by the serum transferrin receptor and erythropoietin. Acta Clinica Belgica. 56, 146–54;
- Beguin Y. (2003). Soluble transferrin receptor for the evaluation of erythropoiesis and iron status. Clin. Chim. Acta. 329, 9–22;
- Kohgo Y., Torimoto Y. and Kato J. (2002). Transferrin receptor in tissue and serum: updated clinical significance of soluble receptor. International Journal of Hematology. 76, 213–8;
- Shintani N., Kohgo Y., Kato J., Kondo H., Fujikawa K., Miyazaki E. et al. (1994). Expression and extracellular release of transferrin receptors during peripheral erythroid progenitor cell differentiation in liquid culture. Blood. 83, 1209–15;
- Harms K. and Kaiser T. (2015). Beyond soluble transferrin receptor: Old challenges and new horizons. Best Practice & Research Clinical Endocrinology & Metabolism. 29, 799–810;
- Skikne B., Flowers C. and Cook J. (1990). Serum transferrin receptor: a quantitative measure of tissue iron deficiency. Blood. 75, 1870–6;
- Serum transferrin receptor levels for the assessment of iron status and iron deficiency in populations. (2014). WHO;
- Kuvibidila S., Warrier R.P., Ode D. and Yu L. (1996). Serum transferrin receptor concentrations in women with mild malnutrition. The American Journal of Clinical Nutrition. 63, 596–601;
- Remacha A.F., Sarda M.P., Parellada M., Ubeda J. and Manteiga R. (1998). The role of serum transferrin receptor in the diagnosis of iron deficiency. Haematologica, 83, 963–966;
- Oustamanolakis P., Koutroubakis I.E., Messaritakis I., Niniraki M. and Kouroumalis E.A. (2011). Soluble transferrin receptor-ferritin index in the evaluation of anemia in inflammatory bowel disease: A case-control study. Ann. Gastroenterol. 24, 108–114;
- Flowers C.H., Skikne B.S., Covell A.M. and Cook J.D. (1989). The clinical measurement of serum transferrin receptor. J. Lab. Clin. Med.. 114, 368–377;
- Allen J., Backstrom K.R., Cooper J.A., Cooper M.C., Detwiler T.C., Essex D.W. et al. (1998). Measurement of soluble transferrin receptor in serum of healthy adults. Clinical Chemistry. 44, 35–9;
- Agorasti A., Trivellas T., Papadopoulos V. and Konstantinidou D. (2007). Innovative parameters RET-Y, sTfR, and sTfR-F index in patients with microcytic, hypochromic anemia--their special value for hemoglobinopathies. Laboratory Hematology: Official Publication of the International Society for Laboratory Hematology. 13, 63–8;
- Punnonen K., Irjala K. and Rajamäki, A. (1997). Serum Transferrin Receptor and Its Ratio to Serum Ferritin in the Diagnosis of Iron Deficiency. Blood. 89, 1052–7;
- Goyal R., Das R., Bambery P. and Garewal G. (2008). Serum transferrin receptor-ferritin index shows concomitant iron deficiency anemia and anemia of chronic disease is common in patients with rheumatoid arthritis in north India. Indian Journal of Pathology and Microbiology, Medknow Publications. 51, 102;
- Kasvosve I. and Delanghe J. (2002). Total Iron Binding Capacity and Transferrin Concentration in the Assessment of Iron Status. Clinical Chemistry and Laboratory Medicine : CCLM / FESCC. 40, 1014–8;
- Preventing and controlling Iron Deficiency Anemia. (1989). WHO;
- Cappellini M.D., Comin‐Colet J., de Francisco A., Dignass A., Doehner W., S. P. Lam C. et al. (2017). Iron deficiency across chronic inflammatory conditions: International expert opinion on definition, diagnosis, and management. American Journal of Hematology. 92, 1068–78;
- Milman N.T., Schioedt F.V., Junker A.E. and Magnussen K. (2019). Diagnosis and Treatment of Genetic HFE-Hemochromatosis: The Danish Aspect. Gastroenterology Research. 12, 221–32;
- Garcia-Casal M.N., Pasricha S.-R., Martinez R.X., Lopez-Perez L. and Peña-Rosas J.P. (2018). Are Current Serum and Plasma Ferritin Cut-offs for Iron Deficiency and Overload Accurate and Reflecting Iron Status? A Systematic Review. Archives of Medical Research. 49, 405–17;
- Marcus D.M. and Zinberg N. (1975). Measurement of Serum Ferritin by Radioimmunoassay: Results in Normal Individuals and Patients With Breast Cancer2. JNCI: Journal of the National Cancer Institute. 55, 791–5;
- Radioimmunoassay (RIA). (2018). Bioscience Notes;
- Hallberg L., Bengtsson C., Lapidus L., Lindstedt G., Lundberg P.-A. and Hultén, L. (1993). Screening for iron deficiency: an analysis based on bone-marrow examinations and serum ferritin determinations in a population sample of women. British Journal of Haematology. 85, 787–98;
- Концентрации ферритина в сыворотке крови для оценки статуса железа и степени дефицита железа у населения. (2011). ВОЗ;
- Serum ferritin concentrations for the assessment of iron status and iron deficiency in populations. (2011). WHO;
- Garcia-Casal M.N., Peña-Rosas J.P. and Pasricha S.-R. (2014). Rethinking ferritin cutoffs for iron deficiency and overload. The Lancet Haematology. 1, e92–4;
- Saito H. Metabolism of Iron Stores. Nagoya J. Med. Sci. 76, 235–254;
- Wish J.B. (2006). Assessing iron status: beyond serum ferritin and transferrin saturation. Clinical Journal of the American Society of Nephrology: CJASN. 1 Suppl 1, S4-8;
- Hoofnagle A.N. (2017). Harmonization of blood-based indicators of iron status: making the hard work matter. The American Journal of Clinical Nutrition. 106, 1615S-1619S;
- Yamashita N., Oba K., Nakano H. and Metori S. (1996). [Age-related changes in concentrations of ferritin, glyeosylated ferritin, and non-glycosylated ferritin]. Nihon Ronen Igakkai Zasshi Japanese Journal of Geriatrics. 33, 754–60;
- Nilsson-Ehle H., Jagenburg R., Landahl S. and Svanborg A. (2000). Blood haemoglobin declines in the elderly: implications for reference intervals fromage 70 to 88. European Journal of Haematology. 65, 297–305;
- Higgins C. (2005). Hemoglobin and its measurement. Acute Care Testing;
- Preventing and controlling Iron Deficiency Anemia. (2011). WHO;
- Beutler E. and Waalen J. (2006). The definition of anemia: what is the lower limit of normal of the blood hemoglobin concentration? Blood, 107, 1747–50;
- Vranken M. (2010). Evaluation of Microcytosis. Am. Fam. Physician. 82, 1117–1122;
- Raisinghani N., Kumar S., Acharya S., Gadegone A. and Pai V. (2019). Does aging have an impact on hemoglobin? Study in elderly population at rural teaching hospital. Journal of Family Medicine and Primary Care. 8, 3345–9;
- Milman N., Pedersen A.N., Ovesen L. and Schroll M. (2008). Hemoglobin concentrations in 358 apparently healthy 80-year-old Danish men and women. Should the reference interval be adjusted for age? Aging Clinical and Experimental Research. 20, 8–14;
- Sangkhae V. and Nemeth E. (2017). Regulation of the Iron Homeostatic Hormone Hepcidin123. Advances in Nutrition. 8, 126–36;
- Pinhas-Hamiel O., Newfield R.S., Koren I., Agmon A., Lilos P. and Phillip M. (2003). Greater prevalence of iron deficiency in overweight and obese children and adolescents. International Journal of Obesity Nature Publishing Group. 27, 416–8;
- Miller J.L. (2013). Iron Deficiency Anemia: A Common and Curable Disease. Cold Spring Harbor Perspectives in Medicine. 3;
- Lopez A., Cacoub P., Macdougall I.C. and Peyrin-Biroulet L. (2016). Iron deficiency anaemia. Lancet (London, England), 387, 907–16;
- DeLoughery T.G. (2017). Iron Deficiency Anemia. Medical Clinics of North America. 101, 319–32;
- Donovan A., Roy C.N. and Andrews N.C. (2006). The Ins and Outs of Iron Homeostasis. Physiology, American Physiological Society. 21, 115–23;
- Killip S., Bennett J.M. and Chambers M.D. (2007). Iron deficiency anemia. Am. Fam. Physician. 75, 671–678;
- Massey A.C. (1992). Microcytic anemia: Differential Diagnosis and Management of Iron Deficiency Anemia. Medical Clinics of North America. 76, 549–66;
- Andrews N.C. (1999). Disorders of Iron Metabolism. New England Journal of Medicine. 341, 1986–95;
- Rockey D.C. and Cello J.P. (1993). Evaluation of the gastrointestinal tract in patients with iron-deficiency anemia. The New England Journal of Medicine. 329, 1691–5;
- Leischker A.H., Fetscher S. and Kolb G.F. (2016). [Anaemia in the elderly]. Deutsche Medizinische Wochenschrift (1946). 141, 954–9;
- Jackson C.S. and Strong R. (2017). Gastrointestinal Angiodysplasia: Diagnosis and Management. Gastrointestinal Endoscopy Clinics of North America. 27, 51–62;
- Ly J., Marticorena R. and Donnelly S. (2004). Red blood cell survival in chronic renal failure. Am. J. Kidney Dis. 44, 715–719;
- Gershon H. and Gershon D. (1988). Altered enzyme function and premature sequestration of erythrocytes in aged individuals. Blood Cells. 14, 93–101;
- Emiroglu C., Görpelioglu, S. and Aypak C. (2019). The Relationship between Nutritional Status Anemia and Other Vitamin Deficiencies in the Elderly Receiving Home Care. The Journal of Nutrition Health & Aging 23, 677–82;
- Wawer A.A., Jennings A. and Fairweather-Tait S.J. (2018). Iron status in the elderly: A review of recent evidence. Mechanisms of Ageing and Development. 175, 55–73;
- Poggiali E., Migone De Amicis M. and Motta I. (2014). Anemia of chronic disease: a unique defect of iron recycling for many different chronic diseases. European Journal of Internal Medicine. 25, 12–7;
- Ponti F., Santoro A., Mercatelli D., Gasperini C., Conte M., Martucci M. et al. (2019). Aging and Imaging Assessment of Body Composition: From Fat to Facts. Frontiers in Endocrinology. 10, 861;
- Brill J.R. and Baumgardner D.J. (2000). Normocytic Anemia. Am. Fam. Physician. 62, 2255–2263;
- Shaikh H. and Aeddula N.R. Anemia Of Chronic Renal Disease. Treasure Island (FL): StatPearls Publishing;
- Weiss G. (2002). Pathogenesis and treatment of anaemia of chronic disease. Blood Reviews. 16, 87–96;
- Županić-Krmek, Sučić M. and Bekić D. (2014). Anemia of chronic disease: Illness or adaptive mechanism. Acta. Clin. Croat. 53, 348–354;
- Arezes J., Jung G., Gabayan V., Valore E., Ganz T., Bulut Y. et al. (2013). Hepcidin-Induced Hypoferremia Is a Host-Defense Mechanism Against Siderophilic Bacteria. Blood. 122, 176;
- Madu A.J. and Ughasoro M.D. (2017). Anaemia of Chronic Disease: An In-Depth Review. Medical Principles and Practice. 26, 1–9;
- Speeckaert M.M., Speeckaert R. and Delanghe J.R. (2010). Biological and clinical aspects of soluble transferrin receptor. Critical Reviews in Clinical Laboratory Sciences. 47, 213–28;
- HFE homeostatic iron regulator [Homo sapiens (human)]. (2022). NCBI;
- Witte D.L., Crosby W.H., Edwards C.Q., Fairbanks V.F. and Mitros F.A. (1996). Hereditary hemochromatosis. Clinica Chimica Acta. 245, 139–200;
- Pietrangelo A. (2010). Hereditary hemochromatosis: pathogenesis, diagnosis, and treatment. Gastroenterology. 139, 393–408, 408.e1-2;
- Merryweather-Clarke A.T., Pointon J.J., Jouanolle A.M., Rochette J. and Robson K.J.H. (2000). Geography of HFE C282Y and H63D Mutations. Genetic Testing, Mary Ann Liebert, Inc., publishers. 4, 183–98;
- Bittencourt P.L., Palácios, S.A., Couto C.A., Cançado E.L.R., Carrilho F.J., Laudanna A.A. et al. (2002). Analysis of HLA-A antigens and C282Y and H63D mutations of the HFE gene in Brazilian patients with hemochromatosis. Brazilian Journal of Medical and Biological Research = Revista Brasileira De Pesquisas Medicas E Biologicas. 35, 329–35;
- Lewis E. (2020). The Genetics of Hemochromatosis. Hemochromatosis Help;
- Fenton Reaction. (2021). ScienceDirect Topics..