
Очень нервное возбуждение
11 сентября 2015
Очень нервное возбуждение
- 34983
- 1
- 37
Глутаминовая кислота. Молекула-трудоголик: главный возбуждающий нейромедиатор, посредник в профессиональных схемах других «нейропосредников», регулятор синаптической пластичности и... просто строительный кирпичик белков.
Рисунок в полном размере.
рисунок с сайта www.deviantart.com
-
Автор
-
Редактор
Шестая (и последняя) статья цикла о нейромедиаторах будет посвящена глутамату. Это вещество больше знакомо нам как усилитель вкуса в продуктах, но оно играет важную роль в нашей нервной системе. Глутамат — это самый распространенный возбуждающий нейротрансмиттер в нервной системе млекопитающих вообще и человека в частности.
Молекулы и связи
Глутамат (глутаминовая кислота) является одной из 20 основных аминокислот. Кроме участия в синтезе белков он может выполнять функцию нейромедиатора — вещества, которое передает сигнал от одной нервной клетки к другой в синаптической щели. При этом нужно учитывать, что глутамат, который есть в пище, не проникает через гематоэнцефалический барьер, то есть не оказывает прямого влияния на мозг. Глутамат образуется в клетках нашего тела из α-кетоглутарата путем трансаминирования. Аминогруппа переносится с аланина или аспартата, заменяя кетоновый радикал α-кетоглутарата (рис. 1). В итоге мы получаем глутамат и пируват или щавелевоуксусную кислоту (в зависимости от донора аминогруппы). Два последних вещества участвуют во многих важных процессах: щавелевоуксусная кислота, например, — это один из метаболитов в великом и ужасном цикле Кребса. Разрушение глутамата происходит при помощи фермента глутаматдегидрогеназы, и в ходе реакции образуются уже знакомый нам α-кетоглутарат и аммиак.
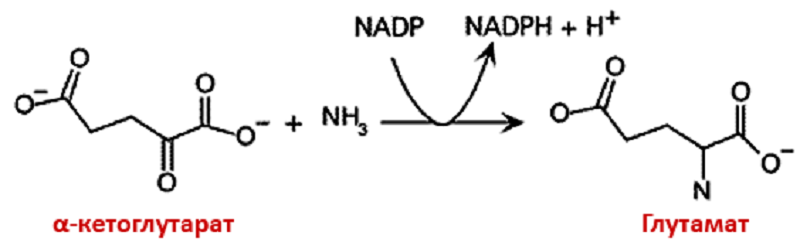
Рисунок 1. Синтез глутамата. Глутамат образуется из α-кетоглутарата путем замены кетогруппы на аминогруппу. При проведении реакции в клетках тратится никотинамидадениндинуклеотидфосфат (НАДФ, NADP).
рисунок с сайта lecturer.ukdw.ac.id
У глутамата, как и у большинства других медиаторов, есть два типа рецепторов — ионотропные (которые открывают мембранную пору для ионов в ответ на присоединение лиганда) и метаботропные (которые при присоединении лиганда вызывают метаболические перестройки в клетке). Группа ионотропных рецепторов делится на три семейства: NMDA-рецепторы, AMPA-рецепторы и рецепторы каиновой кислоты. NMDA-рецепторы так называются, поскольку их селективным агонистом, веществом, избирательно стимулирующим эти рецепторы, является N-метил-D-аспартат (NMDA). В случае AMPA-рецепторов таким агонистом будет α-аминометилизоксазолпропионовая кислота, а каинатные рецепторы избирательно стимулируются каиновой кислотой. Это вещество содержится в красных водорослях и используется в нейробиологических исследованиях для моделирования эпилепсии и болезни Альцгеймера. В последнее время к ионотропным рецепторам стали также добавлять δ-рецепторы: они расположены на клетках Пуркинье в мозжечке млекопитающих. Стимуляция «классических» — NMDA-, AMPA- и каинатных — рецепторов приводит к тому, что калий начинает выходить из клетки, а кальций и натрий поступают в клетку. В ходе этих процессов в нейроне возникает возбуждение, и запускается потенциал действия. Метаботропные же рецепторы связаны с системой G-белков и участвуют в процессах нейропластичности [1]. Под нейропластичностью понимается способность нервных клеток образовывать новые связи друг другом или уничтожать их. Также в понятие нейропластичности включается способность синапсов изменять количество высвобождаемого нейромедиатора в зависимости от того, какие поведенческие акты и мыслительные процессы происходят в данный момент и с какой частотой.
Глутаматная система неспецифична: на глутаминовой кислоте «работает» почти весь мозг. Прочие, описанные в предыдущих статьях, нейромедиаторные системы имели более или менее узкую специфику — например, дофаминовая влияла на наши движения и мотивацию [2]. В случае с глутаматом такого не происходит — слишком широко и неизбирательно его влияние на процессы внутри мозга. Сложно выделить какую-то конкретную функцию, кроме возбуждающей. По этой причине приходится говорить о глутаматной системе как о совокупности большого количества связей в головном мозге. Такую совокупность называют коннектомом. Мозг человека содержит огромное количество нейронов, которые образуют между собой еще большее количество связей. Составить коннектом человека — задача, которая на сегодняшний день науке не под силу. Однако уже описан коннектом червя Caenorhabditis elegans [3] (рис. 2). Поклонники идеи коннектома утверждают, что в человеческих коннектомах записана наша идентичность: наши личность и память. По их мнению, в совокупности всех связей прячется наше «Я». Также «связисты» считают, что после описания всех нейронных связей мы сможем понять причину множества психических и неврологических расстройств, а значит и сможем их успешно лечить.
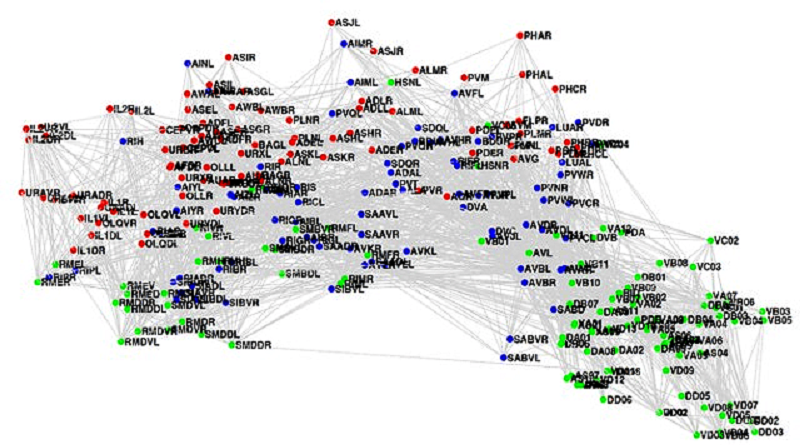
Рисунок 2. Коннектом нематоды Caenorhabditis elegans Каждый нейрон червя имеет свое название, а все связи между нейронами учтены и нанесены на схему. В итоге схема выходит запутаннее, чем карта токийского метро.
рисунок с сайта connectomethebook.com
Как мне кажется, эта идея перспективна. В упрощённом виде связи между нейронами можно представить в виде проводов, сложных кабелей, соединяющих одни нейроны с другими. При поражении этих связей — искажении сигнала, обрыве проводов — может происходить нарушение слаженной работы головного мозга. Такие болезни, возникающие при сбое в нейронных каналах связи, называются коннектопатиями. Термин новый, но за ним скрываются уже известные ученым патологические процессы. Если вам хочется узнать о коннектомах больше, рекомендую прочесть книгу Себастьяна Сеунга «Коннектом. Как мозг делает нас тем, что мы есть» [4].
Перегрузка сети
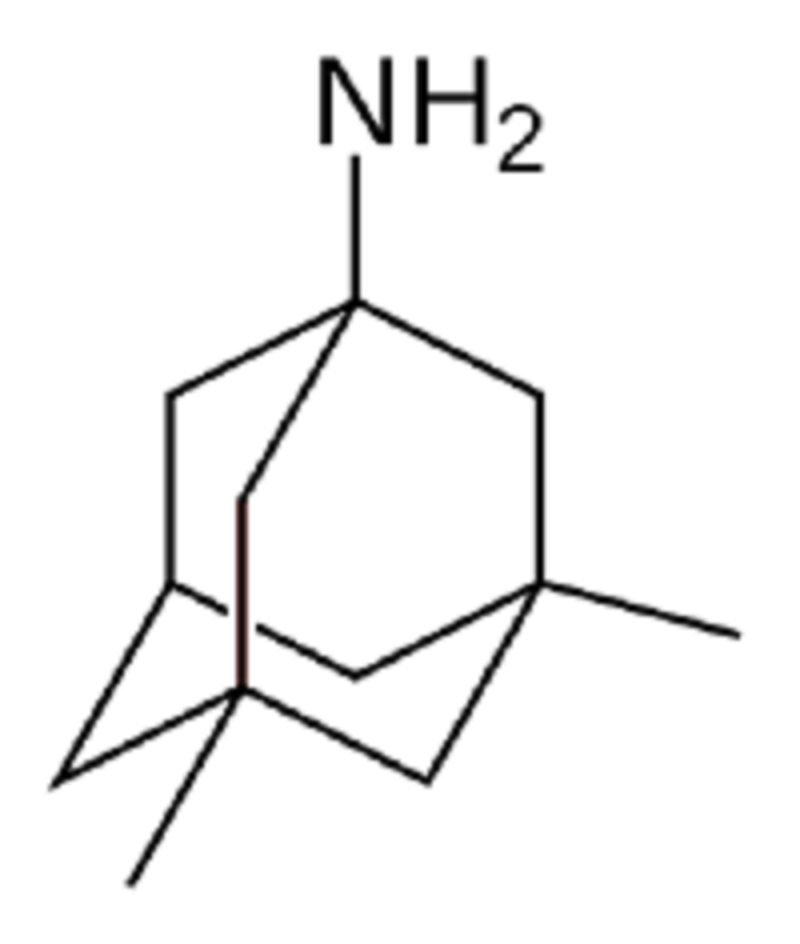
Рисунок 3. Структура мемантина. Мемантин является производным углеводорода адамантана (не путайте с адамантом).
рисунок из «Википедии»
В нормально работающем мозге сигналы от нейронов равномерно распределены по всем другим клеткам. Нейромедиаторы выделяются в необходимом количестве, и нет поврежденных клеток. Однако после инсульта (острое поражение) или при деменции (длительно текущий процесс) из нейронов в окружающее пространство начинает выделяться глутамат. Он стимулирует NMDA-рецепторы других нейронов, и в эти нейроны поступает кальций. Приток кальция запускает ряд патологических механизмов, что в итоге приводит к гибели нейрона. Процесс повреждения клеток за счет выделения большого количества эндогенного токсина (в данном случае — глутамата) называется эксайтотоксичностью.
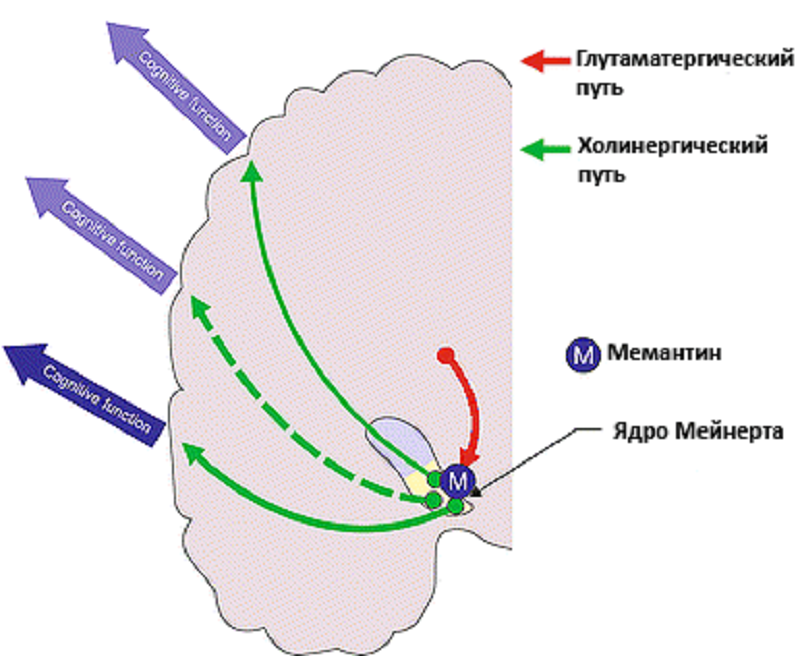
Рисунок 4. Действие мемантина при альцгеймеровской деменции. Мемантин снижает интенсивность возбуждающих сигналов, которые приходят от корковых нейронов на ядро Мейнерта. Ацетилхолиновые нейроны, составляющие эту структуру, регулируют внимание и ряд других когнитивных функций. Уменьшение избыточной активации ядра Мейнерта приводит к уменьшению симптомов деменции.
Для того чтобы предотвратить развитие эксайтотоксичности или уменьшить ее влияние на течение болезни, можно назначить мемантин. Мемантин — очень красивая молекула-антагонист NMDA-рецепторов (рис. 3). Чаще всего этот препарат назначают при сосудистой деменции и деменции при болезни Альцгеймера. В норме NMDA-рецепторы заблокированы ионами магния, но при стимуляции глутаматом эти ионы высвобождаются из рецептора, и в клетку начинает проникать кальций. Мемантин блокирует рецептор и препятствует прохождению ионов кальция в нейрон — лекарство оказывает свое нейропротективное действие, снижая общий электрический «шум» в сигналах клетки. При альцгеймеровской деменции, помимо глутамат-опосредованных проблем, снижается уровень ацетилхолина — нейромедиатора, участвующего в таких процессах как память, обучение и внимание. В связи с этой особенностью болезни Альцгеймера психиатры и неврологи используют для лечения ингибиторы ацетилхолинэстеразы, фермента, который разрушает ацетилхолин в синаптической щели. Использование этой группы лекарств увеличивает содержание ацетилхолина в мозге и нормализует состояние пациента [5]. Специалисты рекомендуют совместное назначение мемантина и ингибиторов ацетилхолинэстеразы для более эффективной борьбы с деменцией при болезни Альцгеймера [6]. При совместном применении этих препаратов происходит воздействие сразу на два механизма развития болезни (рис. 4).
Деменция — это растянутое по времени поражение головного мозга, при котором гибель нейронов происходит медленно. А бывают заболевания, приводящие к быстрому и большому по объему поражению нервной ткани. Эксайтотоксичность — важный компонент повреждения нервных клеток при инсульте. По этой причине при нарушениях мозгового кровообращения применение мемантина может быть оправданно, однако исследования на эту тему только начинаются. В настоящее время есть работы, проведенные на мышах, где показано, что назначение мемантина в дозе 0,2 мг/кг в день уменьшает объем поражения мозга и улучшает прогноз инсульта [7]. Возможно, дальнейшие работы на эту тему позволят усовершенствовать терапию инсультов у людей.
Голоса в голове
Шизофрения — это еще одно заболевание, при котором воздействие на глутаматную систему мозга является новым и перспективным направлением терапии. В настоящее время главной причиной развития шизофрении считают нарушение дофаминовой передачи в мозге. Избыток дофамина в одних частях нервной системы приводит к бреду и галлюцинациям, а недостаток в других — к апатии, подавленности и отсутствию побуждений. Нейролептики — лекарства, блокирующие дофаминовые рецепторы — хорошо справляются с галлюцинациями и бредом, но с другой группой симптомов возникают проблемы. Ограниченность клинического эффекта нейролептиков указывает на то, что в развитие шизофрении могут быть вовлечены другие нейромедиаторные системы.
Если глутаматная система задействована при шизофрении, то можно проверить это даже на здоровых людях. Если здоровым испытуемым вводить препараты, блокирующие действие глутамата (кетамин, амфетамин), то у них развиваются симптомы шизофрении [8]. Введение кетамина больным шизофренией приводило к повторному возникновению психоза с повторением типичных для пациента симптомов, то есть кетамин вызывал не «просто психоз», а возвращал галлюцинации и бред, которые были раньше [9]. Это противоречие двух гипотез усложняет и без того непростую картину нейробиологических основ шизофрении. Психотическую симптоматику при введении кетамина можно объяснить его способностью влиять и на дофаминовые рецепторы. Другим объяснением может быть то, что дофаминовые и глутаматные нейроны способны оказывать влияние на полосатое тело. Эта часть мозга активно задействована в «производстве» галлюцинаций [10].
Самые частые галлюцинации у пациентов с шизофренией — слуховые: больной слышит «голоса» в своей голове. Голос может ругать, комментировать происходящее вокруг, в том числе и действия пациента. У одной из моих пациенток «голоса» читали вывески магазинов на улице, где она шла; другая услышала, как голос произнес: «Получишь пенсию, и пойдем в кафе». В настоящее время существует теория, объясняющая возникновение таких голосов. Представим, что пациент идет по улице. Он видит вывеску, а мозг автоматически «прочитывает» ее. При повышенной активности в височной доле, отвечающей за слуховое восприятие, у пациента возникают слуховые ощущения. Они могли бы подавляться за счет нормальной работы участков лобной коры, но этого не происходит из-за снижения их активности (рис. 5). Избыточная активность слуховой коры может быть вызвана гиперфункцией глутаматной (возбуждающей) системы или дефектом ГАМКергических структур, отвечающих за нормальное торможение в мозге человека. Вероятнее всего, недостаточная активность лобной доли в случае шизофрении также связана с нарушением нейромедиаторного баланса. Рассогласованность действий приводит к тому, что человек начинает слышать «голоса», которые явно соотносятся с окружающей обстановкой или передают его мысли. Очень часто свои мысли мы «проговариваем» в голове, что тоже может быть источником «голосов» в мозге человека, больного шизофренией [11].
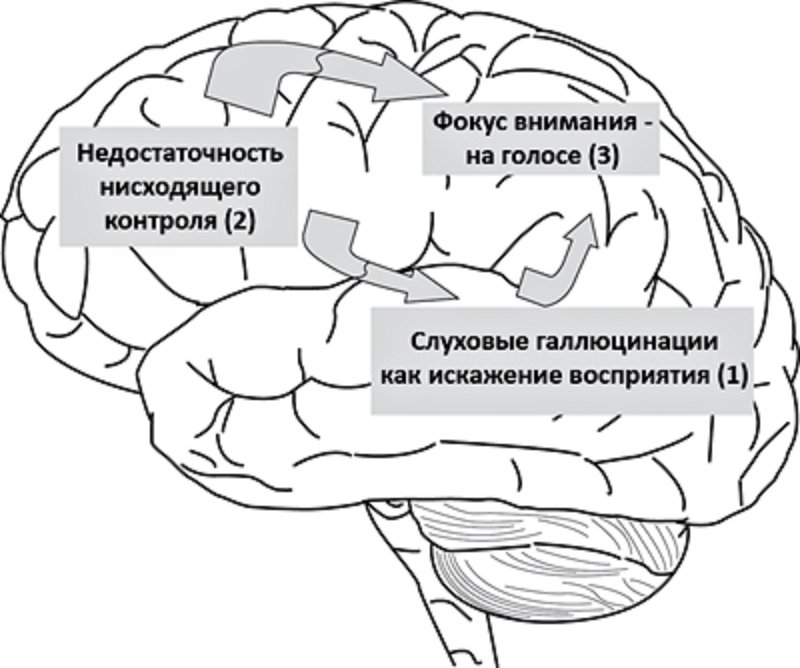
Рисунок 5. Возникновение слуховых галлюцинаций в мозге пациента с шизофренией. Первичное ощущение от автоматического «прочтения» вывесок или при возникновении мыслей, локализованное в височной коре (1), не подавляется лобной корой (2). Теменная кора (3) улавливает возникший паттерн активности в головном мозге и смещает на него фокус активности. В итоге человек начинает слышать «голос».
На этом наше путешествие в мир нейромедиаторов закончено. Мы познакомились с мотивирующим дофамином, успокаивающей γ-аминомасляной кислотой и еще четырьмя героями нашего мозга. Интересуйтесь своим мозгом — потому что, как гласит название книги Дика Свааба, мы — это наш мозг.
Литература
- Brian S. Meldrum. (2000). Glutamate as a Neurotransmitter in the Brain: Review of Physiology and Pathology. The Journal of Nutrition. 130, 1007S-1015S;
- Дофаминовые болезни;
- Lav R. Varshney, Beth L. Chen, Eric Paniagua, David H. Hall, Dmitri B. Chklovskii. (2011). Structural Properties of the Caenorhabditis elegans Neuronal Network. PLoS Comput Biol. 7, e1001066;
- Сеунг С. Коннектом. Как мозг делает нас тем, что мы есть. М.: Бином, 2014 — 440 с.;
- Молекула здравого ума;
- Chris G. Parsons, Wojciech Danysz, Andrzej Dekundy, Irena Pulte. (2013). Memantine and Cholinesterase Inhibitors: Complementary Mechanisms in the Treatment of Alzheimer’s Disease. Neurotox Res. 24, 358-369;
- Melissa Trotman, Philipp Vermehren, Claire L Gibson, Robert Fern. (2015). The Dichotomy of Memantine Treatment for Ischemic Stroke: Dose-Dependent Protective and Detrimental Effects. J Cereb Blood Flow Metab. 35, 230-239;
- John H. Krystal, Edward B. Perry, Ralitza Gueorguieva, Aysenil Belger, Steven H. Madonick, et. al.. (2005). Comparative and Interactive Human Psychopharmacologic Effects of Ketamine and Amphetamine. Arch Gen Psychiatry. 62, 985;
- A Lahti. (1995). Subanesthetic Doses of Ketamine Stimulate Psychosis in Schizophrenia. Neuropsychopharmacology. 13, 9-19;
- Benjamin Rolland, Renaud Jardri, Ali Amad, Pierre Thomas, Olivier Cottencin, Régis Bordet. (2014). Pharmacology of Hallucinations: Several Mechanisms for One Single Symptom?. BioMed Research International. 2014, 1-9;
- Kenneth Hugdahl. (2015). Auditory hallucinations: A review of the ERC “VOICE” project. WJP. 5, 193;
- Kenneth Hugdahl. (2009). Left temporal lobe structural and functional abnormality underlying auditory hallucinations. Front. Neurosci.. 3.





