Зачем клетки стареют
04 декабря 2015
Зачем клетки стареют
- 6750
- 0
- 12
Один из признаков живых организмов — способность поддерживать гомеостаз, или постоянство своего состава. Почему со временем они теряют эту способность?
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Старение клеток, в отличие от старения организма, представляет собой важный и нужный процесс. В этой статье рассказывается, как благое намерение клеточного сообщества слаженно жить в составе организма со временем приводит к такому вредному явлению, как старение живых существ. А также о том, как с этим вредным явлением можно бороться.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая статья о механизмах старения и долголетия» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
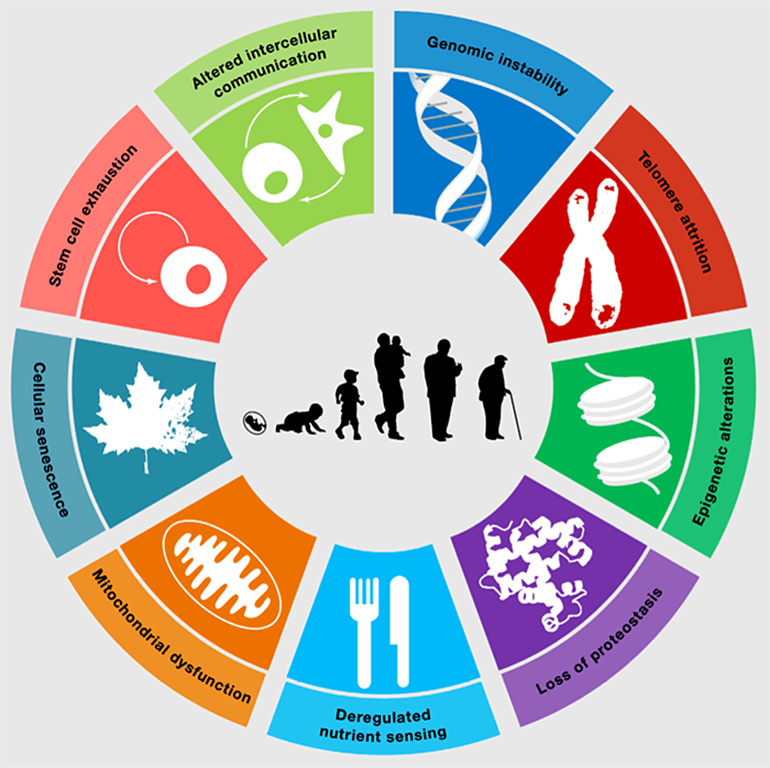
Старение клеток — это не то же самое, что старение организма. В великом и могучем английском языке для обозначения этих понятий даже используют разные слова: aging — для старения организма, а senescence — для клеточного старения. Так избежать путаницы намного проще. Senescence — это механизм, отсеивающий неблагонадежные клетки, которые с большой вероятностью могут стать раковыми. У голых землекопов, знаменитых практически полным отсутствием старения на уровне организма (aging), а также устойчивостью к раку, система клеточного старения (senescence) работает очень активно и эффективно, безжалостно отсеивая все клетки, в которых происходит нечто хоть немного подозрительное [1]. Проявление старения на уровне организма — это не прямое следствие старения поврежденных клеток. Старый организм не состоит из клеток с признаками клеточного старения, в нём лишь выше их доля. Например, у молодых мышей доля клеток с признаками senescence — 8%, а у очень старых особей эта доля растет приблизительно до 17% [2]. В некоторых органах — например, сердце, скелетных мышцах и почках — доля клеток с признаками клеточного старения в течение жизни вообще не растет, хотя сами эти органы с возрастом, несомненно, работают хуже. Следовательно, старение организма сложнее суммы старений его отдельных клеток (рис. 1), и происходит оно не в последнюю очередь благодаря тонким нарушениям регуляции межклеточных взаимодействий. К сожалению, без понимания запутанных клеточных отношений и сложных перемен, которые они вызывают в отдельных клетках, в старении не разобраться.
Открытие голых землекопов и некоторых других видов животных без выраженного старения уже какое-то время наводит ученых на мысль, что старение — это не следствие накопления организмом повреждений, а генетическая программа, которая хоть и работает в большинстве живых организмов, но всё-таки не является обязательной . Такой оптимистичный взгляд предполагает, что однажды людям удастся найти способ отключить программу старения, которая нам больше ни к чему. Некоторые исследования подтверждают идею о том, что с возрастом в организме не накапливается несовместимых с молодостью повреждений.
Вообще, теорий старения на разных уровнях организации живой материи — от молекулярного до популяционного, да еще с разнящимися объяснениями эволюционных закономерностей и механизмов — несколько сотен. И далеко не все они конфликтуют друг с другом, поскольку могут концентрироваться на разных уровнях или рассматривать старение под разными углами. Словосочетание «накопление повреждений» разными группами биологов/геронтологов тоже понимается по-разному, но, пожалуй, основной логический «оппонент» теории программируемого старения (и смерти) — концепция, полагающая, что организмы — если уж говорить о программах — запрограммированы скорее на выживание, чем на смерть. А старение — результат сбоя этой программы, связанный с действием на организм множества внешних и внутренних факторов, — но это уже отсылает к другим теориям старения, не программным. — Ред.
Во-первых, еще в 1958 году Джону Гёрдону удалось вырастить здоровую и плодовитую лягушку, добавив в яйцеклетку ядро соматической клетки взрослого животного [3]. Как оказалось, за время жизни взрослой особи ее генетический материал не накопил повреждений, которые помешали бы развитию здорового животного «с нуля». И, что важнее, любые изменения ДНК — унаследованные или возникшие за время жизни лягушки — удалось обратить, фактически обнулив возраст генетического материала. В обнулении «часов» клеток вообще нет ничего противоестественного — ведь оно происходит при каждом зачатии, когда из двух половых клеток достаточно зрелых людей получается зародыш нулевого возраста.
Во-вторых, ряд экспериментов демонстрирует, что клетки можно вернуть в «более молодое» состояние, если поместить их в «более молодую» среду — культивировать в сыворотке крови молодого животного или соединить кровеносные системы молодой и старой особей [4]. Примечательно, что в последнем случае исследованные клетки молодого животного, подключенного к кровеносной системе старого, по ряду признаков стали «старше». Это означает, что состояние клеток во многом определяется средой, в которой они находятся, и в крови и других внеклеточных субстанциях как старых, так и юных животных содержатся факторы, влияющие на проявления возраста.
Наконец, изобретение способов генетического перепрограммирования специализированных клеток в плюрипотентные внушает большой оптимизм: ведь если возможно вернуть специализированную клетку к состоянию стволовой, вполне может существовать способ менее фундаментального перепрограммирования клеток, возвращающего их «часы» не к нулю, а лишь на некоторое время назад [5].
Тем не менее у оптимистичной концепции старения как генетической программы есть некоторые слабые места. Во-первых, странно думать, что природа снабдила подавляющее большинство животных программой старения просто для того, чтобы они гарантированно не задерживались на этом свете. Большинство животных вообще не доживает до старости, и такой механизм гарантированной отправки на тот свет для них выглядит явно избыточным. Пример голых землекопов подтверждает, что программа старения животных не нужна ни для контроля за численностью (голых землекопов не становится слишком много из-за того, что они не стареют) , ни для усиления отбора и, как следствие, улучшения приспособленности животных (голые землекопы кому угодно дадут фору в приспособленности: они, например, научились бороться с раком, до чего другим животным еще очень далеко) [6]. Так зачем большинству животных могла бы понадобиться такая программа, без которой легко можно обойтись?
У голых землекопов численность популяции, видимо, ограничивается в основном за счет гибели особей раннего возраста (высокая младенческая смертность — нормальное для большинства видов явление). В колонии этих животных размножается только одна самка — королева, но делает она это довольно интенсивно, поэтому сложно сказать, ограничивает ли размножение «по лицензии» общую численность (в противном случае наверняка работали бы иные механизмы контроля рождаемости и расселения) и повлияло ли оно на закрепление отбором аномально высокой продолжительности жизни землекопов (а может, причинно-следственная связь была обратной, или ее и вовсе нет?). Так или иначе, землекопы смертны. И, судя по всему, даже стареют (дальнейшие наблюдения это уточнят), но по-своему — слишком уж отсроченно и совсем нетипично для млекопитающих, не проявляя признаков обычных старческих патологий. Обитание в защищенной подземной среде располагает к долгой жизни, а долгая жизнь предполагает выработку механизмов, противодействующих раку и прочим «возрастным» болезням. И специфика этой самой подземной среды когда-то определила, какими именно эти механизмы должны быть. — Ред.
Жертвы во благо коллектива
Жить в составе многоклеточного организма клеткам очень выгодно, но невозможно без жертв со стороны участников сообщества. Клетка как часть организма не может бесконтрольно расти и делиться, ведь так она рискует нарушить план строения и погубить не только себя, но и коллег по организму. Поэтому клетки многоклеточного организма подключены к сложной системе сигналов, которая указывает им, как жить, чтобы не вредить сообществу. Проявления «этикета» составляющих многоклеточного организма можно наблюдать даже у клеток, выращиваемых на чашках Петри: когда клетка касается другой клетки, она перестает расти [7].
К подчинению системе правил совместной жизни можно отнести и отсутствие фермента теломеразы в большинстве клеток организма. Копировать ДНК необходимо перед каждым клеточным делением, чтобы обеим дочерним клеткам достался наследственный материал. Но при каждом копировании молекулы ДНК неизбежно укорачиваются. У большинства клеток нет теломеразы, которая восстанавливает длину ДНК после ее удвоения, поэтому они могут поделиться лишь ограниченное число раз — пока ДНК их хромосом не укоротится до критической длины. Такое согласие на жизнь без теломеразы, с ограниченным числом возможных делений, тоже можно рассматривать как жертву клеток многоклеточного организма во благо сообщества.
Если система правил совместной жизни клеток нарушается, возникают опухоли — бесконтрольно делящиеся клетки, которым наплевать на план строения и которые заботятся только о собственном сиюминутном благосостоянии. Против такого саботажа у клеток организма есть защитные системы: в идеале каждая клетка должна жертвовать собой, если в ней начинаются процессы, которые могут привести к злокачественному перерождению. Например, из-за мутаций могут случайно активироваться гены, провоцирующие бесконтрольное деление или потерю специализации. Подобные подозрительные процессы и приводят к клеточному старению — остановке клеточного цикла и проявлению некоторых других характерных признаков. Например, старые клетки секретируют факторы воспаления, привлекающие к ним внимание клеток иммунной системы. Клеточное старение — это шанс исправить накопившиеся ошибки, после чего цикл, вообще говоря, может возобновиться. Поэтому на ранних стадиях старение обратимо, в том числе и экспериментально [8]. Но если постаревшая клетка не справляется с залечиванием повреждений, ее уничтожают клетки иммунной системы, пока она не превратилась в опухолевую и не причинила вреда организму.
Клеточное старение — это разумная система защиты от рака, и, как уже было сказано, у голых землекопов — почти не стареющих грызунов — эта система прекрасно работает. Недавно было обнаружено, что у голых землекопов образуется уникальный вариант белка, который останавливает клеточный цикл при старении: он представляет собой гибрид двух белков, которые могут и порознь выполнять эту функцию, — p15 и p16 [1]. Гибридный белок очень быстро и эффективно блокирует клеточный цикл подозрительных клеток, не давая раку никаких шансов. Что важно, те два белка, из половин которых собран гибрид, тоже нарабатываются, и их пропорции сложным образом зависят от тяжести стресса, которому подвергается животное. Получается, что клеточное старение голых землекопов не только мощное, но и гибкое: клетки этих животных благодаря сложным системам регуляции наработки разных форм блокаторов клеточного цикла дают каждой клетке — в зависимости от обстоятельств — правильное время на то, чтобы прийти в себя после стресса.
Еще одна особенность клеток голых землекопов — усиленное «чувство такта» [9]. Их клетки при контакте с соседями прекращают рост намного раньше клеток других животных. Получается, что голый землекоп — своего рода «сверхмногоклеточное», в котором системы правил совместной жизни клеток и отсеивания «мошенников» — раковых клеток — доведены до совершенства. И проявляется это в запуске клеточного старения везде, где оно действительно нужно.
Если клеточное старение — это такая хорошая защита от рака, почему у всех животных не развились такие мощные и эффективные его программы, как у голых землекопов? Ответ, видимо, кроется в том, что происходит в организме после уничтожения состарившейся клетки. Чтобы организм продолжал существовать в прежней форме, уничтоженные клетки необходимо заменять новыми, получившимися в результате деления стволовых. Стволовые клетки в идеале должны делиться постоянно, а стареть не должны. Для этого у них есть фермент теломераза, который поддерживает длину концов хромосом, из-за чего их ДНК после ряда делений не укорачивается. Кроме того, в череде делений стволовых клеток, как недавно выяснилось, каждая новая стволовая клетка оставляет себе лучшие клеточные компоненты, скидывая своей сестринской клетке, уходящей в специализацию, что похуже [10]. И всё-таки стволовые клетки нельзя полностью защитить от мутаций и накопления некачественных клеточных компонентов. В итоге они тоже стареют, пусть и не так, как специализированные клетки [11]. Старые стволовые клетки сохраняют способность к делению, но вот его скорость перестает быть оптимальной — клетки делятся либо слишком редко, либо, наоборот, слишком часто. В первом случае новых клеток образуется слишком мало, чтобы занимать вакансии, появляющиеся после удаления старых специализированных клеток. А если стволовые клетки делятся слишком часто, они не успевают восстанавливать ресурсы после каждого деления и просто перестают быть стволовыми. Из-за попыток сэкономить стволовые клетки и продлить себе жизнь и проявляется то старение, которое aging — на уровне организма.
Перегибы в работе полезных механизмов
Всё больше данных указывают на то, что старение — это не результат действия вредной программы, а следствие перегибов в работе механизмов, которые при умеренной активности приносят пользу. Под таким углом можно посмотреть на все механизмы, которые способствуют старению: накопление активных форм кислорода, ослабление передачи сигналов по инсулиновому пути, воспаление. В малых «дозах» всё это идет на пользу организму, но при злоупотреблении или нарушении баланса этих процессов эффект оказывается разрушительным. Притом не только для самόй клетки, но и для всего организма.
Активные формы кислорода (АФК) — побочный продукт процесса клеточного дыхания — склонны бурно реагировать со всем, что попадется на их пути. Несмотря на это, клетки, которые не любят, чтобы что-то пропадало даром, используют эти опасные молекулы в качестве сигнальных. Со стороны это решение выглядит примерно настолько же мудрым, как идея применять ядерные ракеты для доставки почты. К счастью, некоторые свежие научные работы опровергают первое впечатление о полностью безумном устройстве живых клеток. Да, АФК даже в малых дозах реагируют со всем, что попадется, и несут разрушение. Но небольшие разрушения вызывают восстановительные ответы, которые приводят клетку в тонус и заодно усиливают ее защиту против других потенциальных опасностей [12]. АФК в малых дозах можно сравнить с прививкой, которая должна активизировать иммунитет, но не должна быть по-настоящему опасной для организма.
И всё же, когда активных форм кислорода становится слишком много, они начинают вредить. Одна из первых действительно популярных теорий старения, разработанная в 50-х годах Дэнхемом Харманом, связывает старение именно с накоплением АФК [13]. Однако в наше время у этой теории в ее чистом виде остается всё меньше сторонников. Уже получено много данных о том, что само по себе большое количество активных форм кислорода не обязано приводить к старению. Например, у тех же голых землекопов АФК образуется много, а каких-то продвинутых систем защиты от этих молекул нет [14], [15]. Данные о том, что старение напрямую не связано с количеством образующихся активных форм кислорода, получены и для других видов животных [16], [17]. Тем не менее не приходится сомневаться, что накопление свободных радикалов усугубляет состояние клетки и ускоряет старение, если этому способствуют и другие факторы [18].
Похожим образом дело обстоит и с ослаблением передачи сигнала по инсулиновому пути, которое проявляется при старении клеток животных разных видов [19]. Молекулы инсулинового пути «чувствуют» количество питательных веществ и сигнализируют клетке, есть ли сейчас возможность запасать питательные вещества или придется, наоборот, расходовать ранее накопленное. Как уже было сказано, с возрастом активность этого пути снижается, и клетка начитает вести себя так, будто наступили голодные времена — сокращает затраты на рост и синтезы и менее активно делится. Раз этот эффект проявляется с возрастом, можно было бы ожидать, что после его «включения» у молодых животных начнется преждевременное старение. Как бы не так! Исследования показали, что постоянное подавление инсулинового сигналинга хорошо сказывается на состоянии животного и продлевает ему жизнь [20].
Противоречие здесь только мнимое: подавление инсулинового сигналинга — это в целом полезная реакция организма, которая оказывает тот же эффект, что и ограничение калорийности пищи, продлевающее жизнь и улучшающее здоровье животных самых разных видов. Если инсулиновый путь постоянно слегка подавлен, это, как и небольшие количества активных форм кислорода, оказывает на клетку тонизирующее влияние. А в процессе старения этот путь уже активно подавляется — главным образом для того, чтобы сэкономить стволовые клетки и продлить жизнь организма. Последствия на организменном уровне получаются далеко идущие — к примеру, снижается количество клеток иммунной системы, которые, помимо борьбы с инфекциями, важны для удаления уже состарившихся клеток [21]. Из-за этого с возрастом растет и доля старых клеток в организме, и предрасположенность к болезням.
На активность инсулинового пути ориентируется и знаменитый путь mTOR, влияющий на скорость синтеза белка, а также на ход клеточного цикла, исходя из количеств доступных питательных веществ. Ингибиторы mTOR, самый известный из которых рапамицин, увеличивают продолжительность жизни, в том числе здоровой, у самых разных видов живых существ [22–25]. Тем не менее активно подавлять такой важный путь опасно — достаточно вспомнить, что изначально рапамицин использовали в качестве иммуносупрессора [26]. Есть у него и другие побочные эффекты: ухудшение заживления ран, развитие катаракты и резистентности к инсулину, дегенерация семенников [27]. Всё это еще раз подчеркивает мысль, что нет никакого единственного вредного процесса, который можно подавить, чтобы покончить со старением. Механизмы, приводящие в конечном итоге к старению организма, полезны, но могут начать работать несвоевременно или с неподходящей интенсивностью, из-за чего и возникают неприятные последствия. Пытаться полностью отключить эти механизмы, чтобы победить старение, слишком опасно, так как они жизненно важны.
Еще один сопровождающий старение процесс, который сам по себе нужен, но при чрезмерном использовании только усугубляет ситуацию — это воспаление. Воспаление — способ привлечь внимание иммунной системы к части организма, где что-то пошло не так — например, возник очаг инфекции. Для этого клетки выделяют специальные факторы, которые ведут к расширению сосудов (чтобы клеткам иммунной системы было легче туда добраться), притоку крови (поэтому участки воспаления часто выглядят покрасневшими), а также к нашествию иммунных клеток, готовых разобраться с проблемой. Факторы воспаления входят в набор веществ, которые секретирует в кровь постаревшая клетка, а пути, связанные с воспалением, с возрастом клетки начинают работать активнее [11], [28]. Хотя направить иммунную систему к старой клетке необходимо, чтобы поскорее ее удалить, чрезмерное накопление таких клеток, пытающихся привлечь к себе внимание, приводит к системному воспалению — реакции на уровне всего организма. На этом фоне легко возникают многие старческие болезни: ревматоидный артрит, атеросклероз и миопатии, при которых слишком разбушевавшаяся иммунная система начинает уничтожать мышечные клетки. Что самое интересное, усиленное воспаление способствует тому, против чего и затевались все эти сложности с клеточным старением — развитию рака [29]. Механизмы этого эффекта сложны и еще не до конца исследованы, однако точно известно, что воспалительная среда способствует размножению опухолевых клеток. Возможно, так получается из-за частичного перекрывания воспалительных путей и пути ответа на стероидные гормоны, в результате чего опухолевые клетки воспринимают воспаление как еще один повод поделиться [30].
Наконец, само по себе клеточное старение можно рассматривать как полезный механизм, который тем не менее может сломаться во множестве разных мест и потому опасен. Действительно, тормозить развитие клеток, которые потенциально могут стать опухолевыми, очень важно. А небольшое повышение содержания белка p16 — основного эффектора клеточного старения — даже продлевает животным жизнь [31]. Но если процесс клеточного старения идет слишком активно, то старые клетки будут накапливаться быстрее, чем удаляться, что приведет к неприятным изменениям среды всего организма. Другая потенциальная проблема — что старые клетки будут удаляться достаточно активно, а заменяться новыми не будут, из-за чего могут возникнуть дистрофии. С другой стороны, повышенное рвение в замене старых клеток новыми приведет к стремительному истощению запаса стволовых клеток.
Как с этим жить
Проблемы, приводящие к старению организмов, серьезные, но решаемые (рис. 2). Например, можно помочь организму удалять клетки с признаками старения, чтобы они не накапливались и не выделяли в кровоток вредные факторы. Недавно ученым удалось получить линию мышей, у которых клетки, нарабатывающие один из основных маркеров старения — белок p16, — самоуничтожались, не дожидаясь появления клеток иммунной системы. Таким прямолинейным путем удалось значительно улучшить состояние мышей с прогерией (преждевременным старением) [32]. К сожалению, на здоровых грызунах таких экспериментов пока не ставили, но в целом результат работы обнадеживающий и интересный.
Проблема со стволовыми клетками тоже не кажется нерешаемой: как уже было сказано, их состояние можно улучшить, поместив их в более «молодую» среду, а значит, можно выделить факторы, которые помогут стволовым клеткам сохранять молодость. Улучшить регенеративные способности стволовых клеток удается и с помощью ингибирования инсулинового пути и пути mTOR [33], [34].
Борьбе с накоплением повреждений может помочь стимуляция систем репарации ДНК, а также шаперонных систем, исправляющих дефекты укладки белковых молекул [35], [36]. Кроме того, для своевременного удаления поврежденных белков полезно усилить работу убиквитин-протеасомной системы уничтожения белков (которая, кстати, у голых землекопов очень активна), а также системы аутофагии поврежденных органелл (активности которой, по некоторым данным, способствуют занятия спортом) [37–39]. Важным шагом на этом пути должно стать развитие способов целевого воздействия на нужную группу клеток — потому что некоторые воздействия понадобится прикладывать или только к стволовым клеткам, или только к специализированным, которые уже начали стареть. К примеру, то же воздействие на инсулиновый путь положительно влияет на функции стволовых клеток, но остальным клеткам организма было бы желательно сохранить возможность адекватно оценивать, как обстоят дела с питательными веществами. Благодаря точечному воздействию только на нужные группы клеток можно будет уменьшить побочные эффекты вмешательства в жизнь организма.
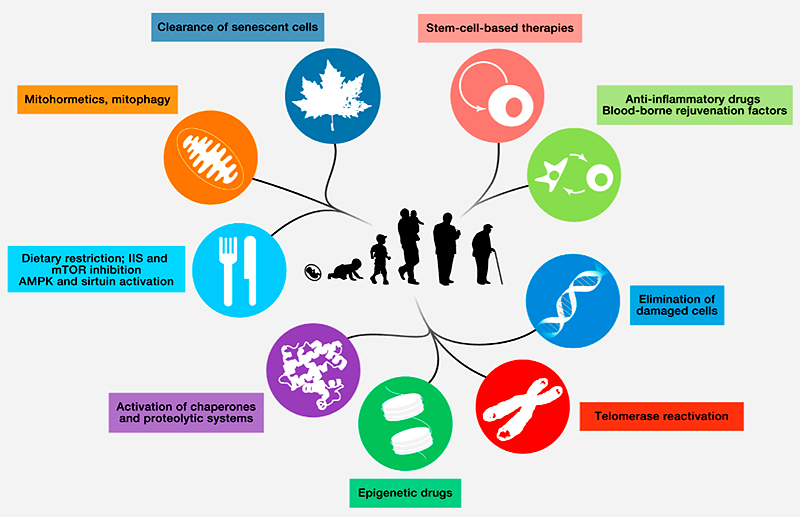
Рисунок 2. Идеи по устранению признаков старения организма.
Еще одно важное направление работы — это качественное улучшение систем клеточного старения, благодаря чему этот процесс шел бы именно в тех клетках, где нужно, и с «правильной» интенсивностью. Для этого нужно как можно подробнее исследовать системы регуляции клеточного старения голых землекопов — животных с самой эффективной и гибкой системой ответов на самые разные типы стрессов. Ведь именно благодаря способности очень точно определять, от каких клеток пора избавиться, а также быстрым и аккуратным механизмам их удаления, голым землекопам удается прожить свою жизнь в замечательно здоровом состоянии и без признаков старения на уровне организма. Другими словами, эти животные не скатываются в ненужное и вредное жмотничество своих стволовых клеток, потому что четко понимают, у каких клеток больше нет шансов оставаться нормальными участниками сообщества, и вовремя их уничтожают. Возможно, какие-то решения из этой системы удастся воплотить и в клетках других видов животных.
Живые клетки учились совместной жизни в составе организмов сотни миллионов лет. Со свойственной им прижимистостью они создавали системы коммуникации из подручных средств. Некоторые компоненты использовались для решения сразу многих задач, что привело к возникновению, с одной стороны, более тесной взаимосвязи разных параметров, благодаря которой клетки многоклеточного организма лучше понимают состояние всей системы, а с другой стороны, некоторых странных побочных эффектов, которые эволюции теперь сложновато распутать (например, воспаление, запускаемое для устранения старых клеток, способствует развитию опухолей, против формирования которых клеточное старение и направлено). Живые существа устроены не идеально, но не настолько безумно, чтобы автоматически начинать портиться со временем, если это не начало с ними происходить по внешним причинам. Не существует никакой бомбы замедленного действия, которую природа закладывает в бόльшую часть живых существ, чтобы они почаще сменяли друг друга. Есть не самые удачные инженерные решения, не очень аккуратные оценки собственных возможностей (клетки, которые не устраняются вовремя) и, конечно же, халявщики, пытающиеся паразитировать на сообществе (опухолевые клетки), с которыми организм обязательно должен бороться. Всё это — бытовые, в общем-то, проблемы, в которых нет ничего мистического, рокового или нерешаемого.
Литература
- Xiao Tian, Jorge Azpurua, Zhonghe Ke, Adeline Augereau, Zhengdong D. Zhang, et. al.. (2015). INK4locus of the tumor-resistant rodent, the naked mole rat, expresses a functional p15/p16 hybrid isoform. Proc Natl Acad Sci USA. 112, 1053-1058;
- Chunfang Wang, Diana Jurk, Mandy Maddick, Glyn Nelson, Carmen Martin‐Ruiz, Thomas Von Zglinicki. (2009). DNA damage response and cellular senescence in tissues of aging mice. Aging Cell. 8, 311-323;
- J.B. Gurdon. (1962). Adult frogs derived from the nuclei of single somatic cells. Developmental Biology. 4, 256-273;
- Irina M. Conboy, Michael J. Conboy, Amy J. Wagers, Eric R. Girma, Irving L. Weissman, Thomas A. Rando. (2005). Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature. 433, 760-764;
- Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126, 663-676;
- Jamila R. Sanchez, Sarah L. Milton, Kevin C. Corbit, Rochelle Buffenstein. (2015). Multifactorial processes to slowing the biological clock: Insights from a comparative approach. Experimental Gerontology. 71, 27-37;
- Википедия: Contact inhibition (англ.);
- Liesbeth C.W. Vredeveld, Patricia A. Possik, Marjon A. Smit, Katrin Meissl, Chrysiis Michaloglou, et. al.. (2012). Abrogation of BRAFV600E-induced senescence by PI3K pathway activation contributes to melanomagenesis. Genes Dev.. 26, 1055-1069;
- A. Seluanov, C. Hine, J. Azpurua, M. Feigenson, M. Bozzella, et. al.. (2009). Hypersensitivity to contact inhibition provides a clue to cancer resistance of naked mole-rat. Proceedings of the National Academy of Sciences. 106, 19352-19357;
- Чтобы клетка стала стволовой, ей должны достаться митохондрии поновее;
- Jason Doles, Mekayla Storer, Luca Cozzuto, Guglielmo Roma, William M. Keyes. (2012). Age-associated inflammation inhibits epidermal stem cell function. Genes Dev.. 26, 2144-2153;
- Ana Mesquita, Martin Weinberger, Alexandra Silva, Belém Sampaio-Marques, Bruno Almeida, et. al.. (2010). Caloric restriction or catalase inactivation extends yeast chronological lifespan by inducing H 2 O 2 and superoxide dismutase activity. Proc. Natl. Acad. Sci. U.S.A.. 107, 15123-15128;
- Википедия: «Свободнорадикальная теория старения»;
- Blazej Andziak, Rochelle Buffenstein. (2006). Disparate patterns of age‐related changes in lipid peroxidation in long‐lived naked mole‐rats and shorter‐lived mice. Aging Cell. 5, 525-532;
- Kaitlyn N. Lewis, Blazej Andziak, Ting Yang, Rochelle Buffenstein. (2013). The Naked Mole-Rat Response to Oxidative Stress: Just Deal with It. Antioxidants & Redox Signaling. 19, 1388-1399;
- In vivo — in vitro — in silico;
- Ryan Doonan, Joshua J. McElwee, Filip Matthijssens, Glenda A. Walker, Koen Houthoofd, et. al.. (2008). Against the oxidative damage theory of aging: superoxide dismutases protect against oxidative stress but have little or no effect on life span in Caenorhabditis elegans. Genes Dev.. 22, 3236-3241;
- Siegfried Hekimi, Jérôme Lapointe, Yang Wen. (2011). Taking a “good” look at free radicals in the aging process. Trends in Cell Biology. 21, 569-576;
- Наука рождает искусство;
- L. Fontana, L. Partridge, V. D. Longo. (2010). Extending Healthy Life Span--From Yeast to Humans. Science. 328, 321-326;
- Albert C Shaw, Samit Joshi, Hannah Greenwood, Alexander Panda, Janet M Lord. (2010). Aging of the innate immune system. Current Opinion in Immunology. 22, 507-513;
- R. W. Powers. (2006). Extension of chronological life span in yeast by decreased TOR pathway signaling. Genes & Development. 20, 174-184;
- Kailiang Jia, Di Chen, Donald L. Riddle. (2004). The TOR pathway interacts with the insulin signaling pathway to regulateC. eleganslarval development, metabolism and life span. Development. 131, 3897-3906;
- Pankaj Kapahi, Brian M Zid, Tony Harper, Daniel Koslover, Viveca Sapin, Seymour Benzer. (2004). Regulation of Lifespan in Drosophila by Modulation of Genes in the TOR Signaling Pathway. Current Biology. 14, 885-890;
- David E. Harrison, Randy Strong, Zelton Dave Sharp, James F. Nelson, Clinton M. Astle, et. al.. (2009). Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. 460, 392-395;
- Robert T. Abraham, Gregory J. Wiederrecht. (1996). IMMUNOPHARMACOLOGY OF RAPAMYCIN. Annu. Rev. Immunol.. 14, 483-510;
- John E. Wilkinson, Lisa Burmeister, Susan V. Brooks, Chi‐Chao Chan, Sabrina Friedline, et. al.. (2012). Rapamycin slows aging in mice. Aging Cell. 11, 675-682;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Lisa M. Coussens, Zena Werb. (2002). Inflammation and cancer. Nature. 420, 860-867;
- John A. Copland, Melinda Sheffield‐Moore, Nina Koldzic‐Zivanovic, Sean Gentry, George Lamprou, et. al.. (2009). Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue‐specific intervention possible?. BioEssays. 31, 629-641;
- Ander Matheu, Antonio Maraver, Manuel Collado, Isabel Garcia‐Cao, Marta Cañamero, et. al.. (2009). Anti‐aging activity of the Ink4/Arf locus. Aging Cell. 8, 152-161;
- Darren J. Baker, Tobias Wijshake, Tamar Tchkonia, Nathan K. LeBrasseur, Bennett G. Childs, et. al.. (2011). Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479, 232-236;
- Joe V. Chakkalakal, Kieran M. Jones, M. Albert Basson, Andrew S. Brack. (2012). The aged niche disrupts muscle stem cell quiescence. Nature. 490, 355-360;
- Ömer H. Yilmaz, Pekka Katajisto, Dudley W. Lamming, Yetis Gültekin, Khristian E. Bauer-Rowe, et. al.. (2012). mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake. Nature. 486, 490-495;
- Siobhán Q. Gregg, Verónica Gutiérrez, Andria Rasile Robinson, Tyler Woodell, Atsunori Nakao, et. al.. (2012). A Mouse Model of Accelerated Liver Aging Caused by a Defect in DNA Repair. Hepatology. 55, 609-621;
- Jin-Na Min, Ryan A. Whaley, Norman E. Sharpless, Pamela Lockyer, Andrea L. Portbury, Cam Patterson. (2008). CHIP Deficiency Decreases Longevity, with Accelerated Aging Phenotypes Accompanied by Altered Protein Quality Control. Molecular and Cellular Biology. 28, 4018-4025;
- Karl A. Rodriguez, Yael H. Edrey, Pawel Osmulski, Maria Gaczynska, Rochelle Buffenstein. (2012). Altered Composition of Liver Proteasome Assemblies Contributes to Enhanced Proteasome Activity in the Exceptionally Long-Lived Naked Mole-Rat. PLoS ONE. 7, e35890;
- Gang Liu, Jason Rogers, Coleen T Murphy, Christopher Rongo. (2011). EGF signalling activates the ubiquitin proteasome system to modulate C. elegans lifespan. EMBO J. 30, 2990-3003;
- David C. Rubinsztein, Guillermo Mariño, Guido Kroemer. (2011). Autophagy and Aging. Cell. 146, 682-695;
- Carlos López-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano, Guido Kroemer. (2013). The Hallmarks of Aging. Cell. 153, 1194-1217;
- Ergün Sahin, Ronald A. DePinho. (2012). Axis of ageing: telomeres, p53 and mitochondria. Nat Rev Mol Cell Biol. 13, 397-404.