Длина теломер и времена года
27 октября 2015
Длина теломер и времена года
- 1456
- 0
- 6
В определенные периоды года динамика длины теломер может меняться. В центре рисунка изображены концы хромосом с теломерами. Стрелка показывает направление течения времени, при котором длина теломер изменяется в ту или иную сторону.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Между живыми существами и окружающей средой постоянно происходят многочисленные взаимодействия. Однако отдельный организм находится в более зависимом положении от внешних условий, чем окружающая среда от жизнедеятельности этого организма. На разных уровнях организации живой материи такая зависимость проявляется по-разному. В этой статье речь пойдет о влиянии климатических условий в разные периоды года на изменение длины теломер животных и растений. Имеющиеся данные позволяют говорить о том, что теломеры можно рассматривать в качестве структур, чувствительных к переменам внешних факторов.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
В любой области нашей планеты условия окружающей среды непостоянны. Самым наглядным примером, конечно, являются области умеренного пояса, где наблюдаются четко различающиеся сезоны: весна, лето, осень, зима. Но в тропическом и субтропическом поясах также бывают неблагоприятные периоды (засуха или дожди), что, естественно, сказывается на жизнедеятельности организмов и на пищевых ресурсах. Чтобы переживать такие резкие перемены погоды и избегать голода, организмы выработали несколько стратегий. К ним относятся, во-первых, поражающие воображение миграции животных (вспомним, например, удивительное перемещение антилоп в парке Серенгети (Африка) или перелеты полярных крачек). Другая стратегия заключается в изменении уровня метаболизма и количества потребляемой пищи. Самые крайние разновидности этой стратегии — спячка и оцепенение. К организмам с такой адаптацией относятся, например, сурки, хомяки, сони, ежи, летучие мыши, некоторые птицы, также к этой группе живых существ можно отнести листопадные деревья.
Так как перемена условий обитания влечет за собой мобилизацию большинства функций в организме, то, несомненно, это приводит к стрессу и может влиять на процессы, связанные со старением. В этом отношении полезно вспомнить о теломерах [1], ведь эти концевые структуры хромосом могут служить удобной моделью отслеживания изменений, которые происходят в разные сезоны года, так как их основные свойства — динамичность и чувствительность к переменам во внешней и внутренней среде. Уже показано, что изменения в длине теломер связаны как со стрессом, так и со старением [2–5]. И чем хуже внешние условия, тем нагляднее изменения в этих хромосомных структурах. В настоящее время существует достаточно работ, подтверждающих сезонную чувствительность теломер и их связь со стратегиями переживания или избегания неблагоприятных времен года.
Сезонные изменения в длине теломер у растений
Самым красивым событием осени является листопад, но за этой внешней красотой скрываются драматические изменения, происходящие в теломерной биологии клеток листа. Группа китайских ученых, исследуя возрастную динамику длины теломер у разных видов древесных растений, обнаружила резкое укорочение теломер в их листьях в период с сентября по октябрь (рис. 1) [6], [7]. Причем как молодые, так и многовековые особи реликтового дерева гинкго были подвержены такой динамике теломер, то есть это естественный постоянно повторяющийся процесс, не зависящий от возраста дерева, но зависящий от возраста листа. Листопад — это необходимая адаптация лиственных деревьев к сезонам засухи или холодов. Наблюдаемое укорочение теломер можно рассматривать как следствие взаимодействия внешних и внутренних факторов, которые запускают необратимые процессы в тканях листа (например, апоптоз). Температура и влажность окружающей среды здесь играют не последнюю роль, так же как уровни гормона этилена и активных форм кислорода.

Рисунок 1. Динамика длины теломер в период с апреля по октябрь у трех видов листопадных деревьев: гинкго (Ginkgo biloba L.) [5], ясеня (Fraxinus pennsylvanica Mars. var. Subintegerrima [Vahl.] Fern.) и ивы (Salix matsudana Koidz.) [6]. По оси ординат на графиках указаны значения длины теломер в парах нуклеотидов (п.н.).
Здесь интересно заметить, что влияние температуры на теломеры было выявлено также у таких простейших, как тетрахимены [8] и трипаносомы [9], а кроме того — у дрожжей Candida [10]. У тетрахимены, например, при повышении температуры культивирования длина теломер увеличивалась почти в три раза [8]. Теломеры и у этих организмов реагируют на изменение температуры окружающей среды, скорее всего, как на стрессовый фактор. Возможно, увеличение длины теломер является особым защитным механизмом.
Длина теломер у животных, впадающих в спячку
Продолжая говорить о влиянии сезонов на длину теломер, стоит обратить внимание на животных, впадающих в спячку. Интересные работы в этом направлении были проделаны на трех видах мелких грызунов — джунгарском хомяке [11], соне-полчке [12] и садовой соне [13]. Существуют данные о том, что маленькие впадающие в спячку грызуны имеют бóльшую максимальную продолжительность жизни и медленнее стареют, чем грызуны того же размера, не впадающие в спячку [14]. Хотя рекордсменом по продолжительности жизни среди грызунов, конечно, является голый землекоп, который живет до 30 лет и обладает особыми адаптациями к долгожительству [15]. При исследовании теломерной биологии грызунов, впадающих в спячку, было обнаружено, что как в периоды оцепенения, так и во время спячки длина теломер у них остается постоянной или даже увеличивается [11], [12], [13]. Это может говорить о замедлении процесса старения. Однако у садовой сони при пробуждении — когда происходит так называемое оттаивание, и температура тела повышается — происходит усиление метаболизма, которое опосредуется окислительным стрессом и укорочением теломер [13]. Несмотря на это, компенсация длины теломер в другие периоды жизни позволяет этим грызунам жить дольше. В отличие от сонь, голый землекоп, по сути, является пойкилотермным животным с низким уровнем метаболизма и не испытывает стресса, связанного с повышением обмена веществ. В фибробластах у землекопа и у близких к нему по образу жизни и некоторым молекулярным адаптациям слепышей была обнаружена активная теломераза, а укорочения теломер с возрастом не происходило [16], [17], [18].
У летучих мышей, впадающих в спячку, во всех анализируемых органах (печень, поджелудочная железа, почки, легкие, сердце) была выявлена более высокая активность теломеразы по сравнению с представителями того же отряда, но в спячку не впадающими [19]. У ранее упомянутых впадающих в спячку грызунов, скорее всего, теломераза тоже активна. Это может объяснять поддержание теломер у животных, предпочитающих переживать неблагоприятные условия во сне.
Сезонные изменения длины теломер у людей
Самым животрепещущим вопросом, наверное, является влияние смены сезонов на теломерную биологию людей. Удалось найти только одно исследование, проведенное в этом направлении [20]. Объектами исследования стали костариканцы. Для Коста-Рики характерны сильные сезонные различия: ежегодно в некоторых районах страны наступают периоды дождей. В анализ включили людей старше 60 лет. Оказалось, что в дождливый сезон их теломеры были значительно короче, чем в остальное время года (рис. 3). Если в райской Коста-Рике теломеры так реагируют на смену сезона, то можно только предполагать, что происходит с нашими теломерами, когда наступает русская осень и зима...
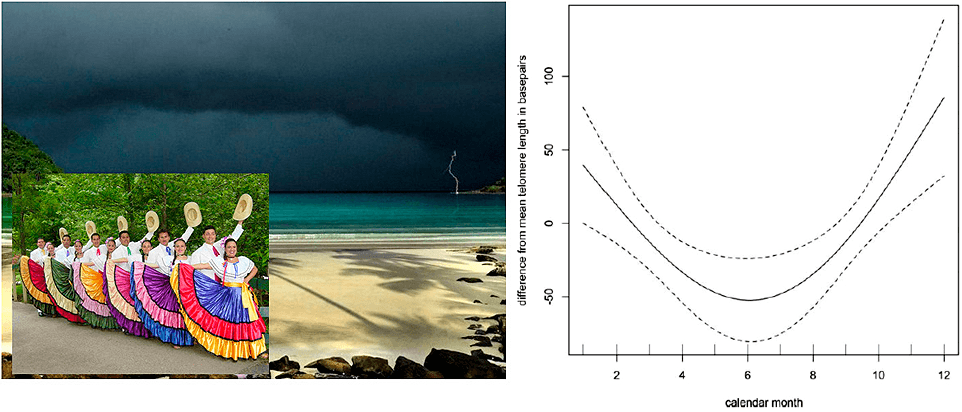
Рисунок 2. Сезонное изменение длины теломер у костариканцев. На графике видно, что наибольшее укорочение теломер происходит в июне (шестой месяц) [20].
Изменение длины теломер у птиц
Глобальные климатические изменения и даже тектонические процессы могут также оказывать влияние на теломеры. На примере чернохвостой чайки Larus crassirostris было показано, что изменения в динамике длины теломер у этой птицы могут быть объяснены такими явлениями, как Эль-Ниньо (2009/2010 гг.) и землетрясение (2010/2011 гг.). В первый временной период наблюдалась тенденция к увеличению длины теломер, а во второй — к сокращению, причем связи динамики теломер с возрастом выявлено не было (рис. 3) [21].
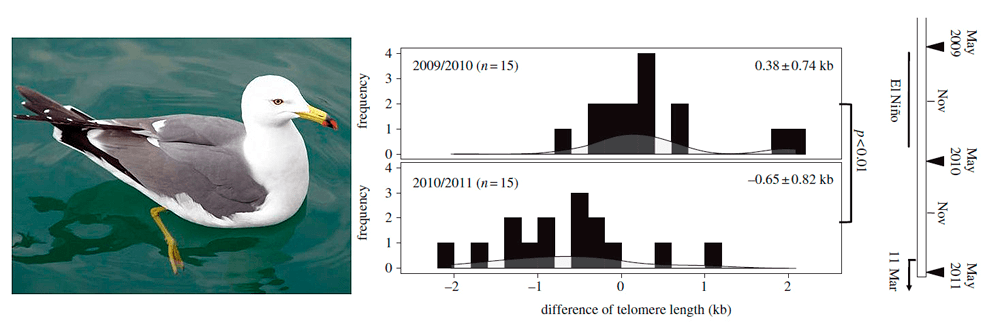
Рисунок 3. Изменения в длине теломер у чернохвостой чайки в зависимости от природных катаклизмов. На рисунке представлено частотное распределение темпов изменения теломер по годам наблюдения. Видно, что в период 2009/2010 гг. изменения в длине теломер сдвинуты вправо (увеличение), а в 2010/2011 — влево (укорочение). На шкале справа треугольниками показано время сбора образцов (в мае каждого года).
фотография с сайта Australian Wildlife, графики из [21]
Возможно, увеличение длины теломер было связано с тем, что период Эль-Ниньо был благоприятен для добывания корма: снижались энергетические затраты на поиск пищи, что благоприятно сказывалось на физиологии птиц. А вот сильное землетрясение и последующее цунами вызвали перераспределение пищевых ресурсов, что потребовало от чаек больших энергетических затрат, при которых длина теломер стала укорачиваться. Понятно, что такое влияние условий происходит через стрессовое состояние, которое неизбежно возникает у организмов при подобных катаклизмах.
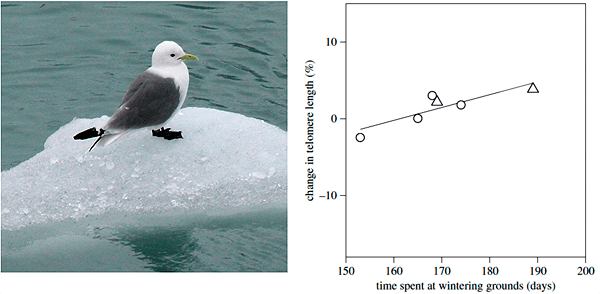
Стратегия избегания неблагоприятных условий путем миграции может быть наиболее выгодной в мире животных. Приспособления к длительным переходам или перелетам затрагивают многие структуры и функции организма, в том числе и теломеры. Исследование на обыкновенных моевках Rissa tridactyla показало, что перелет птиц в края зимовки оказывает положительное влияние на длину теломер (рис. 4) [22].
Это значит, что механизм поддержания длины теломер работает как одно из следствий адаптаций к стрессу. Перелеты на большие расстояния требуют от организма многих затрат, которые компенсируются изменениями в физиологии. Например, перед перелетом у птиц происходит накопление жира, в то же время обмен веществ замедляется. Это позволяет птицам расходовать энергию оптимально, уменьшать окислительный стресс и сохранять теломеры.
Влияние сезона на динамику теломер, конечно, не может быть прямым. При перемене климата происходит изменение всех физиологических параметров. Теломеры же могут рассматриваться как своеобразные точки пересечения молекулярных процессов, которые при этом происходят. Чувствительность этих структур хромосом к разным факторам делает их очень популярными в научной среде. И тот факт, что в мире все взаимосвязано, благодаря подобным исследованиям теломер приобретает новый оттенок.
Литература
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Houben J., Moonen H., van Schooten F., Hageman G. (2008). Telomere length assessment: biomarker of chronic oxidative stress? Free Radical Biology & Medicine. 44, 235–246;
- Idan Shalev, Sonja Entringer, Pathik D. Wadhwa, Owen M. Wolkowitz, Eli Puterman, et. al.. (2013). Stress and telomere biology: A lifespan perspective. Psychoneuroendocrinology. 38, 1835-1842;
- Jeyapalan J., Sedivy J. (2008). Cellular senescence and organismal aging. Mech. Ageing Dev. 129, 467–474;
- Старение — плата за подавление раковых опухолей?;
- Han Song, Di Liu, Xin Chen, Zehua Ying, Bo Zhang, et. al.. (2010). Change of season-specific telomere lengths in Ginkgo biloba L.. Mol Biol Rep. 37, 819-824;
- Ying Mu, Lan-fang Ren, Zhi-li Xun, Dan-dan Zhang, Han Song, et. al.. (2014). Sex- and season-dependent differences in telomere length and telomerase activity in the leaves of ash and willow. SpringerPlus. 3;
- Ahmed S., Sheng H., Niu L., Henderson E. (1998). Tetrahymena mutants with short telomeres. Genetics. 150, 643–650;
- Bernards A., Michels P., Lincke C., Borst P. (1983). Growth of chromosome ends in multiplying trypanosomes. Nature. 303, 592–597;
- McEachern M. and Hicks J. (1993). Unusually large telomeric repeats in the yeast Candida albicans. Mol. Cell Biol. 13, 551–560;
- Turbill C., Smith S., Deimel C., Ruf T. (2012). Daily torpor is associated with telomere length change over winter in Djungarian hamsters. Biol. Lett. 8, 304–307;
- Turbill C., Ruf T., Smith S., Bieber C. (2013). Seasonal variation in telomere length of a hibernating rodent. Biol. Lett. 9, 20121095;
- Sylvain Giroud, Sandrine Zahn, François Criscuolo, Isabelle Chery, Stéphane Blanc, et. al.. (2014). Late-born intermittently fasted juvenile garden dormice use torpor to grow and fatten prior to hibernation: consequences for ageing processes. Proc. R. Soc. B.. 281, 20141131;
- Turbill C., Bieber C., Ruf T. (2011). Hibernation is associated with increased survival and the evolution of slow life histories among mammals. Proc. Biol. Sci. 278, 3355–3363;
- Элементы: «Геном голого землекопа — ключ к секрету долголетия?»;
- Seluanov A., Chen Z., Hine C., Sasahara T., Ribeiro A., Catania K. et al. (2007). Telomerase activity coevolves with body mass, not lifespan. Aging Cell. 6, 45–52;
- Gomes N., Ryder O., Houck M., Charter S., Walker W., Forsyth N. et al. (2011). Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination. Aging Cell. 10, 761–768;
- V. Gorbunova, C. Hine, X. Tian, J. Ablaeva, A. V. Gudkov, et. al.. (2012). Cancer resistance in the blind mole rat is mediated by concerted necrotic cell death mechanism. Proceedings of the National Academy of Sciences. 109, 19392-19396;
- Wang L., McAllan B., He G. (2011). Telomerase activity in the bats Hipposideros armiger and Rousettus leschenaultia. Biochemistry (Mosc). 76, 1017–1021;
- Rehkopf D., Dow W., Rosero-Bixby L., Lin J., Epel E., Blackburn E. (2014). Seasonal variation of peripheral blood leukocyte telomere length in Costa Rica: a population based observational study. Am. J. Hum. Biol. 26, 367–375;
- Mizutani Y., Tomita N., Niizuma Y., Yoda K. (2013). Environmental perturbations influence telomere dynamics in long-lived birds in their natural habitat. Biol. Lett. 9, 20130511;
- Schultner J., Moe B., Chastel O., Bech C., Kitaysky A. (2014). Migration and stress during reproduction govern telomere dynamics in a seabird. Biol. Lett. 10, 20130889.