
Бактерии и ртуть
29 января 2024
Бактерии и ртуть
- 762
- 1
- 4
Некоторые бактерии способны обезвреживать токсичную ртуть с помощью специальных механизмов.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Бактерии — удивительные и по-настоящему уникальные организмы. Их можно найти практически везде: в воде, воздухе, в почве и других местах. А некоторые представители могут выживать в таких условиях, которые бы привели к неминуемой гибели других живых организмов. Так, существуют виды, обитающие при экстремальных температурах, например, в вечной мерзлоте и горячих источниках. Некоторые бактерии способны выдерживать пониженное или повышенное давление. А другие — противостоять действию высокотоксичных веществ, например, тяжелых металлов.
В этой статье мы разберемся, как бактерии могут противостоять действию токсичных веществ, смертельных для других организмов. Но для начала нужно понять, что такое тяжелые металлы и какую опасность они представляют.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Тяжелые металлы
Тяжелые металлы — группа металлов с плотностью выше 5 г/см3. К ним относят около 40 химических элементов. Например, ртуть, мышьяк, свинец, кадмий, цинк, хром, медь, сурьма, марганец, кобальт и другие. Они могут накапливаться в воде и почве, а реже — и в атмосфере. Среди этой группы встречаются элементы разной токсичности для разных организмов. Так, например, марганец и кобальт входят в состав фотосистем в электрон-транспортной цепи фотосинтеза растений.
Но большинство металлов этой группы все же высокотоксичны для значительной части живых существ. Опасность этих металлов в том, что без определенных систем обезвреживания они не могут быть удалены из организма. При попадании в живое существо они необратимо повреждают жизненно важные органы. Металлы накапливаются в организме и поддерживаются в экосистеме через пищевые цепочки. Первыми эти элементы получают растения из почвы через свою корневую систему, а дальше они передаются по цепочке консументам первого и более высоких порядков [1].
Рассмотрим подробнее один из особо токсичных металлов этой группы — ртуть.

Рисунок 1. Металлическая ртуть.
Ртуть — жидкий металл, относящийся к 12 группе таблицы Менделеева (рис. 1). Чаще всего в природе встречаются следующие формы: металлическая ртуть, неорганические соли Hg2+ или Hg+, а также их органические соли. [2] Этот элемент чрезвычайно опасен как для животных и растений, так и для человека.
Из-за того, что ртуть — это единственный известный жидкий металл, она обладает интересными свойствами, не характерными для других элементов. Так, она начинает испаряться уже при комнатной температуре. Сама металлическая ртуть не так токсична, как ее пары. Степень влияния паров ртути на организм зависит от их концентрации. Отравление происходит из-за того, что ртуть осаждается на альвеолах легких, окисляется и попадает в кровь в виде ионов этого металла через сеть капилляров. Это вещество нейротоксично и в первую очередь поражает нервную систему, серьезно нарушая все ее функции.
Известны причины токсичности ртути на молекулярном уровне. При попадании данного металла внутрь клетки происходит нарушение нативной структуры белковых молекул (например, ферментов), что, в свою очередь, приводит к их инактивации. Основная мишень для ртути — это сульфгидрильные (-SH) группы аминокислотных остатков цистеина, причем это относится как к эукариотическим, так и к прокариотическим клеткам. Интересно, что в эукариотических клетках ртуть с помощью таких взаимодействий может запускать каскад реакций, приводящий к апоптозу лимфоцитов [3]. Кроме того, еще один эффект действия ртути — повреждение структуры ДНК. Таким образом, этот металл приводит к одноцепочечным разрывам, которые плохо подвергаются репарации [4].
Неорганические соли ртути Hg+ менее токсичны, чем органические соли Hg2+ и пары металлической ртути [5]. Однако отравление ими тоже серьезно. Оно сопровождается изменением цвета слизистых оболочек и повреждением желудочно-кишечного тракта. В середине XX века люди не задумывались о возможной токсичности ртути и последствиях, к которым может привести отравление этим металлом. Так, соли ртути использовали при изготовлении некоторых продуктов, например, зубного порошка и кремов. Это приносило непоправимый вред здоровью людей. Интересно, что соединения ртути использовали и при изготовлении фетровых шляп. Это делало материал более мягким и удобным для использования. Так как этот металл сильно влияет на нервную систему, то часто шляпники сходили с ума. Тогда люди еще не знали, что виной всему этот токсичный металл. Таким образом, безумный шляпник, герой произведения Льюиса Кэрролла «Алиса в стране чудес» — человек, пострадавший от действия ртути (рис. 2) [6].

Рисунок 2. Безумный шляпник из «Алисы в стране чудес» Льюиса Кэролла.
Самыми опасными считаются органические соединения ртути. Их особенность в том, что отравление становится заметно не сразу, а через несколько недель. Эти вещества атакуют нервную систему, мозжечок и зрительную кору. Человек становится более раздраженным, появляются проблемы с концентрацией и быстрая утомляемость. Кроме того, они практически не выводятся из организма [5].
Как ртуть попадает в окружающую среду?
На Земле ртуть можно найти либо в месторождениях ртутных руд, либо в золотосеребряных и колчеданных месторождениях в качестве побочного продукта [7]. Ртуть попадает в биосферу в ходе различных природных процессов: извержений вулканов, геотермальной активности и эрозии почвы.
Загрязнения ртутью, конечно, происходят не только в результате естественных процессов, но и из-за деятельности человека. Ртуть является отходом на различных предприятиях химической промышленности. Так, пары ртути выделяются на различных этапах при переработке руд цветных (меди, цинка, свинца) и драгоценных металлов (золота и серебра), а также в процессе обогащения руды (то есть разделения металлов в зависимости от их химических или физических свойств). Ртуть обнаруживается и в бокситовой руде, которую используют для добычи оксида алюминия (глинозема), а также в угольных отложениях в следовых количествах [8]. Кроме того, ртуть выделяется при сжигании ископаемого топлива [9]. При попадании в атмосферу в виде пара ртуть окисляется до Hg2+ и осаждается в почве или водоемах.
В истории уже встречались глобальные загрязнения ртутью, которые привели к ужасным последствиям для всех живых существ.
В 1956 году в японском городе Минамата на побережье моря Сирануи начались вспышки неизвестной болезни. У всех пациентов обнаруживались сходные симптомы неврологического повреждения: затрудненность речи, конвульсии. Врачи долго не могли понять природу этого загадочного и страшного заболевания [10].
Кроме того, что все заболевшие жили в одном городе, их объединял еще один факт — их семьи занимались рыболовным промыслом. Тогда же местные жители заметили еще одну странность. Неизвестная болезнь поражала не только людей, но и кошек, которых они называли «танцующими». Из-за поражения нервной системы у животных начинались конвульсии, похожие на жуткий танец.
Тогда было выдвинуто предположение, что загадочная болезнь не несет инфекционный характер, а вызвана массовым отравлением каким-то веществом, накапливающимся в рыбе.
Рядом с городом находился завод по производству химических реактивов, сточные воды которого стекали прямо в море. В их составе обнаружили органические соединения ртути — метилртуть. Она является опаснейшим нейротоксином. Попадая в воду, ртуть в огромных концентрациях накапливалась в донных осадках и рыбе [10]. Интересно, что концентрация накапливаемой метилртути зависит от возраста, размера, типа питания и положения рыбы в трофической цепи. Таким образом, при переходе от одного звена цепи к следующему концентрация увеличивается почти в 5–10 раз. Это значение может быть выше содержания ртути в среде в сотни тысяч раз. Хищные рыбы, как самые крупные, долгоживущие и быстрорастущие накапливают наибольшее количество ртути. Таким образом, для каждого вида рыбы существует своя предельная концентрация этого вещества, превышение которой приводит к гибели [11].
Приведенный выше пример показывает, насколько опасной и токсичной является ртуть для живых существ. Так каким же образом некоторые бактерии могут выживать даже при содержании в огромных концентрациях этого смертельного вещества в среде?
Бактерии и ртуть
Бактерии научились по-разному справляться с различными токсичными веществами. Так, у микроорганизмов есть специальные системы генов, которые обуславливают их устойчивость к различным ионам. Можно выделить несколько стратегий по борьбе с токсичными веществами. Наиболее распространенный вариант — система выведения ионов из клетки с затратой энергии. В других случаях с помощью каскада ферментативных реакций происходит превращение вещества в менее токсичную его форму. Механизм устойчивости к ртути является по-настоящему уникальным, поскольку основан на системе транспортных белков, обеспечивающих перенос ионов токсичного металла не наружу, а внутрь клетки.
К ртути могут быть устойчивы как грамположительные, так и грамотрицательные бактерии [12]. Самая большая проблема таких высокотоксичных веществ в том, что они сразу начинают действовать на компоненты клетки и разрушать их. Из-за этого бактериям нужно обеспечить безопасную транспортировку металла к ферменту, который переведет его в менее токсичную форму.
Рассмотрим механизм устойчивости ртути на примере грамотрицательных бактерий, для которых он лучше всего изучен (рис. 3) [13]. Ртуть находится снаружи клетки в виде ионов Hg2+. Она проникает через клеточную мембрану посредством диффузии. После этого в периплазме тут же происходит связывание ионов с остатками цистеина белка MerP. Далее происходит перенос ионов ртути с двух остатков цистеинов этого белка на два свободных остатка цистеина белка MerT, локализованного на внутренней мембране. Таким образом, в этом процессе ионы металла переносятся внутрь клетки, причем это происходит без затрат энергии. Также на этом этапе существуют альтернативные варианты транспорта — через мембранные белки MerC или MerF. Далее по такому же механизму происходит передача ионов на ртутьредуктазу MerA. MerA представляет собой флавиноксидоредуктазу, состоящую из трех доменов. В центральном домене происходит перенос двух электронов с NADPH на Hg2+ через переносчик FAD. N-домен направляет Hg2+ к активному сайту MerA. Таким образом, ионы восстанавливаются до инертного металла, который впоследствии просто испаряется из клетки [14].
Эта описанная выше сложная система белков регулируется так называемым mer-опероном. Часто он располагается на плазмидах и может входить в состав различных транспозонов [15].
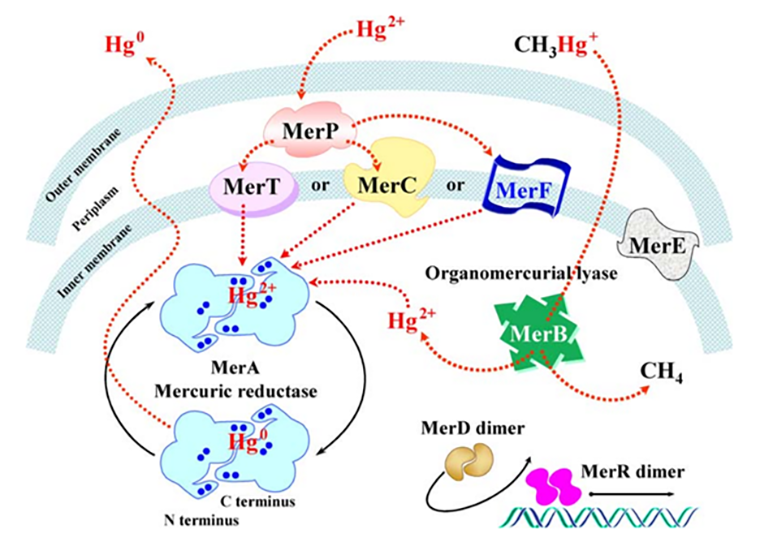
Рисунок 3. Транспорт и перевод ионов Hg2+ в инертную форму металла. После попадания в периплазму ионы Hg2+ связываются с белком MerP, далее через MerT (MerC и MerF участвуют в альтернативных путях транспорта) передаются на ртутьредуктазу MerA. Этот фермент восстанавливает Hg2+ до Hg0, после чего инертная форма металла просто испаряется из клетки. MerE — вспомогательный белок. MerB — органортутная лиаза, расщепляющая C—Hg связь. Это приводит к высвобождению ионов Hg2+ и связыванию их с MerA (присутствует не у всех бактерий). MerR и MerD — регуляторы транскрипции структурных генов mer-оперона.
В состав mer-оперона входят гены — одноименные с теми белками, которые они кодируют. К обязательным генам относятся merA, merT, merP, merC и merR. MerR играет важную роль в активации генов устойчивости, так как он является регулятором транскрипции. При появлении ионов ртути белок MerR меняет свою форму, что, в свою очередь, приводит к повороту и изгибанию ДНК. Этот процесс активирует транскрипцию вышеперечисленных генов. MerD —дополнительный регулятор транскрипции. Он связывается с участком ДНК вместе с MerR, играя вспомогательную роль в описанном выше процессе [16].
Ген merB относят к дополнительным, он характерен не для всех микроорганизмов [13]. Он участвует в регуляции экспрессии органортутной лиазы. Ее основная функция состоит в расщеплении связи C—Hg в таких соединениях, как фенилртуть или метилртуть, что приводит к высвобождению ионов Hg2+. Это нужно для того, чтобы ион мог свободно связаться с ферментом MerA. Опероны, несущие ген merB, называются оперонами широкого спектра, поскольку обеспечивают устойчивость как к неорганическим, так и органическим соединениям ртути [16].
Биоремедиация
Биоремедиация — процесс устранения загрязнений окружающей среды с помощью таких биологических объектов, как растения или микроорганизмы [17].
В случае микробной биоремедиации подбирается микроорганизм, способный обезвреживать нужный загрязнитель. Иногда используют генную инженерию для создания такого организма. Биоремедиацию можно проводить как путем внесения микроорганизмов прямо на место загрязнения (то есть in situ), так и в лабораториях (ex situ).
Микробная биоремедиация in situ достаточно выгодна с экономической точки зрения и благоприятна для окружающей среды. Штаммы, содержащие ртутные опероны, встречаются, например, среди бактерий следующих родов: Pseudomonas [18], Achromobacter [19], Acidithiobacillus [20] и других.
Deinococcus radiodurans — уникальная бактерия, устойчивая к радиации (рис. 4). Ученые с помощью генной инженерии смогли получить штамм, способный обезвреживать ионы ртути, переводя их в инертную форму металла. Этот организм можно использовать для очистки радиоактивных отходов от тяжелых металлов [21].
Рисунок 4. Deinococcus radiodurans — бактерия, устойчивая к радиации.
Среди рода Pseudomonas встречается много представителей, обладающих механизмом устойчивости к ртути. Так, к ним относятся, например, штаммы Pseudomonas putida (рис. 5). Они используются в биотехнологии, так как могут эффективно разлагать различные ксенобиотики. Проводили эксперименты, в которых бактерии использовались при очистке сточных вод от ртути. Через биопленки данного штамма пропускали сточные воды, содержащие различные концентрации ртути. Эксперимент показал, что бактерии перерабатывали до 90–95 % ртути, содержащихся в образцах сточных вод [22].
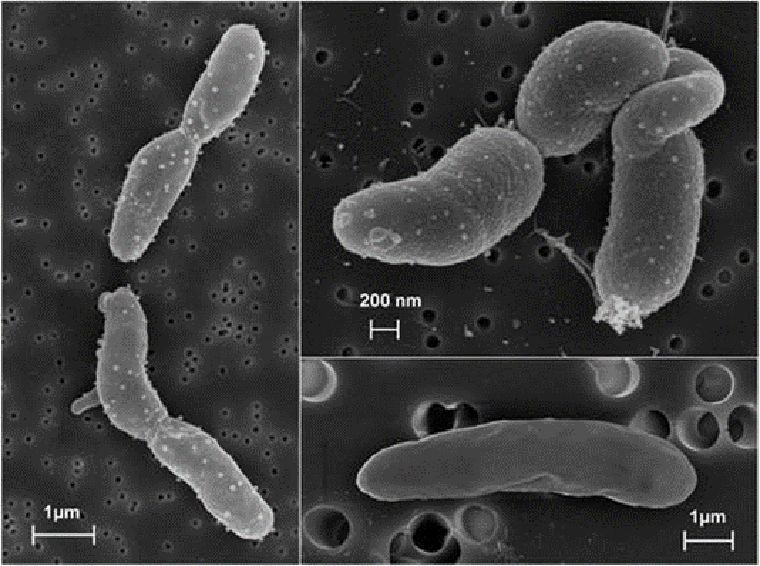
Рисунок 5. Сканирующая электронная микроскопия Pseudomonas putida.
Заключение
Ртуть — чрезвычайно токсичный элемент для многих живых существ. Загрязнения, вызванные этим металлом, приводят к разрушительным последствиям для окружающей среды. Однако некоторые бактерии обладают механизмами, способными противостоять этому веществу. Применение таких микроорганизмов в биоремедиации может быть очень перспективным.
Литература
- Sharma R.K., Agrawal M. (2005). Biological effects of heavy metals: an overview. J Environ Biol. 26, 301–313;
- Robin A. Bernhoft. (2012). Mercury Toxicity and Treatment: A Review of the Literature. Journal of Environmental and Public Health. 2012, 1-10;
- Арефьева А.C., Барыгина В.В., Зацепина О.В. (2010). Современные представления о влиянии соединений ртути на клеточном и системном уровне (обзор). Экология человека. 8, 35–41;
- Max Costa, Nelwyn T. Christie, Orazio Cantoni, Judith T. Zelikoff, Xin Wei Wang, Toby G. Rossman. (1991). DNA Damage by Mercury Compounds: An Overview. Advances in Mercury Toxicology. 255-273;
- NJ Langford, RE Ferner. (1999). Toxicity of mercury. J Hum Hypertens. 13, 651-656;
- Neville Grant. (1969). Legacy of the Mad Hatter. Environment: Science and Policy for Sustainable Development. 11, 18-44;
- James J. Rytuba. (2003). Mercury from mineral deposits and potential environmental impact. Env Geol. 43, 326-338;
- K. Grace Pavithra, P. SundarRajan, P. Senthil Kumar, Gayathri Rangasamy. (2023). Mercury sources, contaminations, mercury cycle, detection and treatment techniques: A review. Chemosphere. 312, 137314;
- Tamar Barkay, Susan M. Miller, Anne O. Summers. (2003). Bacterial mercury resistance from atoms to ecosystems. FEMS Microbiol Rev. 27, 355-384;
- Toshihide Tsuda, Takashi Yorifuji, Soshi Takao, Masaya Miyai, Akira Babazono. (2009). Minamata disease: Catastrophic poisoning due to a failed public health response. J Public Health Pol. 30, 54-67;
- Немова Н.Н., Лысенко Л.А., Мещерякова О.В., Комов В.Т. (2014). Ртуть в рыбах: биохимическая индикация. Биосфера. 6, 176–186;
- J D Helmann, Y Wang, I Mahler, C T Walsh. (1989). Homologous metalloregulatory proteins from both gram-positive and gram-negative bacteria control transcription of mercury resistance operons. J Bacteriol. 171, 222-229;
- Simon Silver, Le T. Phung. (2005). A bacterial view of the periodic table: genes and proteins for toxic inorganic ions. J IND MICROBIOL BIOTECHNOL. 32, 587-605;
- Patricia Giovanella, Lucélia Cabral, Fátima Menezes Bento, Clesio Gianello, Flávio Anastácio Oliveira Camargo. (2016). Mercury (II) removal by resistant bacterial isolates and mercuric (II) reductase activity in a new strain of Pseudomonas sp. B50A. New Biotechnology. 33, 216-223;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Hirak R. Dash, Surajit Das. (2012). Bioremediation of mercury and the importance of bacterial mer genes. International Biodeterioration & Biodegradation. 75, 207-213;
- Modupe S. Ayilara, Olubukola O. Babalola. (2023). Bioremediation of environmental wastes: the role of microorganisms. Front. Agron.. 5;
- Abd Aziz Bin Mohd Azoddein, Mani Malam Ahmad. (2016). A Bioremediation Approach to Mercury Removal in a Shake Flask Culture Using Pseudomonas putida (ATCC 49128). J Anal Bioanal Tech. 07;
- Shee Ng, Belinda Davis, Enzo A Palombo, Mrinal Bhave. (2009). A Tn5051-like mer-containing transposon identified in a heavy metal tolerant strain Achromobacter sp. AO22. BMC Research Notes. 2, 38;
- Yoshito SASAKI, Takahiro MINAKAWA, Atushi MIYAZAKI, Simon SILVER, Tomonobu KUSANO. (2005). Functional Dissection of a Mercuric Ion Transporter, MerC, fromAcidithiobacillus ferrooxidans. Bioscience, Biotechnology, and Biochemistry. 69, 1394-1402;
- Hassan Brim, Sara C. McFarlan, James K. Fredrickson, Kenneth W. Minton, Min Zhai, et. al.. (2000). Engineering Deinococcus radiodurans for metal remediation in radioactive mixed waste environments. Nat Biotechnol. 18, 85-90;
- H. von Canstein, Y. Li, K. N. Timmis, W.-D. Deckwer, I. Wagner-Döbler. (1999). Removal of Mercury from Chloralkali Electrolysis Wastewater by a Mercury-Resistant Pseudomonas putida Strain. Appl Environ Microbiol. 65, 5279-5284.







