Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?
15 апреля 2024
Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?
- 1732
- 0
- 9
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Болезнь Паркинсона — одно из самых распространенных заболеваний во всем мире. На 2019 год более 8,5 миллионов людей страдало данной болезнью, сейчас же цифра, скорее всего, возросла. До сих пор ученые не смогли до конца изучить все факторы возникновения этого заболевания, что делает болезнь актуальной проблемой для исследователей и врачей. Доказано, что болезнь Паркинсона возникает и развивается вследствие гибели дофаминергических нейронов в головном мозге. Гибель нейронов сопровождается появлением так называемых телец Леви, основным компонентом которых является патологическая форма белка альфа-синуклеина. В данной статье будут описаны основные признаки болезни Паркинсона, а также строение, функции и агрегации белка альфа-синуклеина.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Впервые данная болезнь была описана в мае 1817 года Джеймсом Паркинсоном в его книге «Эссе о дрожательном параличе» [1]. В ней он описал 6 разных людей, которых он заметил на улицах Лондона со скованностью в движениях и тремором. На протяжении 50 лет его работу никто не воспринимал всерьез, однако позднее благодаря таким неврологам, как Уильям Говерс, Сэмюель Вильсон, Вильгельм Эрб и Жан Шарко, описанные Паркинсоном патологии у людей были вынесены в качестве отдельного заболевания. В своих лекциях Жан Мартен Шарко часто подчеркивал, что описанная Джеймсом Паркинсоном болезнь имеет важное значение для неврологии, однако он отвергал термин «дрожательный паралич», так как не у всех людей с данным заболеванием был заметен тремор, поэтому он предложил заменить данный термин на более точную альтернативу «болезнь Паркинсона». Несмотря на его авторитет, термин «дрожательный паралич» использовался еще на протяжении многих лет, вплоть до ХХ века. После этого долгое время продолжались исследования, касающиеся данной болезни, и в 1919 году Константином Михайловичем Третьяковым было обнаружено, что болезнь сопровождается скоплением специфических клеточных включений (в дальнейшем — «тельца Леви») в черной субстанции среднего мозга. С 1950-х годов начались исследования, касающиеся биохимических изменений, возникающих вследствие болезни. В 1997 году был выявлен состав телец Леви, а позднее, в 2000 году шведский фармаколог Арвид Карлссон получил Нобелевскую премию за исследование нейромедиатора дофамина, который играет важную роль в возникновении и дальнейшем проявлении болезни.
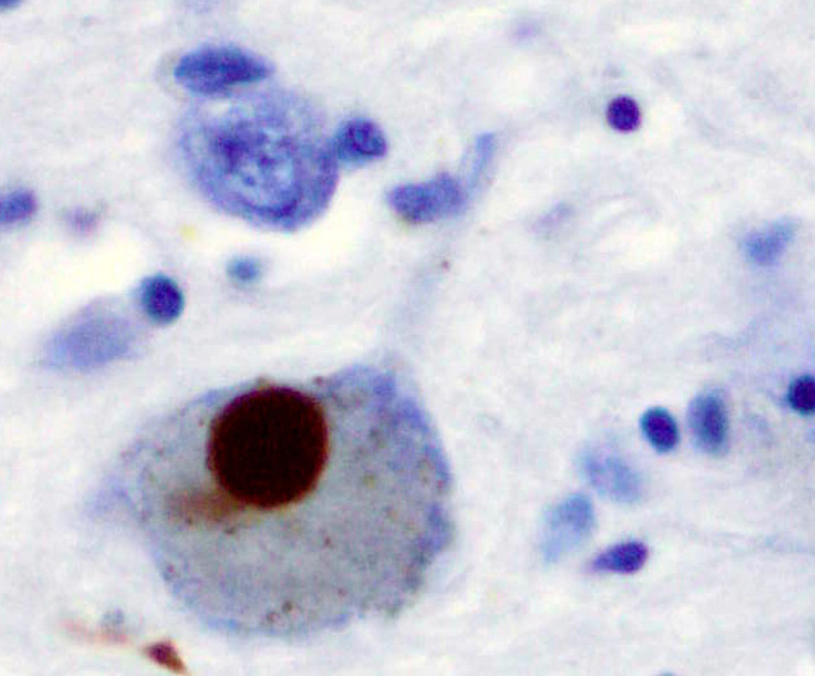
Рисунок 1. Тельца Леви.
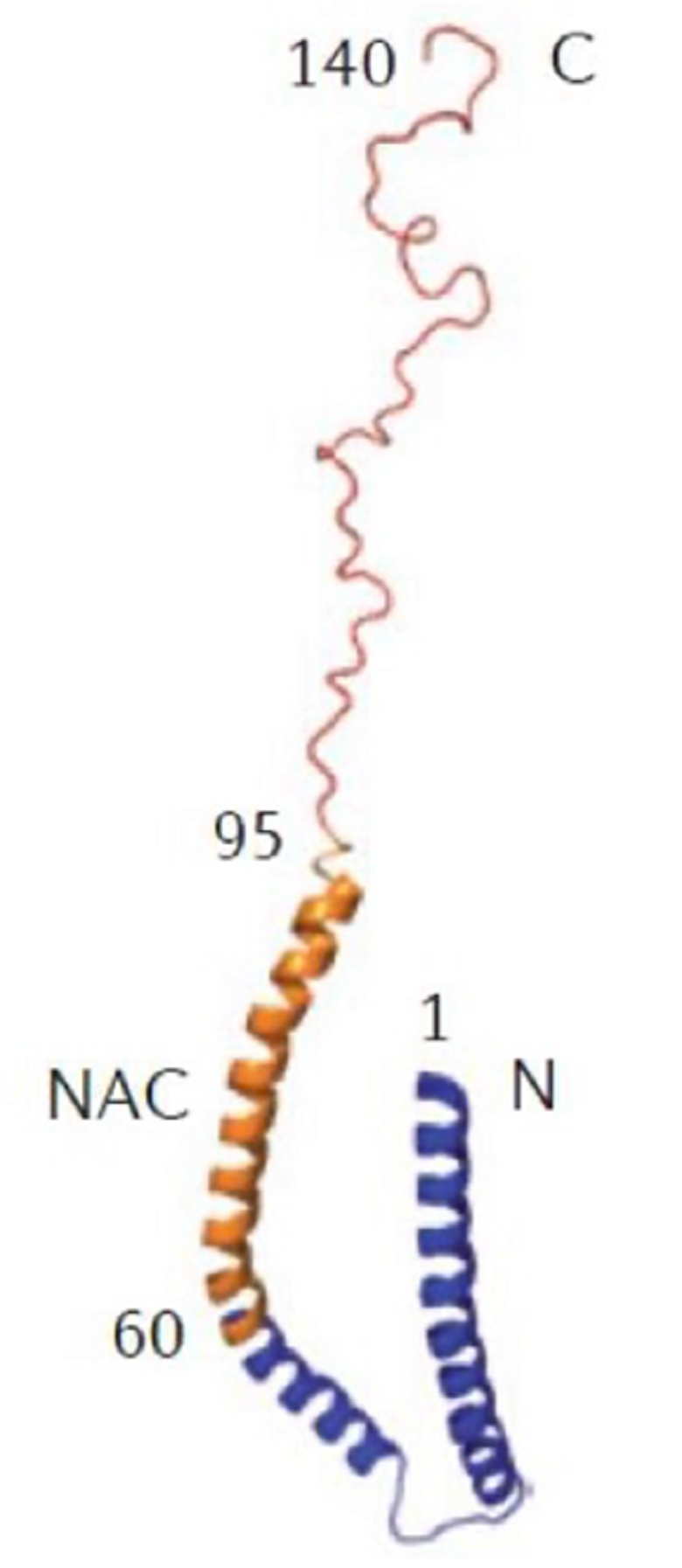
Рисунок 2. Структура белка альфа-синуклеина.
Болезнь Паркинсона — это заболевание, которое относится к классу синуклеопатий (группа нейродегенеративных заболеваний, возникающих из-за отложений патологических форм белков-синуклеинов в нейронах и глиальных клетках головного мозга). Основными признаками данной болезни являются треморы, ригидность (скованность движений частей тела из-за повышения мышечного тонуса) и брадикинезия (замедленность движений). В результате болезни Паркинсона гибнут дофаминергические нейроны черной субстанции среднего мозга, и сопровождается данный процесс появлением в цитоплазме телец Леви, образованных скоплением патологических форм белка альфа-синуклеина, который представляет собой основной биомаркер данного заболевания. Альфа синуклеин — это небольшой нейрональный пресинаптический белок, который кодируется геном SNCA, расположенным на длинном плече 4 хромосомы в локусе 4q21-22 и состоит из 140 аминокислот. Данный белок в основном располагается в черной субстанции среднего мозга, неокортексе и гиппокампе, а также, по неизвестным причинам, встречается в эритроцитах и тромбоцитах [2].
Болезнь Паркинсона в большинстве случаев начинает проявляться после 60 лет, и явные признаки становятся видны при гибели 50–60% нейронов черной субстанции мозга. Данная закономерность прослеживается в опыте группы исследователей под руководством Вивианы Градинару (Viviana Gradinaru) из Калифорнийского технологического университета [3]. В ходе эксперимента здоровым мышам вводился предшественник белка альфа-синуклеина — нить (протофибрилла), на которую в дальнейшем налипали другие молекулы белка, образовывая фибриллы. Данная нить вводилась в мышечную оболочку двенадцатиперстной кишки, так как, согласно данным, именно в кишечнике начинают появляться первые признаки болезни, и образовавшиеся в кишечнике патологические формы белка могут попасть в мозг по блуждающему нерву. У молодых мышей через 3 месяца появлялись проблемы с пищеварением, вес экскрементов становился меньше, а пик количества белка альфа-синуклеина в кишке приходился на 60-ый день после введения нити. Однако на 120-ый день количество белка не увеличивалось, а снижалось в несколько раз. Ученые предполагают, что это связано с тем, что у молодых особей активно работает фермент глюкоцереброзидаза, который помогает клеткам иммунной системы расщеплять внеклеточные скопления белка.
Соответствующую процедуру повторили на более пожилых мышах, и у них в стенках кишечника образовывалось большее количество белка альфа-синуклеина, а также после 120-го дня эксперимента у них продолжало ухудшаться состояние пищеварительной системы и моторная деятельность, а концентрация дофамина в головном мозге была ниже концентрации того же дофамина у молодых мышей в 3–4 раза. Данный эксперимент может показать не только то, что болезнь Паркинсона в большинстве случаев начинает развиваться в более пожилом возрасте вследствие меньшего количества фермента глюкоцереброзидазы, но и что концентрация дофамина может зависеть от концентрации белка альфа-синуклеина в клетке.
Свойства и функции белков зачастую определяются их строением. Что касается строения альфа-синуклеина, то здесь можно выделить 3 главные части: лизин-богатая аминоконцевая область, схожая с липид-связывающим доменом аполипротеинов, что указывает на то, что данная часть белка может связываться с билипидным слоем мембраны клеток; NAC (non-amyloid component) — гидрофобная центральная часть, известная как неамилоидный компонент, который был впервые выделен из амилоидных бляшек пациента с болезнью Паркинсона и является необходимым для фибрилляции белка (скручивание белка в фибриллу); С-концевой неупорядоченный участок, который заряжен отрицательно и участвует в регуляции ядерной локализации, а также взаимодействует с металлами и другими белками [5].
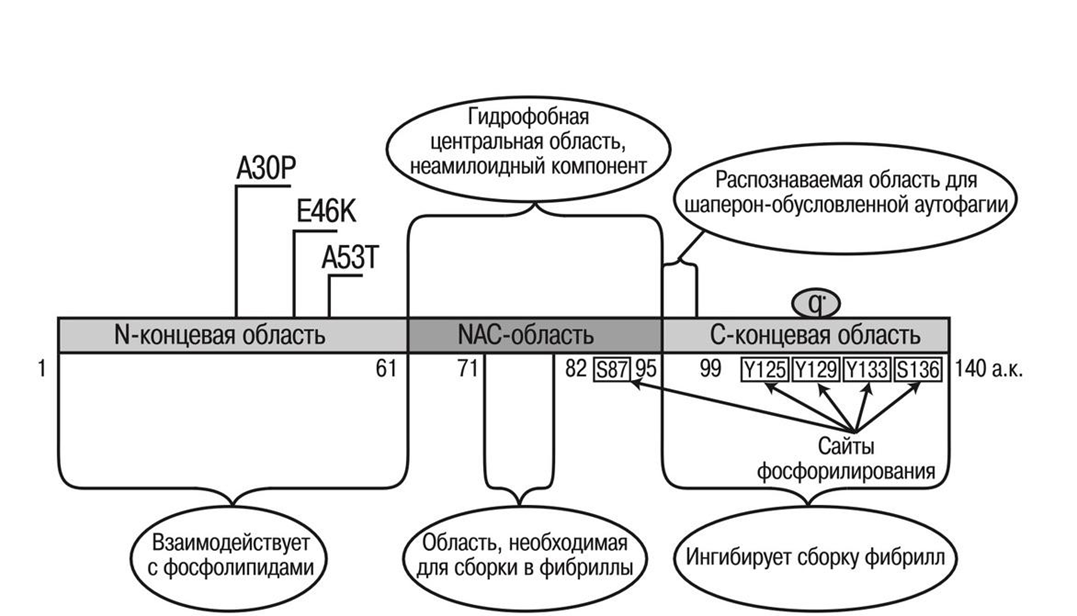
Рисунок 3. Строение белка альфа-синуклеина.
Функции нормальной конформации белка до конца не ясны, однако, учитывая, что белок расположен в пресинаптических окончаниях и что N-конец способен взаимодействовать с мембранами клеток, ученые предполагают, что данный белок участвует в регуляции везикулярного нейронального транспорта, а именно — регуляции поступления и выхода дофамина в нервных клетках посредством воздействия на комплекс SNARE — большую группу интегральных белков, управляющих слиянием внутриклеточных транспортных везикул с клеточной мембраной с дальнейшим высвобождением нейромедиатора в синапс.
Болезнь Паркинсона может быть как наследственной, так и спорадической, вызванной, к примеру, внешними факторами, такими как взаимодействие с нейротоксинами, а именно пестицидами. Также болезнь может развиться вследствие особенностей генома и системного метаболизма. Другим важным фактором является, как было указано ранее, возраст.
Наиболее распространенной наследственной формой болезни Паркинсона, которая приводит к развитию аутосомно-доминантной формы заболевания, является мультипликация гена SNCA. Может происходить дупликация (удвоение гена) и трипликация (утроение гена), причем проявление данных патологий происходит по-разному. При дупликации признаки болезни Паркинсона проявляются после 40 лет, а при трипликации это происходит в более раннем возрасте, а также протекает в более тяжелой форме. За счет мультипликации гена SNCA в черной субстанции среднего мозга обнаруживается большое количество растворимого альфа-синуклеина, а также образуются агрегаты данного белка. Как было упомянуто ранее, в тельцах Леви, обнаруживаемых при болезни Паркинсона, основным компонентом являются фибриллы белка альфа-синуклеина, которые образуются в несколько стадий: изначально имеются растворенные олигомерные формы белка, которые принимают сферические, кольцевые или трубчатые формы. Такие структуры называются протофибриллами (маленькие олигомеры, которые содержат бета-складчатую структуру), которые постепенно становятся нерастворимыми и потом объединяются в фибриллы. Собственно, весь данный процесс называется агрегацией белка альфа синуклеина.
Механизмы токсичности протофибрилл и фибрилл до конца не изучены, однако существует предположение, что нерастворимые фибриллы представляют собой как бы «куски арматуры», плавающие в цитоплазме и препятствующие протеканию различных процессов в клетке, что ведет к гибели дофаминергических нейронов в черной субстанции и развитию болезни Паркинсона. Также ученые предполагают, что агрегатная форма белка оказывает негативное влияние и на различные органеллы, и структуры клетки: альфа-синуклеин, взаимодействуя с митохондриями, способствует увеличению кривизны мембран митохондрий, а также их (митохондрий) фрагментации (дроблению); протофибриллы способны нарушать Ca2+ гомеостаз путем возможного образования пор в клеточной мембране, и так далее. Вследствие всего этого клетка начинает деградировать и в конце концов умирает.
Разберемся поподробнее с тем, что, как показывают исследования, происходит с митохондриями. Митохондрии — это полуавтономные органеллы, которые имеют собственную ДНК, кодирующую некоторые белки, а также свой собственный трансляционный аппарат. Однако часть митохондриальных белков кодируется ядерной ДНК и синтезируется на цитозольных рибосомах с N-концевыми сигнальными последовательностями, которые распознаются рецепторными белками в транслоказе внешней мебраны (TOM) — комплексе белков на внешней мембране митохондрий. Данный белковый комплекс состоит из 7 субъединиц, но нам важны только 3 субъединицы: Tom40, Tom20, Tom22. Белки Tom20 и Tom22 располагаются на внешней мембране митохондрий, образуя единый комплекс, и отвечают за распознавание поступающих в митохондрию препротеинов, необходимых для митохондрий. После того, как этот комплекс распознал белок, последний проникает в митохондрию через пору, образованную другим белком Tom40. Эксперименты показали, что накопление патологических форм альфа-синуклеина сопровождается нарушением работы митохондрий, а дисфункция митохондрий способствует накоплению большего количества альфа-синуклеина в клетке и его олигомеризации, но точные механизмы данных процессов не до конца известны [6]. Ученые предполагают, что альфа-синуклеин способен связываться с белком Tom20 и нарушать его работу, не давая ему связываться с белком Tom22 [7]. Вследствие этого нарушается процесс проведения белков в митохондрии, что способствует нарушению митохондриального дыхания, образованию большого количества АФК — активных форм кислорода, которые ведут к повреждению ДНК, особенно митохондриальной. Также альфа-синуклеин нарушает работу митохондрий, действуя на комплекс I электронно-транспортной цепи. Согласно исследованиям, альфа-синуклеин ингибирует комплекс I, что приводит к снижению дыхания и выработки АТФ, необходимых для нормального функционирования клетки [8], [9]. Это приводит к дисфункции митохондрий, ведущей к гибели клетки.
Экспериментальным путем было выявлено, что агрегатная форма белка альфа-синуклеина повышает концентрацию Ca2+ в клетке, что ведет к гибели клеток (эксайтотоксичность — оксилительный стресс). Ca2+ является вторичным мессенджером в клетках, концентрация которого в цитоплазме во много раз меньше, чем во внеклеточном пространстве. Данная разница в концентрациях помогает клеткам быстро реагировать на происходящие изменения и так же быстро к ним адаптироваться. Как было упомянуто ранее, в своей структуре альфа-синуклеин имеет лизин-богатую аминоконцевую область, которая по свойствам похожа на липид-связывающий домен аполипопротеинов, исходя из чего ученые делают предположения, что благодаря этому белок способен связываться с билипидным слоем мембраны клеток. Предположительно, при этом олигомеры альфа-синуклеина способны создавать Ca2+-поры в клеточной мембране, из-за чего образуется повышенный приток Са2+ в клетку, ведущий к нарушению гомеостаза и неминуемой гибели клеток [10].
Подводя итоги, можно сказать, что участие альфа-синуклеина в возникновении и развитии болезни Паркинсона подтверждается в ряде экспериментов, однако установить, какие точно агрегаты белка являются токсичными, невозможно. Поэтому можно только предполагать, что альфа-синуклеин представляет собой терапевтическую мишень при болезни Паркинсона. Одной из самых перспективных терапевтических стратегий лечения данного заболевания сейчас может стать создание небольших молекул, которые способны изменять конформацию протофибриллярных форм альфа синуклеина и делать их непатогенными.
Литература
- A. J. Lees. (2018). Some reflections on the lasting importance of James Parkinson's Essay on the Shaking Palsy. Z. nevrol. psikhiatr. im. S.S. Korsakova. 118, 75;
- Лыткина О.А. Сравнительный анализ функции альфа- и гамма-синуклеинов в синаптических везикулах: дис. канд. биол. наук. — Москва, 2014. — 120 с.;
- Collin Challis, Acacia Hori, Timothy R. Sampson, Bryan B. Yoo, Rosemary C. Challis, et. al.. (2020). Gut-seeded α-synuclein fibrils promote gut dysfunction and brain pathology specifically in aged mice. Nat Neurosci. 23, 327-336;
- Сенкевич К.А., Копытова А.Э., Усенко Т.С., Емельянов А.К., Пчелина С.Н. (2021). Болезнь Ааркинсона, ассоциированная с мутациями в гене GBA: молекулярные аспекты и возможные подходы к лечению. Acta Naturae (русскоязычная версия). 13, 70–78;
- Пчелина С.Н. (2011). Альфа-синуклеин как биомаркер болезни Паркинсона. Анналы клинической и экспериментальной неврологии. 5, 46–51;
- Minee L. Choi, Alexandre Chappard, Bhanu P. Singh, Catherine Maclachlan, Margarida Rodrigues, et. al.. (2022). Pathological structural conversion of α-synuclein at the mitochondria induces neuronal toxicity. Nat Neurosci. 25, 1134-1148;
- Roberto Di Maio, Paul J. Barrett, Eric K. Hoffman, Caitlyn W. Barrett, Alevtina Zharikov, et. al.. (2016). α-Synuclein binds to TOM20 and inhibits mitochondrial protein import in Parkinson’s disease. Sci. Transl. Med.. 8;
- A K Reeve, M HR Ludtmann, P R Angelova, E M Simcox, M H Horrocks, et. al.. (2015). Aggregated α-synuclein and complex I deficiency: exploration of their relationship in differentiated neurons. Cell Death Dis. 6, e1820-e1820;
- A. H. V. Schapira, V. M. Mann, J. M. Cooper, D. Dexter, S. E. Daniel, et. al.. (1990). Anatomic and Disease Specificity of NADH CoQ1 Reductase (Complex I) Deficiency in Parkinson's Disease. Journal of Neurochemistry. 55, 2142-2145;
- Plamena R. Angelova, Marthe H.R. Ludtmann, Mathew H. Horrocks, Alexander Negoda, Nunilo Cremades, et. al.. (2016). Calcium is a key factor in α-synuclein induced neurotoxicity. Journal of Cell Science.