
CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?
03 мая 2017
CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?
- 4194
- 0
- 5
Примерно так работает превращение Т-клеток в CAR-T in vivo.
рисунок автора статьи
-
Автор
-
Редактор
«Ученые вылечили рак», — будто нарочно сбежавшая из популярного мема фраза то и дело всплывает в средствах массовой информации. Восемь из десяти таких заметок в последние дни посвящены действительно очень мощному и интересному изобретению ученых — лимфоцитам с химерными рецепторами — chimeric antigen receptor T cells, или сокращенно CAR-T-клеткам.
Что же такое CAR-T-клетка ? В Т-лимфоциты с помощью вирусного вектора или плазмидной ДНК путем электропорации доставляют генетическую конструкцию, заставляющую лимфоцит экспрессировать химерный рецептор. Внеклеточная часть такого рецептора представляет собой scFv-фрагмент антитела и способна распознавать конкретную заданную мишень, а внутриклеточная часть — кусок внутриклеточной части Т-клеточного рецептора, которая активирует лимфоцит. Устройство CAR-T-клетки схематично показано на рисунке 1 на примере CAR-T, сконструированного против рецептора-мишени CD19. CD19 экспрессируется на поверхности всех В-клеток, в том числе и злокачественных клеток при В-клеточных лейкозах и лимфомах.
О CAR-T-клетках «биомолекула» ранее писала в статье «Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [1].
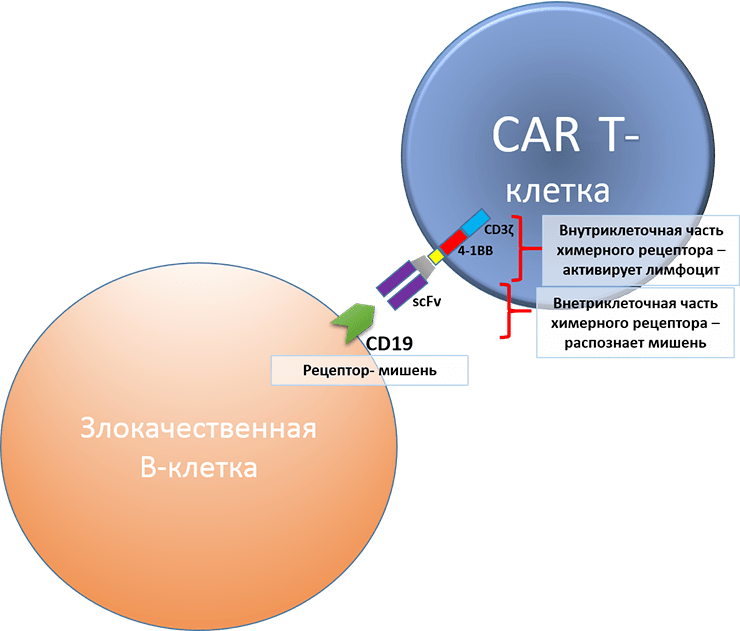
Рисунок 1. Устройство анти-CD19 CAR-T-клеток, применяющихся для терапии В-клеточных онкогематологических заболеваний.
Рисунок автора статьи
Традиционная схема получения CAR-T-клеток — это схема ex vivo: Т-клетки извлекают из периферической крови самих пациентов (в этом случае говорят об аутологичных клетках) или других доноров (аллогенные клетки), модифицируют с помощью вектора, несущего конструкцию с химерным рецептором, очищают, тестируют и вводят в пациента (рис. 2). Цикл производства требует весьма больших материально-технических и человеческих ресурсов, контроля качества и безопасности на каждом этапе и разрешения регулирующих органов, что делает такую терапию «бутиковой».
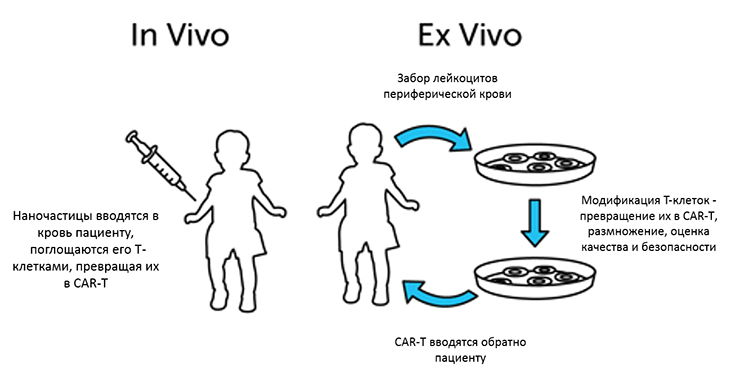
Рисунок 2. Методы клеточной терапии ex vivo и in vivo.
Gene therapy FAQs, рисунок адаптирован
Еще одна, вероятно, более важная проблема — сложность стандартизации терапии, которая не позволяет рассматривать CAR-T в качестве того агента, с которым можно производить полноценные мультицентровые исследования: разные центры могут использовать отличные друг от друга генетические конструкции химерных рецепторов, различные способы доставки этих генетических конструкций в ядро, руководствоваться разными дизайнами исследований. Получается, как в уравнении, в котором очень много переменных — даже, если терапия сработает шикарно, вы никогда не узнаете до конца почему.
Некоторые исследователи идут на хитрость — можно создать суперцентр, в котором централизовано делать CAR-T: вы присылаете им Т клетки пациентов, а они за две недели делают CAR-T, проверяют и отправляют вам обратно [2]. Получите, распишитесь — стандартная доза, стандартные кондиционирование-лимфодеплеция перед введением, стандартные критерии оценки эффективности и осложнений. Разумеется, схема хороша в случае сильных межцентровых коммуникаций, отсутствии проблем с доставкой и технической оснащенностью центров; она вполне реализуема, например, в пределах США. Но все равно это не идеал. «Фармакологический» идеал можно несложно измерить, долго и просто хранить, транспортировать без лишней головной боли, проводить с ним привычные фармакокинетические испытания и теоретически распространить на центры, лишенные развитой лабораторно-технической базы. Было бы проще, если можно было наделать CAR-T, засушить, расфасовать и продавать в порошке — мол, просто добавь воды в такой-то пропорции. Фантазии все это, да не совсем.
Авторы недавней статьи в Nature Nanotechnology [3] предложили альтернативу классической схеме получения CAR-T ex vivo — придумали наночастицы (рис. 3), которые способны производить CAR-T in vivo: при введении в кровоток эти наночастицы привлекают Т-клетки пациента и, заставляя экспрессировать химерный рецептор, превращают их в CAR-T. Для этого пришлось решить несколько очень интересных задач, с которыми исследователи блестяще справились.

Рисунок 3. Получение наночастицы, способной производить анти-CD19 CAR-T клетки in vivo. а — Схема наночастицы. На вставке — микрофотография наночастицы, полученная методом просвечивающей электронной микроскопии (шкала — 100 нм). Показаны схемы двух плазмид, инкапсулированных в наночастицы. Одна кодирует мышиный 194-1BBz CAR, другая — гиперактивную iPB7-транспозазу. б — Схема изготовления наночастиц. Чтобы увидеть рисунок в полном размере, нажмите на него.
Задача первая: наночастица должна найти T-клетку и проникнуть в нее путем эндоцитоза. Для этого наночастицу покрыли полиэтиленгликолем и функционализировали фрагментом анти-CD3 антитела. CD3 — это, как известно, маркер всех Т-клеток.
Задача вторая: генетическая конструкция, кодирующая химерный рецептор, из наночастицы должна попасть в ядро T-клетки. Для этого отрицательно заряженную плазмидную ДНК с генетической конструкцией мешали с положительно заряженным полимером PBAE 447, в который зашили пептиды, содержащие последовательность ассоциированного с микротрубочками белка (microtubule-associated sequences, MTAS) и сигнал ядерной локализации (nuclear localization signal, NLS), что обеспечивало быстрый транспорт генетического конструкта по «рельсам»-микротрубочкам к ядру и его беспрепятственное проникновение внутрь.
Задача третья: генетическая конструкция должна более-менее устойчиво экспрессироваться. Для этого ее нужно встроить в геном Т-клетки. Чтобы произошла интеграция, конструкцию фланкировали траспозонными последовательностями piggyBac и ввели в наночастицу дополнительную плазмиду, кодирующую гиперактивную траспозазу iPB7.
Наночастицы успешно протестировали на мышиной модели В-клеточного острого лимфобластного лейкоза и показали антилейкемическую активность и безопасность, не уступающую CAR-T, полученным традиционным способом — ex vivo.
Понятно, что представленная технология еще далека от клинического применения, но авторы выражают большую надежду на то, что она станет основой для сравнительно недорогого и широкодоступного применения CAR-T.
Литература
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Premal Lulla, Carlos A. Ramos. (2017). Expanding Accessibility to CD19-CAR T Cells: Commercializing a “Boutique” Therapy. Molecular Therapy. 25, 8-9;
- Smith T.T., Stephan S.B., Moffett H.F., McKnight L.E., Ji W., Reiman D. et al. (2017). In situ programming of leukaemia-specific T cells using synthetic DNA nanocarriers. Nat. Nanotechnol..





