Что будет, если человек попадет в ускоритель частиц, и при чем тут лечение опухолей?
17 марта 2022
Что будет, если человек попадет в ускоритель частиц, и при чем тут лечение опухолей?
- 1428
- 0
- 5
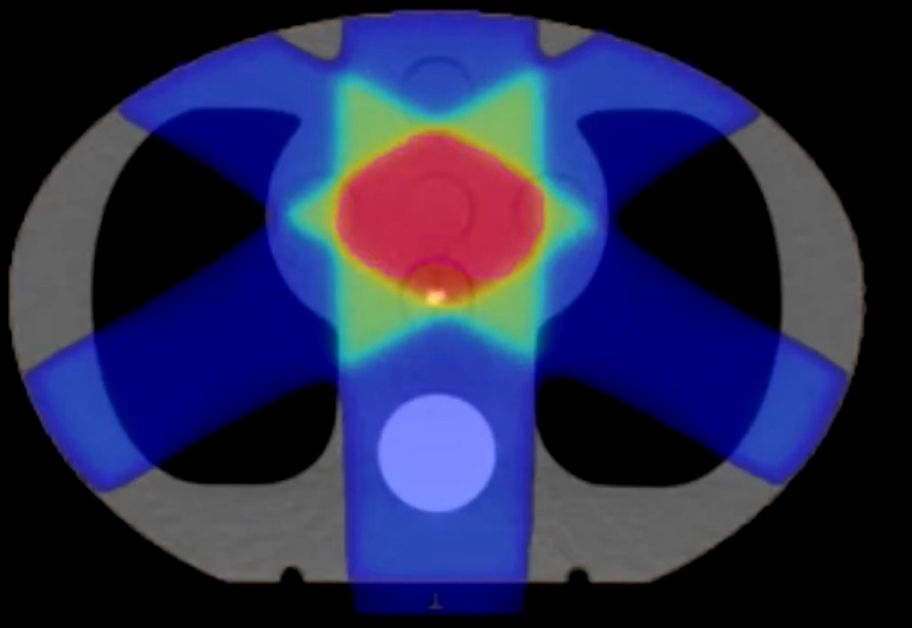
Художественная иллюстрация действия лучевой терапии на опухоль.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Терапия злокачественных новообразований — это длительный и тяжелый процесс, который требует от пациента невероятной стойкости духа. К сожалению, на сегодняшний день нет ни одного метода лечения, который был бы полностью безопасен для пациента. Принцип лечения онкологических больных можно сравнить с выжиганием поля: чтобы избавиться от сорняков, приходится сжигать все поле целиком, не разбирая, кто свой, а кто чужой. Выраженность побочных эффектов иногда заставляет прекратить терапию, и тогда пациент оказывается беспомощным перед своей болезнью. В данной статье мы разберем, какое решение предлагает современная наука.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Каждая клетка тела — это маленькая фабрика, в которой кипит производство. Все участники процесса с завидной точностью знают свои обязанности и четко их выполняют. Но даже в такой слаженной системе случаются поломки, и клетка превращается в неисправный завод с грудой сломанных деталей.
Самой важной молекулой в клетке является ДНК. Она бережно хранит информацию о всех процессах, которые должны протекать в нашем организме, и обусловливает нашу индивидуальность. Защита ДНК — основа нормального функционирования клеток. А повреждение ДНК происходит довольно часто: множество факторов способы привести к появлению мутаций (изменению последовательности нуклеотидов) или изменению структуры ДНК за счет появления разрывов или присоединения различных химических групп к нуклеотидам [1]. К таким факторам можно отнести химические вещества (алкилирующие агенты, полициклические ароматические углеводороды, ароматические амины), физические канцерогены (ультрафиолетовые лучи, ионизирующая радиация) и некоторые вирусы (онкогенные штаммы ВПЧ, вирус Эпштейна—Барр, вирус гепатита В и С) [2], [3].
Мутации возникают в здоровом организме практически каждый день. Однако системы репарации, существующие в клетке, быстро справляются со сбоем, восстанавливая правильную последовательность ДНК, и вновь возвращают ее к работе.
Но так происходит не всегда: иногда устранить дефект не удается, и тогда, чтобы сберечь гомеостаз организма, клетка благородно включает систему самоуничтожения. В этом случае реализуется одна из форм запрограммированной клеточной гибели — апоптоз [4].
Существует и другая линия защиты — иммунная система. Лейкоциты с помощью рецепторов на своей поверхности осматривают каждую клетку организма и вылавливают тех, кто несет опасность. Например, клетки, в которых находится вирус или повреждена ДНК. Ключевую роль в противоопухолевой защите играют цитотоксические CD8+ Т-клетки, способные непосредственно уничтожать опухолевые клетки [5].
По такому сценарию происходит гибель множества клеток каждый день нашей жизни. Но как бы ни была совершенна система защиты, полностью избежать ошибок невозможно. По различным причинам может произойти так, что «опасная» клетка не будет уничтожена, и тогда, словно снежный ком, в организме запустится рост опухоли. Такие клетки приобретают новые свойства и становятся бомбой, способной взорваться в любой момент.
В культовых статьях The Hallmarks of Cancer [6], Hallmarks of Cancer: The Next Generation [7] и Hallmarks of Cancer: New Dimensions [8] были обозначены ключевые признаки рака: неограниченный рост клеток, независимость от супрессоров клеточного роста, избегание иммунной системы, активация инвазии, немутационное эпигенетическое перепрограммирование и другие. Эти свойства помогают опухоли выживать и активно размножаться.
Когда собственные бойцы не справляются, на помощь организму приходят другие защитники: скальпель, лазер или особые молекулы, созданные в лаборатории. Терапия онкологических заболеваний развивается со стремительной скоростью. Но каждый метод лечения сопряжен с большим количеством побочных эффектов и сам по себе несет опасность для организма.
Луч, прожигающий опухоль
В проведении лучевой терапии нуждается около 50% онкологических пациентов. Облучение может использоваться с целью лечения или в качестве паллиативной терапии для облегчения симптомов, вызванных опухолью.
Лучевая терапия основана на применении ионизирующего излучения, которое названо так за счет своей способности отрывать электроны от атомов и придавать им заряд. Во время процедуры опухоль уничтожают с помощью энергии, которую несут фотоны, электроны или протоны. Оказавшись в клетке, они взаимодействуют с атомами и приводят к их возбуждению и ионизации. В результате в клетке формируются свободные радикалы, которые атакуют белки, липиды, а главное — ДНК, нарушая их структуру.
В этом существует некий парадокс: ионизирующее облучение за счет своей способности повреждать генетический материал относят к канцерогенным факторам [9], но в то же время, умелое обращение и научный подход позволили направить губительное действие излучения против опухолевых клеток и применять его в качестве терапии злокачественных новообразований.
В ходе лучевой терапии используются несколько типов ионизирующего излучения: чаще используют фотоны и электроны, реже — протоны. Основное различие заключается в характере распределения доставляемой ими дозы облучения (рис. 1) и эффективности поражения опухолевых клеток. Главная задача лучевой терапии — доставить максимум энергии в опухоль и минимум — в окружающие нормальные ткани, поэтому оптимальный вариант облучения во многом зависит от локализации опухоли.
Так, для электронов максимальная величина дозы облучения достигается вблизи поверхности облучаемого объекта. Они не проникают вглубь тканей и используются тогда, когда опухолевые клетки находятся на поверхности тела. Например, при метастатическом поражении кожи [10].
В отличие от них, фотоны способны проникать в глубокие ткани и достигать опухоль, расположенную в лёгком или предстательной железе. Они достигают опухоль, а затем продолжают свое движение. При этом максимальная доза облучения достигается вблизи точки входа. И, хотя по мере их продвижения величина дозы уменьшается, нормальные ткани вне опухоли также подвергаются облучению [11].
Протоны обладают иными свойствами. Для них доза облучения на поверхности минимальна. Максимальная величина приходится на так называемый пик Брэгга, глубина которого зависит от количества энергии пучка, а после достижения пика доза облучения резко падает. Таким образом, правильно подобрав энергию, можно направить пик прямо в область злокачественной опухоли, а ткани, находящиеся до или позади заданной точки, защитить от облучения.
Протоны используют в особых случаях. Например, в детской онкологии для лечения опухолей головного мозга, когда очень важно минимизировать количество энергии, доставляемой в крайне чувствительную к облучению здоровую ткань мозга [12], [13].
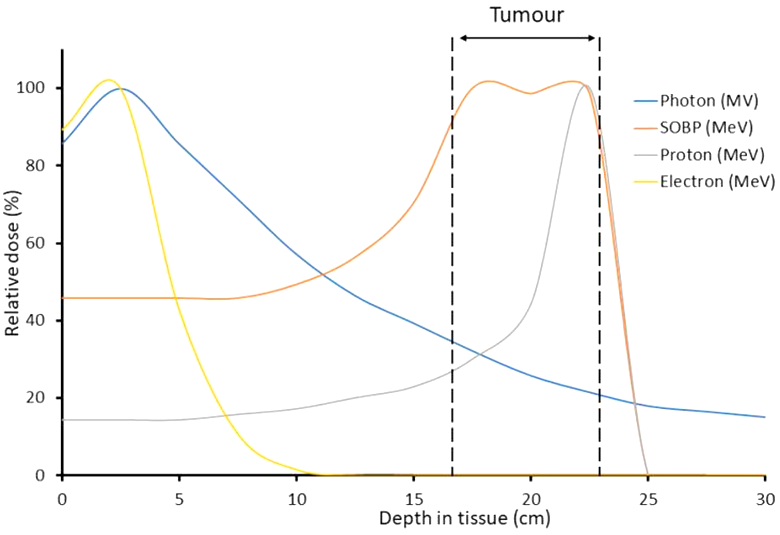
Рисунок 1. Сравнение распределения фотонов (синяя кривая), протонов (серая кривая) и электронов (желтая кривая) по глубине проникновения в ткани по отношению к опухоли-мишени. Также показан расширенный пик Брэгга (оранжевая кривая), искусственно созданный с помощью нескольких модулированных пучков протонов.
Для лучшего понимания проведем забавную аналогию. Если сравнить ионизирующее облучение с игрой Angry birds, фотоны были бы красными птичками, которые летят далеко, поражают цель и продолжают свое движение. А протоны были бы черной птичкой, которая взрывается в конкретной точке, а затем практически прекращает полет.
Лучевая терапия в действии
Энергия, направленная на любую клетку, приводит к повреждению многих структур, но основной мишенью является ДНК. Именно ее повреждение является ключевым механизмом патологического процесса.
Принято выделять прямое и опосредованное повреждение ДНК ионизирующим излучением. Прямое повреждение заключается в непосредственном воздействии на структуру ДНК, в результате которого происходит разрыв фосфодиэфирных связей, удерживающих нуклеотиды, повреждение азотистых оснований и появление сшивок молекул. Возникают однонитевые (повреждение одной цепочки) и двунитевые (повреждения обеих цепочек) разрывы ДНК.
Непрямое повреждение осуществляется за счет радиолиза воды, когда происходит разложение воды под влиянием ионизирующего излучения. Это приводит к образованию свободных радикалов и активных форм кислорода, которые, словно заведенные моторы, постоянно взаимодействуют с молекулами вокруг себя, повреждают их и нарушают метаболические процессы в клетке. Активные формы кислорода вызывают в клетке окислительный стресс, повреждают клеточные мембраны, белки и нуклеиновые кислоты [14].
Отличительной чертой ионизирующего излучения являются кластерные повреждения ДНК — множественные поврежденные участки, находящиеся в пределах одного или двух витков спирали [15].
Вся проблема радиотерапии состоит в том, что сам луч не способен различать нормальную и опухолевую клетку. Он повреждает все на своем пути. Чтобы воздействовать на опухоль, облучению придется подвергнуть нормальную ткань, окружающую опухоль. То есть в ходе лучевой терапии повреждения возникают как в опухолевых, так и в нормальных клетках. Почему же она продолжает использоваться в лечении?
Дело в том, что здоровая ткань обладает некоторым преимуществом. Приобретая бессмертие, опухолевая клетка жертвует многими нормальными функциями [16].
Например, теряет контроль над своим геномом, который становится нестабильным и еще более чувствительным к поломкам. Система репарации в злокачественных клетках работает плохо, а накопление большого количества мутаций приводит к невозможности дальнейшего существования клетки. В опухолевых клетках включаются механизмы запрограммированной клеточной гибели, такие как апоптоз и митотическая катастрофа [17].
В то же время, геном нормальных клеток защищен от ионизирующего излучения системами репарации: BER (Base Excision Repair — эксцизионная репарация оснований), NER (Nucleotide Excision Repair — эксцизионная репарация нуклеотидов, репарация одноцепочечных разрывов и более протяженных, чем при BER, повреждений одной цепи ДНК), MMR (Mismatch Repair, репарация ошибочно спаренных оснований), NHEJ (Non-Homologous and Joining — негомологичное соединение концов) и HR (Homologous Repair — гомологичная рекомбинация) [18–20].
Если дать клеткам время для восстановления, можно рассчитывать на то, что системы репарации исправят ошибки и позволят клетке восстановить функции.
Базовое представление о принципах лучевой терапии можно получить, рассмотрев рисунок 2 [21].
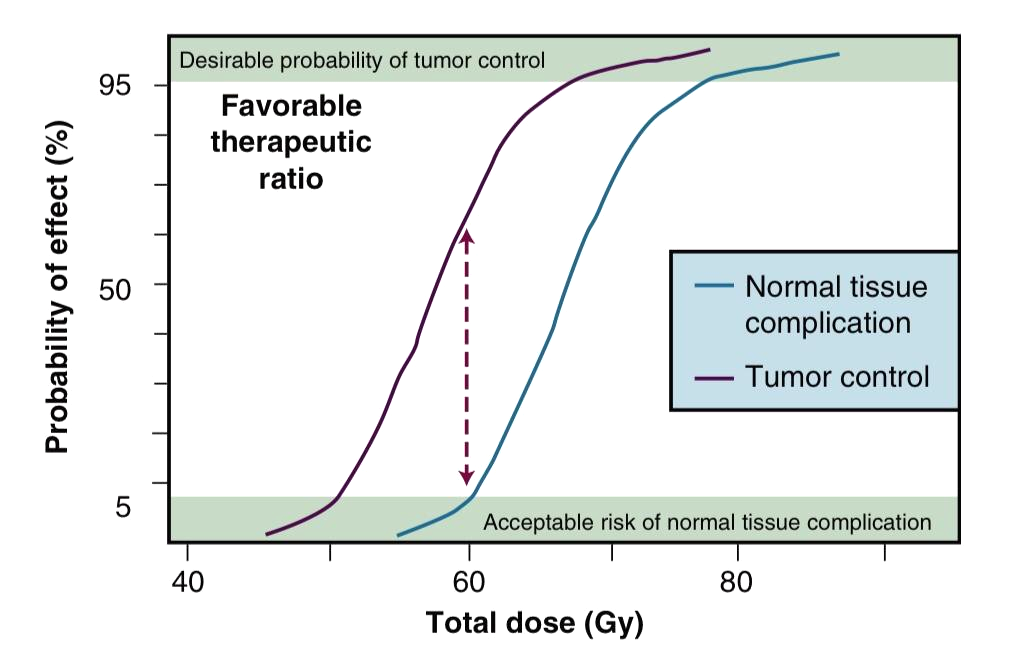
Рисунок 2. На графике представлены гипотетические кривые, иллюстрирующие влияние дозы облучения на эффект. Чтобы добиться контроля над опухолью (гибель клеток или остановка их деления), к очагу подводится определенная доза облучения (фиолетовая кривая). Однако вместе с опухолью воздействию подвергается и нормальная ткань, в которой могут возникнуть осложнения (синяя кривая). Опухолевые клетки и нормальные клетки обладают разной чувствительностью к лучевой терапии. Эту разницу называют терапевтическим выигрышем или интервалом (пунктирная стрелка). Чем больше интервал, тем больше вероятность того, что терапия убьет опухоль и сохранит жизнеспособность окружающих тканей.
Во время составления плана лечения подбор доз облучения является ключевым моментом. Врачи должны умело балансировать между максимальной пользой и минимальным вредом. С этой целью используются два направления: контроль дозы и четкая локализация опухоли.
В каждом конкретном случае для уничтожения каждой конкретной опухоли врачи рассчитывают оптимальную дозу облучения. Такая доза может составлять, к примеру, 70 Грей (суммарная очаговая доза). Однако сразу доставить всю дозу облучения к опухоли нельзя. Чтобы минимально повредить нормальные клетки, доза облучения за один сеанс обычно составляет 2 Грея (разовая очаговая доза). Используя простую математику, можно подсчитать, что для доставки к опухоли всей дозы облучения в 70 Грей необходимо 35 сеансов по 2 Грея.
Так работает фракционирование: на протяжении длительного времени опухоль облучают маленькими дозами, чтобы в итоге доставить дозу, необходимую для гибели всех опухолевых клеток. При этом перерыв между сеансами дает возможность нормальным тканям восстановить повреждения [22].
Другой способ уменьшить воздействие на нормальные ткани — использование нескольких полей облучения, которые сходятся в одной точке. Это необходимо, чтобы создать высокую дозу облучения в глубине тканей, при этом снизив нагрузку на окружающие нормальные ткани. Можно понять, как это работает, представив цирковую арену, освещаемую несколькими прожекторами (рис. 3). На ней самая яркая точка находится в месте пересечения света, а вокруг сохраняется темнота. Так и в лучевой терапии, максимальная доза концентрируется в опухоли.
Точная локализация опухоли в тканях также крайне важна. Ведь опухоль, как и весь организм, постоянно меняется, а в лучевой терапии важен каждый миллиметр. Передовые технологии позволяют создавать трехмерное изображение опухоли (3D-CRT), регулировать интенсивность облучения внутри поля (IMRT) и даже синхронизировать облучение с дыханием (Respiratory gating) [23], [24].
Однако даже самые современные методы не могут полностью нивелировать поражение нормальной ткани, и пациенты продолжают сталкиваться с побочными эффектами лучевой терапии. К тому же, доступ к высоким технологиям есть далеко не в каждом онкологическом диспансере.
Побочные эффекты снижают качество жизни пациентов и ограничивают врачей в подборе оптимальных режимов терапии. К острым побочным эффектам относятся состояния, возникающие во время или в течение несколько недель после облучения. Они обратимы и проходят после регенерации нормальной ткани [25]. У 95% пациентов встречается лучевой дерматит, который проявляется в виде покраснений кожи, боли, отечности, шелушения, появления пузырей и изъявлений [26]. Также часто встречаются усталость, выпадение волос в месте облучения и анемия [27].
Состояния, которые проявляются через несколько месяцев или лет после лучевой терапии, называют отдаленными побочными эффектами. Они часто носят хронический и прогрессирующий характер. Например, пациентки с раком левой молочной железы, подвергшиеся лучевой терапии, имеют более высокие риски возникновения ишемической болезни сердца. Это связано с тем, что сердце и сосуды, питающие его, также попадают в зону облучения [28], [29]. Другим примером может быть сахарный диабет II типа [30] и — очень редко, но все-таки встречающиеся — радиоиндуцированные вторичные опухоли [37].
Давайте попробуем представить, каким же должен быть идеальный способ лечения. Луч, который не повреждает здоровую ткань, а убивает опухоль и ничего, кроме опухоли. Луч настолько эффективный, что потребуется лишь нескольких секунд облучения, чтобы добиться контроля над опухолевыми клетками. Возможно ли достичь таких результатов?
Но вот мы продвинулись уже до середины статьи и ни разу не упомянули ускорители частиц. Сейчас исправим.
Человек под ударом синхротрона
Радиотерапию разделяют на внутреннюю, когда радиоактивный источник помещают внутрь тела в непосредственной близости от опухоли, и внешнюю (телетерапия), когда источником энергии является прибор. Обычно используют линейные ускорители (LINAC — linear accelerator), в которых заряженные частицы ускоряются с помощью микроволновых полей, а затем подаются в заранее обозначенную на теле пациента область. На второй план отошли установки, в которых источником гамма-излучения является радиоактивный кобальт-60 [32].
Все установки для лучевой терапии имеют общие черты в строении. Основными компонентами аппарата являются: источник излучения, система коллиматоров, необходимая для формирования и направления луча, ионизирующая камера для контроля дозы пучка, гантри (подвижная часть), позволяющая вращать вокруг пациента облучающий пучок заряженных частиц, а также стол, на котором находится пациент. При этом у каждого прибора существует изоцентр — точка в пространстве, в которой пересекаются все оси вращения [21]. Строение линейного ускорителя представлено на рисунке 4.
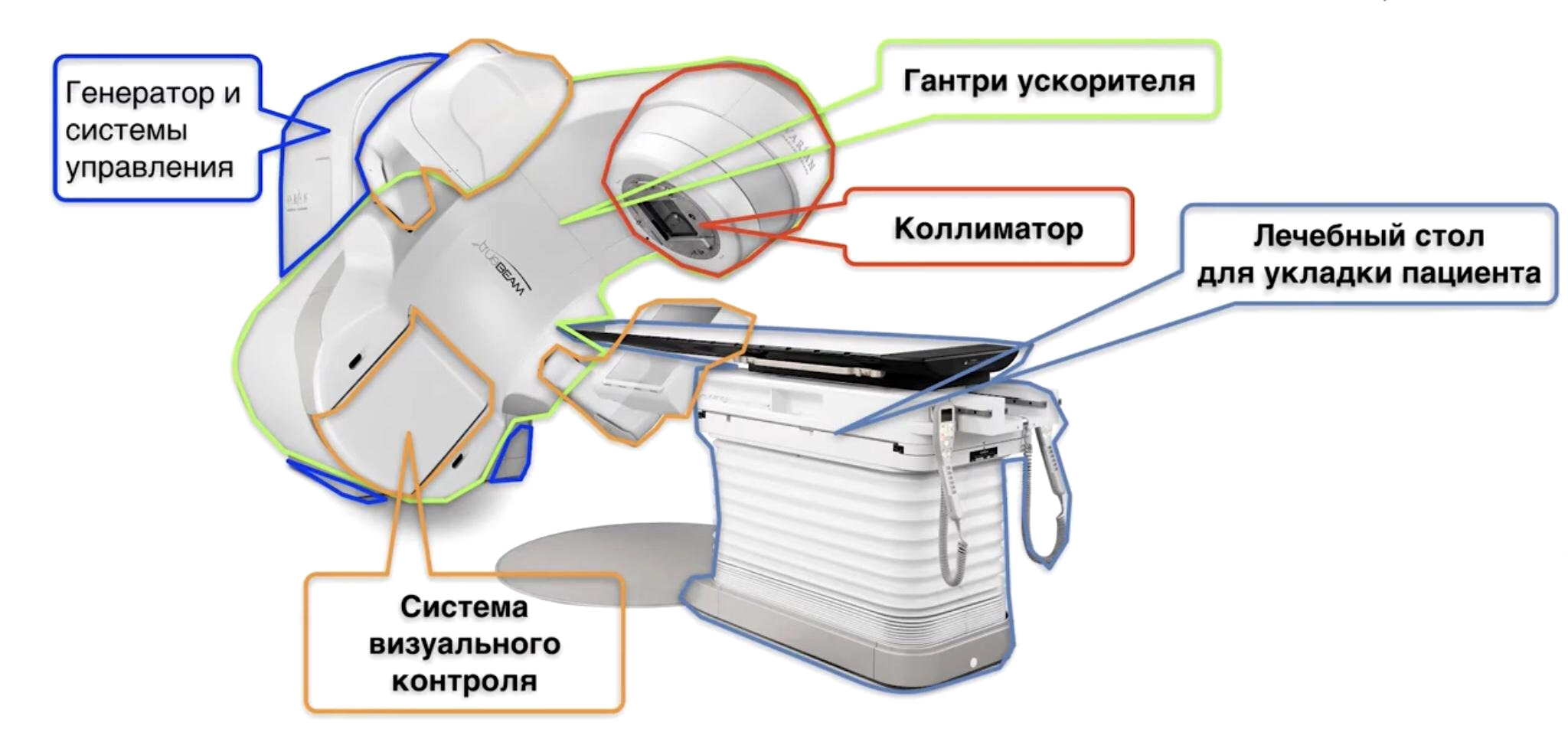
Рисунок 4. Схема устройства аппарата для внешнего облучения и внешний вид линейного ускорителя.
Линейные ускорители используются в медицине достаточно давно, они безопасны, а сама процедура абсолютно безболезненна. Но в мире также существуют ускорители частиц огромных масштабов и невероятной мощности.
Синхротрон — это мощнейшая установка, в которой атомы ускоряются до скорости света. Под воздействием магнитного поля (и некоторых других воздействий) они уклоняются и испускают поток, названный синхротронным излучением. Оно используется в химии, биологии, археологии и иногда в медицине.
Чтобы понять, как связаны синхротрон и лучевая терапия, перенесемся на несколько десятилетий в прошлое.
В июне 1978 года в Институте физики высоких технологий наукограда Протвино Анатолий Петрович Бугорский направился к синхротрону У—70, чтобы исправить неполадки в приборах, установленных в месте выхода лучей. Ряд роковых случайностей привел к тому, что он наклонился к датчику именно в тот момент, когда в установке проносился пучок протонов высокой энергии. Пучок буквально прошел сквозь голову ничего не подозревающего физика и... ничего. Анатолий Бугорский рассказывает, что увидел яркую вспышку, но не почувствовал боли, и в растерянности не сразу решил сообщать о происшествии.
Однако вскоре его состояние стало ухудшаться, левая сторона головы стала распухать, на лице остались шрамы в месте входа и выхода пучка (затылок и область левой ноздри) (рис. 5). Анатолий Бугорский был доставлен в Клиническую больницу № 6 Третьего главного управления при Минздраве СССР (ныне ФМБЦ им. А. И. Бурназяна ФМБА России). Согласно записям в медицинской карте, доза облучения на входе пучка составила 200 000 рентген, а на выходе — 300 000 рентген.
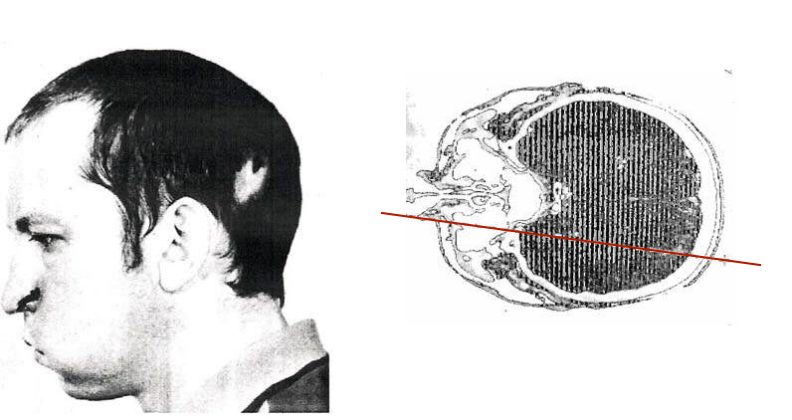
Рисунок 5. Слева — фотография, сделанная спустя 3 месяца после аварии. Справа красной линией показан путь, который проделал пучок.
Прогнозы врачей были неутешительными. Столь высокая энергия должна была буквально «выжечь» все клетки на своем пути, повредить геном и спровоцировать появление множественных опухолей.
Но Анатолий Бугорский остался жив и продолжил работать в Институте физики высоких энергий. Он потерял слух на левое ухо и жалуется на приступы мигрени, левая половина его лица парализована, однако никаких онкологических заболеваний у него не выявили. Не это ли считать настоящим чудом?
И все-таки, при чем тут онкология?
Этот невероятный случай — яркий пример того, как воздействует на живой организм излучение сверхвысокой мощности. Нельзя сказать, вдохновил ли ученых опыт российского физика, но использование сверхвысоких доз облучения рассматривается как новый вариант лечения злокачественных новообразований.
FLASH-терапия — это новый способ доставки энергии. Суть этого метода состоит в том, что опухоль облучают высокой дозой на протяжении очень короткого времени. FLASH-терапию также называют импульсной лучевой терапией, потому что энергия доставляется в опухоль короткими импульсами [33]. Иными словами, это сверхбыстрое облучение, при котором используются дозы, в несколько тысяч раз превышающие те, что обычно применяются в клинической практике.
Первые эксперименты, связанные с высокодозированной лучевой терапией, проводились на бактериях. В 1959 году ученые обнаружили, что увеличение мощности облучения приводит к снижению радиочувствительности бактерии Serratia marcescens. Это значит, что высокие дозы облучения в сравнении с нормальными оказались для бактерий более безопасными [34].
Похожие эксперименты стали проводиться на клетках млекопитающих [35] и живых мышах [36]. Накапливались данные, которые подтверждали, что высокие дозы облучения не опасны для нормальной ткани [37–39]. Позже подобный эффект получил название FLASH-эффект.
Очевидно, что подобное щадящее воздействие на нормальные ткани найдет применение в онкологии. Но главной целью лучевой терапии остается гибель опухолевых клеток, поэтому в первую очередь необходимо выяснить, как облучение высокими дозами влияет на злокачественные клетки.
Новую жизнь FLASH-эффект получил в 2014 году благодаря исследованию, проведенному во Франции. Оказалось, что FLASH-эффект обладает избирательностью и безопасен для здоровой ткани, но губителен для опухолевых клеток. В сравнении со стандартной дозой, воздействие на опухоль сверхвысоких доз (средняя мощность 40 Гр/с в сравнении с обычной мощностью 0,03 Гр/с) за ультракороткое время оказалось более безопасным для нормальной ткани. При этом повреждающее действие на опухоль не уменьшается [40].
Применение на практике
Даже самая блестящая теория может оказаться совершенно неприменимой на практике. Чтобы доказать безопасность и эффективность FLASH-терапии, ученые проводят эксперименты на мышах [41] , рыбках данио-рерио [42] и других животных. Группа ученых из Швеции исследовала влияние нового метода радиотерапии на карликовых свиней и кошек [43].
Первая цель ученых — сравнить действие FLASH-терапии и стандартного облучения на нормальную неповрежденную кожу. Исследование проводилось на живых карликовых свиньях, кожа которых имитирует реакцию кожи человека на лучевую терапию и часто используется в качестве радиобиологической модели [44], [45]. Кожу карликовой свинки подвергали воздействию двух видов лучей: с одной стороны использовали стандартное облучение (≈5 Гр/мин), а с другой — FLASH-терапию (≈300 Гр/сек). После облучения в течение 48 недель кожа свиньи подвергалась тщательному еженедельному осмотру с оценкой проявлений токсичности (рис. 6). Спустя 36 недель была выполнена биопсия кожи с последующим гистологическим анализом. В участках, подвергшихся FLASH-терапии, наблюдалось выпадение волос, однако волосяные фолликулы сохранялись, а также отсутствовали признаки токсичности. В участках, подвергшихся стандартной терапии, произошла гибель волосяных фолликулов с отсутствием роста волос в течение следующих 6 месяцев, а также был зафиксирован фибронекроз (изменение ткани кожи с развитием изъязвлений эпителия, гиперкератозом и воспалением).
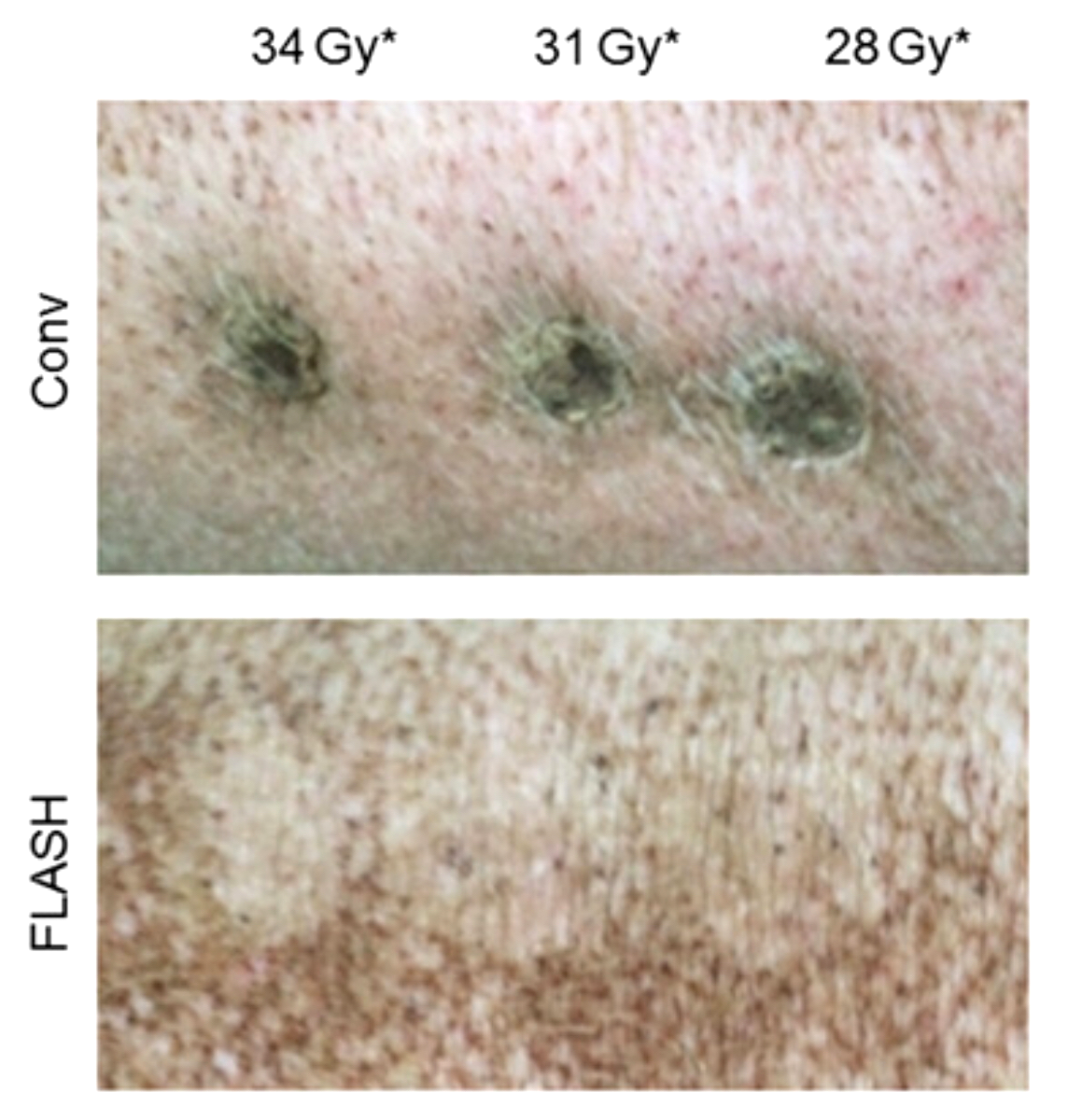
Рисунок 6. Сверху показан эффект стандартной лучевой терапии на нормальную кожу свиньи, снизу показан эффект FLASH-терапии.
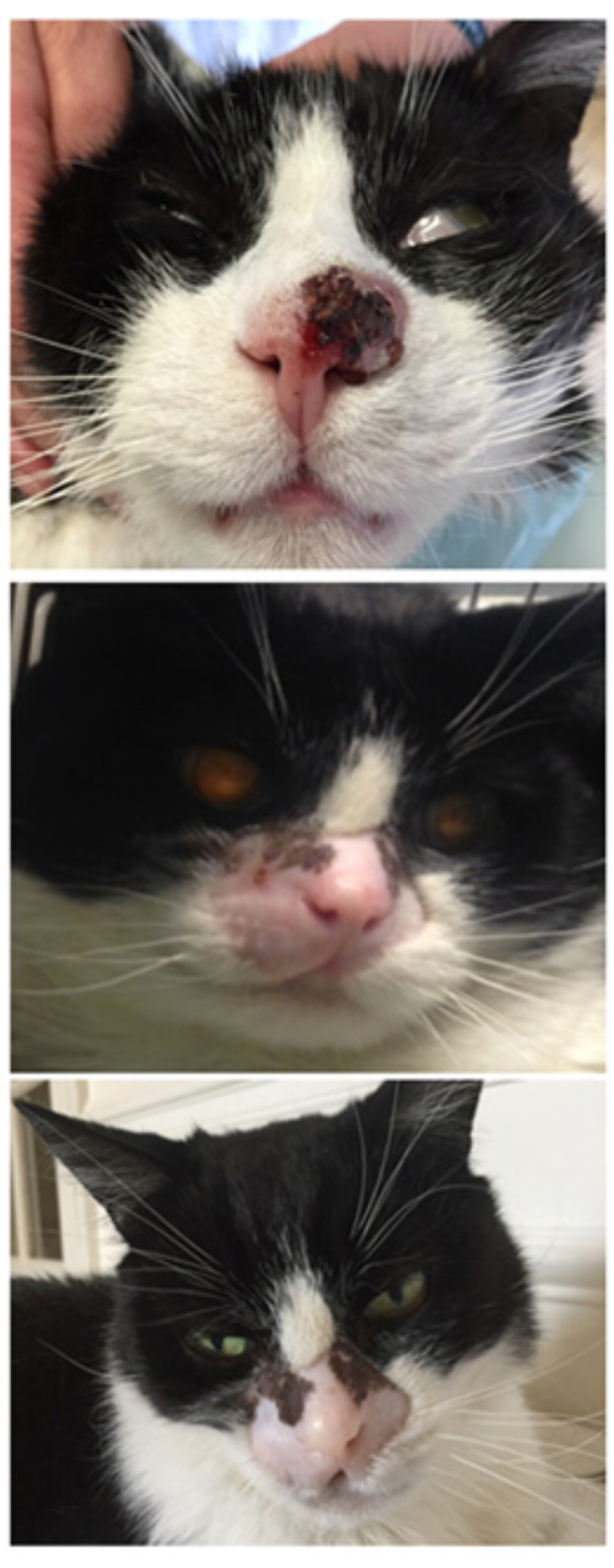
Рисунок 7. Внешний вид опухоли до лечения (первая картинка), спустя 7 месяцев (вторая картинка) и спустя 14 месяцев (третья картинка).
Чтобы понять, как FLASH-терапия воздействует на опухоли в живом организме, ученые отобрали 6 кошек с местно распространенным плоскоклеточным раком в области носа на поздних стадиях [43]. Такая локализация была выбрана из-за особенностей лечения. Лучевая терапия, которая наиболее часто используется для данных опухолей, обладает низкой эффективностью. Поэтому экспериментальная FLASH-терапия могла стать для кошек неожиданным спасением.
Четвероногим пациентам был проведен один сеанс FLASH-терапии под общей анестезией. В этом заключается еще одно преимущество: стандартное облучение требует многократных повторных сеансов, проводимых под общей анестезией, что само по себе несет определенную опасность для животных.
Во время исследования кошки подвергались возрастающим дозам облучения. Это было необходимо для определения дозолимитирующей токсичности (токсичности, достаточно серьезной для прекращения увеличения дозы облучения) и максимальной токсической дозы (максимальной дозы, при которой наблюдается приемлемая токсичность). Исследователи оценивали появление у кошек мукозита (воспаление слизистой полости рта), дисфагии (затруднение глотания) и изъязвления кожи.
После облучения кошки подвергались ветеринарному осмотру через 3, 6 и 16 месяцев. Спустя 3 месяца после лечения у всех кошек наблюдался полный ответ на терапию (отсутствие клинических признаков онкологического заболевания). Спустя 16 месяцев четыре кошки оставались в ремиссии, у двух случился рецидив заболевания. Визуальный эффект действия терапии на опухоль показан на рисунке 7.
В 2018 году FLASH—терапию получил первый в мире человек [46]. Это был пациент 75 лет с CD30+ T-клеточной лимфомой кожи (заболевание, при котором злокачественные Т-лимфоциты инфильтрируют кожу) [47]. Болезнь была диагностирована в 1999 году; в ходе предыдущего лечения пациент получал химиотерапию, иммунотерапию, многократную лучевую терапию с 2008 по 2018 годы, а также другие методы. При этом стандартная лучевая терапия сопровождалась выраженной токсичностью.
После проведенной FLASH-терапии опухоль начала уменьшаться через 10 дней; полный ответ наступил через 36 дней и сохранялся в течение последующих 5 месяцев. Также у пациента временно появились покраснение в месте облучения, отек, которой не наблюдался после сеансов обычной лучевой терапии, а также выпадение волос и усиление васкуляризации (формирование новых кровеносных сосудов). Внешние изменения пациента после терапии показаны на рисунке 8.
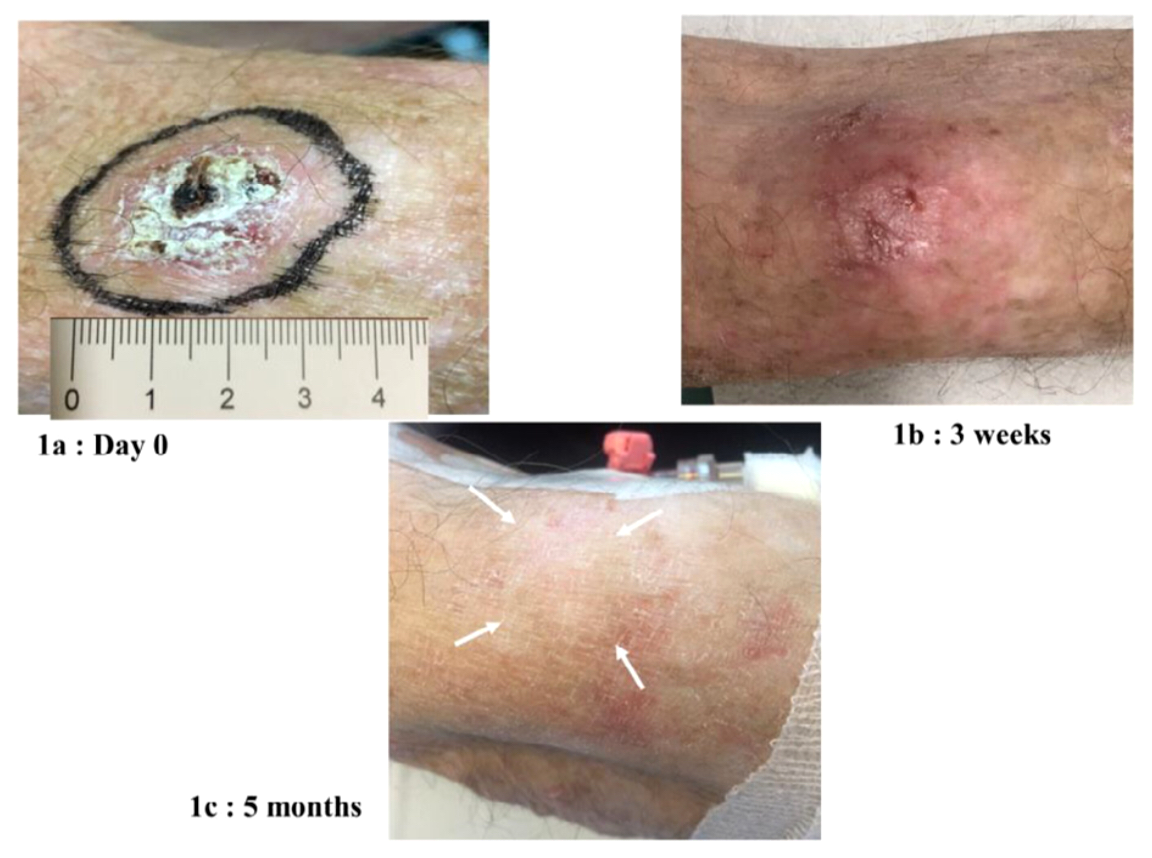
Рисунок 8. Состояние пациента, наблюдаемое до облучения (1а), через 3 недели (1b) и спустя 5 месяцев (1с).
Исследование эффективности лучевой терапии в лечении злокачественных опухолей у людей продолжается. В 2020 году фирма Varian анонсировала проведение клинического исследования FAST-01, в ходе которого FLASH-терапия проведут на пациентах с метастатическим поражением костей.
Также медицинская корпорация IntraOp совместно с университетской больницей Лозанны (CHUV, Швейцария) объявили о проведении I фазы клинического исследования, в котором FLASH-терапию получат пациенты с метастатическим поражением кожи при меланоме. Такие виды опухоли плохо поддаются стандартной лучевой терапии и относятся к радиорезистентным. Поэтому в случае эффективности FLASH-терапия сможет претендовать на статус нового метода лечения опухолей данной локализации.
Что дальше?
FLASH-терапии предстоит долгий путь от стен лабораторий до кабинетов лучевой терапии. Множество экспериментов должны подтвердить полную безопасность и эффективность данного метода. И немало времени понадобится для того, чтобы подходящее для проведения данной терапии техническое оснащение стало доступным для медицинских центров всех стран. Но игра стоит свеч. Уже сейчас создаются большие проекты, которые направлены на изучение FLASH-эффекта.
Потенциально FLASH-терапия может быть использована в лечении опухолей лёгкого и средостения. Во время дыхания положение опухолей данной локализации смещается, поэтому нужно либо расширять область облучения, либо использовать методы синхронизации облучения с дыханием. FLASH-терапия, проводимая за секунды, может оказаться «быстрее вдоха», и врачам не придется проводить поправку на дыхание. Также большие надежды на FLASH-терапию возлагают в области лечения опухолей головного мозга у детей (медуллобластомы и нейробластомы), так как на сегодняшний день добиться полного излечения пациентов не удается.
Ученым в действительности пока неизвестно, что лежит в основе FLASH-эффекта. Существуют гипотезы, согласно которым FLASH-эффект может быть обусловлен влиянием кислорода и гипоксии [48] или изменением иммунного ответа организма на опухоль [49]. За счет своих уникальных свойств FLASH-терапия обещает стать настоящим прорывом в области лечения онкологических пациентов.
Литература
- Имянитов Е.Н. (2017). Биология опухолевого процесса. Практическая онкология. 17, 307–315;
- Кумар В., Аббас А.К., Фаусто Н., Астер Дж. К. Основы патологии заболеваний по Роббинсу и Котрану. М.: «Логосфера», 2016. — 500 с.;
- Alla Arzumanyan, Helena M. G. P. V. Reis, Mark A. Feitelson. (2013). Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma. Nat Rev Cancer. 13, 123-135;
- Апоптоз, или Путь самурая;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Douglas Hanahan. (2022). Hallmarks of Cancer: New Dimensions. Cancer Discov. 12, 31-46;
- John B Little. (2003). Genomic instability and bystander effects: a historical perspective. Oncogene. 22, 6978-6987;
- Shigeki Arase, Naoko Sanuki, Hiroshi Matsuura. (2019). Cutaneous metastasis of prostate carcinoma treated with electron radiotherapy. IJU Case Reports. 2, 190-192;
- Pataje G. Prasanna, Kamila Rawojc, Chandan Guha, Jeffrey C. Buchsbaum, Justyna U. Miszczyk, C. Norman Coleman. (2021). Normal Tissue Injury Induced by Photon and Proton Therapies: Gaps and Opportunities. International Journal of Radiation Oncology*Biology*Physics. 110, 1325-1340;
- Masashi MIZUMOTO, Yoshiko OSHIRO, Tetsuya YAMAMOTO, Hidehiro KOHZUKI, Hideyuki SAKURAI. (2017). Proton Beam Therapy for Pediatric Brain Tumor. Neurol. Med. Chir.(Tokyo). 57, 343-355;
- Jonathan R. Hughes, Jason L. Parsons. (2020). FLASH Radiotherapy: Current Knowledge and Future Insights Using Proton-Beam Therapy. IJMS. 21, 6492;
- Julie A. Reisz, Nidhi Bansal, Jiang Qian, Weiling Zhao, Cristina M. Furdui. (2014). Effects of Ionizing Radiation on Biological Molecules—Mechanisms of Damage and Emerging Methods of Detection. Antioxidants & Redox Signaling. 21, 260-292;
- M.E. Lomax, L.K. Folkes, P. O'Neill. (2013). Biological Consequences of Radiation-induced DNA Damage: Relevance to Radiotherapy. Clinical Oncology. 25, 578-585;
- https://biomolecula.ru/articles/put-kletki-iz-grekov-v-varia-malignizatsiia-prichiny-i-sledstviia;
- Joseph Sia, Radoslaw Szmyd, Eric Hau, Harriet E. Gee. (2020). Molecular Mechanisms of Radiation-Induced Cancer Cell Death: A Primer. Front. Cell Dev. Biol.. 8;
- Jochen Kuper, Caroline Kisker. (2013). DNA Helicases in NER, BER, and MMR. Advances in Experimental Medicine and Biology. 203-224;
- Howard H. Y. Chang, Nicholas R. Pannunzio, Noritaka Adachi, Michael R. Lieber. (2017). Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nat Rev Mol Cell Biol. 18, 495-506;
- Xuan Li, Wolf-Dietrich Heyer. (2008). Homologous recombination in DNA repair and DNA damage tolerance. Cell Res. 18, 99-113;
- Tepper J. Gunderson and Tepper’s Clinical Radiation Oncology. Elsevier, 2019. — 1656 p.;
- John E. Moulder, Colin Seymour. (2018). Radiation fractionation: the search for isoeffect relationships and mechanisms. International Journal of Radiation Biology. 94, 743-751;
- Rajamanickam Baskar, Kuo Ann Lee, Richard Yeo, Kheng-Wei Yeoh. (2012). Cancer and Radiation Therapy: Current Advances and Future Directions. Int. J. Med. Sci.. 9, 193-199;
- Cinzia Crivellaro, Luca Guerra. (2020). Respiratory Gating and the Performance of PET/CT in Pulmonary Lesions. CRP. 13, 218-227;
- Lara Barazzuol, Rob P. Coppes, Peter Luijk. (2020). Prevention and treatment of radiotherapy‐induced side effects. Mol Oncol. 14, 1538-1554;
- Nicola Alessandro Iacovelli, Yvan Torrente, Adriana Ciuffreda, Vittorio A Guardamagna, Marta Gentili, et. al.. (2020). Topical treatment of radiation-induced dermatitis: current issues and potential solutions. DIC. 9, 1-13;
- Louis B. Harrison, Daniel Shasha, Carol White, Beverly Ramdeen. (2000). Radiotherapy-Associated Anemia: The Scope of the Problem. The Oncologist. 5, 1-7;
- Brown K., Richards J. (2022). Radiation Induced Coronary Artery Disease. StatPearls [Internet];
- Lauren E. Carlson, Gordon P. Watt, Emily S. Tonorezos, Eric J. Chow, Anthony F. Yu, et. al.. (2021). Coronary Artery Disease in Young Women After Radiation Therapy for Breast Cancer. JACC: CardioOncology. 3, 381-392;
- Danielle Novetsky Friedman, Chaya S Moskowitz, Patrick Hilden, Rebecca M Howell, Rita E Weathers, et. al.. (2020). Radiation Dose and Volume to the Pancreas and Subsequent Risk of Diabetes Mellitus: A Report from the Childhood Cancer Survivor Study. JNCI: Journal of the National Cancer Institute. 112, 525-532;
- ANGELICA FACOETTI, AMELIA BARCELLINI, FRANCESCA VALVO, MARCO PULLIA. (2019). The Role of Particle Therapy in the Risk of Radio-induced Second Tumors: A Review of the Literature. Anticancer Res. 39, 4613-4617;
- Van Dyk J., Battista J. (2020). A Retrospective of Cobalt-60 radiation therapy : “The Atom Bomb that Saves Lives”;
- А. V. Каrtashev, Т. N. Bochkareva, А. S. Anokhina. (2021). FLASH Radiotherapy: a Promising Direction in the Fight Against Cancer. Vestn. rentgenol. radiol.. 102, 240-246;
- D. L. DEWEY, J. W. BOAG. (1959). Modification of the Oxygen Effect when Bacteria are given Large Pulses of Radiation. Nature. 183, 1450-1451;
- C. D. TOWN. (1967). Effect of High Dose Rates on Survival of Mammalian Cells. Nature. 215, 847-848;
- SHIRLEY HORNSEY, TIKVAH ALPER. (1966). Unexpected Dose-rate Effect in the Killing of Mice by Radiation. Nature. 210, 212-213;
- Roger J. Berry, Eric J. Hall, David W. Forster, Thomas H. Storr, Michael J. Goodman. (1969). Survival of mammalian cells exposed to X rays at ultra-high dose-rates. BJR. 42, 102-107;
- Shirley Hornsey, D.K. Bewley. (1971). Hypoxia in Mouse Intestine Induced by Electron Irradiation at High Dose-rates. International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine. 19, 479-483;
- S.B. Field, D.K. Bewley. (1974). Effects of Dose-rate on the Radiation Response of Rat Skin. International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine. 26, 259-267;
- Vincent Favaudon, Laura Caplier, Virginie Monceau, Frédéric Pouzoulet, Mano Sayarath, et. al.. (2014). Ultrahigh dose-rate FLASH irradiation increases the differential response between normal and tumor tissue in mice. Sci. Transl. Med.. 6;
- Karen Levy, Suchitra Natarajan, Jinghui Wang, Stephanie Chow, Joshua T. Eggold, et. al. FLASH irradiation enhances the therapeutic index of abdominal radiotherapy for the treatment of ovarian cancer — Cold Spring Harbor Laboratory;
- Elke Beyreuther, Michael Brand, Stefan Hans, Katalin Hideghéty, Leonhard Karsch, et. al.. (2019). Feasibility of proton FLASH effect tested by zebrafish embryo irradiation. Radiotherapy and Oncology. 139, 46-50;
- Marie-Catherine Vozenin, Pauline De Fornel, Kristoffer Petersson, Vincent Favaudon, Maud Jaccard, et. al.. (2019). The Advantage of FLASH Radiotherapy Confirmed in Mini-pig and Cat-cancer Patients. Clin Cancer Res. 25, 35-42;
- J-L. Lefaix, J. Mignot. (1996). Effects of radiation on skin surface contour.. Skin Res Technol. 2, 177-181;
- J-L Lefaix, M Martin, Y Tricaud, F Daburon. (1993). Muscular fibrosis induced after pig skin irradiation with single doses of192lr γ-rays. BJR. 66, 537-544;
- Jean Bourhis, Wendy Jeanneret Sozzi, Patrik Gonçalves Jorge, Olivier Gaide, Claude Bailat, et. al.. (2019). Treatment of a first patient with FLASH-radiotherapy. Radiotherapy and Oncology. 139, 18-22;
- O. M. Demina, O. E. Akilov, A. G. Rumyantsev. (2018). Cutaneous T-cell lymphomas: modern data of pathogenesis, clinics and therapy. Onkogematologiâ. 13, 25-38;
- Pierre Montay-Gruel, Munjal M. Acharya, Kristoffer Petersson, Leila Alikhani, Chakradhar Yakkala, et. al.. (2019). Long-term neurocognitive benefits of FLASH radiotherapy driven by reduced reactive oxygen species. Proc. Natl. Acad. Sci. U.S.A.. 116, 10943-10951;
- Joseph D. Wilson, Ester M. Hammond, Geoff S. Higgins, Kristoffer Petersson. (2020). Ultra-High Dose Rate (FLASH) Radiotherapy: Silver Bullet or Fool's Gold?. Front. Oncol.. 9.