
Что гигантские сперматозоиды дрозофил могут рассказать о мужском бесплодии?
08 марта 2024
Что гигантские сперматозоиды дрозофил могут рассказать о мужском бесплодии?
- 401
- 0
- 2
Рисунок в полном размере.
коллаж авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Как говорил Аристотель, жизнь есть движение. Как говорят ученые сегодня, воспроизведение жизни без движения невозможно. Подвижность сперматозоидов считается ключевым фактором, определяющим фертильность. Их сниженная мобильность или неподвижность называется астенозооспермия. Это одна из форм мужского бесплодия, которая возникает из-за нарушения организации жгутика или неправильного созревания сперматозоидов. Как происходит это созревание? За что ответственны структурные элементы жгутика в зрелых половых клетках? Ответы на эти вопросы способны решить проблему мужского бесплодия.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Червь из Дюны учит головастиков жизни
Зачастую на объекте высокой сложности, как человек, затруднительно разобрать интересующие детали. Альтернативный подход — использование модельных объектов. Так, движение сперматозоидов и строение их жгутиков удобно изучать на примере дрозофилы (плодовой мушки). Это особенно интересно еще и потому, что среди плодовых мушек есть виды с гигантскими сперматозоидами, подвижность которых вызывает много вопросов. Например, у Drosophila bifurca длина мужских половых клеток может достигать рекордных 6 сантиметров.
Стоит учитывать, что жгутик — сложный. Стальные тяжи микротрубочек, пружины митохондрий и настоящий лабиринт цитоскелета! Любое нарушение этой хрупкой системы приводит к неподвижности сперматозоида и бесплодию. Кроме того, в попытке подсмотреть, как это происходит у насекомых, есть подводные камни, ведь их сперматозоиды обладают своей спецификой.
И все-таки современные исследования позволяют сделать вывод о том, что основными причинами неподвижности сперматозоидов являются нарушения в формировании производных митохондрий и фибриллярных структур, параллельных главному осевому элементу жгутика — аксонеме.
Вступительное слово (осторожно, спойлеры)
Гигантские сперматозоиды Drosophila bifurca — нашумевшая тема. Неудивительно, ведь эти клетки вырастают до 6 сантиметров в длину, что в десятки раз длиннее самой мушки. Есть мнение, что огромный размер сперматозоидов — последствие полового отбора, аналогичное развитию огромных рогов у оленей [1]. С другой стороны, длина сперматозоида насекомых коррелирует с его подвижностью в узких половых путях самки [2]. При этом в сперматогенезе дрозофил успешное удлинение не гарантирует подвижность [3]. Вот какую путаницу вы увидите, если попробуете переместиться в будущее, пролистав статью до самого интересного места. Ничего не понятно? Тогда по порядку.
Очерки анималькулизма (введение)
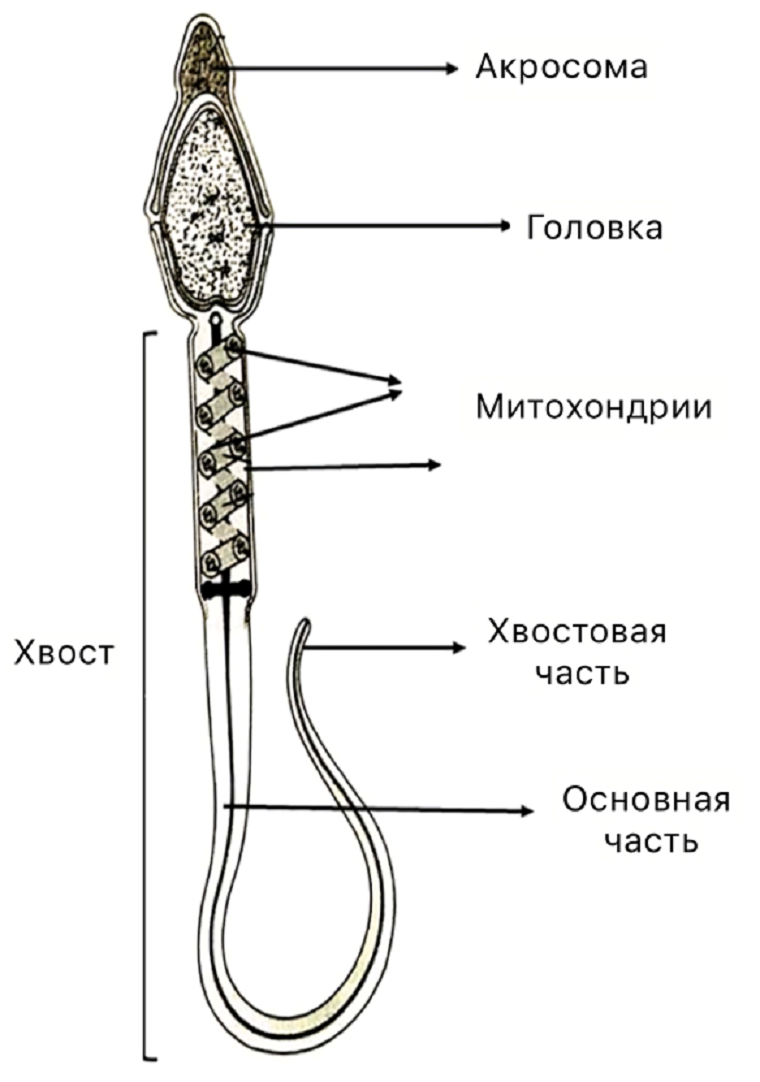
Рисунок 1. Структура сперматозоида человека.
адаптировано из [5], с изменениями
Сперматозоиды — мужские половые клетки. У большинства животных сперматозоиды подвижны. Они обладают жгутиком, который помогает им перемещаться в среде и достигать яйцеклеток самки. Преодоление расстояния до женской половой клетки — один из важнейших моментов оплодотворения, который подвержен отбору.
Сперматозоид напоминает самостоятельный одноклеточный организм, клетка которого разделена на структурные компоненты. В первом приближении можно сказать, что сперматозоид похож на головастика и состоит из головки и жгутика (хвоста). Но на самом деле сперматозоид сложнее. В нем можно выделить четыре участка:
- головка, содержащая ядро и акросому (резервуар с ферментами, обеспечивающими слияние гамет при оплодотворении);
- средняя часть, в которой расположены аксонема (осевой элемент жгутика, состоящий из микротрубочек) и производные митохондрий;
- жгутик, или основная часть, в которой находится аксонема и дополнительные структурные элементы;
- концевая часть, в которой есть исключительно аксонема, окруженная клеточной мембраной (рис. 1) [4], [5].
Интересно, что такая сложная дифференцировка почти полностью происходит на последних стадиях формирования сперматозоидов. Связано это с тем, что у человека на ранних этапах сперматогенеза мужские гаметы развиваются как клоны с единой цитоплазмой. Разделение клетки на участки (компартменты) в таком состоянии затруднительно. Тем не менее, подобный «коллективизм» в развитии позволяет достичь невероятной продуктивности. Так, у мужчины за время одного вдоха формируется порядка тысячи зрелых сперматозоидов [4]. Правда, для выполнения финальной цели (оплодотворения) клеткам нужно разъединиться, затем правильно упаковать митохондрии и, наконец, пройти этап элонгации, на котором мужская половая клетка приобретет головку, среднюю часть и хвост [6]. Чем сложнее задача, тем больше шанс ошибиться, поэтому именно последние стадии сперматогенеза рассматриваются как источник проблемы бесплодия.
Парадигма сперматозоида
Нельзя достичь женской половой клетки, будучи неподвижным.
Астенозооспермия — одна из форм мужского бесплодия у человека, которая заключается в сниженной мобильности или неподвижности сперматозоидов. Подвижность обеспечена жгутиком, поэтому его формирование — значимый этап сперматогенеза, нарушения в котором приводят к бесплодию. Таким образом, разработка методов терапии и предупреждения астенозооспермии должна быть основана на двух пунктах: (1) изучении отклонений в структуре жгутика и (2) исследовании процессов формирования мужских половых клеток [7]. Таких работ достаточно, но они не отвечают на все вопросы, встающие перед исследователями. В связи с этим мы предлагаем расширить взгляд на проблему, обратившись к насекомым. Этот класс членистоногих животных впечатляет не только своим видовым разнообразием, но и разнообразием примеров структуры и физиологии сперматозоидов.
Насекомые: модельный объект или подборка исключений?
Для обоснования нашей затеи сразу стоит сказать, что наблюдается консервативность основных генов сперматогенеза, из-за чего мутации в генах дрозофилы и их ортологах (гомологах) у человека могут вызывать схожие нарушения [3], [8]. Отсюда следует, что генетические исследования на насекомых пригодны для решения проблем мужского бесплодия. Но так ли консервативна структура их сперматозоидов?
Как устроены сперматозоиды насекомых и чем отличаются от человеческих
Сперматозоидам насекомых приписывается план строения, который отличается от сперматозоидов человека. Мужская гамета насекомых представляет собой подвижную нитевидную клетку, состоящую из головки (акросомы и ядра), переходной зоны и жгутика. Термин «жгутик» является лишь функциональным описанием, а настоящий гомолог жгутика насекомых — средняя часть жгутика млекопитающих. Эта гомология основана на том, что в жгутике насекомых митохондрии растянуты почти на всю длину аксонемы, а у млекопитающих расположены в средней части сперматозоида (рис. 2) [5], [9], [10].
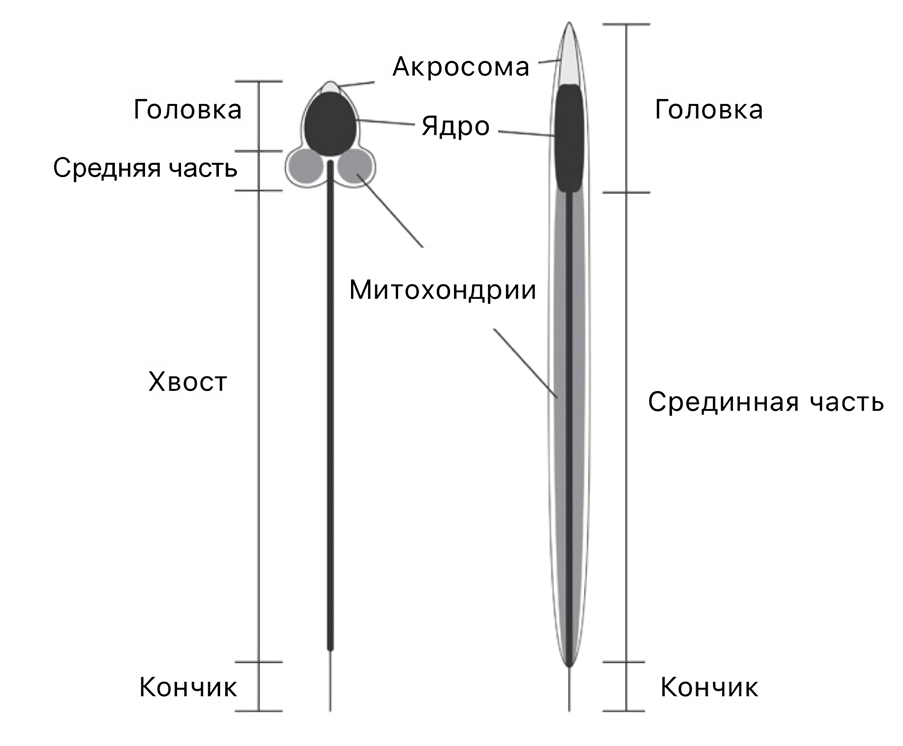
Рисунок 2. Сперматозоиды млекопитающих и насекомых.
адаптировано из [10], с изменениями
Аксонема сперматозоидов насекомых консервативна и состоит из 9 дуплетов и центральной пары микротрубочек (9+2), что соответствует строению аксонемы большинства других организмов. Однако в структуре жгутика встречается уникальная черта — еще 9 микротрубочек, расположенных по кругу снаружи от дуплетов (9+9+2). Помимо этого, в жгутике присутствуют два вспомогательных тельца и две длинные видоизмененные митохондрии (рис. 3) [10].
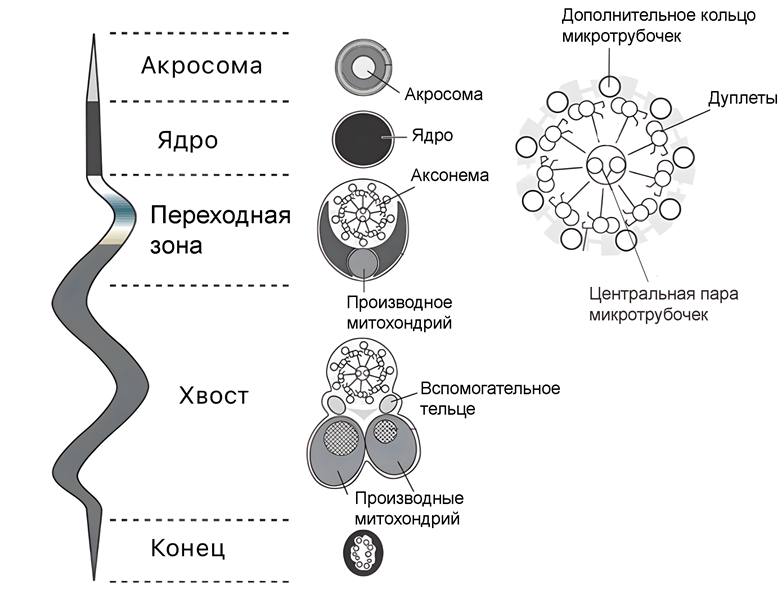
Рисунок 3. Строение сперматозоида насекомого.
адаптировано из [10]
В то же время, в сперматозоидах человека митохондрии тоже сильно видоизменены, образуют спиральную структуру вокруг аксонемы, но не обладают такой большой протяженностью. Аксонема окружена наружными плотными волокнами и волокнистой оболочкой, в которой выделяются два продольных тяжа (рис. 4) [11]. Несмотря на разницу в цитоархитектуре жгутика у насекомых и человека, проглядываются и некоторые аналогии в их строении. По крайней мере, важно, что аксонема — отнюдь не единственный элемент в жгутике. Это делает насекомых потенциально успешным модельным объектом для исследования фертильности сперматозоидов человека [5], [9].
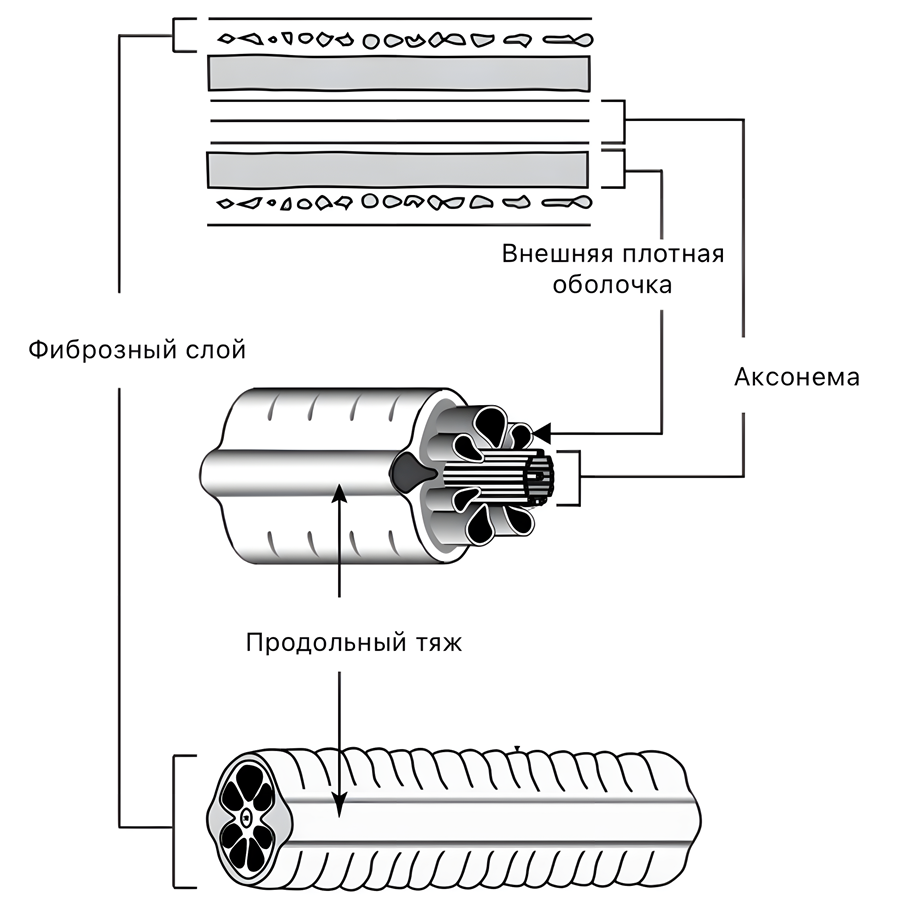
Рисунок 4. Строение жгутика сперматозоида человека.
адаптировано из [11]
В попытке подсмотреть всё у насекомых есть и подводные камни. Несмотря на многочисленные утверждения о тотальной консервативности формулы аксонемы 9+2, на деле это не совсем так. У насекомых встречается множество вариантов альтернативного строения локомоторной системы мужских гамет. Они выражаются в количестве жгутиков и аксонем в жгутике, количестве вспомогательных телец, количестве и положении дуплетов микротрубочек, расположении центральной пары и отсутствии одного или обоих плечей динеина (моторного белка аксонемы). Интересно, что в случае каждого такого отклонения от «нормы», подвижность сперматозоидов сохраняется. Например, отсутствие центральной пары микротрубочек не приводит к утрате контроля над ритмикой биения аксонемы. Впрочем, важно отметить, что может меняться характер подвижности. Если в сперматозоидах насекомых отсутствуют внешние плечи динеина, их локомоция осуществляется вокруг своей продольной оси и наблюдается трехмерный паттерн движения [12].
Как связаны подвижность и длина сперматозоида?
Разнообразие в строении жгутиков у насекомых коррелирует с разнообразием в формах подвижности сперматозоидов. В зависимости от строения аксонемы можно выделить минимум три паттерна движения сперматозоидов насекомых: простая плоская волна (9+2), трехмерная спиральная волна (9+9+2) и двуспиральная волна (9+9+2+вспомогательные тела). Основная тенденция состоит в усложнении паттерна движения при усложнении строения жгутика [12]. Если же экстраполировать это на человека, то принципиальная схема организации жгутика мужской гаметы также может отражать характер его подвижности. Это означает, что малейшие нарушения любого элемента этих структур должны приводить если не к снижению мобильности, то к изменению типа этой мобильности [5].
Тем не менее, не получится строго использовать как модельный объект сперматозоиды насекомых, в том числе дрозофил. Если сперматозоид человека похож на головастика, то сперматозоид насекомого — на червя, причем, временами, на гигантского. Дело в том, что червеобразная форма сперматозоида и паттерн его подвижности намекают, что его движение — это не «плавание», а «ползание» по стенкам половых путей самки. Эта модель объясняет интересное явление: сперматозоиды дрозофил способны двигаться как «передом», так и «задом» в половых путях самки. «Ползание» для такого способа движения очень подходит [13]. Кроме того, «ползание» половых клеток объясняет отбор на гигантизм сперматозоидов у некоторых дрозофил [9]. Предполагается, что длина дает конкурентное преимущество сперматозоиду при движении по стенкам узких половых путей, так как увеличивает площадь соприкосновения с поверхностью. В то же время, огромная длина жгутика создает сложности в его формировании и функционировании. Поэтому представляют интерес исследования по фертильности и подвижности гигантских сперматозоидов дрозофил, включая аномально длинные сперматозоиды Drosophila bifurca (рис. 5) [3], [13], [14].

Рисунок 5. Гигантский сперматозоид Drosophila bifurca.
адаптировано из [14]
Back to the fustructure
Так вот, длина сперматозоида насекомых положительно коррелирует с его подвижностью в узких половых путях самки [13], но при этом оказалось, что в сперматогенезе у дрозофил успешное удлинение не гарантирует подвижность [3]. Это было проверено при нокауте трех генов, которые предположительно были вовлечены в стадию удлинения сперматозоидов дрозофил. Было предсказано, что эти гены кодируют динеины, а значит, должны были влиять на структуру аксонемы. По результатам, при выключении каждого из трех генов с аксонемой ничего не случалось. Тем не менее, в каждом случае сперматозоиды теряли способность к оплодотворению по разным причинам. Проявлялось нарушение последних стадий мейоза, нарушалась целостность клеточной мембраны и менялась подвижность из-за неправильного формирования производных митохондрий. Получается, инфертильность сперматозоидов связана с неподвижностью. Та, в свою очередь, вызвана неправильным формированием окружения аксонемы. Это указывает на то, что причина неподвижности сперматозоидов — нарушения в фазе удлинения жгутика (рис. 6). Что интересно, выключение описанных генов не приводит к уменьшению длины сперматозоидов [3]. Отсюда следует, что фертильность зависит от подвижности, а подвижность в данном случае не зависит от длины, а зависит от наличия и правильной организации дополнительных элементов в цитоскелете жгутика. В любом случае, такие исследования создают перспективы для создания лекарств на основе подходов генетического редактирования.
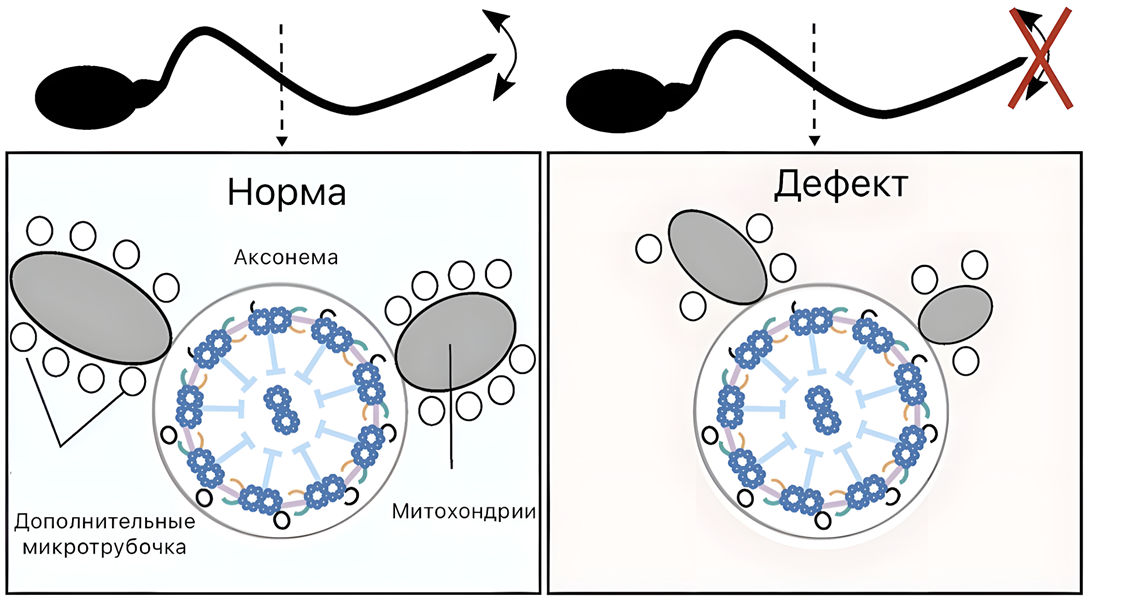
Рисунок 6. Неправильная организация дополнительных структурных элементов жгутика приводит к неподвижности сперматозоидов.
адаптировано из [3]
На этой высокомолекулярной ноте мы действительно предлагаем вернуться назад к структуре. Как было упомянуто ранее, нарушение в формировании производных митохондрий приводит к неподвижности жгутиков. Можно было бы сказать, что это связано с энергетической дисфункцией неправильно организованных митохондрий, но не все так однозначно. Кристы в митохондриях насекомых подвергаются частичной редукции, образуют спираль, а основное пространство занимают спирально закрученные кристаллические белковые нити. Эти белковые структуры упруги и могут накапливать и высвобождать кинетическую энергию, как пружины, обеспечивая волнообразное движение жгутика.
На фоне такой биомеханической функции митохондрий в жгутиках насекомых, их роль как источника энергии подвергается сомнению. И это несмотря на наличие ферментов энергетического обмена в этих органеллах. Крайне любопытно, что последние исследования показывают то же самое для сперматозоидов человека. Оказывается, большую роль в энергетическом обмене сперматозоида играет гликолиз — процесс бескислородного дыхания, для которого митохондрии не нужны. Основываясь на этом, стоит предположить, что формирование производных митохондрий в сперматозоидах человека тоже нужно для биомеханических функций [3], [6].
Даже если это не так, можно провести аналогию между структурой жгутика сперматозоидов насекомых и человека. Дополнительные осевые, мембранные, фибриллярные элементы — все это структуры, принципиально необходимые для поддержания подвижности и правильного характера этой подвижности у сперматозоида.
Три столпа фертильности. Длина—структура—подвижность
Что длина говорит о подвижности? Длина сперматозоида повышает подвижность в узких половых путях самки у дрозофил за счет увеличения площади контакта с поверхностью. Сперматозоид, как червь, ползет по стенкам половых путей [13]. Конечно, Drosophila bifurca — экстремальный случай, но и другие дрозофилы обладают крупными сперматозоидами с отбором на увеличение их длины. Условия, в которых происходит перемещение сперматозоидов у дрозофил, требуют особого характера движения. Проблема мобильности таких сперматозоидов решается дополнительными структурами, включая особый белок в длинных производных митохондрий и дополнительные мембранные структуры, параллельные аксонеме. То есть, структурные элементы жгутика обеспечивают особый характер движения сперматозоидов, необходимый для оплодотворения [9], [13]. Отсюда мы проводим аналогию со сперматозоидами человека, где подвижность тоже может быть завязана на структурах в средней части сперматозоида и в основном участке. Естественно, в данном случае корреляции с длиной нет, но это не значит, что подвижность не зависит от структуры.
Совсем недавно при помощи «3Д-микроскопа» (Digital holographic microscopy) было открыто, что сперматозоид человека двигается, вращаясь вокруг своей оси, а не извивая жгутик в стороны [15]. Возможно, особый характер движения необходим для оплодотворения и достигается как раз за счет дополнительных структур в жгутике и средней части [16]. Стоит обратить внимание на спиральные производные митохондрий у сперматозоидов человека и оценить их влияние на подвижность и характер подвижности, от которых зависит фертильность. Это особенно интересно в связи с разобранным выше обсуждением участия митохондрий в энергетическом обеспечении движения сперматозоидов, которое, похоже, преувеличено.
Занавес
Как в действительности подвижность связана с длиной сперматозоидов? Какова главная роль митохондрий в сперматозоидах человека? Что еще могут рассказать гигантские сперматозоиды дрозофил о мужском бесплодии? Это вопросы, на которые мы отвечаем не полностью, но мы бы очень хотели. Как и все, кто ценит науку, мы сетуем, что ответы откроются нам в будущем, и вновь постараемся донести их до вашего сведения.

коллаж авторов статьи
Литература
- Stefan Lüpold, Mollie K. Manier, Nalini Puniamoorthy, Christopher Schoff, William T. Starmer, et. al.. (2016). How sexual selection can drive the evolution of costly sperm ornamentation. Nature. 533, 535-538;
- Nathalie Luck, Béatrice Dejonghe, Stéphane Fruchard, Sophie Huguenin, Dominique Joly. (2007). Male and female effects on sperm precedence in the giant sperm species Drosophila bifurca. Genetica. 130, 257-265;
- Elisabeth Bauerly, Takuya Akiyama, Cynthia Staber, Kexi Yi, Matthew C. Gibson. (2022). Impact of cilia-related genes on mitochondrial dynamics during Drosophila spermatogenesis. Developmental Biology. 482, 17-27;
- James E. Weber, Lonnie D. Russell. (1987). A study of intercellular bridges during spermatogenesis in the rat. Am. J. Anat.. 180, 1-24;
- Naina Kumar, Amit Kant Singh. (2021). The anatomy, movement, and functions of human sperm tail: an evolving mystery. Biology of Reproduction. 104, 508-520;
- Chiara Castellini, Settimio D’Andrea, Giuliana Cordeschi, Maria Totaro, Antonio Parisi, et. al.. (2021). Pathophysiology of Mitochondrial Dysfunction in Human Spermatozoa: Focus on Energetic Metabolism, Oxidative Stress and Apoptosis. Antioxidants. 10, 695;
- S. Mortimer. (1997). A critical review of the physiological importance and analysis of sperm movement in mammals. Human Reproduction Update. 3, 403-439;
- Helen White-Cooper, Nina Bausek. (2010). Evolution and spermatogenesis. Phil. Trans. R. Soc. B. 365, 1465-1480;
- Tatsuhiko Noguchi, Michiko Koizumi, Shigeo Hayashi. (2011). Sustained Elongation of Sperm Tail Promoted by Local Remodeling of Giant Mitochondria in Drosophila. Current Biology. 21, 805-814;
- Michael Werner, Leigh W. Simmons. (2008). Insect Sperm Motility. Biological Reviews. 83, 191-208;
- Plant T., Zeleznik A. Knobil and Neill's Physiology of Reproduction Physiology of Reproduction, 4th Edition. Academic Press, 2014. — 2684 p.;
- Romano Dallai, Pietro Lupetti, Caterina Mencarelli. (2006). Unusual Axonemes of Hexapod Spermatozoa. International Review of Cytology. 45-99;
- Michael Köttgen, Alexis Hofherr, Weizhe Li, Kristy Chu, Stacey Cook, et. al.. (2011). Drosophila Sperm Swim Backwards in the Female Reproductive Tract and Are Activated via TRPP2 Ion Channels. PLoS ONE. 6, e20031;
- Adam Bjork, Romano Dallai, Scott Pitnick. (2007). Adaptive modulation of sperm production rate in Drosophila bifurca , a species with giant sperm. Biol. Lett.. 3, 517-519;
- Marzena Kamieniczna, Ewa Stachowska, Agata Augustynowicz, Tomasz Woźniak, Maciej K. Kurpisz. (2022). Human live spermatozoa morphology assessment using digital holographic microscopy. Sci Rep. 12;
- Igor Crha, Jana Zakova, Martin Huser, Pavel Ventruba, Eva Lousova, Michal Pohanka. (2011). Digital holographic microscopy in human sperm imaging. J Assist Reprod Genet. 28, 725-729.






