
Диагностика РАС и генетика
25 февраля 2021
Диагностика РАС и генетика
- 28386
- 4
- 7
Головоломка-«пазл» и синий цвет — общепринятые символы РАС.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Расстройства аутистического спектра (РАС) — часто встречающиеся нарушения развития. Однако диагностика РАС всё ещё затруднена. Генетические маркеры могут помочь с выявлением расстройств аутистического спектра, но в этой области всё ещё много вопросов и неоднозначности.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Расстройства аутистического спектра (РАС) — это нарушения развития, которые характеризуются дефицитом социального взаимодействия, дисфункцией сенсорных систем, а также склонностью к стереотипным действиям. У некоторых людей с РАС есть также сопутствующие аутоиммунные нарушения и избирательность в еде.
По данным Всемирной организации здравоохранения, частота встречаемости РАС в мире — 1:160. При этом ВОЗ отмечает, что данная «оценка является усредненной цифрой, и сообщаемая распространенность значительно варьируется между исследованиями».
По данным Центра по контролю и профилактике заболеваний США, расстройство аутистического спектра встречается у каждого пятьдесят четвертого ребенка или у 18,5 человек на 1000. Организация CDC проводила исследования на восьмилетних детях, которые проживают на территории 11 штатов Америки, и частота встречаемости расстройств аутистического спектра варьирует в диапазоне от 13,1 до 31,4 на 1000 человек [1].
Исходя из таких серьёзных различий в цифрах между данными ВОЗ и CDC, можно сделать вывод о том, что диагностика РАС — проблемная сфера.
Между тем, именно диагностика позволяет оказать своевременную помощь, улучшить качество жизни, дает возможность пациенту и его родным понять причины нежелательного поведения и принять соответствующие меры.
Диагностика РАС
На сегодняшний день диагностируют расстройства аутистического спектра с использованием стандартизированных тестов. Основные методики представлены в таблице 1.
| Название теста | Аббревиатура | Краткое описание теста |
|---|---|---|
| Childhood Autism Rating Scale | CARS | Шкала рассчитана на детей 2–4 лет, подходит для первичного скрининга симптомов РАС. Методика является скрининговым методом и не может служить основой для постановки диагноза. |
| Modified Checklist for Autism in Toddlers, Revised | M-CHAT-R | Тест рассчитан на родителей. Позволяет выявить риск развития РАС у ребёнка. Тест не может служить основанием для постановки диагноза. Необходима дополнительная оценка ребёнка профильным специалистом. Рассчитан на возраст 18–30 месяцев. |
| Autism Treatment Evaluation Checklist | ATEC | Тест служит для оценки динамики развития ребенка и эффективности методов реабилитации. На основании результатов теста нельзя ставить диагноз. Для постановки диагноза следует обратиться к специалистам. |
| Checklist for Autism Spectrum Disorder | CASD | Быстрый и относительно надежный метод диагностики РАС. Рассчитан на детей от 1 до 16 лет. Тест состоит из 79 вопросов, на которые необходимо ответить «Да» или «Нет». |
| Autism Diagnostic Observation Schedule | ADOS | Тестирование проводится психиатром или сертифицированным специалистом. Есть вариации теста для разных возрастных групп, в том числе и для взрослых. |
| Autism Diagnostic Interview–Revised | ADI-R | Опросник для родителей, дополнение к ADOS. |
| Дополнительные тесты | ||
| Verbal Behavior Milestones Assessment and Placement Program | VB-MAPP | Программа оценки и определения этапов вербального поведения напрямую не связана с диагностикой РАС. Но она позволяет отслеживать динамику языковых и социальных навыков, что очень важно при построении коррекционной программы. |
| Тест Векслера | — | Напрямую не связан с диагностикой РАС, но позволяет понять уровень интеллектуального развития, что важно для построения коррекционных занятий. Существует три варианта шкалы Векслера, в зависимости от возраста тестируемого. |
Суть этих методов сводится к следующему: родитель, психотерапевт, невролог или психиатр оценивают человека по имеющейся шкале. Оценка базируется на наблюдениях и опросе тестируемого или его родственников. Понятно, что при таком подходе оценки для одного и того же человека, данные разными людьми, могут сильно отличаться. Тэмпл Грандин, которая одной из первых решила открыто рассказать о своей жизни с РАС, в книге «Отворяя двери надежды» пишет о том, что ей долгое время не ставили диагноз «аутизм» только потому, что у неё была речь [2]. Этот аспект существенно влиял на количество баллов в тесте, и в результате специалист пришёл к выводу, что у Темпл Грэндин нет РАС. Верный диагноз был поставлен ей позже.
Современные создатели диагностических тестов утверждают, что вероятность выявления людей с расстройствами аутистического спектра очень высока. К примеру, разработчики методики CASD сообщают, что их опросник способен выявить детей с аутизмом с точностью 99,5%. Данные CASD согласуются с общепризнанными методиками диагностики аутизма на 93–98%, а также на 90% совпадают при заполнении опросника клиницистами и родителями. Однако такие оптимистические цифры не отменяют необходимости в поиске относительно объективных маркеров РАС и достоверной дифференциальной диагностике других нарушений развития.
Маркеры расстройств аутистического спектра можно искать на разных уровнях функционирования организма. Так, некоторые исследователи ищут их в нейроанатомических отличиях индивидов с РАС от нормотипичных людей. Особенности эти могут сводится к недостаточности границ между серым и белым веществом головного мозга, утолщению коры, повышению плотности нейронов, специфике работы мозжечка и передачи сигналов, уменьшенным размерам нейронов миндалины у людей с РАС [3]. Немного подробнее о предполагаемых нейроанатомических отличиях у людей с РАС можно прочитать в статье «Расстройство аутистического спектра: “дети дождя”» [4].
Существуют исследования, в которых РАС связывают с тремя фазами патологического изменения объема головного мозга (рис. 1). Исходя из этих данных, у детей с расстройствами аутистического спектра в возрасте 2–4 лет наблюдается аномальный чрезмерный рост мозга. Поскольку этот рост происходит во время первых обнаруживаемых поведенческих признаков РАС, то можно предположить, что нервные дефекты, вызывающие увеличение, могут лежать в основе расстройств аутистического спектра. Затем следует фаза остановки роста. В возрасте 12–16 лет возможно уменьшение объема мозга, а также частичная атрофия коры головного мозга и миндалевидного тела [5].
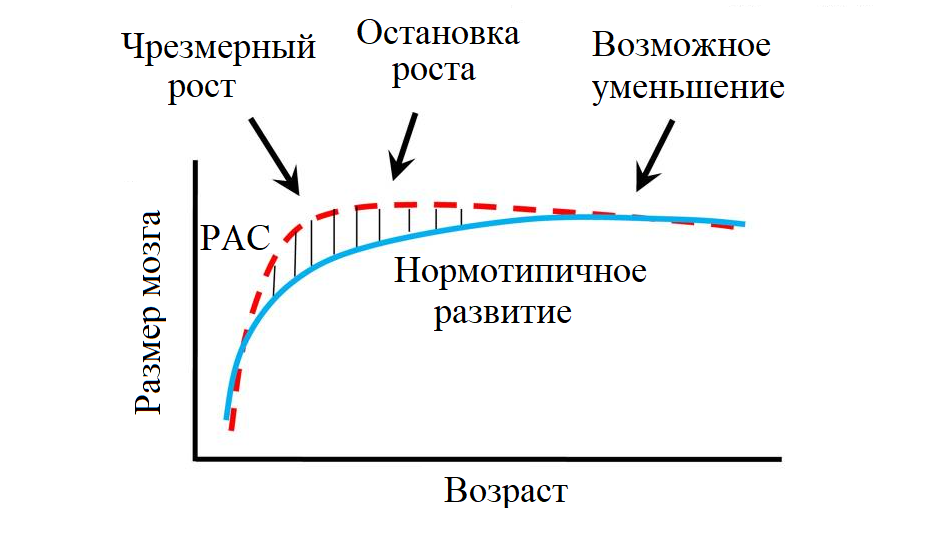
Рисунок 1. Три фазы патологического изменения объема головного мозга при РАС.
Есть также предположения об иммунных и аутоиммунных отличиях людей с РАС. Так, у индивидов с расстройствами аутистического спектра может наблюдаться общая супрессия клеточного иммунитета, пониженная активность клеток-киллеров, субнормальные уровни определенных видов лимфоцитов. Некоторые авторы выдвигают гипотезу аутоиммунного характера аутистического регресса. Причиной РАС также может быть хроническое нейровоспаление в организме матери, которое оказывает «влияние на созревание, функционирование и апоптоз нейронов» [3].
В некоторых исследованиях причиной РАС называют нарушение функционирования зеркальных нейронов, которые отвечают за подражание и сочувствие [6]. Ещё один возможный путь формирования расстройств аутистического спектра — митохондриальные дисфункции, которые приводят к дисрегуляции кальциевых каналов [3].
Данные отличия легли в основу теорий, которыми пытаются объяснить развитие РАС. Среди них:
- теория избыточности коротких нейронных связей и недостаточности длинных;
- теория зеркальных нейронов;
- теория нейронной миграции;
- теория дисбаланса процессов возбуждения-торможения;
- теория морфологии дендритов;
- нейроиммунная теория;
- теория нейровоспаления;
- теория митохондриальной дисфункции [3].
Данная же статья посвящена попытке поиска генетических маркеров для диагностики расстройств аутистического спектра.
РАС и генетика
Уже давно обсуждается вопрос генетической обусловленности РАС. Данная теория подкрепляется тем фактом, что в одной семье двое и больше детей могут быть в аутистическом спектре. Косвенным доказательством того, что РАС имеет генетическую природу является тот факт, что у мальчиков это нарушение развития встречается в четыре раза чаще, чем у девочек. Если бы удалось точно описать генетическую основу аутизма, это помогло бы в диагностике и стало базой для коррекции РАС.
Одно из самых масштабных исследований в этой области было выполнено в 2019–2020 году командой медицинской школы госпиталя Маунт-Синай (США). По результатам этого исследования был составлен список из ста двух ассоциированных с аутизмом генов [7]. Подробнее результаты исследования представлены на рисунке 2. Чем выше на рисунке расположен ген, тем больше вероятность того, что его мутация станет причиной возникновения РАС.
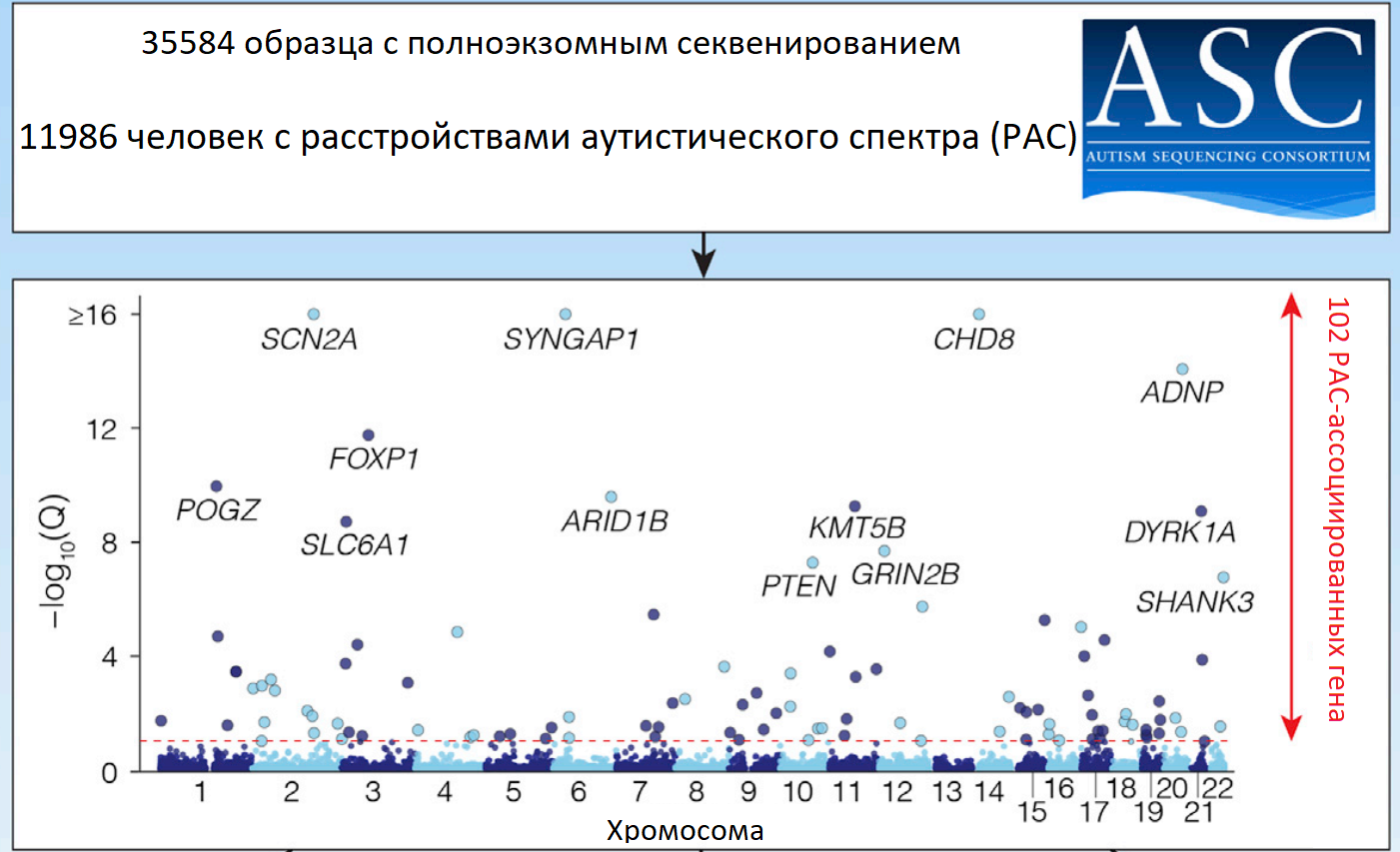
Рисунок 2 Результаты исследования генов, ассоциированных с РАС.
Основное внимание команда сфокусировала на экзоме — той части генетического материала, которая транскрибируется на матричную РНК.В эксперименте принимали участие почти 12 000 детей с аутизмом и около 20 000 нормотипичных людей. Подобные масштабные исследования — важный этап на пути к диагностике и коррекции аутизма [7]. Рассмотрим некоторые гены, предположительно, задействованные в формировании расстройств аутического спектра.
NRXN-гены
Семейство NRXN состоит из трёх генов: NRXN1, NRXN2 и NRXN3.
Эти гены кодируют нейрексины (NRXN) — белки адгезии, которые расположены на пресинаптической мембране и связываются со своим постсинаптическими аналогами, нейролигинами. Малое количество копий NRXN-генов или точечные мутации в них могут стать причиной появления РАС [8].
NLGN-гены
Семейство NLGN состоит из пяти генов, которые кодируют нейролигины. Причиной РАС могут быть делеции или мутации сдвига рамки считывания гена NLGN4. В результате синтезируемый белок получается короче, чем необходимо для полноценного выполнения его функций. Есть также случаи точечных мутаций гена NLGN3, которые предположительно приводили к появлению РАС [9]. Возможный механизм влияния заключается в следующем: мутации в гене NLGN3 вызывают нарушение передачи окситоциновых сигналов, что приводит к специфическим поведенческим стратегиям, которые характерны для людей с расстройствами аутистического спектра. Эксперименты на мышах показали, что подобные мутации могут быть скорректированы с помощью высокоспецифичного ингибитора киназ. Ингибитор помогает восстанавливать окситоциновые сигнальные пути и частично нормализует поведенческие реакции [9].
SHANK-гены
Гены SHANK1, SHANK2, SHANK3 кодируют одноименные фосфопротеины. Все они являются РАС-ассоциированными, но наибольшее диагностическое значение имеет ген SHANK3. Он кодирует протеин, который необходим для формирования нейронных связей. При нехватке белка SHANK3 нарушается функция NMDA-рецепторов (n-methyl, D-aspartate), которые играют важную роль в регуляции высшей нервной деятельности [8]. При дефиците SHANK3 нарушается индукция и поддержание дендритных шипиков [3].
Как показывает статистика, примерно 1% случаев РАС связан именно с геном SHANK3. Исследования влияния дефектов данного гена на поведенческие реакции проводилось на мышах. При включении рабочей копии гена SHANK3 у взрослых мышей наблюдалось увеличение социальных контактов, но уровень тревожности при этом продолжал оставаться высоким [10].
CDH- и PCDH-гены
Семейство СDH-генов кодирует кадгерины. Последние представляют собой гликозилированные трансмембранные белки, которые оказывают влияние на межклеточную адгезию, миграцию нейронов, образование синапсов и синаптическое ремоделирование. Поскольку на функционирование кадгеринов влияет наличие Ca2+, то их называют кальций-зависимыми молекулами клеточной адгезии. Выделяют классические кадгерины (CDH), десмосомальные кадгерины (DSC) и протокадгерины (PCDH).
Семейство этих генов достаточно обширно. C РАС связывают мутации в следующих генах: PCDH9, PCHD13, CDH13, CDH10, CDH9, CDH8. Последний имеет наибольшее диагностическое значение [8]. Как показали исследования, у трансгенных мышей со сниженным на 30% количеством белка CH8 наблюдалось повторяющееся поведение и признаки тревоги. Кроме того, развитие нервной системы мышей происходило с задержкой. Предполагается, что это связано с повышением уровня белка REST, который способен подавлять экспрессию многих генов, ответственных за развитие нервной системы [11].
ENGRAILED-гены
Данное семейство генов задействовано в развитии заднего и среднего мозга. Особое диагностическое значение имеет ген ENGRAILED-2 (EN2), который оказывает значительное влияние на развитие мозжечка [3]. Мыши с дефектным геном EN2 имеют двигательные нарушения, хуже устанавливают социальные связи, у них снижена память. Размер мозжечка таких мышей меньше, чем у их нормотипичных собратьев [12].
* * *
Описанные выше гены — лишь малая часть из тех, которые могут быть связаны с расстройствами аутистического спектра. Учитывая количество исследований, посвященных РАС, этот список в ближайшие годы будет увеличиваться.
Интересно также изучение взаимного влияния выявленных генов друг на друга. Влияния эти могут быть самыми непредсказуемыми. Так, к примеру, ген miR-873, ассоциированный с аутизмом, регулирует экспрессию генов ARID1B, SHANK3 и NRXN2, которые, в свою очередь, оказывают активное влияние на развитие нервной системы [13].
Ста двух генов с их сложными взаимодействиями вполне достаточно для того, чтобы обеспечить работой большое количество исследователей. Но ситуация осложняется ещё больше, если прочитать публикацию Цзянь Чжоу и его коллег, которые заявляют, что на формирование аутизма способны влиять не только экзоны, но и интроны генома [14]. Такой поворот заставляет взглянуть на проблему диагностики РАС с неожиданного ракурса и ставит перед исследователями новые сложные задачи.
Важно отметить, что, несмотря на значительное внимание, которое исследователи уделяют изучению генетических маркеров РАС, нет однозначной прямой связи между расстройствами аутистического спектра и определенной мутацией. Сегодня можно сказать лишь, что существуют гены, которые повышают риск возникновения расстройств аутистического спектра.
Дифференциальная диагностика РАС
Сложность диагностики расстройств аутистического спектра возникает при попытке дифференцировать их среди других патологий и нарушений развития. Тут появляется терминологическая путаница и отсутствие единого подхода к пониманию природы РАС. Долгое время на постсоветском пространстве диагноз «аутизм» ставился только детям. После 18 лет он заменялся либо на диагноз «шизофрения», либо на диагноз «умственная отсталость» (при сниженном интеллекте). Сейчас идёт активный пересмотр подобных подходов к диагностике. Однако значительная часть отечественных специалистов до сих пор считает, что природа РАС и шизофрении родственна и это просто разные полюсы одного и того же состояния [3]. В противовес им, многие зарубежные специалисты считают, что эти нарушения — принципиально разные состояния, и они никогда не переходят друг в друга. Такой взгляд характерен для американской диагностической школы. В рамках этой концепции шизофрения должна сопровождаться галлюцинациями, бредовыми идеями, что не свойственно для расстройств аутистического спектра [3].
Сходные вопросы иногда возникают и при дифференциальной диагностике РАС и СДВГ (синдрома дефицита внимания и гиперактивности).
Теоретически, изучение генетики этих нарушений развития могло бы внести ясность в их диагностику. Но имеющиеся на сегодня данные лишь запутывают ситуацию. Так, к примеру, ген SHANK3, ассоциированный с аутизмом, используется и для диагностики шизофрении [18], [19]. Делеции в гене NRXN1 могут быть связаны не только с расстройствами аутистического спектра, но и с такими патологиями, как шизофрения, биполярное расстройство, СДВГ, синдром Туретта [8].
Подводя итог, можно сказать, что расстройства аутистического спектра имеют полифакторную природу. Однако генетические маркеры диагностики РАС могут в будущем стать важной основой для ранней диагностики и своевременной коррекции данного нарушения развития.
Литература
- Jon Baio, Lisa Wiggins, Deborah L. Christensen, Matthew J Maenner, Julie Daniels, et. al.. (2018). Prevalence of Autism Spectrum Disorder Among Children Aged 8 Years — Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2014. MMWR Surveill. Summ.. 67, 1-23;
- Тэмпл Г. Отворяя двери надежды. Мой опыт преодоления аутизма. М.: Теревинф, 2018. — 184 c.;
- Семаго Н.Я., Бородина Л.Г., Семаго М.М. Типология отклоняющегося развития. Варианты аутистических расстройств. М.: Генезис, 2020. — 368 с.;
- Расстройство аутистического спектра: «дети дождя»;
- Eric Courchesne, Kathleen Campbell, Stephanie Solso. (2011). Brain growth across the life span in autism: Age-specific changes in anatomical pathology. Brain Research. 1380, 138-145;
- Рамачандран В. С, Оберман Л.М. (2008). Разбитые зеркала: теория аутизма. Аутизм и нарушения развития, 3, 1–9;
- F. Kyle Satterstrom, Jack A. Kosmicki, Jiebiao Wang, Michael S. Breen, Silvia De Rubeis, et. al.. (2020). Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism. Cell. 180, 568-584.e23;
- Jianling Chen, Shunying Yu, Yingmei Fu, Xiaohong Li. (2014). Synaptic proteins and receptors defects in autism spectrum disorders. Front. Cell. Neurosci.. 8;
- Hanna Hörnberg, Enrique Pérez-Garci, Dietmar Schreiner, Laetitia Hatstatt-Burklé, Fulvio Magara, et. al.. (2020). Rescue of oxytocin response and social behaviour in a mouse model of autism. Nature. 584, 252-256;
- Yuan Mei, Patricia Monteiro, Yang Zhou, Jin-Ah Kim, Xian Gao, et. al.. (2016). Adult restoration of Shank3 expression rescues selective autistic-like phenotypes. Nature. 530, 481-484;
- Yuta Katayama, Masaaki Nishiyama, Hirotaka Shoji, Yasuyuki Ohkawa, Atsuki Kawamura, et. al.. (2016). CHD8 haploinsufficiency results in autistic-like phenotypes in mice. Nature. 537, 675-679;
- Persico A. M. Neural Circuit Development and Function in the Brain. Academic Press, 2013. — 848 p.;
- Jing Lu, Yan Zhu, Sarah Williams, Michelle Watts, Mary A. Tonta, et. al.. (2020). Autism-associated miR-873 regulates ARID1B, SHANK3 and NRXN2 involved in neurodevelopment. Transl Psychiatry. 10;
- Jian Zhou, Christopher Y. Park, Chandra L. Theesfeld, Aaron K. Wong, Yuan Yuan, et. al.. (2019). Whole-genome deep-learning analysis identifies contribution of noncoding mutations to autism risk. Nat Genet. 51, 973-980;
- Attia Anwar, Provvidenza Maria Abruzzo, Sabah Pasha, Kashif Rajpoot, Alessandra Bolotta, et. al.. (2018). Advanced glycation endproducts, dityrosine and arginine transporter dysfunction in autism - a source of biomarkers for clinical diagnosis. Molecular Autism. 9;
- Eva Loth, Tony Charman, Luke Mason, Julian Tillmann, Emily J. H. Jones, et. al.. (2017). The EU-AIMS Longitudinal European Autism Project (LEAP): design and methodologies to identify and validate stratification biomarkers for autism spectrum disorders. Molecular Autism. 8;
- Andre A. S. Goldani, Susan R. Downs, Felicia Widjaja, Brittany Lawton, Robert L. Hendren. (2014). Biomarkers in Autism. Front. Psychiatry. 5;
- Yang Zhou, Tobias Kaiser, Patrícia Monteiro, Xiangyu Zhang, Marie. S. Van der Goes, et. al.. (2016). Mice with Shank3 Mutations Associated with ASD and Schizophrenia Display Both Shared and Distinct Defects. Neuron. 89, 147-162;
- Ana de Sena Cortabitarte, Franziska Degenhardt, Jana Strohmaier, Maren Lang, Birgit Weiss, et. al.. (2017). Investigation of SHANK3 in schizophrenia. Am. J. Med. Genet.. 174, 390-398.






