Фантастический комплемент и где он обитает
17 марта 2025
Фантастический комплемент и где он обитает
- 1389
- 0
- 7
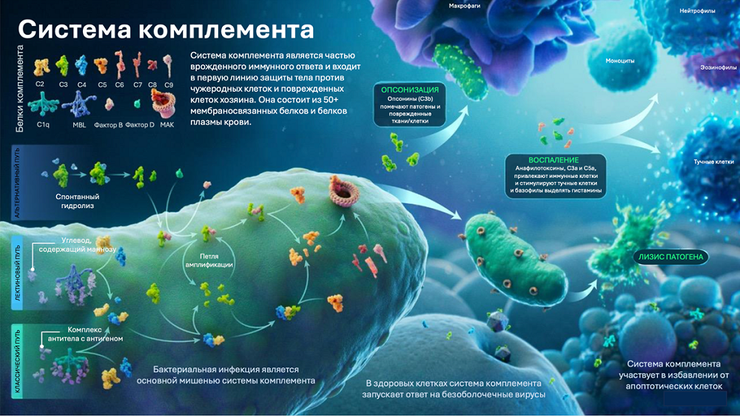
Система комплемента — важная часть врожденного иммунного ответа, включающая в себя более 50 мембраносвязанных белков и белков плазмы крови. Активация системы комплемента может быть вызвана попаданием патогенов (бактерий, вирусов, паразитов) в организм или повреждением собственных тканей хозяина и протекает по трем путям: классическому, альтернативному или лектиновому. Действие системы комплемента основано на каскаде протеолитических реакций, и результатом является выработка мощных провоспалительных медиаторов, лизис патогенных клеток и опсонизация.
Рисунок в полном размере.
адаптировано по материалам сайта azuravesta.com
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Система комплемента — важная часть врожденного иммунного ответа, одна из первых включающаяся в защиту. В систему комплемента входят более 50 белков плазмы крови, которые в основном синтезируются в печени, и мембраносвязанных белков. Действие системы комплемента основано на каскаде протеолитических реакций, и результатом является лизис патогенных клеток, индукция воспаления и привлечение фагоцитов в место инфекции. Активность системы комплемента в норме строго регулируется организмом. Относительно недавно была создана и сейчас активно развивается концепция комплосомы — внутриклеточного комплемента, который оказывает влияние на метаболизм и поведение клеток, и его функции внутри клетки выходят за пределы традиционных представлений о системе комплемента.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Система комплемента — система из более чем 50 мембраносвязанных белков и белков плазмы крови, которая одной из первых включается в иммунный ответ при проникновении патогенов в организм. Комплемент способен избирательно помечать патогенные клетки бактерий для их дальнейшей идентификации фагоцитами, привлекать в место инфицирования другие иммунные клетки и непосредственно лизировать чужеродные клетки [1]. Более того, система комплемента является связующим звеном между адаптивным и врожденным иммунитетом [2]. Систему комплемента открыли еще в конце XIX века, активно изучали в начале XX века, а полностью определили все белки системы комплемента и механизмы его действия к 1980-м годам [3]. Но мы знаем еще далеко не все о комплементе, и его исследования представляют чрезвычайный интерес: недавно ученым удалось выяснить, что комплемент «обитает» не только в плазме крови, но и внутри клеток, и его функции распространяются далеко за пределы реакций врожденного иммунитета.
Добро пожаловать в путешествие по интереснейшему миру системы комплемента!
Nota bene о происхождении и истории изучения комплемента
Система комплемента — это часть врожденного гуморального иммунного ответа, представляющая собой систему сигнальных ферментов. Действие комплемента основано на каскаде протеолитических реакций, запускаемых при попадании в организм патогенных микроорганизмов или появлении апоптотических телец. Собственные клетки организма хозяина защищены от действия системы комплемента специальными мембраносвязанными регуляторными белками, которые подавляют активацию комплемента. Апоптотические тельца не имеют таких белков-регуляторов и поэтому могут становиться мишенью для системы комплемента. Активация системы комплемента ведет к развитию воспаления в месте попадания инфекции, привлечению фагоцитов к патогенным клеткам, а также их лизису с участием непосредственно белков комплемента [1].
Система комплемента гораздо древнее адаптивного иммунитета, возникшего у челюстных позвоночных; это подтверждается тем, что примитивная система комплемента обнаруживается у большинства сохранившихся вторичноротых. Гены, кодирующие белки комплемента или его гомологи, были также обнаружены и у бесчелюстных позвоночных, и у беспозвоночных вторичноротых. Костистые рыбы и высшие позвоночные имеют практически одинаковый набор генов комплемента, у асцидий присутствуют представители большинства семейств генов комплемента. Гены C3 и фактора B были обнаружены в геноме представителей типа стрекающих — у мечехвоста и морской анемоны, что указывает на то, что центральная часть системы комплемента появилась более 1000 млн лет назад [4]. Ключевой белок системы комплемента C3 был обнаружен у миноги, асцидии и морского ежа, и у бесчелюстных позвоночных он обладает структурными особенностями С3 млекопитающих — тиоэфирным сайтом и мотивом β-α-процессинга. C3 образуется из предшественника про-C3 путем удаления 4 остатков аминокислот мотива RXXR, где R — остатки аргинина. процессинг pro-C3 ведет к образованию α и β цепей зрелого С3. Более того, эти белки выполняют схожие функции, что и у позвоночных. Было показано, что С3 у миноги действует как важный фактор фагоцитоза эритроцитов кролика, а С3 у асцидии обладает опсоническим действием — он усиливает фагоцитоз инородных частиц целомоцитами асцидий (это клетки «крови», обнаруживаемые в целомической жидкости). У голохордового Amphioxus был обнаружен C6-подобный ген, потенциально вовлеченный в процессы повреждения мембран [4], [5].
Изучение системы комплемента началось еще в конце XIX века, когда Ганс Бухнер и его коллеги открыли, что в крови существует еще один фактор, участвующий в иммунном ответе помимо фагоцитов, а в 1895 бельгийский врач-исследователь Жюль Борде обнаружил, что термостабильное вещество в сыворотке крови иммунизированных животных агглютинирует живые холерные вибрионы, но не уничтожает их (этим термостабильным веществом были антитела), а термолабильный компонент лизирует вибрионы. Причем этот компонент, названный другим исследователем комплемента Бухнером алексином, проявлял и гемолитическую активность по отношению к чужеродным эритроцитам. Пауль Эрлих ввел термин «комплемент», назвав так специальный термолабильный антимикробный компонент крови, который связывается с антителом и необходим для иммунного ответа. Согласно теории Эрлиха, антитело и комплемент, объединяясь, образуют сложный фермент, способный атаковать и убивать клетки и микроорганизмы. Концепция Эрлиха подчеркивала наличие в сыворотке множества антигенов и компонентов комплемента, в то время как точка зрения Борде основывалась на «единственном компоненте комплемента», который неспецифически связывается с антигеном. Адольфо Феррата в 1907 году представил доказательства того, что комплемент не является единым веществом: методом химического осаждения он получил две фракции комплемента — осажденная «средняя» часть (с белком, названным C’1, и содержащая С1 и часть С3 белка комплемента в современной терминологии) и «конечная» часть в растворе (с белком C’2, содержащая все остальные белки комплемента), причем бактерицидная активность наблюдалась только при наличии обеих фракций. Позднее были открыты еще два компонента, которые участвуют в реакциях системы комплемента, и в порядке обнаружения они были названы С’3 и С’4. Исследования, которые вели Эмиль фон Дангерн, Артур Кока и группа Хьюго Уайтхеда, Джона Гордона и Артура Уормолла параллельно, показали, что, помимо С’1 и С’2, в сыворотке крови существует термостабильный (при 56 oC в течение 30 минут) компонент, инактивируемый дрожжами — он был назван С’3. Эксперименты группы Уайтхеда, Гордона и Уормолла выявили еще один термостабильный компонент комплемента, чувствительный к обработке аммиаком — С’4 [3], [6].

Рисунок 1. Порядок активации компонентов классического пути комплемента. С1 связывается с антигеном в составе иммунного комплекса антиген-антитело, активируется и расщепляет С4 и С2. Фрагменты протеолиза С4 и С2 образуют С3-конвертазу, которая расщепляет С3. Ковалентное связывание фрагмента протеолиза С3 и С3-конвертазы приводит к образованию С5-конвертазы. Фрагмент расщепления С5 и белки С6, С7, С8 и С9 образуют пору в клеточной стенке бактерии — мембраноатакующий комплекс (МАК).
работа автора; при создании использовались изображения из сервиса BioRender и с сайта creative-biolabs.com
С развитием таких технологий, как препаративная хроматография, аналитический электрофорез и ультрацентрифугирование, в 1950–1960-х удалось показать белковую природу комплемента и отбросить гипотезы о его липидном происхождении. С использованием хроматографии удалось разделить известные фракции комплемента С’1—C’4 на отдельные белки, их составляющие. C3, первоначально описанный в 1920—х годах, теперь был представлен как состоящий из шести белков, и первоначально они назывались C’3a—C’3f в порядке их обнаружения (белки, которые мы теперь знаем как C3, C5, C6, C7, C8 и C9). В 1966 Роберт Нельсон, Йорг Дженсен, Ирма Джильи и Нобору Тамура использовали осаждение и многоступенчатую ионообменную хроматографию, чтобы выделить белки, которые мы сейчас знаем как С1—С9, из сыворотки крови морской свинки. Ганс Мюллер-Эберхард и его коллеги в 1960 году продемонстрировали, что С3 является основным белком сыворотки крови с концентрацией около 1 мг/мл, и создали специфическое антитело к нему, которое позволило в том числе визуализировать связанный С3 in vivo в тканях при различных заболеваниях (в том числе в ткани печени человека при системной волчанке, ткани почек при нефрите и ткани селезенки при амилоидозе). Исследователю Ульфу Нильссону и его коллегам удалось определить последовательность активации ферментов комплемента в классическом пути (существуют еще два пути, помимо классического; о них мы подробно поговорим позднее): сначала С1 связывается с антителом, затем последовательно в реакцию включаются C4, С2, C3, C5, C6, C7, C8 и C9 (рис. 1) [3], [6].
К началу 1970-х годов были разработаны методы выделения и очистки всех основных компонентов классического пути комплемента — С1—С9, а также факторов B и D альтернативного пути (фактор B участвует в образовании С3-конвертазы, а фактор D активирует ее). Значительный вклад в эту работу внесли Ганс Мюллер-Эберхард и Дуглас Фирон. Выделение всех основных белков системы позволило провести исследования того, как белки комплемента взаимодействуют друг с другом. Одной из наиболее сложных проблем было выделение нестабильных комплексов C5-конвертаз, состоящих из трех молекул. Киношита и коллеги показали, что они соединены ковалентной связью молекулы C3b с молекулой C4b или с молекулой другого C3b и что комплекс C3b-C4b или C3b-C3b образуют сайт связывания для субстрата — C5 [6].
К концу 1980-х годов было отсеквенировано большинство кодирующих нуклеотидных и аминокислотных последовательностей основных сывороточных и поверхностно-клеточных белков комплемента. Благодаря определению последовательности стало возможным распознать домены в белках комплемента, что сильно облегчило дальнейшее изучение комплемента: для исследования функций и сайтов связывания белков теперь можно было использовать мутанты с делецией домена или экспрессию отдельного домена, а не целого белка [3], [6].
Активация системы комплемента
Система комплемента — это важный игрок первой линии иммунной защиты. Он включается в иммунный ответ против патогенов еще до клеток врожденного ответа — фагоцитов, которые начинают свою борьбу с нарушителями границ уже в первые часы после их попадания в организм. Более того, белки системы комплемента даже обладают способностью привлекать фагоциты и антитела в место обнаружения патогенов.
Активация системы комплемента может идти по трем путям: классическому, лектиновому и альтернативному (рис. 2). Классический путь был открыт первым, но эволюционно более древним является альтернативный путь. Три пути активации различаются по мишеням, которые и вызывают эту самую активацию, и паттерн-распознающим молекулам, но все эти пути сходятся в одной точке — образовании С3-конвертаз. Далее следует этап образования мембран-атакующего комплекса, но к этому мы вернемся позднее [1].

Рисунок 2. Пути активации системы комплемента. Существуют три пути активации системы комплемента: классический, лектиновый и альтернативный. Все три пути включают следующие стадии: инициации, амплификация сигнала, образование С5-конвертаз и образование мембраноатакующего комплекса (МАК).
С1-INH — C1-inhibitor, ингибитор С1; МАК — мембраноатакующий комплекс; MBL — mannose-binding lectin, маннозосвязывающий лектин.
адаптировано из [6]
Активация системы комплемента по классическому пути происходит, когда белок С1 (на самом деле, комплекс из трех белков — C1q и сериновых протеаз C1r и C1s) связывается с Fc-участками антител, прикрепленных к поверхности патогенных клетокм. Связывать комплемент могут не все антитела — только антитела классов G, M и A. В этом есть биологический смысл: антитела IgM являются неспецифическими антителами, которые циркулируют в токе крови в виде пентамеров и способны распознавать широкий спектр патогенов, благодаря чему IgM первыми отвечают на попадание патогенов в организм. IgA существуют в виде димеров и распространены на поверхности слизистых оболочек (то есть на барьерных тканях) и тоже одними из первых реагируют на инфекцию. Не все подклассы IgG одинаково способны активировать систему комплемента: наиболее способными активаторами комплемента являются IgG1 и IgG3 [7]. Таким образом, систему комплемента активируют антитела, реагирующие на инфекцию первыми, и система комплемента включается в иммунный ответ уже на первых стадиях заражения; количество антител тоже играет в этом роль, и это оправдано — чем больше антител связано, тем более вероятно, что активация довольно опасной и разрушительной системы комплемента не будет «ложной тревогой».
После связывания с антителом происходит перестройка комплекса C1, и протеазы С1r и C1s активируются и расщепляют белки C4 и С2 на фрагменты C4b и C2a, которые в будущем станут C3-конвертазой, и C4a и С2b, которые являются медиаторами воспаления. С4b ковалентно связывается с поверхностью патогена и связывает молекулу C2a с образованием комплекса С4bC2a — С3-конвертазы. С3-конвертаза расщепляет С3 на анафилотоксин С3а и опсонин С3b. При расщеплении белка конформационные изменения ведут к открытию во фрагменте С3b крайне активной тиоэфирной связи, способной связывать гидроксильные группы ближайших углеводов и белков и тем самым метить микроорганизмы, как чужие [1], [2], [8]. Мы подошли к точке, в которой сходятся все три пути активации комплемента. Но, прежде чем мы пойдем дальше, давайте сначала обсудим еще два пути активации.
Лектиновый путь активируется образ-распознающими рецепторами, которые распознают и связывают углеводы на поверхности патогенов. К этим рецепторам относятся лектины: маннозосвязывающий лектин и фиколины. Они специализируются на распознавании нескольких высококонсервативных структур, присутствующих в большинстве групп микроорганизмов — молекулярные паттерны, ассоциированные с патогеном (PAMPs); к ним относятся, например, липотейхоевая кислота, которая содержится в клеточной стенке грамположительных бактерий. Рецептор лектинового пути (маннозосвязывающий лектин или фиколин) образует комплекс с MBL-ассоциированными протеазами (MASP) 1, 2 и 3 — этот комплекс аналогичен C1 классического пути. Связывание MBL с патогеном вызывает конформационные перестройки в комплексе и активацию MASP, которые теперь могут расщеплять С4 и С2 с образованием комплекса С4bC2а, являющегося С3-конвертазой [1], [8].
Активация альтернативного пути отличается от лектинового и классического: за нее ответственен спонтанный гидролиз C3. Домен с тиоэфирной связью у С3 спрятан гидрофобным окружением нативной молекулы, но, так как белок находится в жидкой фазе, а именно, в плазме крови, гидрофобные домены могут незначительно расходиться, приоткрывая тиоэфирную связь, которая моментально подвергается гидролизу. Гидролизованная форма C3 обозначается C3b(H2O). События спонтанного гидролиза происходят часто, и в крови постоянно присутствуют «вспышки» таких активированных молекул С3. C3(H2O) имеет, как и C3b, реакционноспособную тиоэфирную связь, и способен связываться с одним из белков системы комплемента — фактором B. Стабилизация фактора B делает его уязвимым для расщепления фактором D на Bb и Ba. Образующийся комплекс C3(H2O)Bb является С3-конвертазой альтернативного пути [1], [2].
Недавно были описаны два дополнительных механизма активации комплемента с неопределенными в настоящее время физиологическими ролями. Первый механизм основан на том, что пропердин (один из белков-регуляторов комплемента) может способствовать сборке С3-конвертазы de novo при иммобилизации на инертных поверхностях и инициировать образование С3-конвертазы на поверхностях микроорганизмов (например, на поверхности Neisseria gonorrhoeae). Кроме того, С3 и С5 могут расщепляться протеазами, не связанными с каскадом комплемента, такими как калликреин и тромбин (они участвуют в свертывании крови). Это приводит к появлению дополнительного источника анафилотоксинов, а также устанавливает новую связь между каскадами комплемента и свертывания крови [2].
Дальнейшая судьба комплемента
После того, как три пути активации комплемента сходятся в одной точке — образовании С3-конвертазы, комплемент может осуществлять свою эффекторную функцию в трех направлениях (рис. 3):
- Образование мембраноатакующего комплекса (МАК) и лизис помеченных комплементом патогенов;
- Воспалительная реакция путем выработки мощных провоспалительных анафилотоксинов;
- Опсонизация патогенных поверхностей, что ведет к их дальнейшему фагоцитозу [1].
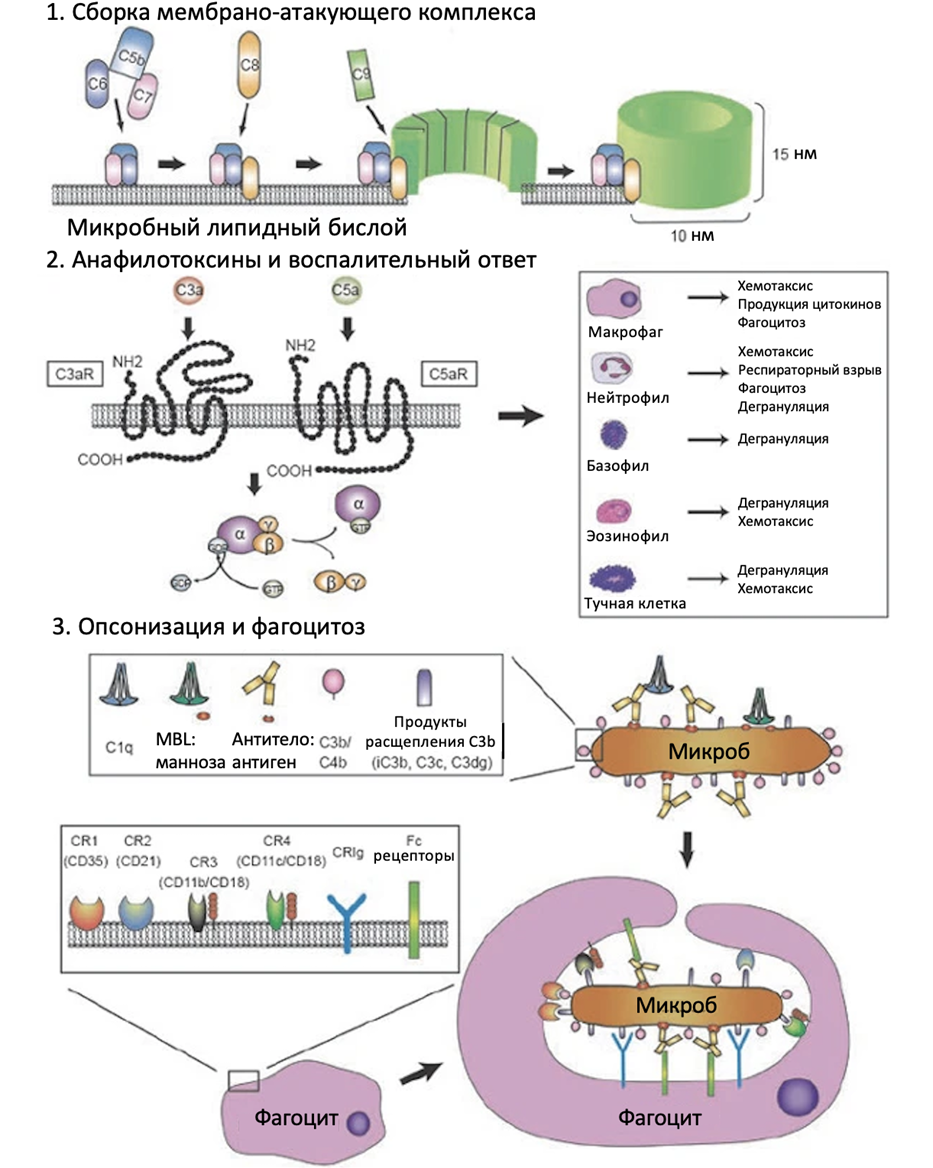
Рисунок 3. Эффекторные функции комплемента. Система комплемента действует тремя способами: через лизис клеток патогенов, через индукцию воспаления при помощи анафилотоксинов и через опсонизацию клеток бактерий.
адаптировано из [1]
Сборка МАК происходит, когда C3b после его прикрепления к поверхности клеток ковалентно связывается с С3-конвертазой и образует С5-конвертазу (C4bC2aC3b классического и лектинового путей и C3bBbC3b альтернативного пути), которая расщепляет С5 на анафилотоксин С5а и компонент МАК C5b. C5b способен связываться с С6, а комплекс С5bC6, в свою очередь, обратимо связывается с поверхностями-мишенями и служит основой для дальнейшей сборки МАК. Далее к нему присоединяется С7, и комплекс С5bC6С7 способен интегрироваться в фосфолипидный мембранный бислой, что служит опорой для внедрения в мембрану компонентов комплемента С8α и С8β. Комплекс С5bC6С7С8 образует в мембране нестабильные поры; связывание С9 с С8α и инициация полимеризации множества молекул С9 ведет к образованию стабильных пор с максимальным диаметром 10 нм (до 13 молекул С9). В мембране могут образовываться множество МАК, и такая «продырявленная» клетка подвергается лизису [1], [9].
Анафилотоксины C3a и C5a — высокородственные провоспалительные молекулы с высокой степенью родства, которые образуются в результате протеолитической активации белков комплемента C3 и C5. Анафилотоксины воздействуют на клетки преимущественно миелоидного ряда (гранулоциты, моноциты, макрофаги, тучные клетки и некоторые дендритные клетки) и привлекают их в место инфицирования. Для взаимодействия с анафилотоксинами фагоциты имеют специальные рецепторы C5aR и С3aR — это рецепторы семейства G-белок-связанных рецепторов с выделяющейся структурой: они состоят из 7 доменов, пронизывающих мембрану. Анафилотоксины взаимодействуют с внеклеточной N-концевой частью рецепторов C3aR и C5aR, что приводит к изменению конформации C-концевой части рецептора, ее связыванию с G-белком и запуску нижестоящих сигнальных путей, которые ведут к высвобождению провоспалительных цитокинов и усилению фагоцитоза [1], [2].
Фагоциты распознают и поглощают клетки, покрытые опсонинами. Для этого у них имеются специальные рецепторы, связывающие различные компоненты системы комплемента: CR1, CR2, CR3, CR4 и CRIg (рис. 4) [10].
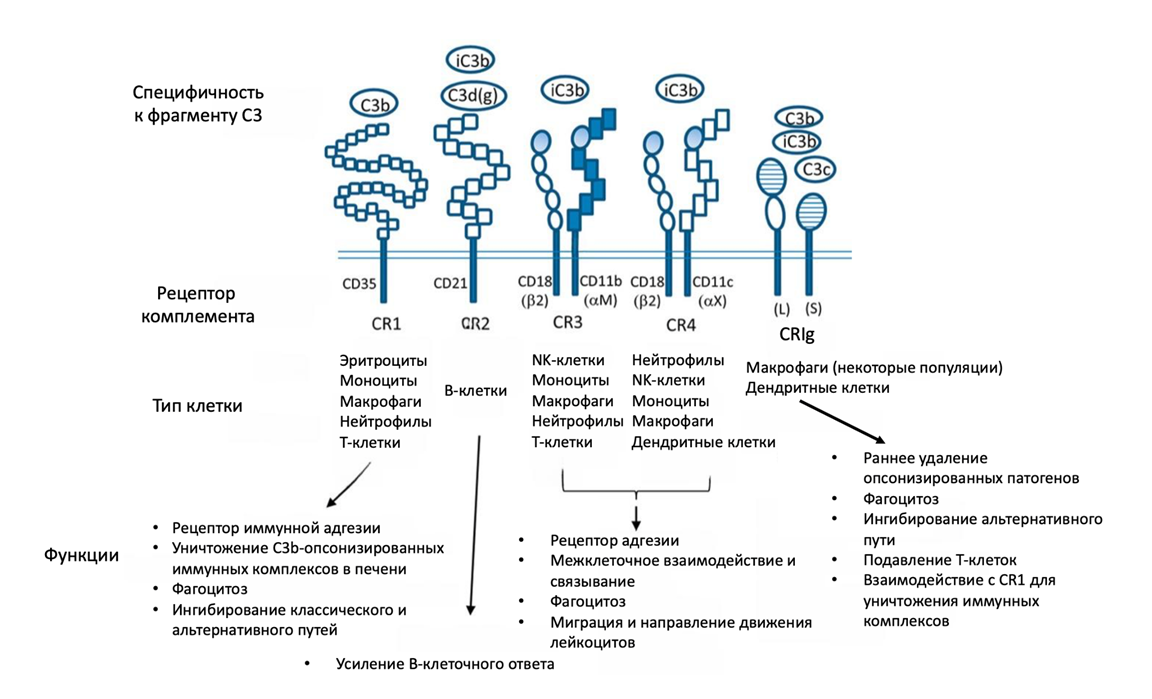
Рисунок 4. Рецепторы иммунных клеток, связывающие опсонины. Рецепторы различаются по типам клеток, на которых экспрессируются, и по распознаваемым фрагментам расщепления С3. Функции рецепторов не ограничиваются только участием в фагоцитозе: CR1 является важным регулятором классического и альтернативного путей комплемента, CR3 и CR4 участвуют в миграции и адгезии иммунных клеток, а с CR2 все сложно (по разным данным он усиливает либо подавляет В-клеточный иммунный ответ).
адаптировано из [10]
CR1 — это мембранный гликопротеин, который экспрессируется на поверхности эритроцитов и иммунных клеток и связывает C3b и C4b. CR1 играет и другую важную роль, помимо фагоцитоза: после связывания со своими мишенями он стимулирует иммунные клетки выделять провоспалительные молекулы (такие как интерлейкин IL-1α, интерлейкин IL-1β и простагландины), а также способен связывать C3b и C4b в составе C3- и С5-конвертаз и тем самым ускоряет их распад, регулируя классический и альтернативный пути активации комплемента. CR1 проявляет кофакторную активность по отношению к фактору I и вместе с ним инактивирует C3b, что служит еще одним механизмом регуляции альтернативного пути [1], [11].
CR2 представляет собой трансмембранный гликопротеин, который в основном экспрессируется В-лимфоцитами в составе корецепторного комплекса CR1-CR2. Он усиливает ответ В-лимфоцитов на антигены, несущие С3-производные фрагменты C3d, iC3b, C3dg; по крайней мере, так утверждает классическая парадигма [12]. Однако появляются исследования, которые опровергают эти данные. Дело в том, что у мышей CR1 и CR2 кодируются одним и тем же геном, и CR2 синтезируется в результате альтернативного сплайсинга, в то время как у человека CR1 и CR2 кодируются разными генами и сильно отличаются по структуре. CR2 у человека обладает той же С-концевой последовательностью и выполняет аналогичную роль корецептора, что и CR1/2 у мыши, а CR1 существенно отличается по структуре и ингибирует несколько функций В-лимфоцитов, включая пролиферацию и выработку антител. В связи с этим нельзя с полной уверенностью распространять результаты экспериментов с CR2 на мышах на человека. Было экспериментально показано, что CR2 у человека не усиливает выработку антител, а, наоборот, проявляет ингибирующие функции: экспрессия маркеров активации (включая CD69, один из первых фенотипических маркеров активации В-клеток), синтез цитокинов, пролиферация и выработка антител подавлялись при совместном воздействии CR2 и BCR на В-клетки человека. Авторы предположили механизм ингибирования: CR2 образует комплекс с CR1, из-за чего предотвращается взаимодействие CR2 и CD19, важной корецепторной молекулы, сигнал от которой необходим для активации В-лимфоцитов [13].
CR3 и CR4 принадлежат к семейству β2-интегринов и играют важную роль в фагоцитозе, адгезии и миграции клеток. Они связывают iC3b и индуцируют фагоцитоз iC3b-опсонизированных бактерий, причем из двух этих рецепторов преимущественно CR3 опосредует фагоцитоз. CR3 и CR4 также участвуют в образовании подосом — цитоскелетных структур на основе актина, связанных с мембраной и участвующих в миграции клеток [14]. Подосомы характерны для клеток моноцитарной линии: моноцитов, макрофагов, дендритных клеток и остеокластов [15].
CRIg экспрессируется на клетках Купфера — резидентных макрофагах печени. Перед клетками Купфера стоит ответственная задача: они должны фагоцитировать бактерии, попавшие из кишечника в печень через воротную вену, и не дать распространиться им дальше по организму. А помогает клеткам Купфера в выполнении этой важной миссии CRIg — рецептор комплемента из суперсемейства иммуноглобулинов, который опосредует фагоцитоз опсонизированных бактерий путем связывания C3b, iC3b и C3c и, более того, может непосредственно и независимо от комплемента связывать липотейхоевую кислоту на клеточной стенке грамположительных бактерий [10], [16].
Регуляция
Безусловно, такую мощную систему, как система комплемента, необходимо регулировать, чтобы она не навредила сама себе. В организме существует целая система сдержек и противовесов для комплемента. Мы рассмотрим некоторые из этих механизмов.
Стоит начать с того, что спонтанный гидролиз С3, который ведет к активации альтернативного пути комплемента и запускает петлю его амплификации, сам по себе является фактором риска аутоиммунного ответа [17]. Клетки хозяина должны быть защищены от атаки комплемента, и существует целый набор механизмов, который используется для этого. Прежде всего, собственные клетки организма защищены от воздействия комплемента специальными рецепторами (трансмембранными и мембраносвязывающими факторами) на своей поверхности, которые обезоруживают комплемент. К ним относятся CD59, CD46, DAF и CR1 [2], [18]. Гликопротеин CD59 блокирует включение С9 в комплекс С5b-C8 МАК и его полимеризацию. Гликопротеин DAF, рецептор CR1 и фактор Н связываются с С3b и C4b и тем самым ускоряют распад С3- и С5-конвертаз. CD46 (он же MCP), СR1 и фактор Н обладают кофакторной активностью по отношению к фактору I и способствует тем самым расщеплению C3b и C4b.
Существуют также и растворимые регуляторы активации комплемента, присутствующими в плазме крови. Альтернативный путь регулируется фактором H и пропердином (рис. 5). Пропердин высвобождается активированными нейтрофилами и стабилизирует С3-конвертазу комплемента, связываясь с C3b и предотвращая ее расщепление факторами H и I. Фактор H связывается со специфическими гликанами, присутствующими только на поверхности позвоночных животных — сиаловой кислотой, гепарином и сульфатированными гикозаминогликанами, и так способен помечать клетки хозяина от инфекционных агентов. Он способен связывать С3b, предотвращая его связывание с фактором B и препятствуя образованию С3-конвертазы C3bBb, а также способствует диссоциации Bb от уже собранного комплекса C3bBb. Более того, фактор В является кофактором сериновой протеазы фактора I (фактор I сам по себе не способен связывать C3b) и опосредует расщепление C3b до iC3b — неактивной формы C3b, неспособной образовать С3-конвертазу [2], [6].
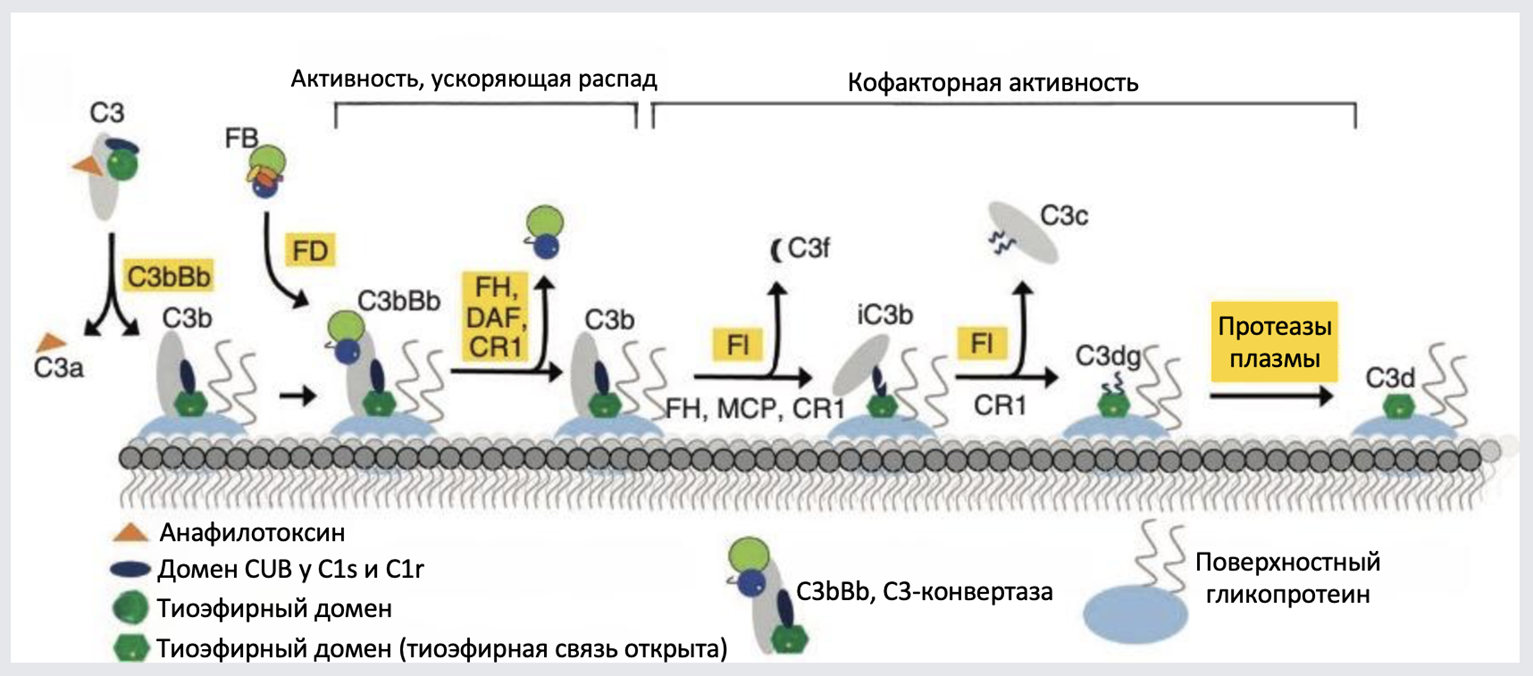
Рисунок 5. Факторы регуляции альтернативного пути системы комплемента. Механизмы регуляции можно обобщенно разделить на два направления: активность, ускоряющая распад С3-конвертазы, и кофакторная активность, при которой белок служит кофактором другого регулятора и опосредует расщепление одной из активированных молекул альтернативного пути.
FB — фактор B; FD — фактор D; FH — фактор Н; FI — фактор I; DAF — decay-accelerating factor, фактор, ускоряющий распад; MCP — мембранный кофакторный белок (membrane cofactor protein).
адаптировано из [18]
Регуляторами классического и лектинового пути являются С4-связывающий белок (C4BP) и ингибитор С1. С4BP действует аналогично фактору H, но связывает С4b, препятствуя образованию С3-конвертазы С4bC2a и способствуя диссоциации C2a от уже сформированного комплекса C4bC2a. C4BP так же, как и фактор Н, служит кофактором для фактора I и опосредует расщепление C4 до неактивной формы iC4b, неспособной образовать С3-конвертазу. C1-INH относится к семейству ингибиторов сериновых протеаз и необратимо блокирует C1r и C1s в составе С1 классического пути и MASP-1 и MASP-2 лектинового пути [2], [6].
Карбоксипептидаза N расщепляет С-концевые остатки аргинина C3a и C5a и тем самым инактивирует их анафилотоксическую функцию, так как в таком виде они больше не могут связываться с рецепторами C5aR и C3aR [6].
Кластерин и витронектин тоже являются растворимыми белками-регуляторами комплемента. Кластерин блокирует связывание С9 с комплексом C5b-C8. Витронектин ингибирует ассоциацию C5b-7 с мембранами, препятствуя сборке МАК и предотвращая лизис клеток [19].
Комплосома: начало
Как вы уже знаете, комплемент начали изучать еще в XIX веке. Система комплемента, как казалось, была ясна и понятна и не привлекала особого внимания вплоть до 2013 года, когда международная команда исследователей не представила миру доказательства, что комплемент еще может удивить! Оказывается, местом обитания белков комплемента является не только плазма крови: в цитозоле и органеллах клеток (и не только в иммунных) находятся целые белки комплемента, которые направляют жизненный путь клетки. В 2014 команда Клаудии Кемпер представила миру концепцию комплосомы [20]. Изначально внутриклеточные запасы С3, С3aR и катепсина L были обнаружены в CD4+ T-клетках, причем было показано, что они необходимы для поддержания гомеостаза Т-клеток и участвуют в их дифференцировке. Позднее транскрипты С3 и С5 были обнаружены во всех типах иммунных клеток, а в В-клетках и CD8+ T-клетках выявили внутриклеточный синтез и активацию С3. Более поздние исследования выявили, что внутри клетки откладываются и другие белки системы комплемента, а их роль в жизненном цикле клетки чрезвычайно важна [20], [21].
Каким образом белки комплемента попадают в клетку? Первое, что приходит на ум — они попадают в клетку извне, из внеклеточного пространства; и да, так действительно иногда происходит. Белки комплемента могут попадать в клетку через опсонизированные бактерии: например, фрагменты С3 могут попадать в эпителиальные клетки через опсонизированные патогены и запускать активацию митохондриального противовирусного сигнального белка. Клетка может повторно поглощать С3, который выработала и секретировала ранее. Клетка может даже просто активно поглощать белок из сыворотки крови, как в случае В-клеток, у которых поглощенный из крови С3 перемещается в ядро и, вероятно, участвует в регуляции транскрипции генов. Но основной путь пополнения запасов внутриклеточного комплемента — синтез самой клеткой. Белки комплосом кодируются теми же генами, что и белки системы комплемента, но по свойствам они отличаются от своих родственников из сыворотки крови; причиной этому служат различия в фолдинге и посттрансляционных модификациях. Так, в эпителиальных клетках С3 существует в цитоплазме в «развернутой» форме белка-предшественника и не имеет классического сигнального пептида секреции; внутриклеточный CD59 синтезируется путем альтернативного сплайсинга гена, кодирующего CD59 на поверхности клетки, и, следовательно, имеет отличную от него структуру. Более того, белки комплемента, которые попадают в клетку извне, не способны либо способны лишь частично выполнять функции внутриклеточного комплемента [20], [21].
Функции комплосомы
Комплосома участвует в основных физиологических процессах клетки (рис. 6). Локализация внутриклеточного комплемента часто связана с лизосомами и митохондриями и, поскольку лизосомы и митохондрии являются ключевыми компонентами клеточного метаболизма, неудивительно, что одна из основных функций внутриклеточного комплемента — контроль клеточного метаболизма.
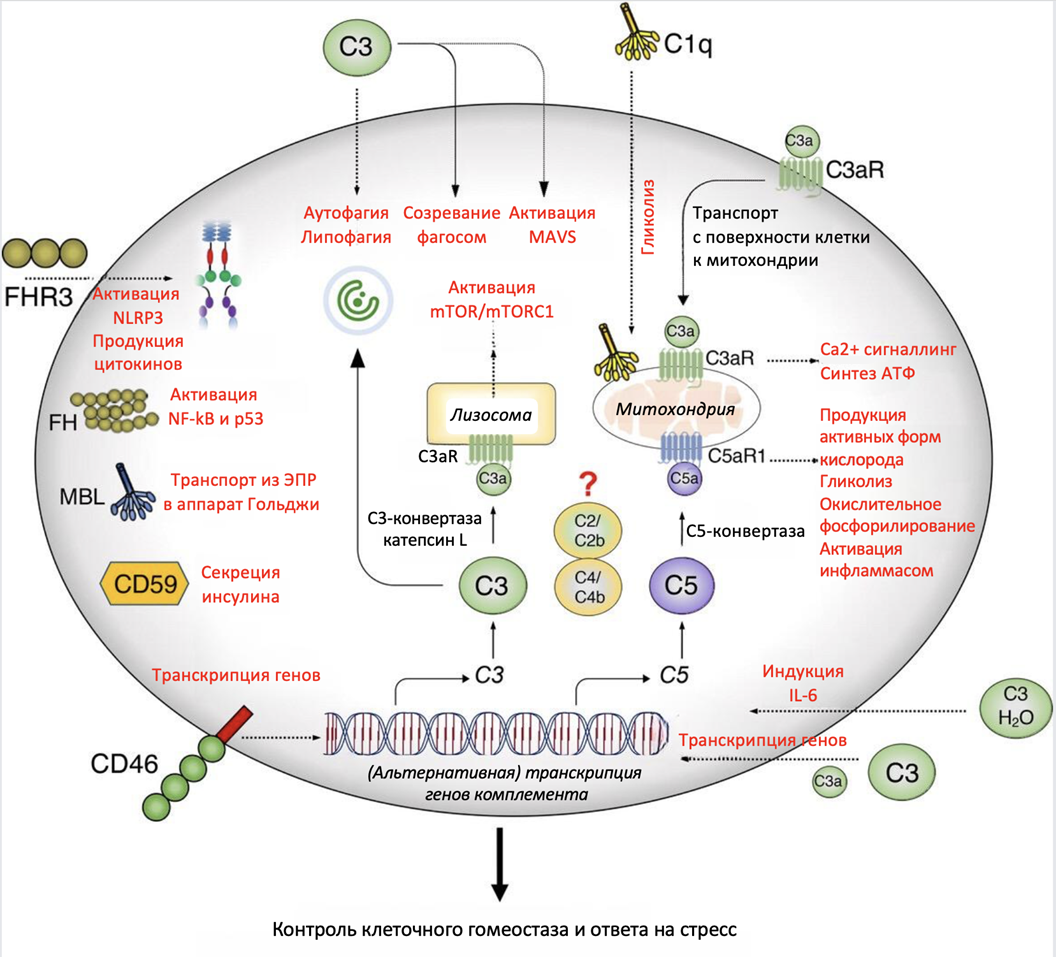
Рисунок 6. Функции внутриклеточного комплемента. Белки комплемента могут синтезироваться в клетке или попадать в нее извне. Затем они могут расщепляться внутриклеточными С3- и С5-конвертазами с образованием своих активированных форм и осуществлять регуляцию ряда важнейших физиологических процессов клетки, среди которых процессы клеточного метаболизма, транскрипция генов и аутофагия.
FH — фактор H; FHR3 — factor H-related protein 3, белок 3, связанный с фактором H; MAVS — mitochondrial antiviral signaling protein, митохондриальный противовирусный сигнальный белок; MBL — mannose-binding protein, белок, связывающий маннозу; mTOR — the mammalian target of rapamycin, мишень рапамицина у млекопитающих; mTORC1 — mammalian target of rapamycin complex 1, мишень рапамицинового комплекса 1 у млекопитающих; NLRP3 — NOD-, LRR- and pyrin domain-containing protein 3 inflammasome, инфламмасома белка 3, содержащая NOD-, LRR- и пириновый домен; «?» указывает на то, что функция внутриклеточной активации C2 и C4 в настоящее время неизвестна.
адаптировано из [21]
C3 в CD4+ T-клетках расщепляется протеазой катепсин L на фрагменты C3a и C3b, то есть, С3 протеолитически активируется и внутри клетки, но без использования специальных С3-конвертаз. Кроме того, внутриклеточные С3 и С5 также могут активироваться расщеплением специфическими протеазами или внутриклеточными С3- и С5-конвертазами, которые образуются на поверхности субклеточных компартментов. Внутриклеточно генерируемый C3a взаимодействует с C3aR, экспрессируемым лизосомами, и поддерживает активацию mTOR у млекопитающих. При активации Toll-подобных рецепторов C3a и C3b перемещаются на поверхность Тh1-клетки и передают сигналы аутокринным образом через свои рецепторы C3aR и CD46, индуцируя иммунный ответ Th1-клеток и выработку IFN-γ. Аутокринная активация CD46 через сигнальный путь mTOR способствует окислительному фосфорилированию и гликолизу, двум процессам, необходимым для выработки IFN-γ. Более того, во время активации Т-клеток сигналы, опосредованные CD46, обеспечивают приток питательных веществ посредством экспрессии большого переносчика нейтральных аминокислот 1 (LAT1) и переносчика глюкозы 1 (GLUT1). Таким образом, белки комплосомы запускают метаболическое перепрограммирование в Th1-клетках, необходимое для секреции провоспалительного цитокина IFN-γ и индукции иммунного ответа Th1-клеток [20], [22], [23].
У моноцитов и макрофагов выработка провоспалительного IL-1β во время иммунного ответа зависит от внутриклеточной активации C3 и C5. Значительная часть воздействия комплосомы на моноциты и макрофаги обусловлена сигнализацией рецептора C5aR1, экспрессируемого в митохондриях, и C5aR1-опосредованным контролем направления потока цепи переноса электронов (ETC) — ее нарушения изменяет морфологию митохондриальной сети и метаболизм клеток. Моноциты и макрофаги человека транскрибируют гены C2 и C4 и содержат внутриклеточные запасы белков C2 и С4 и продуктов их протеолитического расщепления C2b и C4b, то есть, они не просто экспрессируются, но и активируются протеазами внутри клетки, правда, их функции пока неизвестны [20], [21], [23].
Роль комплосомы в жизни клетки не ограничивается только контролем метаболизма. Вторая ее важнейшая функция, известная на данный момент — это аутофагия. Аутофагия — это процесс самоочищения клетки от аберрантных белков, поврежденных органоидов и внутриклеточных патогенов путем их внутриклеточной деградации [24]. Одним из примеров участия комплемента в аутофагии является прямое взаимодействие C3b, попадающего в цитозоль эпителиальных клеток с помощью C3b-опсонизированных бактерий Listeria monocytogenes, с белком аутофагии ATGL16L1. Внутриклеточный С3 в гепатоцитах мыши поддерживает низкоуровневую липофагию — специализированную форму аутофагии — путем контроля уровней триглицеридов. В β-клетках поджелудочной железы человека внутриклеточный C3 индуцирует защитную аутофагию во время гликолитического стресса и поддерживает выживаемость клеток [20], [22].
Комплосома также способна влиять на экспрессию генов и трансляцию белков. Например, после связывания трансмембранного рецептора CD46 его цитоплазматические домены CYT1 и CYT2 транслоцируются в ядро, где запускают транскрипцию генов ряда метаболических и сигнальных путей. Ядерная транслокация CYT1 и CYT2 имеет решающее значение для индукции метаболических изменений, вызываемых CD46. В В-лимфоцитах С3 участвует в регуляции взаимодействия гистонов и ДНК [20], [22]. Было показано, что в эпителиальных клетках линии рака мочевого пузыря CYT-2 напрямую связывается с гетерогенным ядерным рибонуклеопротеином (hnRNP) A1 и облегчает взаимодействие hnRNPA1 с IRES-РНК, способствуя IRES-зависимой трансляции определенных мРНК (а именно, способствующих развитию рака мочевого пузыря HIF1a и c-Myc). Иными словами, CD46 способен избирательно регулировать трансляцию белков. Это исследование также показывает, какие поразительные результаты могут быть получены в дальнейшем при изучении связи белков комплосомы и различных заболеваний [25].
Заключение
Комплемент — мощная и важная система, которая одной из первых включается в процессы врожденного иммунного ответа. Система комплемента активно изучается в контексте различных патологий, вызванных дефицитами или дисфункциями ее компонентов, и представляет исследовательский интерес в этой области. Но, оказывается, функции системы комплемента распространяются далеко за пределы наших классических представлений о ней, и ее влияние на жизненный путь клеток нашего организма еще предстоит исследовать. Одним из перспективных направлений в исследованиях комплемента в XXI веке является комплосома. Эта интересная научная концепция проливает свет на механизмы влияния системы комплемента на внутриклеточные процессы, сопутствующие иммунному ответу, и на жизненный путь клетки в целом. Исследования внутриклеточного комплемента могут в том числе быть полезны и для понимания причин и механизмов патологий комплемента и служить базой для разработки персонализированной терапии. Уже известно, что влияние комплосомы на метаболизм и развитие клеток велико, поэтому исследование внутриклеточного комплемента и манипулирование им потенциально может дать результаты, которые сейчас сложно даже предположить.
Литература
- Jason R Dunkelberger, Wen-Chao Song. (2010). Complement and its role in innate and adaptive immune responses. Cell Res. 20, 34-50;
- J. Vidya Sarma, Peter A. Ward. (2011). The complement system. Cell Tissue Res. 343, 227-235;
- R.B. Sim, W. Schwaeble, T. Fujita. (2016). Complement research in the 18th–21st centuries: Progress comes with new technology. Immunobiology. 221, 1037-1045;
- Masaru Nonaka, Ayuko Kimura. (2006). Genomic view of the evolution of the complement system. Immunogenetics. 58, 701-713;
- 10.1016/S0952-7915(00)004-9;
- Prabhu Nesargikar, B. Spiller, R. Chavez. (2012). The complement system: History, pathways, cascade and inhibitors. European Journal of Microbiology and Immunology. 2, 103-111;
- Nina A. Daha, Nirmal K. Banda, Anja Roos, Frank J. Beurskens, Joost M. Bakker, et. al.. (2011). Complement activation by (auto-) antibodies. Molecular Immunology. 48, 1656-1665;
- Erin E. West, Claudia Kemper. (2023). Complosome — the intracellular complement system. Nat Rev Nephrol. 19, 426-439;
- Catherine B. Xie, Dan Jane-Wit, Jordan S. Pober. (2020). Complement Membrane Attack Complex. The American Journal of Pathology. 190, 1138-1150;
- AG Small, M Al-Baghdadi, A Quach, C Hii, A Ferrante. (2016). Complement receptor immunoglobulin: a control point in infection and immunity, inflammation and cancer. Swiss Med Wkly;
- Matthew P. Hardy, Mariam Mansour, Tony Rowe, Sandra Wymann. (2023). The Molecular Mechanisms of Complement Receptor 1—It Is Complicated. Biomolecules. 13, 1522;
- Ramon Roozendaal, Michael C. Carroll. (2007). Complement receptors CD21 and CD35 in humoral immunity. Immunological Reviews. 219, 157-166;
- Kristóf G. Kovács, Bernadett Mácsik-Valent, János Matkó, Zsuzsa Bajtay, Anna Erdei. (2021). Revisiting the Coreceptor Function of Complement Receptor Type 2 (CR2, CD21); Coengagement With the B-Cell Receptor Inhibits the Activation, Proliferation, and Antibody Production of Human B Cells. Front. Immunol.. 12;
- Szilvia Lukácsi, Zsuzsa Nagy-Baló, Anna Erdei, Noémi Sándor, Zsuzsa Bajtay. (2017). The role of CR3 (CD11b/CD18) and CR4 (CD11c/CD18) in complement-mediated phagocytosis and podosome formation by human phagocytes. Immunology Letters. 189, 64-72;
- Stefan Linder, Christiane Wiesner. (2015). Tools of the trade: podosomes as multipurpose organelles of monocytic cells. Cell. Mol. Life Sci.. 72, 121-135;
- Yi Duan, Huikuan Chu, Katharina Brandl, Lu Jiang, Suling Zeng, et. al.. (2021). CRIg on liver macrophages clears pathobionts and protects against alcoholic liver disease. Nat Commun. 12;
- Michael K. Pangburn. (2023). Initiation of the alternative pathway of complement and the history of “tickover”. Immunological Reviews. 313, 64-70;
- Hugh P Morgan, Christoph Q Schmidt, Mara Guariento, Bärbel S Blaum, Dominic Gillespie, et. al.. (2011). Structural basis for engagement by complement factor H of C3b on a self surface. Nat Struct Mol Biol. 18, 463-470;
- Heeyeon Cho. (2015). Complement regulation: physiology and disease relevance. Korean J Pediatr. 58, 239;
- Fang Xiao, Jixu Guo, Stephen Tomlinson, Guandou Yuan, Songqing He. (2023). The role of the complosome in health and disease. Front. Immunol.. 14;
- Parul Singh, Claudia Kemper. (2023). Complement, complosome, and complotype: A perspective. Eur J Immunol. 53;
- Erin E. West, Claudia Kemper. (2023). Complosome — the intracellular complement system. Nat Rev Nephrol. 19, 426-439;
- Giuseppina Arbore, Claudia Kemper, Martin Kolev. (2017). Intracellular complement − the complosome − in immune cell regulation. Molecular Immunology. 89, 2-9;
- Danielle Glick, Sandra Barth, Kay F. Macleod. (2010). Autophagy: cellular and molecular mechanisms. The Journal of Pathology. 221, 3-12;
- Jin Zeng, Hua Xu, Chunhua Huang, Yi Sun, Haibing Xiao, et. al.. (2021). CD46 splice variant enhances translation of specific mRNAs linked to an aggressive tumor cell phenotype in bladder cancer. Molecular Therapy - Nucleic Acids. 24, 140-153.