Фармакоэкономика: лечить или экономить?
19 марта 2021
Фармакоэкономика: лечить или экономить?
- 3186
- 0
- 5
Подробнее об этой науке, ее методах, а также о том, почему в последние годы в поисках подходящего инструментария для принятия оптимальных решений на нее все чаще обращают взор общественность, медицинские специалисты и регулирующие организации — в нашей статье. При создании лекарства приходится учитывать не только его эффективность и безопасность, но и то, какой экономический эффект даст его внедрение. Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
«Сколько фармакоэкономистов нужно, чтобы поменять лампочку? Правильный ответ — четыре! Один оценит стоимость замены лампочки, второй — рассчитает срок службы новой лампочки, третий выяснит, как изменится качество жизни благодаря свету от новой лампочки, и, наконец, последний предоставит всю информацию лицу, принимающему решение, таким образом, чтобы убедить его выкрутить старую лампочку и поставить новую». Эта остроумная цитата иллюстрирует не только как фармакоэкономика помогает принимать решения в здравоохранении, но и некоторые сложности на пути ее широкого внедрения в практику, ведь пока что потенциал этой науки выше возможностей применения. Впрочем, приведенная метафора отражает лишь суть, но никак не сложность, а ведь фармакоэкономика — дисциплина совсем не простая.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Проблема подверженности людей различным болезням и необходимости медицинской помощи в этих случаях глобальна и многопланова, и так или иначе затрагивает практически каждого. При этом затраты государств как непосредственно на медикаменты, так и на прочие связанные со здравоохранением расходы (госпитализацию, расходные материалы, зарплаты медицинских работников) год от года только растут, а ведь экономические ресурсы далеко не беспредельны.
Поскольку в такой ситуации государственные и частные плательщики стремятся контролировать расходы на фармацевтику, фармакоэкономический анализ в некоторых странах стал обычным подходом для оценки стоимости лекарств, вакцин и других медицинских технологий. Такой анализ оценивает стоимость использования (или возмещения затрат) тех или иных медицинских процедур с учетом их дополнительной пользы для здоровья (health outcomes) и затрат (costs) по сравнению с существующими методами лечения.
- Фармакоэкономика
- новая самостоятельная наука, которая изучает в сравнительном плане соотношение между затратами и эффективностью, безопасностью, качеством жизни при альтернативных схемах лечения (профилактики) заболевания.
Фармакоэкономический анализ (ФА) для оценки экономической эффективности лекарств впервые начали применять в Великобритании, и сейчас он в той или иной степени востребован еще в нескольких европейских странах, а также в США, что мы далее рассмотрим подробнее.
Существует несколько основных способов ФА, востребованных сегодня в разной степени. Все они измеряют затраты в денежном выражении, но различаются по способу оценки результатов лечения [1]:
- Анализ выгод и затрат (cost benefit analysis, CBA) — способ оценки, пришедший в здравоохранение из экономики транспорта, в котором как затраты, так и результаты лечения выражаются в денежном эквиваленте.
- Анализ экономической эффективности (cost-effectiveness analysis, CEA) используется, чтобы сравнить два разных по эффекту медицинских вмешательства (когда эффект от одного превосходит эффект от другого [2]), при этом разницу измеряют в так называемых натуральных единицах (например, излечение от болезни, прожитые годы жизни, понижение артериального давления).
- Анализ затрат и полезности (cost utility analysis, CUA) выражает результаты лечения в преимуществах для пациентов или пользе (utilities), например, в количестве прожитых лет жизни с поправкой на ее качество — QALY [3].
Востребованность этих методов ФА со временем изменялась — CBA постепенно замещался на CEA и CUA. Дело в том, что, хотя CBA хорошо зарекомендовал себя как инструмент для принятия экономических решений в государственной политике (в экономике охраны окружающей среды, экономике транспорта и др. [4], [5]), в экономике здравоохранения существовали опасения по поводу применимости этого метода.
В частности, вызывала беспокойство возможность серьезного неравенства в доступе к ресурсам здравоохранения, если готовность платить (willingness to pay, WTP) будет ограничиваться материальными возможностями пациентов [4]. Вызывала вопросы и корректность оценивания таких важнейших для человечества понятий, как ценность жизни и здоровья, только на основе денежного эквивалента [4].
Так или иначе все это привело к тому, что исторически разработанные позднее CEA и CUA на сегодняшний день доминируют в здравоохранении , [5], [6], и потому далее в нашей статье речь пойдет именно о них.
В тоже время являются ли CEA и CUA наилучшими на сегодня методами экономической оценки медицинских вмешательств — вопрос все еще дискуссионный, поскольку существуют аргументы и в пользу предпочтительности CBA [7], [8].
Фармакоэкономика — что это за блюдо и с чем его едят?
Концепция фармакоэкономики состоит в описании и анализе затрат (costs) на лекарственную терапию для систем здравоохранения и общества — эта наука определяет, измеряет и сравнивает такие затраты для разных медицинских вмешательств, соизмеряя также с результатами (outcomes) их применения [3]. Результатом фармакоэкономического анализа является value based pricing (VBP) — соотнесение ценности (value) фармацевтических препаратов или медицинских услуг со связанными с ними затратами (costs): такая оценка и составляет самую суть этой науки. Другими словами, фармакоэкономика — это наука об установлении цены, соизмеримой с ценностью [9].
В соответствии с соглашениями о ценообразовании, фармацевтические компании могут согласиться увязать оплату за производимое лекарство с измеренной в ходе фармацевтического анализа ценностью.
Однако что конкретно подразумевается под ценностью в здравоохранении? Под этим понятием кроется достижение максимально возможного улучшения состояния здоровья пациентов, соотнесенное с тем, насколько тяжелым бременем оплата этого лечения ляжет на плечи государств, страховых компаний и частных лиц (рис. 1).
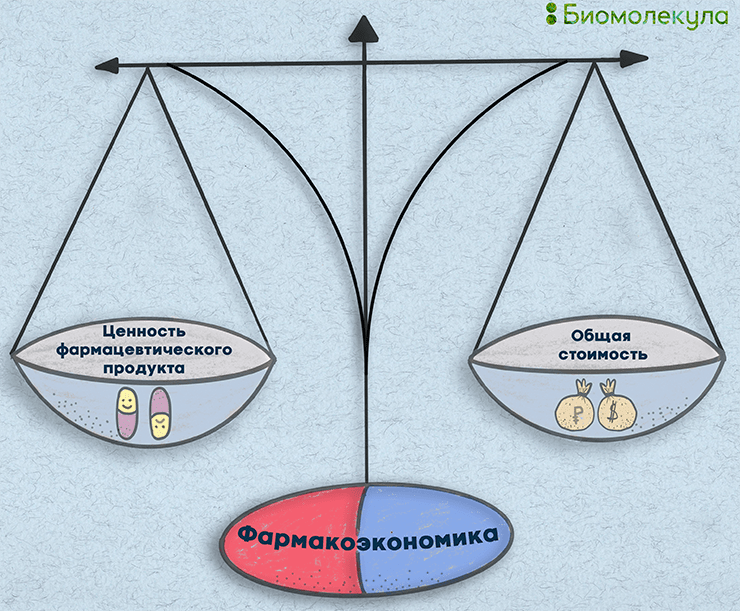
Рисунок 1. Соотнесение ценности фармацевтического продукта и затрат на его приобретение и использование — центральная идея фармакоэкономического анализа.
иллюстрация Ирины Ефремовой
В понятие ценности входит не одна переменная: и чтобы корректно оценить этот комплексный показатель, в рамках CEA и CUA применяют экономические и математические подходы, а помимо этого в фармакоэкономике используют и более продвинутые модели для принятия решений. Далее рассмотрим все это подробнее.
Оценка продолжительности жизни с поправкой на ее качество (QALY)
Новые средства лечения зачастую способны продлевать срок жизни пациентов, и этот «дополнительный» срок с учетом качества его проживания может быть мерой оценки приносимой конкретным препаратом пользы. На практике это означает, что можно построить функцию, отражающую как увеличение продолжительности жизни, так и улучшение ее качества. То есть два основных параметра, на которые влияет лечение — качество жизни (quality of life, QOL) и ее продолжительность (life years), — могут быть объединены в одном показателе, известном в фармакоэкономике как QALY — количество лет жизни с поправкой на ее качество (рис. 2).
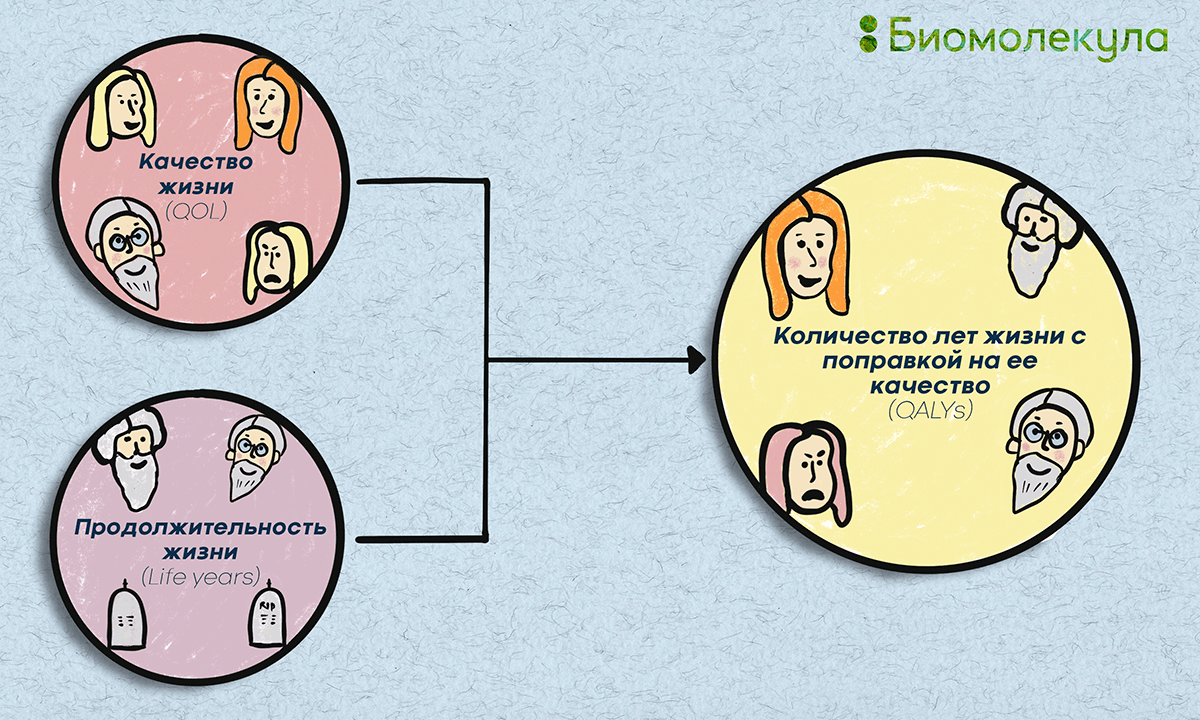
Рисунок 2. QALY — количество лет жизни с поправкой на ее качество. Независимо от того, оцениваются фармацевтические препараты, медицинские устройства или другие медицинские вмешательства (новый метод хирургии или диагностики), «полезность» их внедрения оценивают с точки зрения влияния на продолжительность жизни и ее качество. QALY — единый индекс для этих двух параметров.
иллюстрация Ирины Ефремовой
В этом показателе прожитый при идеальном (стопроцентном) здоровье год человеческой жизни равен единице: QALY = 1 год × 1, но если здоровье уже не идеально (например, его можно оценить как 80%), то будет введен такой же поправочный коэффициент, отражающий качество жизни: QALY = 1 год × 0,8 = 0,8.
Для лучшего понимания разберем пример (рис. 3): возьмем двух пациентов, с рождения получавших разное лечение от некой наследственной болезни, и рассмотрим изменение продолжительности и качества их жизни по QALY:
- Пациент А изначально чувствовал себя прекрасно (качество жизни = 1), но когда ему исполнилось 10 лет, он заболел, из-за чего качество жизни у него снизилось до 0,8. В этом состоянии он прожил еще 10 лет, затем заболел другим заболеванием, — в результате этой болезни качество жизни упало уже до 0,5. Еще через десять лет качество жизни понизилось до 0,2, и после этого, спустя десять лет, он умер.
- Пациент B, напротив, с самого рождения чувствовал себя не очень хорошо и имел показатель качества жизни, равный 0,5. Однако значение его качества жизни оставалось на том же самом уровне в течение последующих 40 лет, по истечении которых он умер.
Если учесть в качестве оцениваемого параметра только продолжительность жизни, эффект от разных терапий в данном случае будет одинаков — оба пациента дожили до 40 лет. Но даже при поверхностном взгляде очевидно, что их здоровье и качество жизни в эти годы было различным, а значит и результат лечения — разный. Но как правильно его оценить?
Именно для этого и был разработан QALY, позволяющий оценивать прожитые годы жизни с учетом QOL. В самом деле, если сравнить двух означенных пациентов по QALY:
QALY пациента A = [10 лет × 1,0] + [10 лет × 0,8] + [10 лет × 0,5] + [10 лет × 0,2] = 25 QALY
Тот же расчет для пациента B: QALY = [40 лет × 0.5] = 20 QALY
Из рисунка 3 видно, что QALY равняется площади под кривой зависимости качества жизни от ее продолжительности.
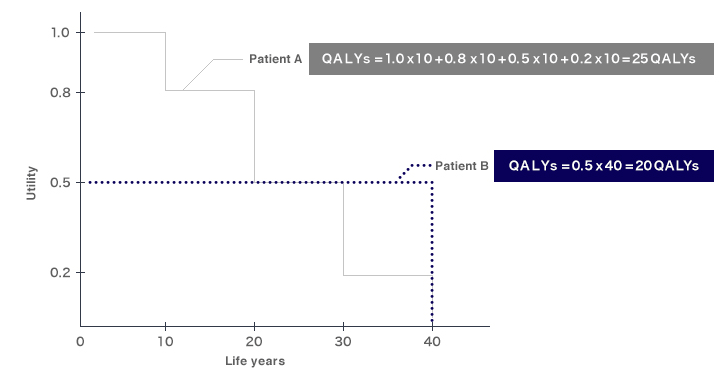
Рисунок 3. Графическое отображение QALY: горизонтальная ось показывает годы жизни, а вертикальная — ее качество. При этом качество жизни оценивается в числах от 0 (смерть) до 1 (идеальное здоровье).
Итак, мы видим, что применение QALY позволяет провести четкое разделение по эффективности для методов лечения A и B, которые по влиянию на продолжительность жизни не различаются. И хотя почти все заболевания влияют как на продолжительность жизни, так и на ее качество, в клинических исследованиях лекарств обычно учитывается только один из этих факторов, и даже если принимаются во внимание оба, обычно они оцениваются отдельно друг от друга, а не в совокупности. Поэтому, несмотря на то, что такого подхода может быть достаточно для сугубо клинической оценки, в случаях, когда требуется объективно оценить ценность лечения, необходима оценка, основанная на QALY.
На «Биомолекуле» выходил спецпроект по клиническим исследованиям и ряд материалов по разработке лекарств: «Путь лекарства» [10], «Драг-дизайн: как в современном мире создаются новые лекарства» [11].
Добавочная экономическая стоимость (ICER)
Коэффициент добавочной экономической эффективности, также известный как ICER, рассчитывается для двух видов лечения (A и B) как частное разности в затратах и разности преимуществ этих двух видов лечения [12]:
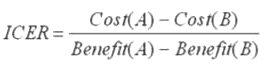
Иначе говоря, это затраты, необходимые для получения одной единицы выгоды или эффективности, и поэтому ICER измеряет преимущества, связанные с медицинским вмешательством, относительно его стоимости. Таким образом, этот показатель удобен для объединения затрат и выгод в единую единицу измерения. При этом видно, что, чем меньше ICER, тем выгоднее новый способ лечения.
Далее рассмотрим эту формулу немного подробнее и разберемся, какой там смысл:
- Числитель в уравнении отражает изменение стоимости при переходе от одного лечения к другому. При этом при подсчете стоимости медицинского вмешательства должны учитываться все расходы, связанные с предоставлением лечения: оплата госпитализации, затраты из-за потери времени, стоимость самого лекарства и т.д. Однако важно помнить, что любая финансовая составляющая, включенная в знаменатель, должна быть исключена из числителя. Другими словами, любое отсутствие дополнительных трат, получаемое благодаря медицинскому вмешательству, — это уже преимущество, и его не должно быть в числителе.
- Знаменатель же несет в себе информацию об изменении преимуществ; при этом получаемые выгоды при переходе от одного лечения к другому можно измерить разными способами, выбор которых диктуется целями и обстоятельствами анализа. Это может быть: количество дней без симптомов; увеличение продолжительности жизни; учет финансовой выгоды, связанной с отсутствием каких-либо затрат или экономией.
Кроме того, выгоду можно измерять и в QALY, — это зачастую предпочтительней, поскольку учитывается не только время жизни, но и ее качество, а значит, преимущества отражаются более полно.
Итак, рассчитав числитель и знаменатель, можно рассчитать ICER и определить с его помощью экономическую эффективность лечения. Для этого ICER сравнивают с неким пороговым значением экономической эффективности (cost-effectiveness threshold) — определенной суммой, которую готовы затратить плательщики (государственные структуры или частные лица, организации). Если значение ICER оказывается ниже порога, использование лекарства считается экономически приемлемым.
При этом не существует единого предела или значения пороговой суммы для определения экономической эффективности — она может разниться в зависимости от региона, страны и системы здравоохранения. Например, максимальная стоимость ICER, которая считается рентабельной, установлена на уровне около 30 000 фунтов за 1 дополнительный QALY в Великобритании и 50 000 — 100 000 долларов в США.
Плоскость экономической эффективности
ICER может быть также представлен в виде плоскости экономической эффективности (cost-effectiveness plane), на которой стоимость и эффективность лечения отражена графически. Ее цель — наглядно проиллюстрировать различия в затратах и эффектах между различными стратегиями лечения, ведь, несмотря на популярность анализа экономической эффективности (CEA), он зачастую бывает очень сложным. Поэтому существует потребность в ясных и интуитивных инструментах визуализации, позволяющих сделать его более доступным для понимания лицами, принимающими решения.
Визуально представляя клиническую и экономическую ценность определенных стратегий лечения, плоскость экономической эффективности помогает интересантам сравнивать альтернативные варианты терапии и принимать более взвешенные решения (рис. 4).
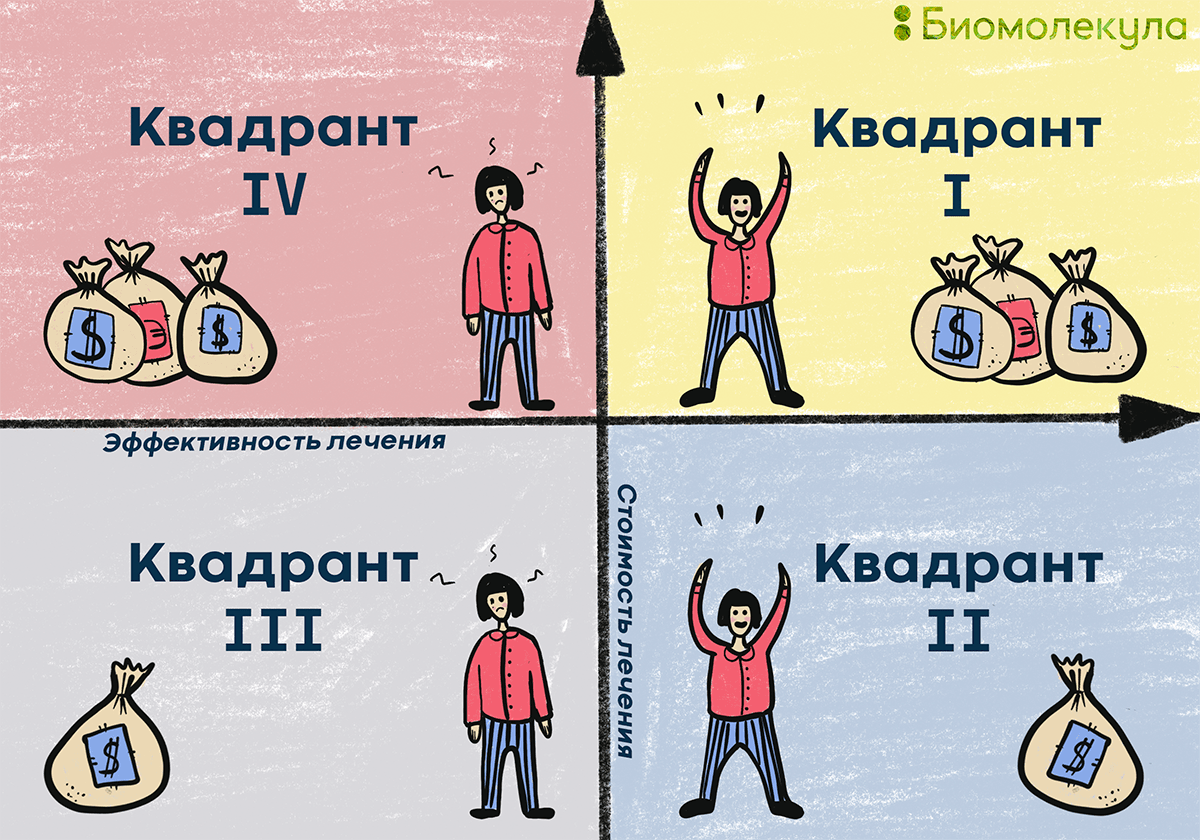
Рисунок 4. Плоскость экономической эффективности состоит из четырех квадрантов, где ось X отражает возрастающую слева направо эффективность лечения, а ось Y — увеличивающуюся снизу вверх стоимость лечения. В итоге в каждом из четырех квадрантов значение ICER различно (пояснение о значении ICER в каждом из квадрантов — в тексте).
иллюстрация Ирины Ефремовой по [15]
Вот что означает местонахождение рассматриваемой терапии в одном из четырех квадрантов:
- Квадрант I говорит, что новое лечение дороже, но и эффективнее; а потому, чтобы понять экономическую приемлемость его внедрения, требуется сравнить ICER с пороговым значением (как описано выше).
- Квадрант II — оптимальный: новое лечение называют доминирующим вариантом (dominant), а значит — это препарат выбора, который нужно внедрять, поскольку он обеспечивает более высокую эффективность по более низкой цене.
- Положение в квадранте III свидетельствует, что новое лечение менее эффективно, но зато оно и дешевле. Выбор этого варианта менее вероятен, но здесь также потребуется вычислить ICER, чтобы взвесить, настолько ли велика экономия по отношению к снижению эффективности.
- Наконец, положение в квадранте IV — новое лечение называют подавленным вариантом (dominated): его внедрение должно быть отклонено, потому что этот препарат обеспечивает меньшую эффективность по более высокой цене [15].
Другие модели принятия решений
Несмотря на полезность рассмотренных подходов, у них есть и ограничения. Допустим, для вывода на рынок новых антигипертензивных препаратов требуется рассмотреть их экономическую эффективность в рамках клинических исследований.
Комплексный анализ на основе QALY потребует количественной оценки увеличения продолжительности жизни и изменения ее качества за время действия лекарства, а значит, необходимо будет получить сведения о числе неблагоприятных сердечно-сосудистых событий (инфарктов и инсультов), появлении инвалидности после таких событий и степени ограничения жизнедеятельности, а также об изменении продолжительности жизни. Очевидно, что для сбора подобных данных необходимо наблюдение в течение жизни человека, но длительность клинических испытаний чаще всего не превышает нескольких месяцев (иногда до нескольких лет), а значит, в таком случае совершенно невозможно получить нужную информацию.
По счастью, в фармакоэкономике существуют более продвинутые модели принятия решений, позволяющие преодолевать эти ограничения (рис. 5).
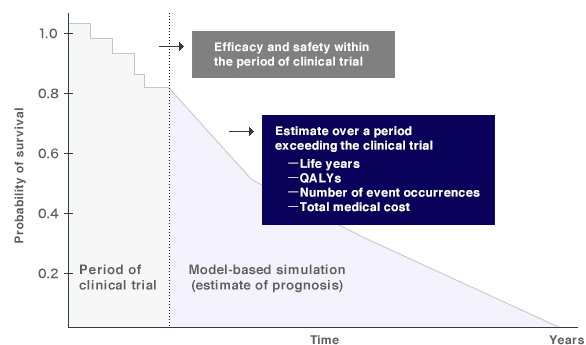
Рисунок 5. Продвинутые модели принятия решений в фармакоэкономике — искусственные модели, дающие прогноз лечения и течения болезни на протяжении длительного времени, что позволяет оценивать возможности возникновения влияющих на здоровье событий и связанных с ними затрат в течение длительного времени, значительно превышающего продолжительность клинических испытаний.
Эти модели позволяют получить значения QALY для всё того же анализа полезности (cost-utility analysis) в тех случаях, когда реальных данных недостаточно.
Деревья принятия решений
Достаточно часто для анализа вариантов лечения при острых инфекционных заболеваниях используют модель дерева решений (decision tree). Эта модель имеет достаточно простую структуру, в которой течение болезни и ее лечение изображается слева направо, а варианты лечения и различные исходы представлены ветками, на которых указаны возможные сценарии и вероятность их возникновения (рис. 6).
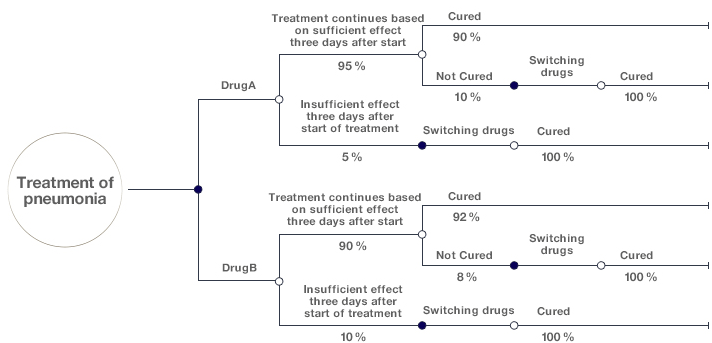
Рисунок 6. Дерево решений для оценки разных вариантов лечения пневмонии. Первая развилка — выбор лекарства А или В. Вторая — показало ли лекарство эффективность через три дня лечения. Третья — произошло ли излечение в случае эффективности. В неудачных случаях происходит смена лекарства.
Как показано на рисунке 6, оценка эффекта от первоначального лечения может быть произведена на третий день после его начала (это условный пример). Если к этому моменту лечение окажется эффективным, его продолжают. В противном случае могут переключиться на другой препарат. Дерево решений позволяет оценить вероятную стоимость и продолжительность жизни (количество лет) в процентах при назначении определенного варианта лечения. В данном случае эти параметры именуют ожидаемыми затратами (expected cost) и ожидаемой продолжительностью жизни (expected life years).
Модели Маркова
Для оценки вариантов лечения хронических заболеваний зачастую используют другие методы принятия решений — модели Маркова. В таком случае прогноз течения длительных болезней разделяется на несколько этапов, и выполняется моделирование прогресса в лечении пациента через эти этапы в течение определенного времени (рис. 7). Ожидаемые значения для событий вычисляются в конце каждого этапа и суммируются в конце моделирования [16].
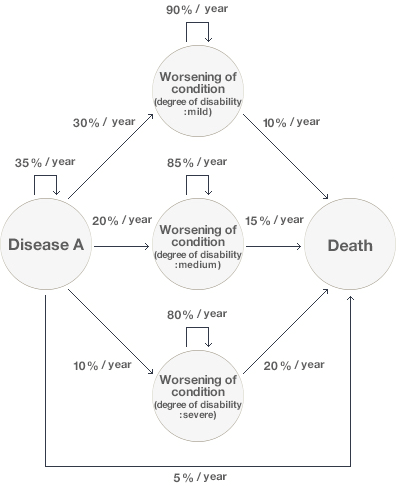
Рисунок 7. Модель Маркова. Круги представляют состояния системы (в данном случае пациента с болезнью А), стрелки — возможные переходы между состояниями, проценты над стрелками — вероятности переходов. Слева — начальное состояние, в середине — ухудшение заболевания (легкое, среднее и тяжелое), справа — смерть.
На рисунке 7 изображена такая Марковская модель, представляющая прогноз течения некого гипотетического заболевания (болезни А). В данном случае предполагалось, что новое лекарство (drug А на рисунке 8) будет на 50% эффективнее снижать скорость прогрессирования (и настолько же эффективнее снижать смертность) от этой гипотетической болезни, чем традиционное лечение. Однако кривая выживания (за период 10 лет), основанная на модели Маркова (рис. 8), показывает, что разница в прогнозируемых годах жизни традиционной терапией и препаратом А составляет 0,9 дополнительных лет (в пользу нового лекарства). Дальше обычными методами фармакоэкономического анализа, описанными выше (cost utility analysis, QALY) решают, стоит ли такая прибавка того, чтобы внедрять лекарство А.
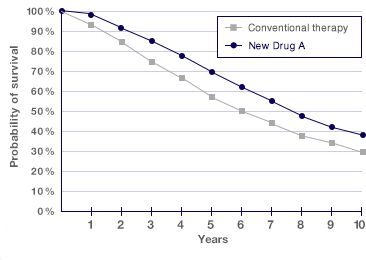
Рисунок 8. Кривая выживания, основанная на Марковской модели. На графике приведена вероятность выживания в зависимости от времени. Серый цвет — зависимость для обычной терапии, синий — для нового лекарства А.
Метод Монте-Карло
Фармакоэкономический анализ с применением моделей — мощный инструмент для оценки экономической эффективности в случаях, когда это требуется для продолжительного периода времени, значительно превышающего длительность клинических исследований. Однако и у такого анализа существуют ограничения, наиболее важное из которых — неопределенность, связанная с входящими (исходными) параметрами. И если для простых случаев статистического расчета никакой неопределенности может и не быть (например, при игре в кости вероятность выпадения любого числа из шести одинакова и составляет 1:6), то при анализе методов терапии все сложнее, и чем больше исходных параметров, тем больше неопределенность расчетной модели, а значит, и выходных данных [16].
Поэтому для анализа лечения заболеваний, при которых в ходе моделирования требуется учитывать в качестве входящих параметров несколько одновременно развивающихся состояний (например, при сахарном диабете), очень важно учитывать возрастающую неопределенность, что и может быть осуществлено при анализе с использованием метода Монте-Карло.
Моделирование Монте-Карло — это компьютеризированный математический метод, при котором каждому входящему параметру модели присваивается уникальное значение, случайно сгенерированное из распределения значений для данной переменной. Затем запускается моделирование, в ходе которого записывается получаемый результат (это называется итерацией). Итерации повторяют снова и снова — сотни и тысячи раз, — и конечным итогом является распределение вероятностей возможных результатов (рис. 9) [17].
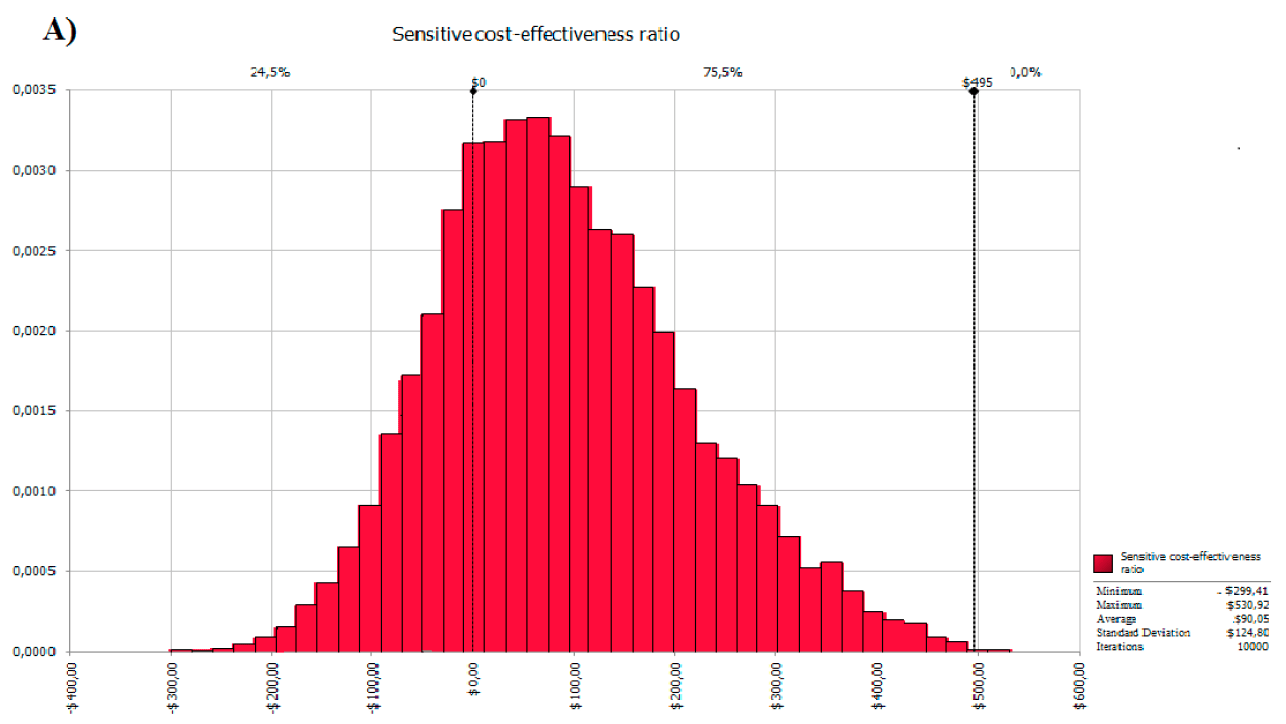
Рисунок 9. Результат моделирования Монте-Карло. В статье исследовалось, насколько повышается экономическая эффективность (cost effectiveness ratio, CER) при лечении гипертензии лекарствами по сравнению с обычным лечением без лекарств. Из данного рисунка видно, что лекарственная терапия в среднем повышает CER на $90,05, вероятность положительных изменений — 75,5%, а максимальный прирост составляет $495.
Данные, полученные в моделировании Монте-Карло, можно использовать для построения кривой приемлемости экономической эффективности. График с подобными кривыми нередко используется в современном фармакоэкономическом анализе и несет информацию о вероятности экономической эффективности при применении того или иного метода лечения (рис. 10).
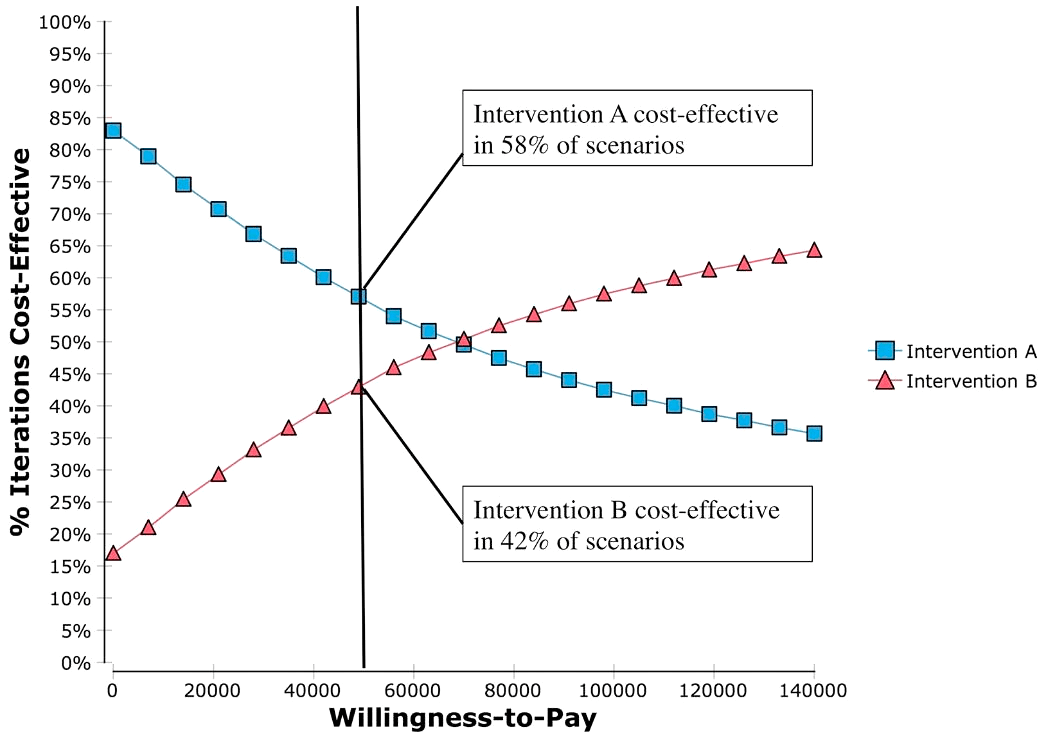
Рисунок 10. Вероятностный анализ чувствительности и кривые приемлемости экономической эффективности для двух терапевтических вмешательств. Вмешательство A рентабельно в 58% сценариев, тогда как вмешательство B рентабельно в 42% сценариев при пороговом значении WTP («готовность платить») в размере 50 000 долларов США / QALY. Вертикальная черная линия ─- черта, отделяющая экономически приемлемые значения для стоимости лечения (лежащие по левую сторону от линии) от неприемлемых значений (по правую сторону).
Фармакоэкономические инструменты используют при ценообразовании во многих странах, но особенно ярко это проявилось в Великобритании и США, ведь в этих странах существуют достаточно известные организации (NICE и ICER), проводящие оценку ценности методов лечения и дающие рекомендации, к которым прислушиваются.
Подходы NICE (Великобритания) и ICER (США)
Великобритания — страна, в которой решения о финансировании использования тех или иных лекарств Национальной службой здравоохранения уже более 20 лет выносит государственная организация — Национальный институт здравоохранения и передового опыта (NICE, National Institute for Health and Care Excellence). Эта организация проводит оценку экономической эффективности разных видов лечения, и если оказывается, что использование какой-либо терапии экономически нецелесообразно, подобное лечение может быть ограничено для государственного использования в Соединенном Королевстве (в рамках частной медицины можно использовать любые средства, одобренные агентством по лекарством MHRA). Это позволяет более разумно расходовать средства, снижает финансовую нагрузку на здравоохранение и приводит к выводу на рынок лекарств с лучшим соотношением «цена—эффективность». Насколько эффективна такая работа, можно судить, сравнив ситуацию в Великобритании с ситуацией в США.
В США не существует регулирующего расходы госоргана, подобного NICE, и в этой стране уже сейчас расходы на здравоохранение самые высокие в мире на душу населения [18]. Возможно, для ведущей экономики мира такая нагрузка пока не критична, однако далеко не факт, что так будет продолжаться вечно.
Не так давно этот вопрос стал подниматься в обществе, и не зря некоммерческий «аналог» NICE в США — ICER — даже окрестили в СМИ наблюдателем за отраслевыми затратами после рекомендаций снижения цен на ряд инновационных лекарств (в том числе на небезызвестный Luxturna [19]) для соответствия пороговым значениям экономической эффективности.
И хотя в целом ICER и NICE схожи в применяемых для оценки инструментах фармакоэкономического анализа (таких как QALY), NICE — правительственная организация, ее рекомендации обязательны и должны начать выполняться не позднее, чем через три месяца после публикации, тогда как ICER подобных полномочий не имеет. Это ключевое различие приводит к разным типам рекомендаций, различиям в своевременности предоставляемых отчетов, разных пороговых значениях экономической эффективности, различиях в прозрачности и формате проводимых организациями совещательных дискуссий [20].
Стоит отметить, что, поскольку главная и несомненная ценность в современном мире — жизнь и здоровье человека, предоставление каким-либо организациям права вето на ограничение в применении лекарств по финансовым соображениям с этической точки зрения довольно сомнительно. Ведь могут быть ущемлены интересы отдельных пациентов, которые не дополучат важные медикаменты из-за «сухого» экономического анализа.
В частности, поскольку длительная выживаемость приводит к увеличению QALY, значительное увеличение стоимости новых препаратов вкупе с увеличением продолжительности жизни могут привести к тому, что экономическая эффективность для таких лекарств станет в принципе недостижимой [18].
И если в некоторых случаях ущемление интересов одного пациента может быть еще оправдано общей пользой для общества (которая, правда, в современном понимании не должна быть выше интересов отдельного его члена), то для некоторых решений NICE даже такая логика не совсем очевидна [21]. Речь идет о том, что в современном обществе уже не приемлема оценка здоровья и жизни только в сухих цифрах.
Учитывая вышесказанное, представляется, что практика, нарождающаяся в США, где принятие решений о финансировании той или иной терапии не находится в зоне ответственности регулирующего госоргана, однако рекомендации по таким решениям выдает некоммерческая организация, — может быть более оправданной. Если предложения ICER будут иметь широкий резонанс, то это будет попадать в поле зрения как общественных организаций, так и госорганов и частных лиц. И хочется верить, что в таком случае неравнодушие широкой общественности и лиц, ответственных за принятие решений, в конечном счете будет приводить к экономически правильным и в тоже время справедливым решениям относительно внедрения той или иной новой терапии.
Экономика должна быть экономной: внедрение VBP для улучшения доступности лекарств во всем мире
Помимо VBP (value based pricing), при образовании цен на лекарства в мире используют и другие подходы, наиболее популярный из которых — external (или international) reference pricing (ERP, или IRP).
ERP — практика, при которой для формирования цены на лекарство в определенной стране используют в качестве ориентира (или референса) цены на аналогичный продукт в одной или нескольких других странах [22]. Этот подход в том или ином виде применяется в большинстве европейских стран, однако в разных государствах стратегии его использования могут значительно варьировать:
- ERP могут использовать для ценообразования всех без исключения лекарств или только определенных категорий: отпускаемых по рецепту; оплачиваемых государством; инновационных медикаментов; и т.д. [23].
- Референсная цена может в разных странах рассчитываться по-разному: как среднее значение или самое низкое значение цены среди выбранных стран; в качестве референсной может использоваться цена страны происхождения лекарства; могут применяться формулы для понижения (или повышения) референсного значения; и пр. [22], [24].
- Периодичность пересмотра референсных цен в разных странах также различна: многие страны пересматривают их на основании таких причин, как появление новых данных по фармацевтическим препаратам или дополнительных соглашений в области ценовой политики на национальном уровне; в других странах основания для пересмотра референсов определены нечетко, и их пересчет может производиться, например, каждые полгода или по запросу производителей лекарств [25].
Перечисленным не исчерпываются различия в использовании ERP, но и из этого ясно, что практика применения данного подхода далеко не универсальна, и это ограничивает его повсеместное внедрение [24]. У ERP есть и другие существенные ограничения, на которых мы в нашей статье подробно останавливаться не будем; заинтересованный читатель найдет их в специальной литературе [24], [26]. Отметим лишь, что один из принципиальных минусов применения ERP при ценообразовании (в отличие от VBP) — отсутствие корреляции между конечной стоимостью лекарств и приносимой ими пользой. При применении VBP такая связь была определена статистически, в то время как для ERP анализ как раз выявил ее отсутствие [27].
Учет этого недостатка ERP (равно как и оппозитного преимущества VBP) очень важен при выборе подходящей стратегии ценообразования, ведь, как мы увидим, из-за баснословной стоимости многих современных медикаментов их применение можно считать оправданным, только если «увеличенная» стоимость компенсируется «увеличенной» же пользой, что, к сожалению, бывает далеко не всегда.
Актуальность более широкого внедрения VBP: экономические сложности фарминдустрии
Увеличение в последние годы объема продаж дорогих и далеко не массовых инновационных лекарств по отношению к более дешевым препаратам [28] — один из существенных факторов в повышении финансовой нагрузки на фармацевтическую отрасль и систему здравоохранения в целом. Это глобальная и очень серьезная проблема, ведь стратегии, позволившие во всем мире сделать лекарства более доступными, включали снижение стоимости и возмещение затрат за счет продаж медикаментов в больших количествах. Ну а стоимость некоторых современных препаратов пока такова, что не совсем ясно, возможно ли в принципе покрыть огромные расходы, еще и вылечив при этом всех нуждающихся.
И хотя внедрение некоторых новых медикаментов ассоциируется с существенным прогрессом в лечении и профилактике болезней, заоблачные цены зачастую делают их недоступными для людей даже в богатейших государствах мира [29], не говоря о развивающихся странах, в которых бывают проблемы с доступом даже к основным лекарствам примерного перечня ВОЗ.
Очевидно, что усиление перечисленных тенденций усугубит существующую проблему неравного доступа к нужным лекарствам и спровоцирует социальную несправедливость. Ведь выделение огромных сумм на внедрение инновационных медикаментов (из-за стоимости доступных совсем немногим), которые, вопреки ожиданиям, зачастую дают лишь небольшие преимущества в улучшении здоровья, может приводить к «перекосу» в распределении ограниченных ресурсов. А в результате недополучат необходимую помощь пациенты, которым требуются не столь дорогие (но не исключено что значительно более эффективные) лекарства.
Именно поэтому в современном мире просто необходимы какие-то рациональные основания как для регулирования цен на медикаменты, так и для принятия решений о внедрении в систему здравоохранения тех или иных методов лечения. И таким основанием может стать оценка ценности лечения в ходе фармакоэкономического анализа, ведь, как мы уже видели, это позволяет не только оценивать приемлемую стоимость лекарств, но и сравнивать их между собой по объективным параметрам, а значит — принимать оптимальные решения по выбору лечения и осуществлять более адекватное ценообразование.
В теории все здорово, но что на практике?
Существуют примеры фармакоэкономического анализа, которые можно интерпретировать достаточно прямолинейно, и где оправданность внедряемой схемы лечения не вызывает больших сомнений как с точки зрения экономической сообразности, так и в отношении эффективности в улучшении здоровья и качества жизни пациентов [30], [31]. Однако далее мы рассмотрим экономическую оценку для более щепетильного случая, что, как мы надеемся, позволит высветить более тонкие нюансы в пользе применения подобной калькуляции.
В одном исследовании осуществили оценку экономической эффективности ниволумаба — препарата из арсенала популярной ныне иммунотерапии (ниволумаб — ингибитор рецептора иммунных контрольных точек PD-1, за которые в 2018 году была вручена Нобелевская премия по физиологии или медицине [32], [33]), — в сравнении с более традиционными схемами лечения плоскоклеточного рака головы и шеи (SCCHN) [18]. Выяснилось, что, хотя этот препарат достоверно увеличивает медианную общую выживаемость (правда незначительно — на 2,4 месяца, — но для людей с заболеванием — смертным приговором и этот срок немал), рентабельность для него практически недостижима. На сегодняшний день стоимость лекарства такова, что даже при условии, что он полностью будет излечивать пациентов, использование препарата все равно не будет экономически эффективным [18]. Это подводит нас к неутешительным выводам и дискуссионным вопросам, однозначного ответа на которые пока нет.
С одной стороны, ценность человеческой жизни в современном мире неоспорима, и даже совсем небольшое увеличение ее продолжительности с этической точки зрения не может считаться экономически нецелесообразным. С другой — как уже упоминалось, — ресурсы всегда ограничены: их перерасход на определенный тип лечения может привести к недостаточности для оплаты других терапий (возможно, более важных). Кроме того, существуют данные о том, что увеличение финансового бремени для онкологических больных может приводить к дополнительным страданиям таких пациентов, снижению приверженности к лечению, а значит — увеличению риска ранней смертности [18].
Сложность и неоднозначность приведенного нами примера только подчеркивает важность применения фармакоэкономического анализа перед изменениями в текущей схеме лечения пациентов. Ведь даже в таких сложных случаях подобная оценка может быть полезна, поскольку предоставляет дополнительные данные, что может стать решающим фактором в принятии более корректных и правильных решений в ситуациях очень непростого выбора — когда на чаше весов находятся жизнь, здоровье и качество жизни многих больных.
Как внедрение VBP и отказ от ERP помогает снижать расходы на здравоохранение
Конечно, мы не можем не рассмотреть применение VBP в конкретных странах, а для этого возьмем в качестве примеров Германию и Швецию.
VBP в Германии
Стоит сказать, что в этой стране VBP хотя и влияет на сдерживание роста цен, но не ключевым образом [34], — главным фактором здесь является регулирование стоимости на федеральном уровне, что, согласно исследованию Гарвардской школы бизнеса, позволяет снижать расходы, не препятствуя инновациям или доступу к медикаментам.
В Германии для определения стоимости медицинских услуг и продуктов создано национальное агентство — Институт качества и эффективности в здравоохранении (QWiG). Эта организация похожа на уже известный нам NICE в Великобритании — она также оценивает различные медицинские вмешательства, чтобы определить, насколько они эффективны. Также здесь с 2010 года принят закон о реорганизации рынка лекарственных средств (AMNOG), согласно которому производители должны предоставлять серию исследований, доказывающих, что их лекарство эффективнее, чем ранее доступные медикаменты.
Благодаря перечисленному, существует определенный (и достаточно строгий) алгоритм, позволяющий на немецком рынке контролировать цены на лекарства, и заключается он в следующем:
- После обнародования оценки нового препарата агентством IQWiG начинается так называемый период уведомления, в течение которого медицинские сообщества, специалисты и производители могут вносить заявления и предоставлять дополнительные данные в Федеральный объединенный комитет Германии — орган, который принимает окончательное решение об уровне пользы нового препарата в сравнении с существующим лечением.
- Далее производитель должен решить, как действовать, и здесь есть несколько основных вариантов:
- если оценка комитета для производителя неудовлетворительна, он может в течение четырех недель принять решение о выводе препарата с рынка Германии, что остановит дальнейшее согласование стоимости лекарства. А помимо этого такое решение еще и предотвратит последующее внесение цены лекарства в официальный немецкий прайс-лист на медикаменты, на который при ценообразовании в рамках ERP потом могут ссылаться другие страны;
- если производитель решает сохранить свой товар на немецком рынке, следующим этапом будут переговоры с государственной зонтичной организацией — Национальной ассоциацией фондов обязательного медицинского страхования, — в процессе которых (в срок до 6 месяцев) стороны должны прийти к соглашению о цене препарата. Если этого не произошло, запускается процедура арбитража, в процессе которой арбитражная комиссия назначает время установки цены в течение трех месяцев, после чего уже частные страховые компании принимают решение об окончательной цене и направляют ее сторонам для согласования;
- после всего перечисленного производитель еще может принять решение о выводе препарата с немецкого рынка, но цена его уже будет опубликована в официальном прайс-листе на медикаменты, а значит, на основе этого будет формироваться стоимость этого лекарства и во многих других странах [35];
- в соответствии с законом AMNOG, спустя максимум год после ввода медикаментов на рынок для большинства из них проводятся переговоры о предоставлении скидки относительно установленной в прайс-листе цены, при этом для оценки стоимости используют различные параметры, включая также и дополнительную терапевтическую ценность (клиническую ценность и качество жизни) [34].
Описанная непростая процедура (впрочем, описана она как раз таки упрощенно), является отличным фильтром, который не позволяет пропускать на немецкий рынок крайне дорогостоящие, но при этом не слишком эффективные препараты, и это только в 2015 году позволило сэкономить ни много ни мало 1 миллиард долларов [36]. Благодаря этому, сейчас уже для многих экспертов немецкая модель принятия решений — это образец [37], [38], а ведь еще до 2011 года стоимость медикаментов в этой стране на 26% превышала средние цены в ЕС.
VBP в Швеции
Швеция — страна с одним из наиболее развитых социальных секторов в мире, а потому и здравоохранение здесь соответствующее. Понятия о справедливости и равном доступе к медикаментам во многом заложены в законе, а регулирование цен осуществляется преимущественно на государственном уровне, и немаловажным здесь является возможность возмещения пациентам стоимости медикаментов.
В 2002 г. Швеция отказалась от системы ERP, использовавшейся с 1990-х годов, и вместо этого ввела систему ценообразования и возмещения затрат на основе стоимости — таким образом, эта страна наряду с Великобританией в значительной степени является родоначальником в области внедрения VBP. Поэтому в сравнении с Германией фармакоэкономические методы используются здесь значительно шире.
Аналогом NICE в Швеции можно в какой-то степени считать TLV (англ. — The Dental and Pharmaceutical Benefits Agency; швед. — Tandvårds-och läkemedelsförmånsverket) — Совет по льготам в фармацевтике и стоматологии: это государственная организация, определяющая, какие лекарственные препараты должны быть включены в национальную систему возмещения расходов [39].
TLV также определяет, является ли цена, запрошенная заявителем, разумной, путем проведения общей оценки с учетом трех этических положений, которые заложены в местный закон о здравоохранении и медицинских услугах:
- Принцип человеческого достоинства подразумевает, что следует уделять внимание равенству всех людей с учетом достоинства личности.
- Принцип потребности и солидарности подразумевает, что приоритет отдается лицам, наиболее нуждающимся в медицинской помощи.
- Принцип экономической эффективности означает, что следует стремиться к разумной взаимосвязи между затратами и эффектом, измеряемым в улучшении здоровья и повышении качества жизни.
Нетрудно догадаться, что одна из главных функций применения фармакоэкономических методов при ценообразовании в Швеции — социальная, то есть обеспечение полноценного доступа к медикаментам для большинства людей. Ведь помимо того, что ценообразование здесь так сильно связано с возмещением расходов, из трех перечисленных принципов ключевыми считаются именно первые два. Достижение экономической эффективности при этом рассматривается лишь как дополнительный аргумент для принятия оптимальных решений, а вовсе не как самоцель.
В тоже время в этой стране удалось добиться снижения расходов на здравоохранение, а значит, внедрение описанной системы оказалось здесь эффективным и с сугубо экономической точки зрения. Ведь до ввода VBP расходы на медикаменты в Швеции только возрастали на 10% каждый год, но уже с 2002 года эту тенденцию удалось значительно замедлить, а к 2010 году практически свести на нет (рис. 11).

Рисунок 11. Ежегодное увеличение расходов на лекарства в Швеции
Заключение
Итак, мы уже поняли, что фармакоэкономический анализ — очень полезный инструмент для оценки истинной ценности медицинских вмешательств, что позволяет обосновывать и регулировать цены на лекарства, а значит, при повсеместном внедрении может значительно снизить расходы на здравоохранение в современном мире. Однако применением при ценообразовании польза от фармакоэкономики далеко не исчерпывается. Ниже перечислены некоторые возможные приложения:
- Может быть полезнейшим бизнес-инструментом при маркетинговых исследованиях в крупных фармкомпаниях, когда решается, имеет смысл запускать новый проект или нет. Ведь он позволяет понять, будет ли новый лекарственный препарат иметь благоприятные фармакоэкономические показатели, а значит, определить — не будут ли ожидаемые производственные затраты слишком высоки по сравнению с преимуществами успешной лекарственной терапии [40]. А ведь это может предотвратить растрату миллионов долларов на запуск потенциально нерентабельных проектов.
- Поскольку фармакоэкономика позволяет прогнозировать не только стоимость, но и эффективность, она может использоваться для оценки преимуществ и рисков при разных вариантах терапии с целью определить, какое лечение выбрать в качестве оптимального варианта.
- На ранних стадиях разработки — еще до проведения доклинических и клинических исследований — фармакоэкономика поможет спрогнозировать эффективность новых препаратов, и такая информация может быть использована для определения стратегии дальнейших исследований.
Есть у фармакоэкономического анализы и ограничения. Хотя это полезный инструмент рациональной оценки, но в современном обществе нельзя отталкиваться только от бюджетных ограничений, нужно принимать во внимание право каждого на жизнь и здоровье независимо от его пользы для общества. QALY и ICER — полностью рациональный подход, он не учитывает то, что в современных западных обществах ценность индивидуума не определяется его ожидаемой продолжительностью жизни и работоспособностью.
Пример Швеции наглядно показывает, что можно сочетать данные ФЭ-анализа с гуманистическими принципами, и в итоге принимать справедливые, гуманные решения в области здравоохранения, соблюдающие баланс между интересами индивида и общества.
Литература
- Dranitsaris G., Truter I., Lubbe M.S., Sriramanakoppa N.N., Mendonca V.M., Mahagaonkar S.B. (2011). Using pharmacoeconomic modelling to determine value-based pricing for new pharmaceuticals in Malaysia. MJMS. 18, 32–43;
- Drug and Therapeutics Committee Training Course. (2007). WHO;
- Wilson J.P. and Rascati K.L. Pharmacoeconomics. Basicmedical Key;
- Adrian Towse, Michael Drummond, Corinna Sorenson Measuring Value: Pharmacoeconomics Theory and Practice — Oxford University Press, 2012;
- Mikael Svensson, Lars Hultkrantz. (2017). A Comparison of Cost-Benefit and Cost-Effectiveness Analysis in Practice: Divergent Policy Practices in Sweden. Nordic J Health Eco. 5, 41-53;
- Guideline for economic evaluations in healthcare. (2016). Zorginstituut Nederland;
- Tessier P. (2011). Should cost-utility analysis be replaced by cost-benefit analysis for the economic evaluation of health care programs? A (somewhat) sceptical view. Université d’Auvergne;
- Anthony J. Culyer, Kalipso Chalkidou. (2019). Economic Evaluation for Health Investments En Route to Universal Health Coverage: Cost-Benefit Analysis or Cost-Effectiveness Analysis?. Value in Health. 22, 99-103;
- Keckley P.H. (2012). Value-based pricing for pharmaceuticals: Implications of the shift from volume to value. The Deloitte Center for Health Solutions;
- Путь лекарства;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- An introduction to the methods of cost-effectiveness analysis. (2012). DTB. 50, 81-84;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Самое дорогостоящее лекарство в мире;
- Applying Principles of Pharmacoeconomics to Improve Medical Product Selection and Use in Low- and Middle-income Countries: Trainer’s Guide. (2017). SIAPS;
- Zanfina Ademi, Hansoo Kim, Ella Zomer, Christopher M. Reid, Bruce Hollingsworth, Danny Liew. (2013). Overview of pharmacoeconomic modelling methods. Br J Clin Pharmacol. 75, 944-950;
- Arvin R. Wali, Michael G. Brandel, David R. Santiago-Dieppa, Robert C. Rennert, Jeffrey A. Steinberg, et. al.. (2018). Markov modeling for the neurosurgeon: a review of the literature and an introduction to cost-effectiveness research. Neurosurgical Focus. 44, E20;
- Kathryn R Tringale, Kate T Carroll, Kaveh Zakeri, Assuntina G Sacco, Linda Barnachea, James D Murphy. (2018). Cost-effectiveness Analysis of Nivolumab for Treatment of Platinum-Resistant Recurrent or Metastatic Squamous Cell Carcinoma of the Head and Neck. JNCI: Journal of the National Cancer Institute. 110, 479-485;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Praveen Thokala, Josh J. Carlson, Mike Drummond. (2020). HTA’d in the USA: A Comparison of ICER in the United States with NICE in England and Wales. JMCP. 26, 1162-1170;
- J. Harris. (2005). It's not NICE to discriminate. Journal of Medical Ethics. 31, 373-375;
- WHO guideline on country pharmaceutical pricing policies. (2013). WHO;
- Toumi M., Rémuzat C., Vataire A.-L., Urbinati D. (2014). External reference pricing of medicinal products: simulationbased considerations for crosscountry coordination. European Commission;
- Cécile Rémuzat, Duccio Urbinati, Olfa Mzoughi, Emna El Hammi, Wael Belgaied, Mondher Toumi. (2015). Overview of external reference pricing systems in Europe. Journal of Market Access & Health Policy. 3, 27675;
- Panos Kanavos, Anna-Maria Fontrier, Jennifer Gill, Olina Efthymiadou. (2020). Does external reference pricing deliver what it promises? Evidence on its impact at national level. Eur J Health Econ. 21, 129-151;
- WHO guideline on country pharmaceutical pricing policies. (2015). WHO;
- Daniele Mengato, Andrea Messori. (2016). Pricing of innovative drugs: correlation between incremental cost and survival gain in four countries. Ther Adv Med Oncol. 8, 309-311;
- Три поколения лекарств;
- Toon van der Gronde, Carin A. Uyl-de Groot, Toine Pieters. (2017). Addressing the challenge of high-priced prescription drugs in the era of precision medicine: A systematic review of drug life cycles, therapeutic drug markets and regulatory frameworks. PLoS ONE. 12, e0182613;
- Чеберда А.Е., Белоусов Д.Ю., Шишкин М.М. (2017). Фармакоэкономический анализ применения ранибизумаба и афлиберцепта для лечения пациентов с диабетическим макулярным отёком. «Качественная клиническая практика». 4, 17–30;
- Kostas Athanasakis, Vasilios Fragoulakis, Vasiliki Tsiantou, Panagiotis Masaoutis, Nikolaos Maniadakis, John Kyriopoulos. (2012). Cost-Effectiveness Analysis of Ranibizumab versus Verteporfin Photodynamic Therapy, Pegaptanib Sodium, and Best Supportive Care for the Treatment of Age-Related Macular Degeneration in Greece. Clinical Therapeutics. 34, 446-456;
- Pei-Wei Huang, John Wen-Cheng Chang. (2019). Immune checkpoint inhibitors win the 2018 Nobel Prize. Biomedical Journal. 42, 299-306;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Claudio Jommi, Patrizio Armeni, Francesco Costa, Arianna Bertolani, Monica Otto. (2020). Implementation of Value-based Pricing for Medicines. Clinical Therapeutics. 42, 15-24;
- Ariel D. Stern, Felicitas Pietrulla, Annika Herr, Aaron S. Kesselheim, Ameet Sarpatwari. (2019). The Impact Of Price Regulation On The Availability Of New Drugs In Germany. Health Affairs. 38, 1182-1187;
- Lauterbach K., McDonough J.E., Seeley E. (2016). Germany’s Model For Drug Price Regulation Could Work In The US. Health Affairs Blog;
- Khazan O. (2014). Why Medicine Is Cheaper in Germany. The Atlantic;
- Kost D. (2019). Germany May Have the Answer for Reducing Drug Prices. Harvard Business School Working Knowledge;
- Ulf Persson, Michael Willis, Knut Ödegaard. (2010). A case study of ex ante, value-based price and reimbursement decision-making: TLV and rimonabant in Sweden. Eur J Health Econ. 11, 195-203;
- Klotz L.C. (2014). Guiding Drug Development: A Pharmacoeconomic Look. Genetic Engineering & Biotechnology News;
- Maurílio de Souza Cazarim, Leonardo Régis Leira Pereira. (2018). Cost-effectiveness analysis of pharmaceutical care for hypertensive patients from the perspective of the public health system in Brazil. PLoS ONE. 13, e0193567.