Фитонематоды — кукловоды молекулярного уровня
19 ноября 2021
Фитонематоды — кукловоды молекулярного уровня
- 2461
- 0
- 2
Главные действующие лица патосистемы растения — фитонематоды — на сцене бесконечного «кукольного спектакля».
Рисунок в полном размере.
коллаж автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Корневые седентарные фитонематоды являются одними из самых экономически значимых паразитов растений, с которыми они образуют долговременные взаимодействия. Виртуозные кукловоды, фитогельминты, искусно манипулируют реакциями растений, индуцируя в их корнях специальные гиперметаболические участки, откуда получают питание. Но растения не готовы мириться с экспансией и пытаются сопротивляться, порой не менее изобретательно обманывая соперника. За этой увлекательной и бесконечной эволюционной схваткой мы попробуем проследить в данной статье.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
Нематоды — самые многочисленные и широко распространенные многоклеточные животные на Земле: тип Nematoda насчитывает не менее 24 тысяч описанных видов, по меньшей мере 20% из которых питается фитотрофно [1]. Так что все известные растения могут являться «счастливыми» хозяевами одного или даже нескольких видов фитонематод [2]!
Фитонематоды, или нематоды, паразитирующие на растениях (в англоязычной литературе plant-parasitic nematodes, или PPN) хотя и представляют собой микроскопических (0,25–3 мм) червей, являются одними из наиболее разрушительных сельскохозяйственных вредителей во всем мире: снижение продукции от наносимых ими повреждений в среднем составляет 10–20%, а общие потери превышают порядка 125 млрд долларов США ежегодно. Наибольший ущерб паразиты наносят растениеводству и лесоводству, поражая широкий спектр коммерчески важных ценных пищевых и кормовых сельскохозяйственных культур, таких как томат, картофель, перец, соя, хлопок, сахарная свекла, рис, пшеница, кукуруза и др. (рис. 1) [3].
Воздействие фитонематод на растения частично сходно с вирусными и бактериальными болезнями и выражается преимущественно в таких общих симптомах, как пожелтение листьев, низкорослость и снижение урожайности. Поэтому, к сожалению, очень часто болезни растений, вызываемые нематодами, проходят незамеченными, так как гибель растений или угнетение их жизнедеятельности приписывается не истинным возбудителям, а другими фитопатогенам или неблагоприятным абиотическим условиям [4], [5].

Рисунок 1. Растения, пораженные цистообразующими нематодами:
а — растения сои, инфицированные нематодами Heterodera glycines;
б — зараженные и неинфицированные растения пшеницы цистообразующей нематодой злаков H. avenae;
в — корни Arabidopsis с цистами свекловичной нематоды H. schachtii;
г, д — растения, пораженные галлообразующими нематодами: корни тыквы, моркови, инфицированные нематодой Meloidogyne incognita;
е — рисовые поля в Азии, зараженные M. graminicola;
ж, з, и — симптомы, вызываемые галлообразующими нематодами у бамии, вишни и капусты, соответственно;
к — питомник помидоров (Неаполь, Флорида, США), опустошенный заражением M. haplanaria.
адаптировано из [5]
Укол зонтиком стилетом
Фитогельминт имеет анатомию настоящего преступника, характерным признаком которого является наличие в ротовой полости колющего органа — стилета, или копья (шипа). С его помощью фитонематоды словно шприцем прокалывают растительные клеточные стенки, впрыскивают секреты пищеводных желез в клетки и «нещадно» высасывают из них питательные вещества [3], [5]. Но обо всем по порядку. Сначала познакомимся с делением фитонематод на «группировки».
Стили жизни
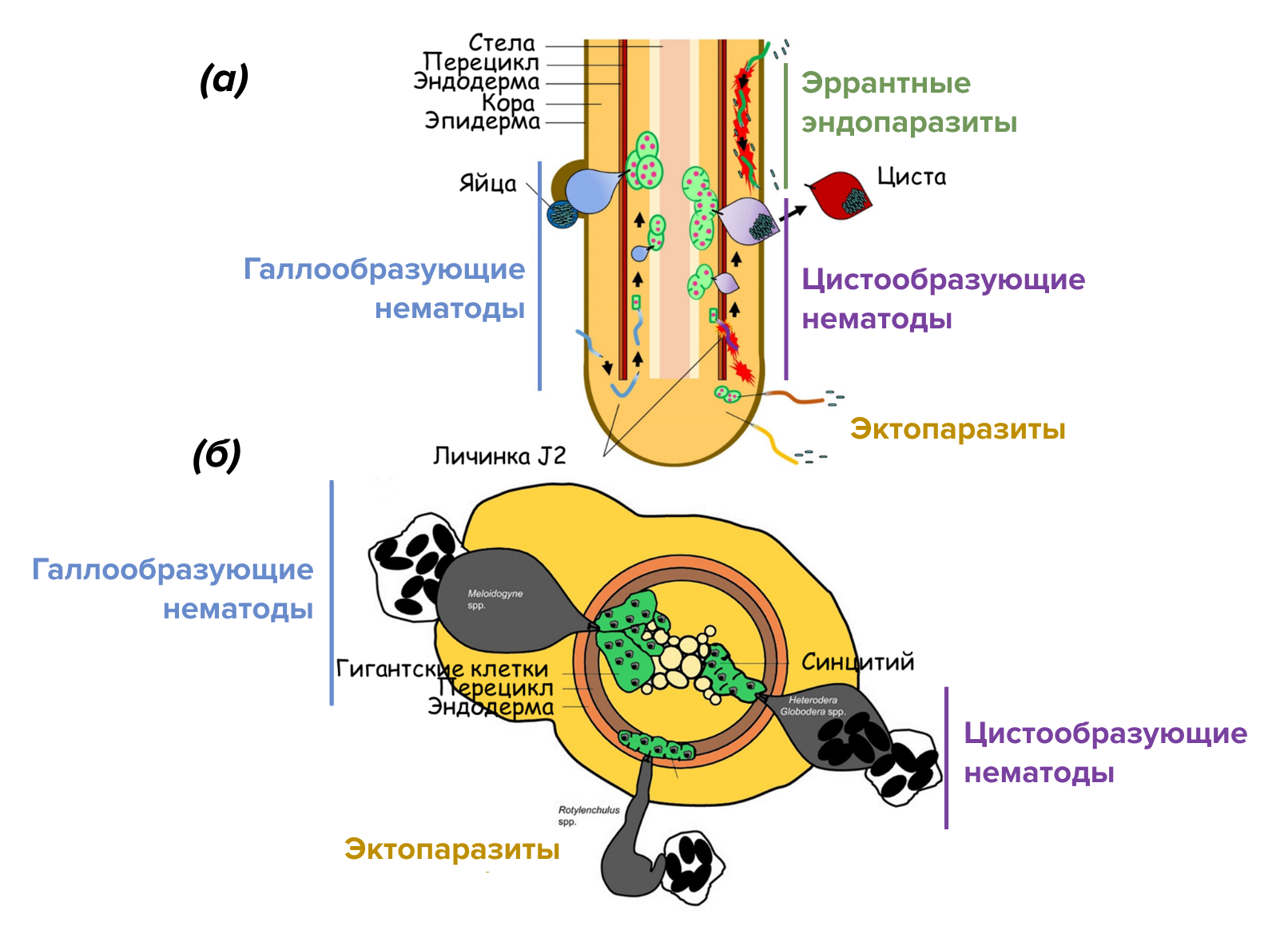
Растения относительно неподвижны, поэтому грех не воспользоваться таким удобным субстратом для паразитизма. Так и поступили некоторые свободноживущие наземные формы нематод. К фитопаразитическому образу жизни неоднократно и независимо перешли представители разных классов нематод [4], [6]. Иначе говоря, фитонематоды — понятие очень широкое; видов в природе огромное множество, поэтому их всячески группируют для различения друг от друга. В частности, удобно деление в зависимости от пищевого поведения, а точнее сказать, «стиля жизни» (рис. 2). Так, единственным физическим контактом эктопаразитических нематод является введение стилета: частичное проникновение в хозяина позволяет нематодам паразитировать на поверхности растения и проводить весь жизненный цикл вне организма-хозяина. Полуэндопаразитические нематоды проникают для питания в корни, но заднюю часть все-таки оставляют в почве, а эндопаразиты полностью прописываются внутри корня и питаются внутренними тканями.
Также существует разделение нематод по подвижности на эррантных (migratory) и седентарных (sedentary). Эррантные эндопаразиты, например, пратиленхус Pratylenchus spp. или роющие нематоды Radopholus spp., проникают через корневые ткани, чтобы питаться растительными клетками, и вызывают повреждения по мере своей миграции. Сидячие же нематоды (sedentary nematodes) устанавливают более близкие отношения со своими хозяевами и чем-то даже напоминают ризобий эндосимбиотических бактерий, которые живут в корневых клубеньках бобовых и фиксируют атмосферный азот (рис. 2б) [7], [8].
Седентарных эндопаразитических фитонематод можно также поделить на две основные группы в зависимости от процесса инфицирования: корневые галловые нематоды (root-knot nematodes, или RKN) рода Meloidogyne и цистообразующие нематоды (cyst nematodes, или CNs) родов Globodera и Heterodera [9].
Займемся разбором двух последних групп фитонематод. Чем они отличились, спросят читатели? Во-первых, именно их представители являются одними из самых опаснейших вредителей в сельском хозяйстве, в частности, потому, что в их жизненном цикле присутствуют выносливые переживающие стадии [3], [7], [9]. А во-вторых, именно по ним накоплен значительный объем свежих данных.
Глава I. Как свить себе уютное гнездышко
«Римляне» и галлы
Как ни парадоксально, но механизмы защиты от врага могут даже способствовать нападению противника, в случае растений — фитопатогена. Такие реакции называются восприимчивыми ответами растений (susceptible response). Совокупностью разноплановых восприимчивых ответов растений на фитонематод является так называемый неопластический рост, классическими симптомами которого служат гипертрофия и гиперплазия (рис. 3а), [10], [11].
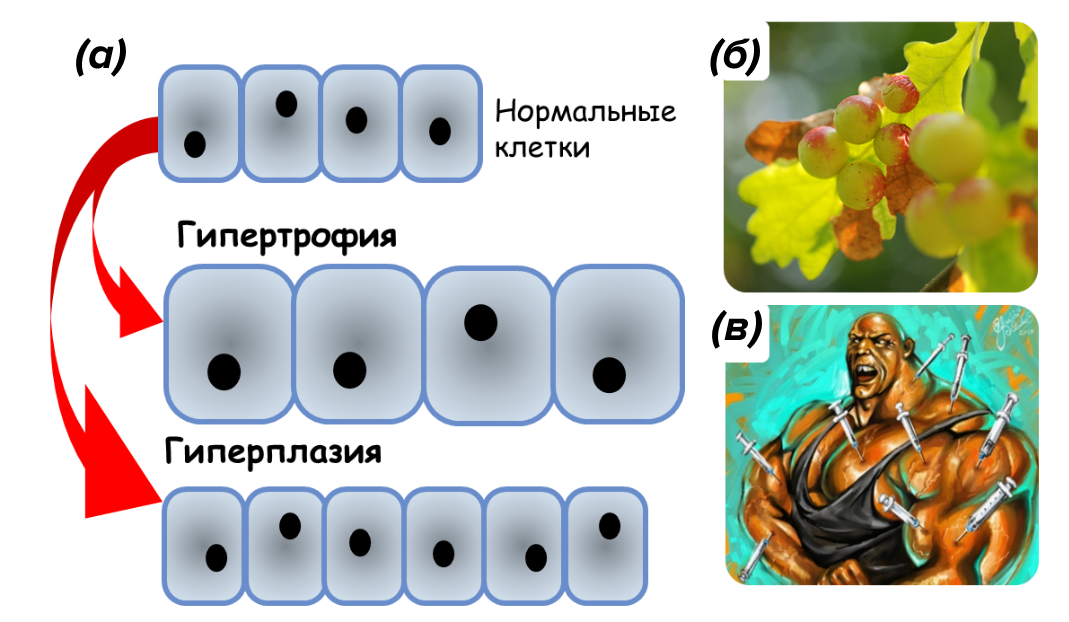
Рисунок 3. А — симптомы гипертрофии и гиперплазии;
б — чернильные орешки;
в — аналогия с бодибилдером.
рисунок автора
Гипертрофия сопровождается патологическим изменением размера клеток в большую сторону, при этом форма клетки может либо сохраняться, либо изменяться. Гиперплазия, в отличие от гипертрофии, сопровождается патологическим увеличением числа клеток, которые сохраняют свои естественные размеры или могут уменьшаться в размерах [12].
При неопластическом росте происходят морфофизиологические преобразования органов и тканей, а также формирование новообразований — опухолей, способных к неограниченному росту, или галлов — нарушений структуры тканей и органов с ограниченным ростом (яркий известный пример галлов, с которым мы часто сталкиваемся в природе — чернильные орешки (рис. 3б), [4], [11], [12].
После такой преамбулы, где мы пробежались по ряду ключевых понятий, вернемся к фитогельминтам. Итак, в области корней галлообразование чаще всего вызывается уже знакомыми нам эндопаразитическими седентарными нематодами корневой системы растений [12]. Они перемещаются в сосудистый цилиндр и, используя для секреции свой стилет, вызывают сложную модификацию клеток корня-хозяина в многоядерные специализированные гиперметаболические участки (то есть где много еды) и похищают питательные вещества [13], [14]. В этих питающих клетках, т.н. местах питания нематод (nematode feeding sites, или NFSs), клетки растения, словно птица феникс, перерождаются заново: реактивируется клеточный цикл и начинается процесс редифференцировки. Места питания, будучи сформированными, поддерживают рост и развитие на протяжении всего онтогенеза паразита, то есть в течение несколько недель [3], [7].
Другими словами, седентарные нематоды, паразитирующие на растениях, являются биотрофами: они не собираются убивать своего хозяина, им важны устойчивые и предсказуемые отношения, поскольку растения служат для них единственным источником питательных веществ. Но, несмотря на общие принципы патогенеза, следует отметить, что галло- и цистообразующие нематоды имеют и значительные различия в биологии заражения, на рассмотрении которых важно остановиться подробнее [3], [5], [11].
Узкие специалисты
Цистообразующие нематоды имеют, как считается, узкую гостальную специфичность (то есть специфичность по хозяевам). В 1965 г. было показано, что наибольшее количество растений-хозяев среди всех цистообразующих нематод поражает свекловичная нематода H. schachtii: 218 видов в 23 семействах растений, причем 80% видов принадлежит к семействам капустных и маревых. Вообще, о биологии этих фитонематод много информации было почерпнуто из исследований уже упомянутой свекловичной нематоды (Heterodera schachtii), а также ее собратьев: соевой цистообразующей нематоды (Heterodera glycines), золотистой картофельной нематоды (Globodera pallida и G. rostochiensis) и ряда злаковых нематод (H. avenae, H. filipjevi и H. latipons) [15].
В жизненном цикле (рис. 4а) нематод родов Heterodera и Globodera личинки II стадии (J2), проникнув в корень, мигрируют прямо через последовательно расположенные клетки непосредственно в область сформировавшейся сосудистой ткани, образно говоря, трубопровода растения. Там, в стеле, где в разные стороны идут потоки воды и питательных веществ, фитогельминты «выбирают» одну клетку (перицикла или прокамбиальную клетку) и поражают ее своим стилетом. Эта клетка-жертва, благодаря секретам слюнных желез, подвергается процессу редифференцировки, во время которого ядро увеличивается за счет эндоредупликации. А затем, благодаря частичному растворению клеточных стенок и слиянию протопластов соседних паренхимных клеток, образуется большой по объему, величиной более 200 клеток и обладающий высокой активностью обмена веществ многоядерный синцитий, из которого уже неподвижный паразит спокойно высасывает питательные вещества. Во время развития нематод синцитий еще и расширяется за счет интеграции соседних клеток [16], [17].
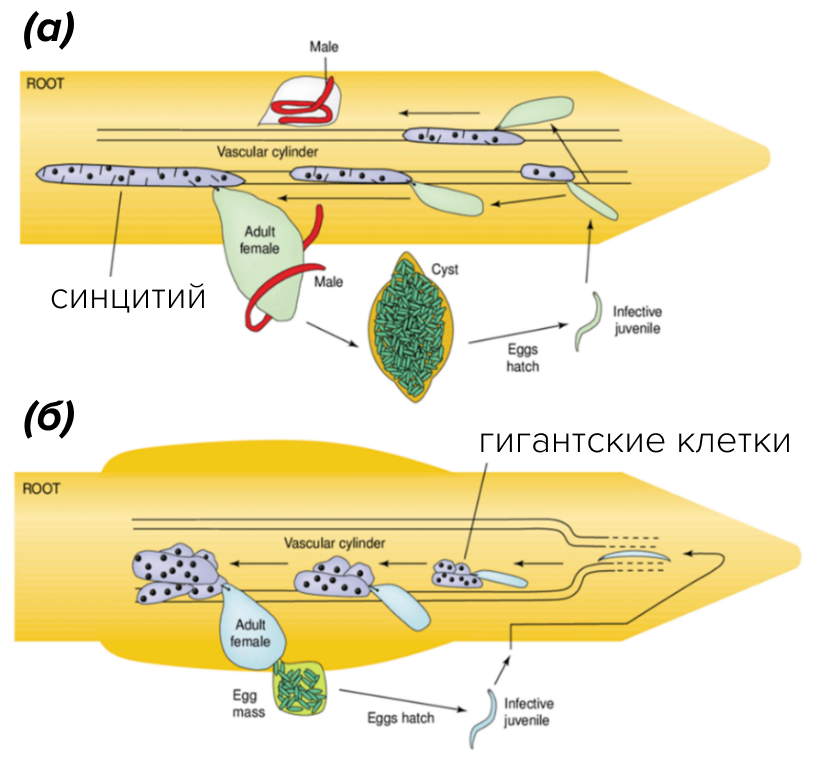
Рисунок 4. Различия в жизненных циклах: а — цистообразующие;
б — галлообразующие нематоды.
Цистообразующие нематоды имеют два пола, механизм определения которого до конца не изучен, но известно, что окружающая среда сильно влияет на соотношение полов: в благоприятных условиях с достаточным количеством питательных веществ большинство молодых особей развиваются, как нетрудно догадаться, в самок [14]. После спаривания взрослые самцы перестают питаться, в то время как самки поддерживают взаимодействие с растением-хозяином. Соответственно, синцитии, ассоциированные с самками нематод, крупнее, чем у самцов.
Внутри тела самки производятся сотни яиц, а когда она умирает, на ее теле образуется циста, которая может долгие годы защищать яйца в почве (рис. 5). От этой особенности происходит и название группы.
Надо заметить, что из-за раздельнополости находить партнера для размножения цистообразующим нематодам не всегда легко, поэтому эти черви не столь распространены, как их родственники, галлообразующие фитогельминты, разговор о которых впереди [18].

Рисунок 5. Циста золотистой картофельной нематоды.
Гулливеры и лилипуты
Галлообразующие нематоды Meloidogyne являются одними из самых распространенных, наиболее узнаваемых и широко изученных фитонематод. Отчасти это связано с тем, что на инфицированных корнях в месте их питания образуются галлы, которые при тяжелом заражении придают корням «узловатый» вид. Впервые про галлообразующих нематод сообщил английский миколог Майлз Джозеф Беркли в 1855 г. Найденные им в галлах на корнях тепличных огурцов яйца и личинки нематод, были названы вибрионами. На сегодняшний день описано около 100 видов рода Meloidogyne, которые могут поражать широкий спектр сосудистых растений. Особенно их много в тропических и субтропических регионах мира, где они наносят наибольший урон [1].
Сайты питания галлообразующих нематод состоят не из синцития, а из нескольких многоядерных гигантских клеток (giant cells, или GCs), каждая из которых развивается из отдельной клетки-предшественницы. Пораженные растительные клетки претерпевают резкую трансформацию, превращаясь в буквальном смысле слова в гигантские многоядерные клетки, на которых нематода питается на протяжении всего остального жизненного цикла [19], [20]. Любопытно, что на зрелой стадии синцитий цистообразующих нематод функционально эквивалентен гигантским клеткам, имея с ними очевидные сходства, такие как плотную цитоплазму, множественные ядра и высокую метаболическую активность [16].
Цикл заражения корневыми галловыми нематодами похож на цикл цистообразующих (рис. 4б) и разделяется на три отдельных этапа: инвазия, индукция гигантских клеток и получение питательных веществ (рис. 6) [21].
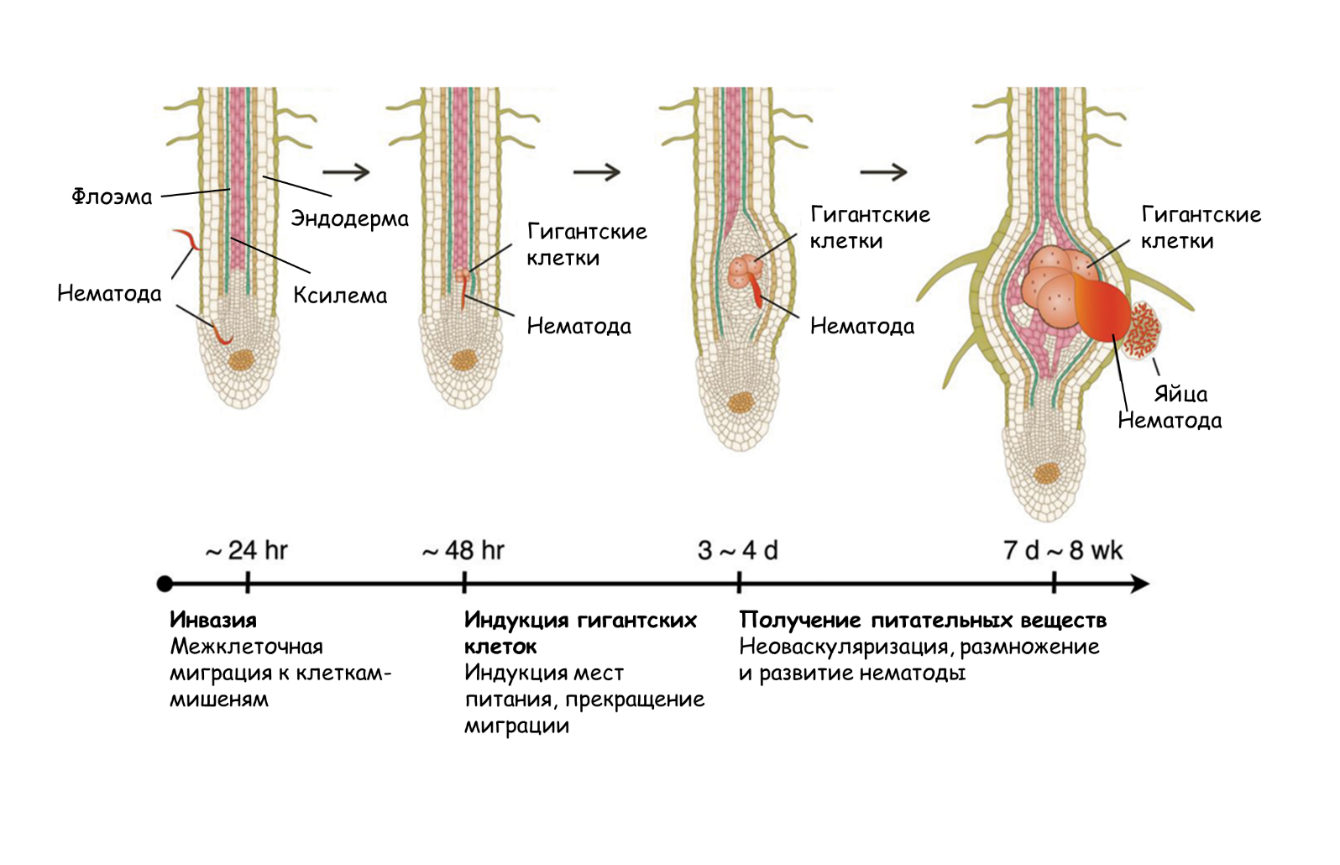
Рисунок 6. Стадии инфицирования галлообразующими нематодами.
адаптировано из [21]
После вылупления из яиц в почве личинки перемещаются в ризосфере, ищут корни хозяина и после обнаружения проникают в растение преимущественно около кончика корня (цистообразующим было все равно, где проникать). Далее нематоды следуют по апопластной сети, то есть клеточным стенкам и межклетникам, не заходя по пути в растительные клетки, в отличие от цистообразующих собратьев. В итоге своих скитаний личинки оказываются в стеле на уровне зоны растяжения корня, где идет процесс дифференцировки сосудистых клеток.
Как только личинки попадают в «благоприятное» место, они выбирают клетки-мишени (развивающиеся клетки паренхимы ксилемы) и инициируют повторную дифференцировку 4–8 соседних сосудистых клеток корня в гипертрофированные и многоядерные гигантские клетки. Начало стадии индукции также знаменует постоянное место прописки паразита, поскольку затем он отказывается от миграции.
Гигантские клетки образуются путем синхронных повторяющихся делений ядра без цитокинеза и поэтому становятся многоядерными, в то время как сами ядра дополнительно подвергаются обширной эндоредупликации. Гипертрофированные зрелые гигантские клетки (рис. 7б) достигают окончательного размера до миллиметра, то есть примерно в 400 раз больше, чем обычные сосудистые клетки, и содержат более 100 полиплоидных ядер [3], [21]. Настоящие Гулливеры!
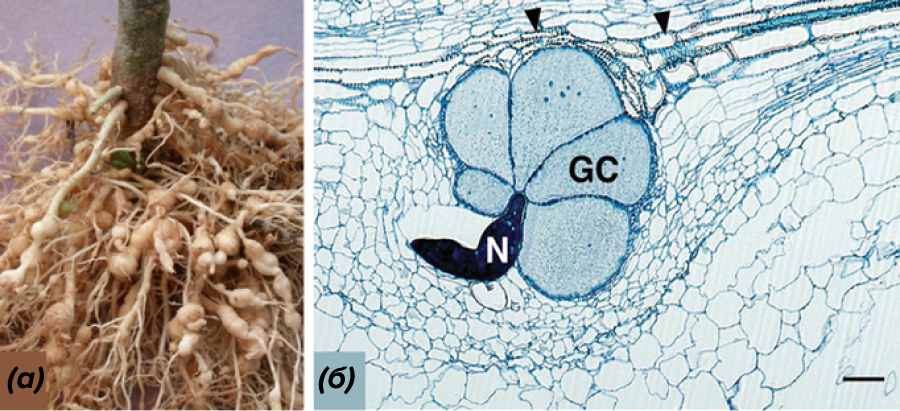
Рисунок 7. Работа галлообразующих нематод:
а — типичные симптомы («галлы») заражения корневыми нематодами корневой системы томата;
б — продольный срез корня, демонстрирующий три реально гигантских гигантских клетки (GC), индуцированные нематодой (N) через 14 дней после инокуляции.
Масштабная линейка = 50 мкм
Тонкое взаимодействие между нематодой и ассоциированными с ней гигантскими клетками осуществляется через специальные питающие трубки (feeding tube) (рис. 8а), [22].
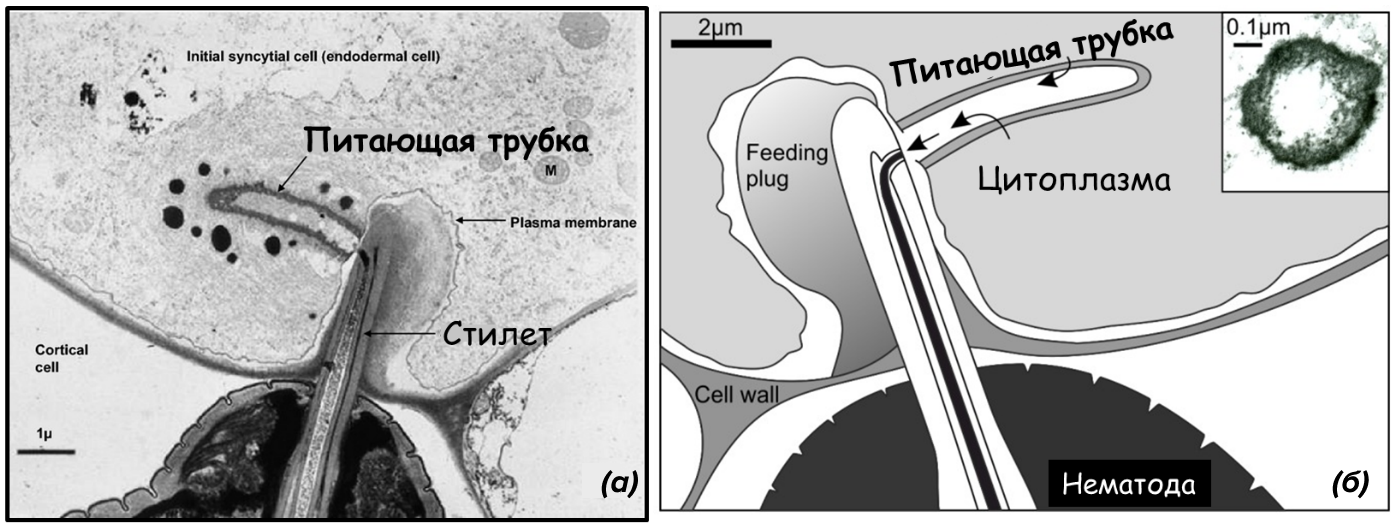
Рисунок 8. Питающие трубки:
а — микрофотография; б — схема.
Что же это за устройство? Питающие трубки образуются внутри клеток растения из соединений, секретируемых самой нематодой, и могут действовать как регулятор давления и ультрафильтр, ограничивающий поступление из клеток крупных молекул пищи, которые могут закупорить отверстие стилета. Не высасывать же все подряд, можно и подавиться! Целостность мембраны растительных клеток на начальных этапах процесса питания не нарушается: нематода извлекает ресурсы из цитозоля аккуратно, через находящиеся в местах инвагинаций плазмалеммы небольшие поры, образующиеся на месте ее контакта с отверстием стилета. Место, где острие стилета входит в питающую клетку, образуется пробка (feeding plug) из белковых продуктов, секретируемых специальными железами нематоды (так называемыми амфидами). Таким образом, головной конец фитонематоды оказывается фактически приклеенным к синцитию (рис. 8б), [15].
На стадии усвоения питательных веществ растущая нематода, гигантские клетки и окружающие ткани — все совокупно вносят свой вклад в формирование типичного симптома корневого галла, который легко обнаруживается невооруженным глазом (рис. 7а). То есть, чтобы приспособиться к растущим гигантским клеткам, окружающие клетки перицикла и коры также вынужденно гипертрофируются и делятся. В результате инфекция сопровождается выраженным и характерным истиранием окружающей ткани («завязкой корня») [23].
Таким образом, на корнях, зараженных галлообразующими нематодами, образуются галлы, которые возникают в результате сильных изменений в биологии клеток, окружающих место питания. Вообще этот процесс напоминает прием оголтелым бодибилдером стероидов: шприцем (стилетом) делается укол веществ (эффекторов), влекущий за собой гипертрофию тканей (рис. 4в). Напомним, что индукция мест питания цистообразующих нематод не требует столь радикальных изменений морфологии корней.
Один корневой галл может содержать сразу несколько нематод и участков питания, хотя при этом каждая особь индуцирует свою собственную отдельную группу гигантских клеток. Обычно на участке питания одной нематоды имеется от 4 до 10 гигантских клеток, которые на зрелой стадии характеризуются высоким метаболизмом, множественными, часто эндополиплоидными ядрами (то есть с кратно увеличенным набором хромосом, образующимся именно в результате эндомитоза, а не слияния диплоидных клеток), плотной цитоплазмой без большой центральной вакуоли, но с множеством небольших вакуолей, высокой плотностью органелл и врастаниями клеточной стенки в областях, прилегающих к окружающей проводящей ткани. Между прочим, такие врастания в интактном растении обычно обнаруживаются в клетках, которые характеризуются повышенным транспортом через их плазматическую мембрану (например, в промежуточных клетках флоэмы у некоторых растений, которые ответственны за передачу продуктов фотосинтеза от ассимиляционной ткани к ситовидным элементам). Но об этом мы еще поговорим. Можно подытожить, что все перечисленные морфологические характеристики мест питания нематод указывают на то, что туда сосудистой сетью растений эффективно доставляются метаболиты, идущие на прокорм фитопаразитов [21].
Галлообразующие нематоды демонстрируют богатый набор способов размножения, таких как амфимиксис, факультативный и облигатный партеногенез, что дает им конкурентные преимущества перед цистообразующими собратьями [3], [21].
Спустя примерно 4–6 недель после заражения взрослая самка грушевидной формы, сформировавшаяся из инфекционной личинки после трех линек, набухает, становится сферической и откладывает яйца в студенистый матрикс. Цист при этом не образуется. Видимо, отсюда и происходит название рода Meloidogyne, по-гречески означающее «женщина в форме яблока» [3], [5], [21].
Итак, мы заметили, как здорово нематоды управляются с растительными клетками и заставляют их плясать под свою дудку. Остап Бендер знал четыреста сравнительно честных способов отъема денег; а какой инструментарий у нематод? Остановимся на этом подробнее.
Глава II. Инструментарий кукловода
Если формализовать, что мы узнали раньше, то можно сказать: действие фитонематод на растения складывается из механического повреждения, химического воздействия и в конечном итоге превращения их в кормовую базу. Для достижения всего перечисленного у фитонематод имеются определенные железы, которые секретируют соединения, способствующие совместимому взаимодействию растений и фитогельминтов, то есть признанию друг друга на молекулярном уровне (это можно объяснить на примере: человеческий глаз воспринимает свет, электромагнитную волну, значит, это совместимое взаимодействие, а вот «послушать» глазом уже вряд ли удастся — несовместимое взаимодействие).
Секреты фитонематод собирательно называются секретомом, то есть совокупностю всех белков, секретируемых нематодой за время паразитирования на растении [24-26]. Эти белки можно сравнить с троянским конем, который запускается в клетки растений и открывает ворота для последующей экспансии. Основная роль во взаимоотношениях растений и нематод принадлежит секретам одноклеточных пищеводных желез: двум субвентральным и одной дорсальной (рис. 9), [5], [26].
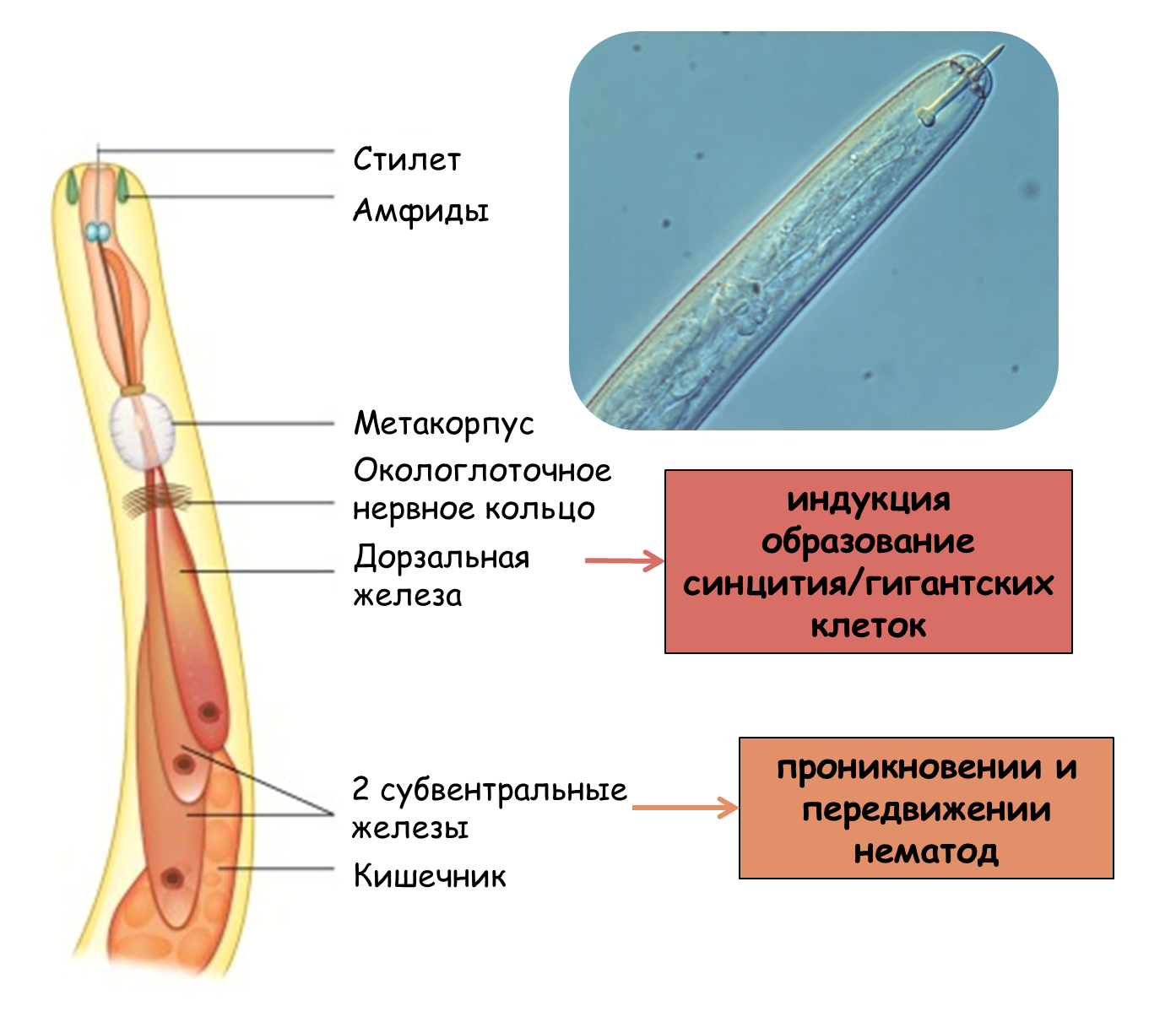
Рисунок 9. Передний конец нематоды с характерным стилетом и ключевые железы.
адаптировано из [25]
Секреты первых имеют значение при проникновении и передвижении нематод по клеткам растений, в то время как секреты второй непосредственно индуцируют образование синцития/гигантских клеток.
Секретомы малоподвижных эндопаразитарных фитонематод особенно интересны из-за их способности вызывать серьезные изменения в экспрессии генов хозяина. Причем в процессе развития нематод в тканях растений происходят изменения активности секретируемых ферментов. Например, секретом южной галловой нематоды Meloidogyne incognita состоит из 486 белков, значительное количество которых являются гомологами растительных белков [26].
Секретируемые белки, косвенно или прямо участвующие в развитии совместимых взаимодействий с растениями-хозяевами, называют паразитомом и рассматривают как составляющую часть секретома [21], [26]. Очень любопытно, что ферменты, обнаруженные в железах нематод, которые обеспечивают паразитирование в клетках растений, присутствуют только у бактерий или грибов. Поэтому в настоящее время считается, что произошла горизонтальная передача генов от бактерий к предковым формам нематод, питание которых было связано с ризосферной микробиотой [26]!
Артподготовка
Паразитом нематод в основном содержит три категории белков. Первая категория включает ферменты, разрушающие клеточную стенку, CWDE (cell wall-degrading enzyme), и ферменты модификации клеточной стенки, действие которых упрощает перемещение и питание нематод [26].
Вообще, клеточная стенка — это первый физический барьер, с которым сталкиваются патогены; она — важный фактор устойчивости: за ней растительная клетка «как за каменной стеной» [11], [26]. Фитонематоды для питания, конечно, должны взять штурмом эту преграду, поэтому они продуцируют шесть семейств белков-ферментов, способных растворять полимеры клеточной оболочки. К ним относятся полигалактуроназы, пектатлиазы, арабиназы, целлюлазы, ксиланазы и экспансины. Также в секретах нематод обнаружена амилаза [14], [27-29].
Любопытно, что ферменты, разрушающие клеточную стенку, особенно активно синтезируются у самок в период откладки яиц, что подчеркивает важность процесса мацерации тканей для завершения онтогенеза паразита. Значительную роль в патогенезе играют пектиназы, способствующие проникновению нематод в растение через воздействие на полимеры, входящие в состав клеточной стенки и срединной пластинки. Так, у эррантного пратиленхуса их активность в 7 раз выше, чем у седентарного паразита Heterodera trifollii, что вполне логично, поскольку подвижному паразиту надо постоянно продираться через «бурелом» клеточных стенок, в отличие от ведущих «диванный» образ жизни седентарных червей [30].
«Эффективные» менеджеры эффекторы
Вторая категория секретируемых белков состоит из эффекторов нематод, участвующих в подстройке под паразита метаболических процессов растения, а также так называемых факторов авирулентности, которые, взаимодействуя со специальными рецепторами, приводят к быстрому обнаружению гельминта растением-хозяином и его ликвидации. Но об этой грустной, с точки зрения нематод, истории поговорим чуть позже.
А пока продолжим хвалить фитопаразитов за чудеса изобретательности. Так, биохимический анализ секретома различных гельминтов продемонстрировал наличие множества эффекторных белков, которые могут взаимодействовать и с генами, и с белками хозяина для установления успешного паразитизма. Эти эффекторы, секретируемые нематодами, работают на подавление защитных реакций хозяина прямым манипулированием метаболическими сетями и путями развития растений, а также на запуск различных сигнальных каскадов, которые приводят к активации генов растений, полезных для создания мест питания. В частности, эффекторные белки могут вызвать изменения в клеточном цикле растений, цитоскелете и выработке малых РНК, сигналинге фитогормонов. Но в то же время, как мы недавно упоминали, обнаружение некоторых «невезучих» эффекторов (факторов авирулентности) самими растениями-хозяевами активирует фитоиммунитет, не предвещающий ничего хорошего для паразитических гельминтов [3], [26].
Ядерные силы
Третья часть секретома — регуляторные белки, которые являются факторами транскрипции. Они поступают в ядро и связываются с промоторами генов растений, чтобы модулировать их экспрессию в пользу паразитов. Причем действуют они и в роли активаторов, например, генов АТФаз, и, что чаще, в роли чаще, супрессоров генов-хозяев, участвующих в защитных реакциях, например, AtWRKYs (синтез фитоалексинов) и AtRAP2.6 (укрепление клеточной оболочки каллозой). Другими словами, к этой группе можно отнести все эффекторы, которые имеют ядерную локализацию.
Так, эффекторный белок M. incognita, Mi-EFF1, был обнаружен в ядрах многоядерных сайтов питания, где он участвует в манипулировании экспрессией генов. Эффектор M. javanica, Mj-NULG1a также был нацелен на ядра гигантских клеток, но для чего, пока неизвестно.
Кроме того, было показано, что свекловичная нематода секретирует ANNEXIN-подобный белок, Hs4F01, способный имитировать аннексины растений за счет связывания фосфолипидов и ионов Ca2+, которые являются важными модуляторами защиты растений, поскольку в норме растительные аннексины включены в ответ на абиотические стрессы: они участвуют в изменении структурной организации мембран, везикулярном транспорте, путях передачи сигналов. А нематодные псевдоаннексины мешают полезной работе этих белков. Но кроме этого, возвращаясь к разговору об эффекторах ядерной локализации, упомянем, что еще один аннексин, вырабатываемый нематодой H. avenae, направляется в ядро растения для подавления базальных защитных реакций хозяина: присоединяясь к промоторам защитных генов, он репрессирует их экспрессию [3], [5], [26].
Хотя вышеназванные компоненты секретома — лишь единичные примеры, так сказать, верхушка айсберга, на этом пока завершим общую характеристику эффекторных молекул. Однако дальше будем постоянно вспоминать о них.
Дополнительные вооружения
Для полноты картины необходимо упомянуть о том, что менее значительное количество секрета выделяется фитогельминтами через амфиды (хеморецепторы нематод) и кутикулу. К примеру, кутикулярные выделения представляют из себя низкомолекулярные липопротеины [5], [31].
Кроме того, в кишечнике питающихся самок обнаружены цистеиновые и сериновые протеиназы, участвующие в переваривании растительных белков и играющие определенную роль во взаимоотношениях с хозяевами. Кроме белков, в выделениях нематод в большом количестве имеются и другие соединения: углеводы, липиды, аммиак, аминокислоты, амины, дикарбоновые кислоты, альдегиды и органические кислоты — это преимущественно токсины, отравляющие жизнь растений [5], [32], [33].
Глава III. Троянский конь в действии
Теперь настало время соединить представления об инструментарии фитонематод, прежде всего — белках-эффекторах секретома, и конкретных результатах — восприимчивых ответах. Это такие процессы в растениях, которые отключить невозможно в силу их витального характера, но из-за их рабочего состояния патогенам гораздо легче манипулировать своим растением-хозяином. Если сравнивать с человеком, то нельзя же вовсе избавиться от эритроцитов, чтобы не заражаться малярией, следовательно, можно сказать, что красные кровяные тельца — это фактор восприимчивости [11].
Дезинформация — манипулирование фитогормонами
На войне первое и самое главное — сломать каналы связи и дезинформировать противника. А в растениях, как известно, за неимением нервной системы важную функцию в передаче информации играют фитогормоны. Отключить их попросту нельзя, даже если очень хочется излечиться от надоедливых нематод.
Индукция неопластического роста нематодами служит наиболее ярким примером воздействия на гормональные системы растений. Патологическое деление и рост растительных клеток — ключевые характеристики гипертрофии и гиперплазии — прямое следствие действия ауксинов и цитокининов. Повышенное содержание определенных фитогормонов при неопластическом росте не только индуцирует деление и рост клеток растений, способствует притоку фотоассимиллятов и разрыхлению клеточной стенки, но и влечет за собой формирование сильного гормонального дисбаланса, что вредит здоровью растений и, конечно, сокращает урожаи [7].
Ауксин — всему голова
Ауксин, или индолил-3-уксусная кислота (IAA), является важным регулятором органогенеза растений. Неудивительно, что в корнях в местах будущей закладки боковых корней, а также клубеньков можно наблюдать локальные максимумы накопления фитогормона. Причем IAA играет двойную роль в управлении развитием корня, выступая, с одной стороны, как морфоген, определяющий место формирования органа, а с другой, как регулятор клеточного цикла, наряду с цитокининами.
Инициация «уютного гнездышка» фитонематод также не обходится без его локального накопления: в частности, ауксин ответственен за многие изменения, происходящие во время развития мест питания, такие как гипертрофия и врастания клеточной стенки. Он может запускать образование как гигантских клеток, так и синцития. Откуда же нематоде взять «волшебный ключик» к сердцу растения? Было предположено, что локальное накопление ауксина при инфекции может быть связано, с одной стороны, с синтезом и секрецией нематодами, а с другой, искусственно повышенным уровнем биосинтеза гормона самим растением или же изменением его полярного транспорта. Но насколько реален каждый из способов?
Так, образование ауксина как продукта разложения триптофана, а также его секреция в конъюгированной с сахарами и аминокислотами форме, была показана у фитонематод. Однако влияние экзогенного ауксина на образование мест питания доказано не было. Но зато было обнаружено, что вскоре после заражения паразитами активируются гены биосинтеза ауксина и ответа на него у клеток растения. Также у арабидопсиса было достоверно установлено изменение транспорта ауксина при нематодной инфекции. Это особенно любопытно.
Напомним, что в интактных растениях значительное количество ауксина продуцируется в побегах, а его транспорт «вниз» генерирует морфогенные градиенты. Взаимодействие переносчиков AUX/LAX (AUXIN/LIKE AUXIN), пассивно впускающих ауксин в клетку на апикальном полюсе, и PIN, осуществляющих активный транспорт ауксина из клетки — на базальном, опосредует его полярный транспорт (рис. 10а).
Транспортеры AUX1 и LAX3 оказались необходимы для образования мест питания фитонематодами, поскольку экспрессия их генов сильно повышается на ранних стадиях инфекции, а мутанты по генам этих транспортеров менее восприимчивы к инфекции. Теперь ясно, что паразитические нематоды вызывают перестройки транспортеров PIN и AUX / LAX. Но как именно нематоды манипулируют транспортом?
Механизм, по-видимому, заключается в том, что эффекторы (у свекловичной нематоды показаны два белка: 19C07 и 10A07), вводимые в растение-хозяина через стилет, напрямую мешают транскрипции регуляторов транспорта ауксина, например, протеинкиназе PINOID (PID) и протеинфосфатазе PP2A, которые определяют статус фосфорилирования белков PIN и тем самым регулируют апикально-базальную полярность локализации транспортера PIN в биполярных клетках корней. Кроме того, эффектор 19C07 может напрямую связываться с переносчиком ауксина LAX3, чтобы контролировать приток ауксина и образование синцития [7], [34].
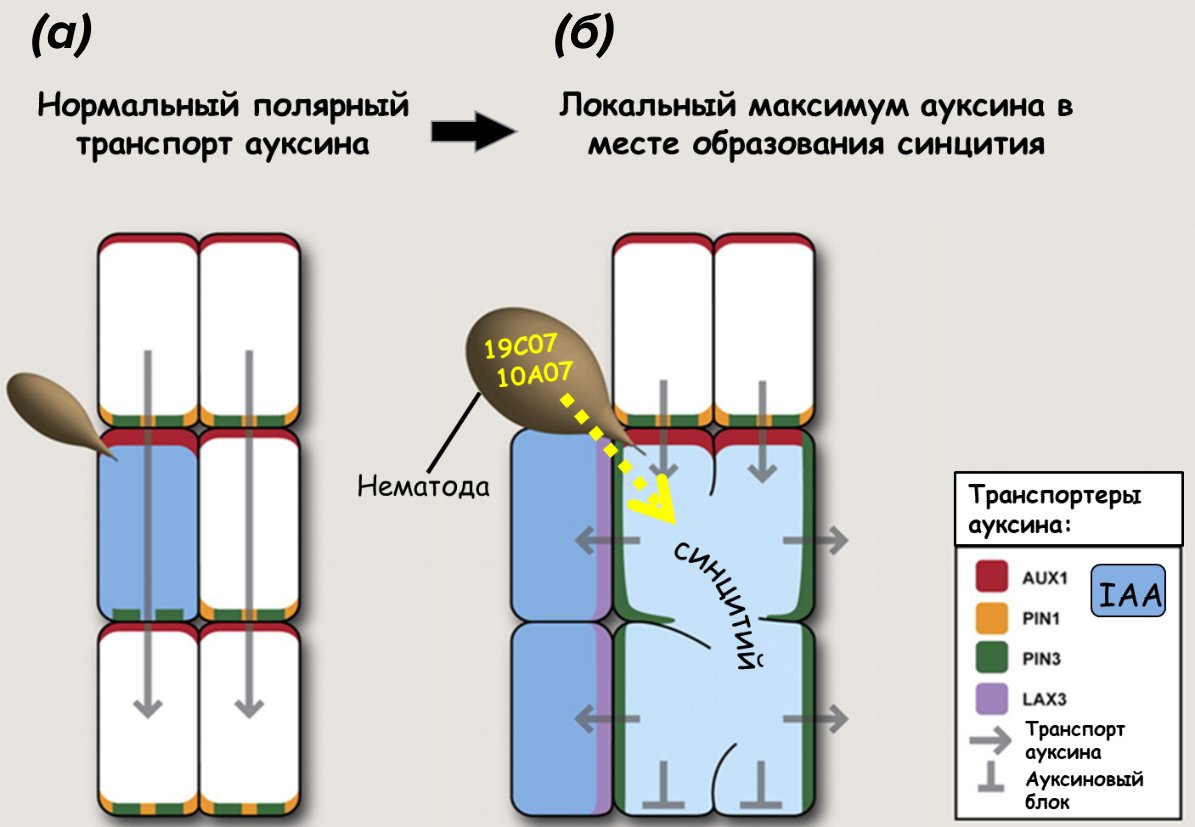
Рисунок 10. Схема манипулирования транспортом ауксина во время образования синцития. Стрелками обозначены потоки ауксина, голубым цветом выделены его локальные максимумы.
адаптировано из [7]
На модели цистообразующих нематод было выяснено, что на ранних стадиях инфекции ауксин накапливается в начальной питающей клетке-жертве (это так называемый инициирующий синцитий), где усилено AUX1-опосредованное поступление ауксина в клетку и снижено его PIN1-опосредованное выведение из клетки благодаря подавлению экспрессии гена этого транспортера. Таким образом, ауксин, оказывается, как бы в заперт ловушке (рис. 10), и ему, делать нечего, приходится работать на благо паразита.
Кроме того, уже в рамках самого синцития другой транспортер, PIN3, перемещается с базальных на латеральные плазматические мембраны, чтобы перенаправить ауксин в соседние клетки для последующего их вовлечения в развивающийся синцитий. Со стороны же соседних клеток ауксин принимает транспортер LAX3, что стимулирует гидролиз клеточных стенок и втягивание окружающей ткани в формирующийся синцитий (рис. 10б) [7], [25].
Идеальная растяжка
Накопился ауксин, а дальше-то что? Наверняка, бросается в глаза характерная черта гигантских клеток и синцития — их сильный рост. Очевидно, что такое мощное растяжение клеток требует и ее скоординированного ремоделирования. Растяжение включает в себя разрыхление сети полисахаридов. Ауксин же как раз известен своей ролью в росте клеток через активацию белков-ферментов, модифицирующих клеточную стенку, и протонных насосов плазмалеммы, которые регулируют «кислый рост». Модифицирующие клеточную стенку ферменты растительного происхождения, такие как эндо-b-D-глюканазы, экспансины, эндотрансгликозилазы, а также пектатлиазы, полигалактуроназы и пектинэстеразы, могут участвовать в формировании питающих клеток, это факт. Например, было показано, что ген эндоглюканазы Atcel1 активируется в развивающихся гигантских клетках. Также при заражении галловыми нематодами у арабидопсиса включается ген LeEXPA5, кодирующий экспансин. Подавление же этого гена влияет на развитие корневых галлов и способность нематод к размножению [8], [35], [36].
Кроме того, переотложение синтезированного материала и разрыхление клеточной оболочки в процессе развития мест питания приводят к утолщению клеточной стенки, а также развитию врастаний [37].
Цитокинины — последний штрих
Еще один тип фитогормонов — цитокинины — необходимы для успешного развития синцития, причем в работах было показано, что фитогельминты сами способны к синтезу и секреции этих гормонов. Ученые обнаружили цитокинины в секретах свекловичной нематоды, что позже было подтверждено идентификацией и соответствующего гена фермента синтеза цитокинина — изопентенилтрансферазы (HsIPT), экспрессирующегося на ранних стадиях инфицирования. Подавление этого гена сильно снижало уровень свободного основания изопентениладенина, предшественника цитокинина, и тормозило передачу цитокининового сигнала, что, в свою очередь, вызывало падение вирулентности нематод. Получается, что работа изопентенилтрансферазы, ключевого фермента в биосинтезе цитокининов, может заметно влиять на степень вирулентности паразитов.
Поскольку путь и тканевую локализацию синтеза цитокининов у нематод определить не удавалось, было высказано предположение, что цитокинины нематодного происхождения могут быть экскретируемыми отходами деградации нуклеиновых кислот, что очень вероятно и уже показано для многих других паразитов растений (рис. 11б), [38], [39].
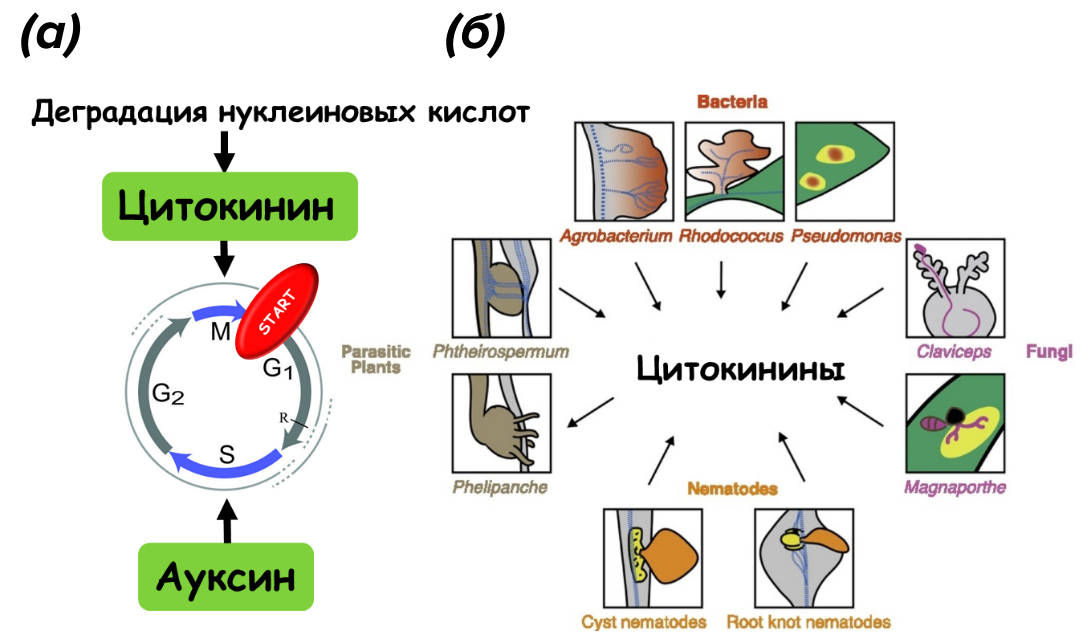
Рисунок 11. Цитокинины: а — запуск клеточного цикла; б — распространенность фитогормона у множества паразитов растений.
адаптировано из [39]
Но также оказывается, что растения-мутанты с нарушенным собственным синтезом цитокининов показывают невосприимчивость к фитонематодам. А это подразумевает, что цитокинины, продуцируемые как растениями, так и самими гельминтами, необходимы для образования хорошего синцития [14].
Итак, нематоды продуцируют цитокинин (или используют растительный источник), далее он выделяется в клетки растения-хозяина в месте заражения и вместе с ауксином контролирует вход клеток в клеточный цикл, индуцируя синтез циклинов (рис. 11а). Кроме того, цитокинины, регулирующие донорно-акцепторные взаимоотношения в растении, повышают акцепторные свойства инфицированной ткани, как бы включают сирену «Хочу кушать», способствуя интенсивному притоку продуктов фотосинтеза в пораженную паразитом область. Этот так называемый аттрагирующий эффект, который обеспечивается прежде всего с помощью ферментов, апопластных инвертаз. Находясь в межклеточном свободном пространстве, инвертазы катализируют реакцию гидролиза основной транспортной формы углеводов, сахарозы, до глюкозы и фруктозы, которые с большим аппетитом поглощаются зараженными клетками. Совершенно очевидно, что аттрагирующий эффект чрезвычайно важен для поддержания нужного количество фотоассимиллятов в местах питания паразитов [11].
Что русскому хорошо, то немцу смерть
Но чтобы обеспечить аттрагирующий эффект, требуется транспортная инфраструктура, то есть сосудистая ткань. Она играет значительную роль во взаимодействиях с паразитами, поскольку седентарные нематоды ведут малоподвижный образ жизни и индуцируют места питания, к которым нужно обеспечить прокладку проводящих тканей растений.
В отношениях с «трубопроводом» проявляются и различия во вкусах двух обсуждаемых групп фитогельминтов. Несмотря на кажущееся тесное филогенетическое родство цистообразующих и галловых нематод, участки питания, индуцированные этими двумя группами нематод, используют принципиально разные стратегии для импорта веществ.
Изначально считалось, что сайты питания обеих групп фитонематод симпластически изолированы, а загрузка питающих клеток опосредуется мембранными переносчиками. Это было подтверждено для галлообразующих нематод, но оказалось неверным для цистообразующих! Так, выяснилось, что в случае гигантских клеток загрузка ассимилятов действительно происходит апопластическим путем с помощью мембранных транспортеров, тогда как синцитии получают питание симпластически, через плазмодесмы от клетки к клетке. Различия наблюдаются и с точки зрения васкуляризации, а также потока питательных веществ. На сегодняшний день предполагается, что разные стратегии питания объясняют, почему диапазон хозяев галлообразующих нематод шире, чем у цистообразующих [21], [40].
Неоваскуляризация — мы новый мир построим...
Галлообразующие нематоды работают основательно и, как мы говорили выше, заметно изменяют морфологию корня. Поэтому помимо собственно индукции гигантских клеток, одной из наиболее ярких особенностей корневых галлов является образование de novo под влиянием гормонов обширных сетей ксилемы и флоэмы, окружающих скопление гигантских клеток. В исследованиях показана жесткая ассоциация гигантских клеток с окружающими их элементами ксилемы и флоэмы, что подтверждает острую необходимость снабжения мест питания водой и питательными веществами от растения-хозяина, для чего и происходит обширное ремоделирование проводящей системы во время инфицирования корней [21].
Однако понимание биологии заражения корневыми нематодами ограничено отсутствием известных генетических мутантов, у которых нарушена неоваскуляризация. Но все-таки кое-что известно: чтобы поддерживать рост гигантских клеток, окружающие клетки также быстро делятся, вызывая отек корня и локальный разрыв проводящих тканей. Из-за этого сосуды ксилемы кажутся искаженными и часто не связаны друг с другом. Получается, что вокруг гигантских клеток на этапах питания личинок имеются отдельные несвязанные одинокие клетки ксилемы, которые, когда взрослые нематоды начинают производить яйца, компенсаторно связываются в характерную сеть. Такая сеть, являющаяся результатом дифференцировки ксилемы de novo, отражает попытку растения хоть как-то поддержать непрерывность сосудов ксилемы в корнях после ее нарушения [21], [41].
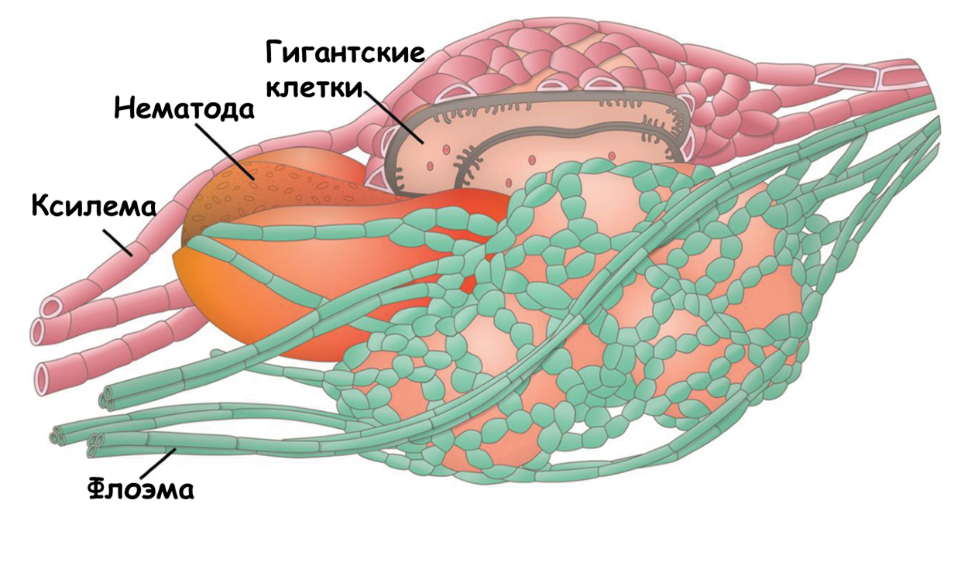
Рисунок 12. Схема неоваскуляризации вокруг гигантских клеток.
Особенность клеток ксилемы, которые дифференцируются вокруг гигантских клеток, состоит в том, что они похожи на элементы ксилемы раневого типа: асимметричны и не вытянуты, как нормальные сосуды, а также образуют нерегулярные взаимосвязанные сети. Более того, есть также некоторые параллели с васкуляризацией, которая происходит при ризобиальном симбиозе и в галлах агробактерий, где образование de novo как флоэмы, так и ксилемы позволяет снабдить сформировавшиеся структуры ассимилятами. Во всех этих случаях базовые механизмы, которые контролируют образование клеток ксилемы, неизвестны, за исключением того, что новые ксилемные клетки являются продуктом дифференцировки клеток паренхимы (рис. 14а) [21]. Итак, видно, что нематоды от жажды не умрут. А как насчет пищи?
Гигантские клетки, как мы ранее упомянули, симпластически изолированы; загрузка питательными веществами и ассимилятами происходит с помощью переносчиков. Поэтому вокруг гигантских клеток индуцируется обширное образование флоэмы (рис. 13), [40], [42]. Интересной особенностью является то, что флоэма зрелого корневого галла, в которую «встраиваются» гигантские клетки, не содержит типичных клеток-спутниц (companion cells) и состоит исключительно из клеток, которые обладают характеристиками ситовидных элементов (sieve element) — и даже часто имеют ядра, где идет транскрипция. Это характеризует данный тип флоэмы как протофлоэму, обычно сохраняющуюся в тех частях растения, которые еще продолжают интенсивно расти.
Любопытно, что изначально клетки-спутницы все-таки присутствуют вокруг развивающихся гигантских клеток [40]. Остается неясным, куда они потом исчезают: теряют ли свою идентичность, переставая экспрессировать ген транспортера SUC2, «потребляются» в процессе васкуляризации или же просто дедифференцируются.
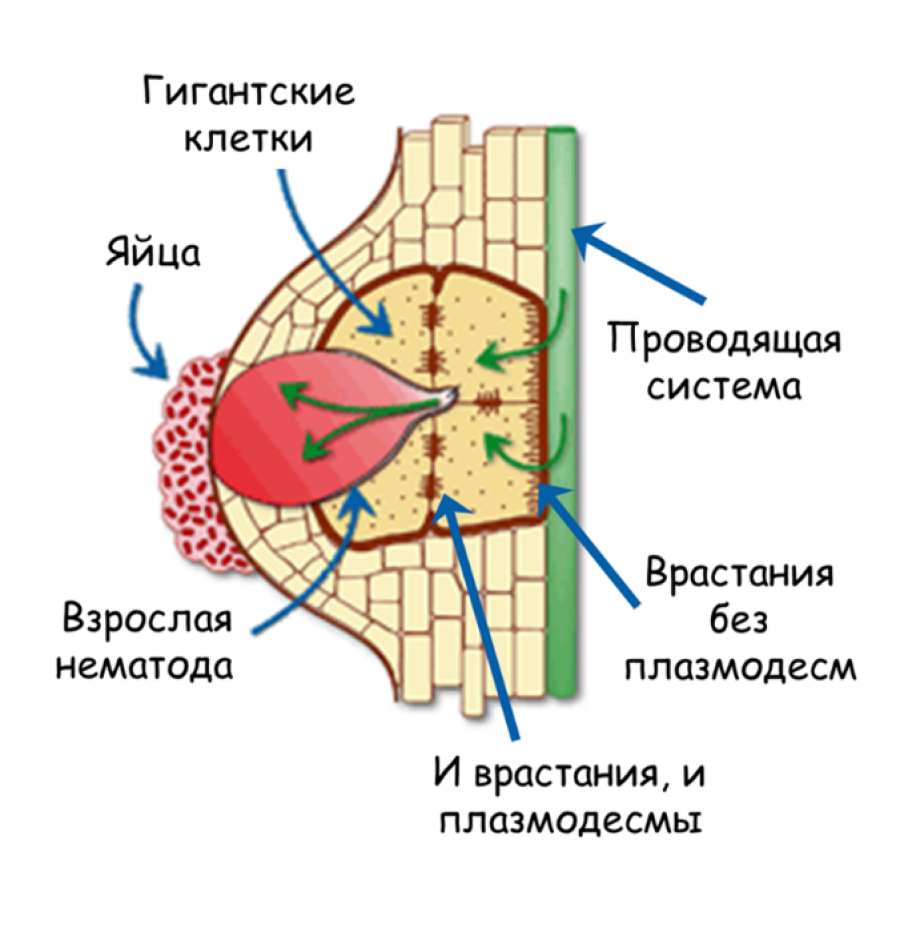
Рисунок 12. Схема потоков воды и питательных веществ в галле.
адаптировано из [10]
В любом случае, остающиеся без спутниц ситовидные элементы вокруг гигантских клеток решают тесно связываться друг с другом с помощью плазмодесм, чтобы облегчать поток ассимилятов от клетки к клетке. Причем такое образование флоэмного синцития для облегчения снабжения питательными веществами мест питания паразитов характерно при инфекции и галло-, и цистообразующими червями. Только в отличие от гигантских клеток галловых нематод, синцитий цистообразующих гельминтов соединяется с флоэмным синцитием посредством вторичных плазмодесм (то есть возникших de novo). Формирующаяся в местах питания флоэма разительно отличается от той, что обычно наблюдается в других тканях растений, включая даже флоэму раневой меристемы (рис. 12), [21].
Тот факт, что флоэма вокруг гигантских клеток не имеет клеток-спутниц, поднимает вопрос о механизмах, которые управляют дифференциальной неоваскуляризацией. Во-первых, известно, что во многом соотношение ауксина и цитокинина регулируется процессами развития, связанными с дифференцировкой флоэмы в местах питания галлообразующих нематод. Во-вторых, есть данные, что сосудистая пролиферация у растений может регулироваться секретируемым пептидом CLE, который связывается с рецептором, локализованным на плазматической мембране, и контролирует скорость деления клеток и события дифференцировки с помощью WUSCHEL-подобного фактора транскрипции [43]. Можно предположить, что фитонематоды тоже умеют секретировать CLE-подобный пептид в гигантские клетки...
«Мимикрия 80 lvl»
... И действительно, гельминты, паразиты растений, развили механизмы имитации сигнальных пептидов растений для превращения клеток хозяина в питающие клетки [44]. Вообще, растительные сигнальные пептиды из семейства CLAVATA3/ESR (CLE), которые участвуют в делении и дифференциации клеток меристемы корней и листьев и осуществляют позиционный контроль развития, давно признаются в качестве пептидных гормонов. Так вот, обнаружилось, что члены этого семейства пептидов также присутствуют в секретах фитонематод, что представляет собой феномен молекулярной мимикрии. Так, у личинки соевой нематоды обнаружен ген Нg-SYV46, кодирующий секреторный белок, функционально и структурно подобный растительному белку CLV3. Это делает возможным связь рецепторов растений с белком паразита и вызов вроде естественного сигнала, но с целью формирования питающих клеток [15], [37].
Таким образом, CLE-пептиды фитогельминтов являются возможными стимуляторами дифференцировки и пролиферации клеток в растениях-хозяевах. Наверное, именно поэтому процессы при патогенезе и дифференцировка проводящих тканей в норме так похожи друг на друга.
Протуберанцы
Как мы заметили, галлообразующие нематоды получают питательные вещества по симпластическому пути из гигантских клеток. Гигантские клетки, в свою очередь, являются сильными метаболическими приемниками питательных веществ из донорных органов растения и развивают обширные внутренние выросты клеточной стенки — протуберанцы, которые увеличивают площадь поверхности их плазматической мембраны и позволяют поддерживать потоки как воды с растворенными веществами, так и ассимилятов в места питания. Такие выросты можно сравнить с микроворсинками в кишечнике.
Обширные внутренние выросты клеточной стенки развиваются как там, где стенки гигантских клеток контактируют с ситовидными элементами (рис. 14б), так и между соседними гигантскими клетками. Кроме того, в стенках между гигантскими клетками, помимо внутренних выростов клеточных стенок, присутствуют внушительные поровые поля со множеством плазмодесматальных связей. На наружных же стенках гигантских клеток такие поровые поля отсутствуют [21].
Вообще, инвагинации клеточной оболочки — особенность, которая прочно ассоциируется с передаточными клетками флоэмы, занимающимися загрузкой проводящей ткани растворенными продуктами фотосинтеза. То есть она связана с активным ближним транспортом растворенных веществ. В нашем случае протуберанцы как раз и сигнализируют о том, что гигантские клетки — место, где происходит существенное перемещение воды и растворенных веществ между апопластом и симпластом [21], [45].
Помимо этого, внутренние выросты клеточной стенки были обнаружены и в месте связи гигантских клеток с элементами ксилемы. Причем там они оказались даже более обширны, чем в местах контакта гигантских клеток с ситовидными элементами (рис. 14а). Наличие таких врастаний, по-видимому, способствует «перенаправлению» ксилемы корня к гигантским клеткам, что позволяет последним напрямую получать незаменимые аминокислоты и другие растворенные вещества, которые обычно ассимилируются в корнях [45].
Таким образом, в местах формирования обширных врастаний клеточной стенки увеличение площади плазматической мембраны оценивается в целых 15 раз, что очень выгодно для ускорения поступления и воды и субстратов в места питания, а оттуда — «в пасть» к гельминтам. Однако механизмы, которые управляют формированием модификаций стенок клеток-переносчиков, остаются неисследованными. Единственное, что можно сказать более-менее уверенно: развитие внутренних выростов клеточной стенки совместно вызывают такие фитогормоны, как ауксин и этилен [21].
Контрольно-пропускной пункт
Гигантские клетки обмениваются друг с другом (рис. 13) питательными веществами по плазмодесмам, располагающимся на обширных выростах клеточной стенки. Но связываться плазмодесмами с окружающими тканями они не хотят [40], поэтому поглощение питательных веществ такими «одинокими» гигантскими клетками из флоэмы не является симпластическим и зависит от транспорта через мембраны.
Это значит только одно: придется пересекать два барьера: сначала плазматическую мембрану ситовидного элемента, а затем — плазматическую мембрану гигантской клетки. Поэтому транспортные белки плазмалеммы массово регулируются со стороны нематоды (выявлено аж 50 генов, кодирующих транспортеры, которые изменяют экспрессию), поскольку потеря функции транспортеров может быть весьма болезненна для гельминтов: они останутся на голодном пайке [46], [47].
Все переносчики, участвующие в захвате ассимилятов в гигантских клетках, как было показано, работают как протон-связанные симпортеры, которые требуют протонного градиента, создаваемого АТФазами плазматической мембраны. Значительное количество этих переносчиков работают на транспорт аминокислот или пептидов, поскольку нематоды являются гетеротрофными организмами, хотя и вегетарианцами [21].
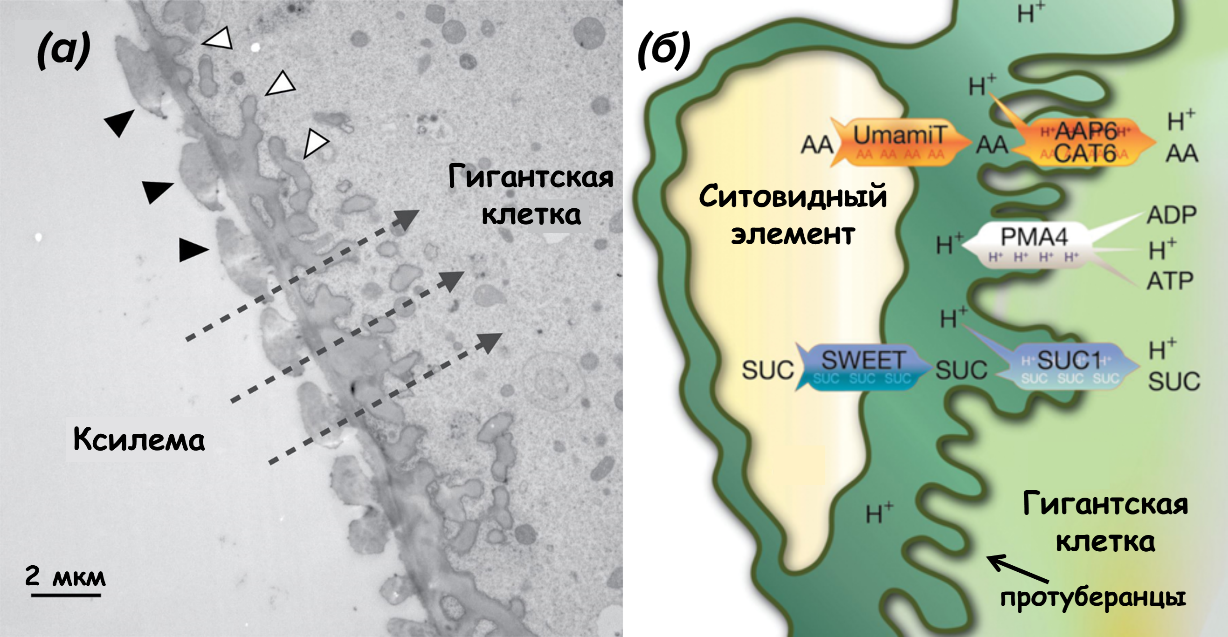
Рисунок 14: а — электронная микрофотография поверхности раздела клеточной стенки между сосудом ксилемы и гигантской клеткой в Lotus japonicus через 3 недели после инокуляции Meloidogyne hapla. Отложения вторичной стенки в ксилемном сосуде отмечены черными стрелками, обширные протуберанцы в стенках гигантских клеток отмечены белыми стрелками.
б — схема апопластного транспорта между ситовидным элементом и гигантской клеткой, указаны основные транспортеры.
адаптировано из [21]
Например, одними из транспортеров, активируемых в гигантских клетках у арабидопсиса и осуществляющих вторично активный транспорт аминокислот, являются AAP6 и AtCAT6 [46]. Кроме того, недавно были идентифицированы двунаправленные аминокислотные транспортеры с говорящим названием UmamiT (рис. 14б), [48].
Совсем недавно в корнях Arabidopsis, зараженных корневыми нематодами, была обнаружена индукция AtSUC1 в галлах, но роль этого транспортера во взаимодействии растений и нематод еще предстоит изучить [21].
Зато уже доказано, что группа переносчиков сахаров, недаром называющихся «сладкими» (SWEETs), может напрямую регулироваться патогенами для обеспечения их углеводами для питания [49], [50]. Индуцированные в ситовидных элементах SWEETs опосредуют транспорт моносахаридов по градиенту концентрации: их роль заключается в оттоке сахара из цитозоля в апопласт, откуда сахара могут быть потом легко закачаны в гигантские клетки [49].
С корневыми галловыми нематодами мы разобрались. А что цистообразующие? Тут надо еще подчеркнуть пару значимых моментов.
Напомним, что поступление ассимилятов в синцитии происходит пассивно — путем диффузии через плазмодесмы по симпласту, следовательно, транспортные белки здесь не играют важную роль. Во флоэме вокруг синцития, что интересно, присутствуют и сетчатые элементы, и сопровождающие клетки, что характеризует эту флоэму как метафлоэму (у галлообразующих, как мы помним, была протофлоэма). Последний факт указывает на то, что соотношение ауксина и цитокинина запускает развитие и пролиферацию различных типов флоэмы [51].
Таким образом, фитонематоды настраивают потоки воды и ассимилятов под свои нужды, просто различные группы действуют несколько разными приемами. И, как мы имели удовольствие убедиться, во многом другом у них несходные стили и вкусы, что суммировано в таблице 1.
| Характеристика | Галлообразующие | Цистообразующие |
|---|---|---|
| Спектр хозяев | Широкий: сосудистые растения | Узкий, определенный набор видов |
| Инвазия | Межклеточная миграция через кончик корня к месту закладки места питания | Разрушительное проникновение сквозь клетки прямо в целевой участок |
| Клетки-мишени | Дифференциация сосудистых клеток в зоне растяжения | Клетки, прилегающие к дифференцированным клеткам сосудов в зоне созревания |
| Питающие клетки | Гигантские клетки, индуцированные из разных исходных клеток | Синцитий, образованный слиянием соседних клеток |
| Окружающие ткани | Образует «корневой галл» | Минимальные морфологические изменения |
| Васкуляризация | Обширные сети ксилемы и флоэмы de novo | Интактная сосудистая ткань |
| Размножение | Партеногенетически, редко половое Яйца секретируются на поверхности корней |
Половое. Яйца остаются в цисте до вылупления |
Переломить хребет
Чтобы запустить процессы в растительной клетке, одних фитогормонов, очевидно, не хватит. Нематодам важно справиться еще с одним элементом — цитоскелетом, ведь этот «клеточный хребет» — важный компонент защитных механизмов растений от атак патогенов [52].
Фитонематоды научились вызвать долгосрочные изменения в организации цитоскелета внутри гигантских клеток. Так, во время образования гигантских клеток актиновые филаменты оказываются случайно ориентированными благодаря действию форминов, белков, стимулирующих полимеризацию актиновых филаментов de novo [53]. У разных видов растений формины участвуют во многих клеточных процессах: цитокинезе, адгезии, эндоцитозе, формировании филоподий, стабилизации микротрубочек и митотического веретена [54]. Индукция трех генов форминов, AtFH1, AtFH6, AtFH10, наблюдается в гигантских клетках. Именно формины, равномерно распределенные по плазматической мембране, регулируют рост гигантских клеток посредством контроля сборки актиновых филаментов, что необходимо для направления везикулярного транспорта, задействованного в биогенезе плазмалеммы и клеточной стенки.
С актиновыми филаментами, согласимся, более или менее понятно. Промежуточных филаментов у растений нет. А что насчет микротрубочек? «Не проблема», — ответят нематоды. Ведь недавно нашелся один растительный белок, MAP65-3 (Arabidopsis thaliana Microtubule-Associated Protein65-3), связанный с микротрубочками и необходимый для развития гигантских клеток. В отсутствие функционального белка гигантские клетки не могут дифференцироваться и разрушаются, а в удачном для нематод случае ген этого белка хорошо экспрессируется, и сам белок в гигантских клетках оказывается ассоциирован с особым типом клеточной пластинки, так называемой мини-клеточной пластинкой (mini cell plate), ), которая разделяет дочерние ядра в гигантской клетке будто маленькими ширмочками, расставленными в огромном зале. Этот белок играет критическую роль в организации массива микротрубочек [52]. Наверное, недаром аббревиатура его названия по-английски означает «карта»: без навигатора в гигантской клетке хромосомы сами не разберутся.
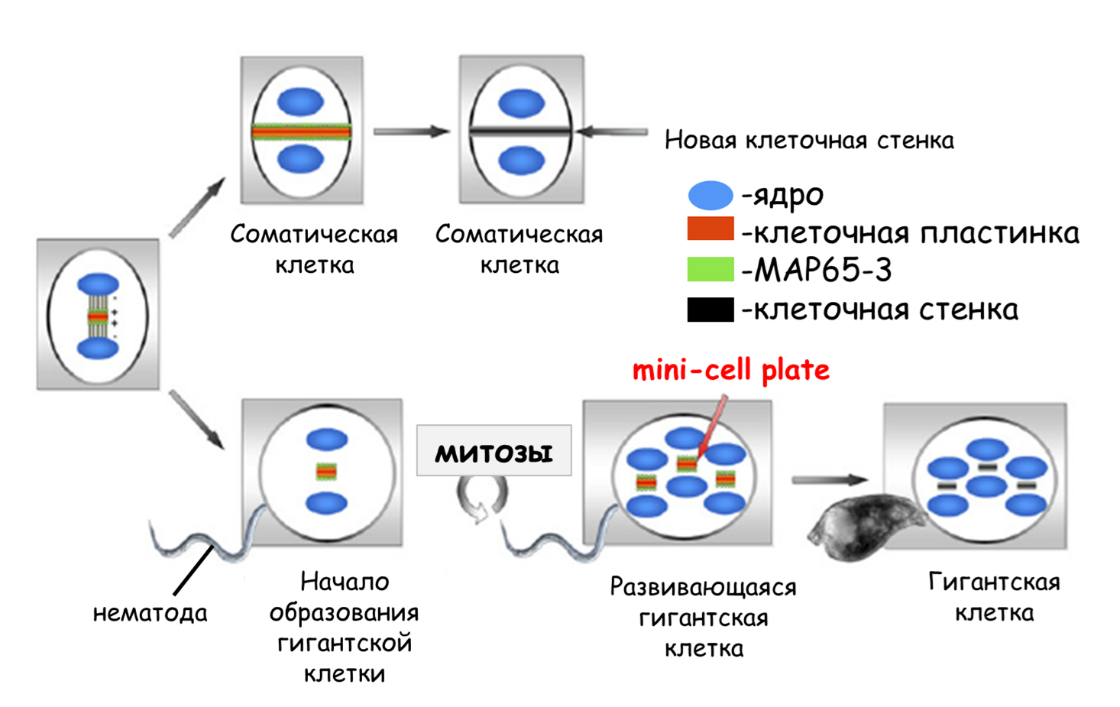
Рисунок 15. В гигантских клетках белок MAP65-3 ассоциирован с так называемой мини-клеточной пластинкой.
адаптировано из [52]
Волк в овечьей шкуре
Как уже выше упоминалось, существует ряд общих черт в развитии программы образования корневых галлов нематодами и клубеньков — симбиотическими бактериями. Этому нашлось экспериментальное подтверждение [55]. Оказалось, что один из первых маркерных генов MtENOD11, который индуцируется у растений в ответ на фактор нодуляции (молекулярный сигнал почвенных бактерий, побуждающий растения к образованию клубеньков) ризобактерии Sinorhizobium meliloti, экспрессируется еще и во время образования арбускулярной микоризы, а также в тканях, окружающих развивающиеся гигантские клетки во время заражения галлообразующими фитогельминтами [56]. Более того, личинки нематод, в частности, M. incognita, продуцируют фермент NemF фактор Nem), который воздействует на корневую систему аналогично фактору нодуляции, или, как его сокращенно называют, Nod-фактор, выделяемому симбиотическими азотфиксаторами. Так, инкубация корней Lotus japonicus в присутствии жизнеспособных личинок галлообразующей нематоды до инфицирования стимулировала идентичную цитоскелетную активность в корневых волосках, как и при обработке Nod-фактором [57]. Вот как подло поступают паразиты.
Этилен — а у нас в квартире газ
При описании изменений сосудистой системы нами был упомянут этилен, который вместе с ауксином участвовал в неоваскуляризации. Однако это, по сути, защитный гормон растений. Поэтому сейчас было бы логично обсудить некоторые вопросы манипулирования оборонительными ответами растений. К сожалению, здесь нас ждет некоторое разочарование, поскольку информация о роли газа этилена в заражении нематодами противоречива. По одним данным, инфекция цистообразующими нематодами, вызывающими сильное механическое повреждение на пути к месту питания, вызывает у растения-хозяина выработку гормона механического стресса, этилена, что в общем-то задерживает появление синцития. Галлообразующие же нематоды мигрируют в корнях по межклетникам, то есть они менее деструктивны, и, следовательно, не индуцируют выработку этилена, и он на них вроде как влиять не должен [11], [58].
Впрочем, все не так просто! В других исследованиях были получены альтернативные результаты. Оказалось, что этилен оказывает положительное влияние на заражение цистообразующими нематодами, но подавляет инфекцию галлообразующими, что происходит из-за снижения «притяжения» нематод к корням! По этой причине устойчивые к инфекции галлообразующими нематодами растения демонстрируют более активный биосинтез этилена. Более того, галлообразующие нематоды вызывают у растений выработку этилена, что, по-видимому, предотвращает вторичную инвазию фитогельминтами за счет снижения «притяжения» в связи с уменьшением секреции аттрактантов и увеличением секреции репеллентов. Однако молекулярная основа этих процессов до сих пор в значительной степени неизвестна. Здесь возможно влияние корневых экссудатов (выделений в ризосферу, содержащих органические вещества для «общения» с почвенной микрофлорой), которые, как оказалось, важны для вылупления яиц, а также хемотаксиса нематод к растениям. Например, корневые экссудаты томатов, картофеля, фасоли, сои содержат нортритерпеноидные соединения эклепины, которых прямо называют стимуляторами вылупления яиц ряда цистообразующих нематод [3].
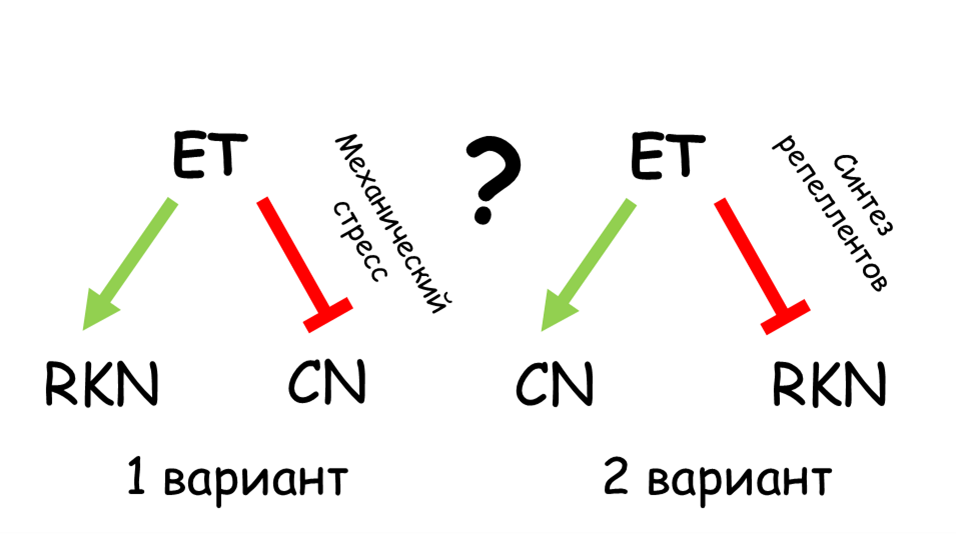
Рисунок 16. Этиленовая дилемма.
рисунок автора
Итак, для цистообразующих нематод получалось, что этилен только усиливает «притяжение» червей к корням растений, что проявлялось в более высоком уровне инфекции и увеличении экспансии синцития у растений с мощным ответом на этилен, в то время как мутанты по генам ответа на этилен были менее подвержены заражению нематодами. Складывается достаточно запутанная ситуация, где неясно, этилен — это фактор устойчивости или восприимчивости (рис. 16).
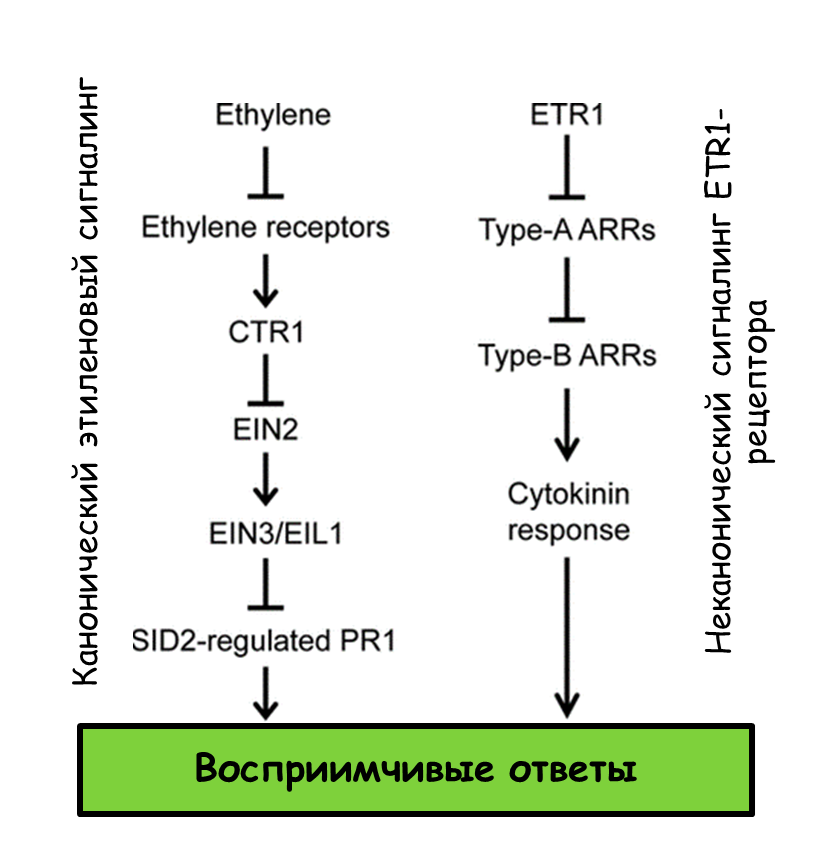
Рисунок 17. Канонический и неканонический пути этиленового сигналинга приводят к одному и тому же итогу.
адаптировано из [59]
Еще в одном предпринятом исследовании выяснилось, что обработка этиленом арабидопсиса приводит к повышению восприимчивости растения к свекловичной нематоде, причем двумя путями [59]. Во-первых, через канонический путь передачи сигнала (canonical ethylene signaling pathway) этилен вызывает подавление в клетках защитного ответа, основанного на салициловой кислоте, которая является ключевым компонентом фитоиммунитета. Это, как нетрудно догадаться, приводит к более высокой восприимчивости к червям. Во-вторых, по другому пути сигналинга, называемому неканоническим, этилен, действуя через рецептор ETR1, вызывает экспрессию генов цитокининового ответа. А цитокинин, как было красочно описано выше, очень даже способствует успешному паразитизму нематод (рис. 17).
Таким образом, выходит, что нематоды научились очень изящно манипулировать защитным ответом растений на механические повреждения, а этиленовый ответ оказался примером восприимчивой реакции растений.
We will ROS you
Развивая тему управления со стороны нематод защитными ответами растений, нельзя не остановиться на вопросе свободных радикалов. Известно, что продукция активных форм кислорода (АФК), или по-английски — reactive oxygen species (ROS), является одним из самых ранних событий в ходе ответа растений на любое нападение [26]. В частности, АФК служат сигнальными молекулами для активации дополнительных иммунных ответов, например, укрепления клеточной стенки за счет сшивания полимеров. Свободные радикалы обладают и прямыми нематостатическими свойствами, поэтому нематодам требуется защита от АФК хозяев.
Самое простое, что возможно сделать для спасения — произвести ряд антиоксидантных соединений и ферментов на своей поверхности и в подкожной клетчатке, что нематоды, собственно, и осуществляют [60]. Например, их секретомы содержат супероксиддисмутазы, глутатион, тиоредоксины, пероксидазы, цитохром C-пероксидазы, аскорбатпероксидазы и каталазы. Фитонематоды продуцируют пероксиредоксины (PRXs), которые удаляют перекись водорода из апопласта растений-хозяев за счет тиоредоксина. Например, PRX2.1, пероксиредоксин корневой галловой нематоды M. incognita, активно вырабатывается при инфекции, а нокдаун его гена у паразита снижает устойчивость к окислительному стрессу и приводит к уменьшению количества галлов. Также у M. incognita глутатион-S-трансферазы доставляются в апопласт хозяина для детоксикации продуктов окислительного стресса [61]. В секретах G. rostochiensis также идентифицирован фермент тиоредоксинпероксидаза, разрушающий гидроперекиси [62]. Кроме того, цистообразующие нематоды секретируют глутатионпероксидазы в гиподерму, чтобы улавливать АФК хозяина и тем самым защищать внешние клеточные мембраны от окисления [63].
Другой стратегией фитогельминтов является активация систем удаления АФК самого растения путем секреции эффекторов. Например, эффектор 10A06 свекловичной нематоды модулирует биосинтез полиамина спермидина растением, что приводит к усилению антиоксидантной защиты. 10A06 взаимодействует с ферментом биосинтеза спермидина, спермидинсинтазой 2 хозяина, и увеличивает содержание полиамина в инфицированных тканях [64]. Спермидин в высоких концентрациях действует как поглотитель АФК, а в более низких — косвенно снижает окислительный стресс, активируя клеточные антиоксидантные системы [65]. Другой пример — MjTTL5, эффектор M. javanica, взаимодействует с ферредоксин-тиоредоксинредуктазой (FTR) в пластидах [66], что, в свою очередь, активирует хлоропластную тиоредоксинпероксидазу [67], [68]. Получается, что усилиями «хитрых» эффекторов резко увеличивается активность хозяина по улавливанию своих же АФК, выработанных для защиты.
Из двух зол выбрать меньшее
Но помимо этого, фитогельминты научились манипулировать Rboh-зависимым путем продукции АФК! Как это происходит? Давайте разбираться.
Для начала вспомним, как поступают фагоциты животных, чтобы уничтожить бактерии? Они осуществляют «дыхательный взрыв» и при помощи активных форм кислорода убивают врагов. Но откуда иммунные клетки берут АФК? Правильно, вырабатывают специальным мембранным ферментным комплексом плазматической мембраны — НАДФН-оксидазой [69], [70].
У растений также имеются связанные с плазматической мембраной НАДФН-оксидазы, называемые Rboh (рис. 18). Они очень важны для продукции апопластных АФК [69]. Растительные Rboh (respiratory burst oxidase homologs) обладают большой степенью подобия животным Nox-гомологам (NADPH oxidase) белка gp91phox, отчего и происходит их название.
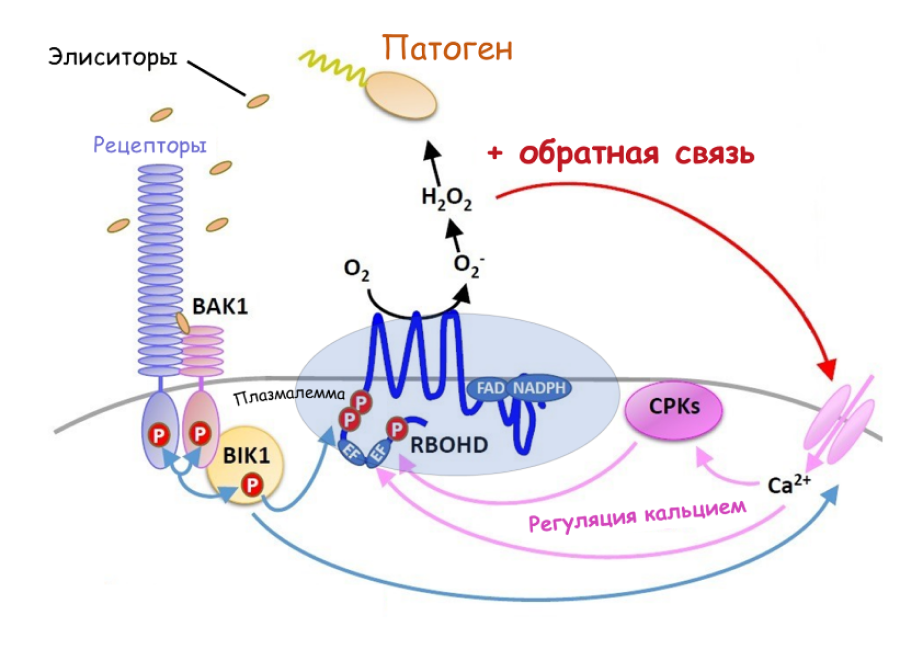
Рисунок 18. Схема активации апопластной продукции АФК с помощью фермента RbohD при узнавании патогена.
адаптировано из [69]
Важно, что растительные Rboh имеют N-концевой участок, который связывает ионы Са2+, что предполагает регулирующую роль Са2+ в активности НАДФH-оксидаз, как показано на рисунке 18. Rboh найдены у риса, табака, картофеля и других видов. Целых 10 генов Atrboh, ответственных за синтез Rboh, имеется у арабидопсиса. AtRbohD является основным продуцентом АФК во время иммунного ответа растений, а также иногда работает AtRbohF, что подтверждается нокаутом этих генов: у мутантов по генам rbohD rbohF образуется больше галлов после инфицирования нематодами, чем у дикого типа [70], [71].
Перейдем к самому интригующему. Оказалось, что фитонематоды, манипулируя работой Rboh, делают это не для снижения уровня свободных радикалов, а наоборот — для выработки АФК. Такой неожиданный поворот.
Действительно, в экспериментах было продемонстрировано, что свекловичная нематода способна стимулировать экспрессию ферментов выработки АФК, RbohD и RbohF, у арабидопсиса для индукции синтеза АФК, что приводит к ингибированию так называемой реакции сверхчувствительности и, следовательно, дает возможность для развития синцития. Поясним механизм.
На самом деле, у растений выработка АФК может запускаться и по другому пути, опосредованному стрессовым гормоном, салициловой кислотой (мы, кстати, тоже принимаем при болячках производное салициловой кислоты — аспирин). Тогда локально запускается мощный окислительный взрыв (это и есть специальный тип программированной клеточной гибели — реакция сверхчувствительности), который и уничтожает фитонематоду вместе с собственными тканями растения, но зато препятствует распространению инфекции. Весьма важно, что салицилат-зависимый путь биосинтеза свободных радикалов не опосредован Rboh. Выходит, что фитонематода, стимулируя выработку АФК, генерируемую НАДФН-оксидазой, точно настраивает паттерн гибели растительных клеток во время инвазии и тем самым противодействует распространению информации о нападении патогена и, следовательно, запуску защитных ответов, индуцированных уже салициловой кислотой, а именно программируемой клеточной гибели.
Между прочим, это также поднимает вопрос о том, не выделяют ли теперь уже сами нематоды факторы, которые активно стимулируют образование АФК? Не далее, как в 2014 г. было обнаружено, что у свекловичной нематоды вышеупомянутый эффекторный белок 10A06, взаимодействуя со спермидинсинтазой 2 хозяина, приводит к увеличению в синцитиях активности полиаминоксидазы, которая может увеличивать продукцию АФК [72]. Видимо, нематода считает, что лучше сначала потерпеть свободные радикалы, но зато потом не погибнуть от рук реакции сверхчувствительности (рис. 19).
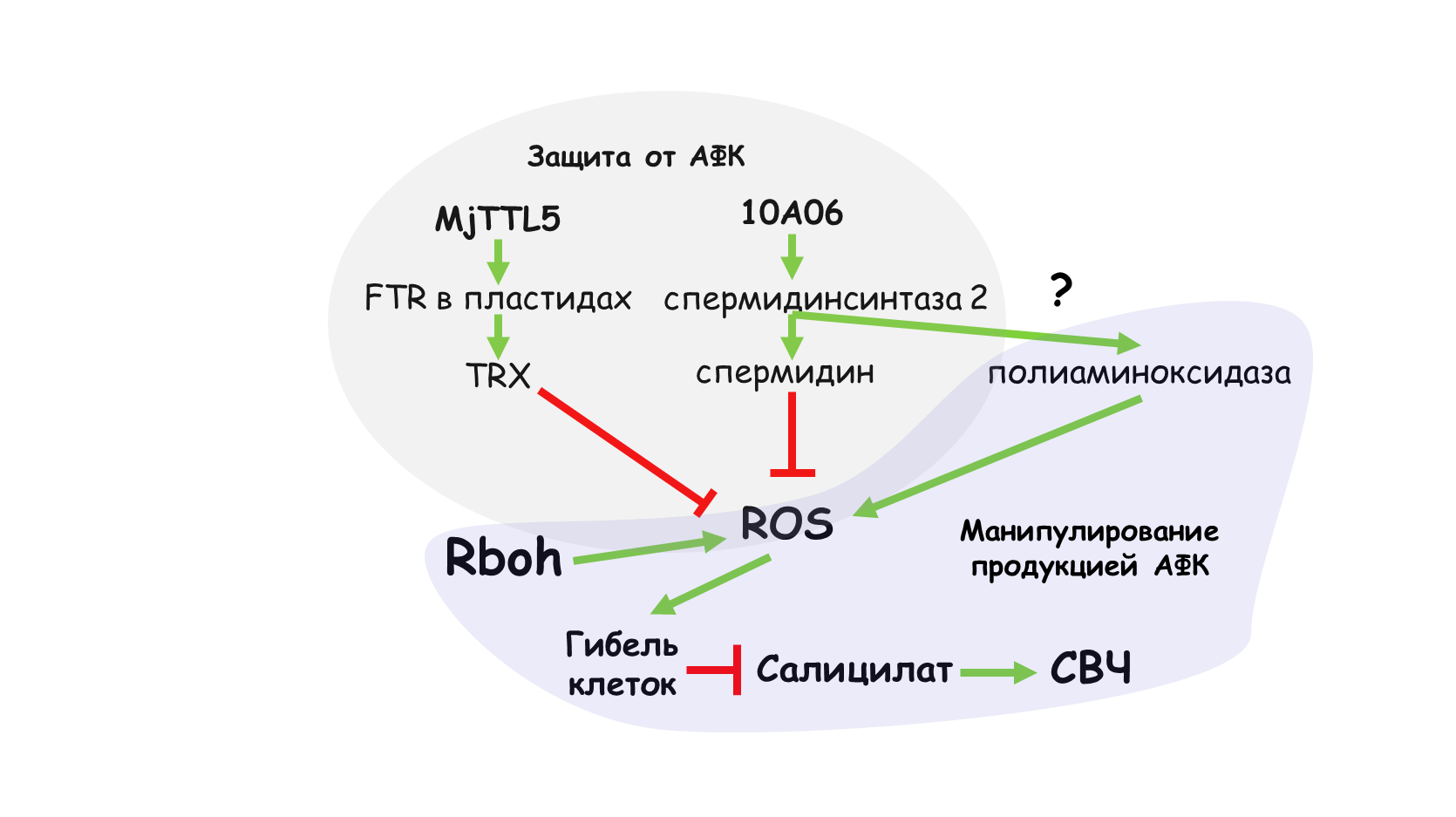
Рисунок 19. Гипотетическая схема взаимоотношений нематод с АФК хозяина.
рисунок автора
Глава IV. Иммунитет растений
Предатели
Выделения фитонематод невероятно функциональны и богаты, но это и их ахиллесова пята. Из букета различных метаболитов нематод находятся и такие, что могут связываться с определенными рецепторами растительных клеток — и далее через сигнальные системы менять экспрессию генов, определяющих защитную реакцию растений. Такие вещества, способные вызывать у растений активный ответ, вызванный «включением» сигнальных систем, называют индукторами, или элиситорами защитных реакций [20]. Элиситоры как бы выдают присутствие нематоды растению-хозяину, а натренированные рецепторы клеток через нижележащие сигнальные системы, обеспечивающие передачу и умножение сигнала, исходящего от патогена, определяют течение ответных реакций на биохимическом уровне [11].
Другими словами, сигнальные системы, функционирующие внутри клетки, начинаются с контакта элиситора с рецептором растительной клетки и завершаются локальным/системным защитным ответом. В настоящее время установлено, что у растений существуют две линии обороны против паразитических фитонематод: неспецифическая (так сказать, базис) и специфическая надстройка устойчивости [5], [11], [15], [73], [74].
Базис
Неспецифический (базовый) фитоиммунитет развивается в ответ на элиситоры, называемые консервативными молекулярными паттернами, ассоциированными с патогенами (pathogen‐associated molecular patterns, PAMPs) и является первой линией обороны растений. Такие паттерны характеризуют многих патогенов, например, бактерий и грибов. PAMPs же нематод на данный момент еще недостаточно изучены, но установлены определенные молекулы-кандидаты. Например, потенциальными PAMPs, а точнее сказать, молекулярными паттернами, ассоциированными с нематодами (nematode-associated molecular patterns, или NAMPs), узнаваемыми растениями и вызывающими у них защитную реакцию, возможно, являются хитин, компоненты кутикулы (глюканы, гликопротеины, липополисахарид), а также другие соединения, контактирующие с клетками растений. Известно, что хитин отсутствует в кутикуле типа Nematoda; откуда же он вообще берется? На самом деле, у нематод хитин присутствует в скорлупе яиц и, возможно, в стилете. Кутикула же образует экзоскелет нематоды и очень важна для ее движения и роста.
Кроме того, было показано, что растительные клетки воспринимают продуцируемые фитонематодами аскарозиды (ascarosides) — небольшие молекулы-феромоны, выделяемые червями в окружающую среду. Структурно они являются производными сахара аскарилозы с добавлением жирнокислотных боковых цепей, по количеству атомов углерода в которых они и классифицируются (рис. 20). Но с чего мы взяли, что именно эти молекулы — предполагаемые NAMP?
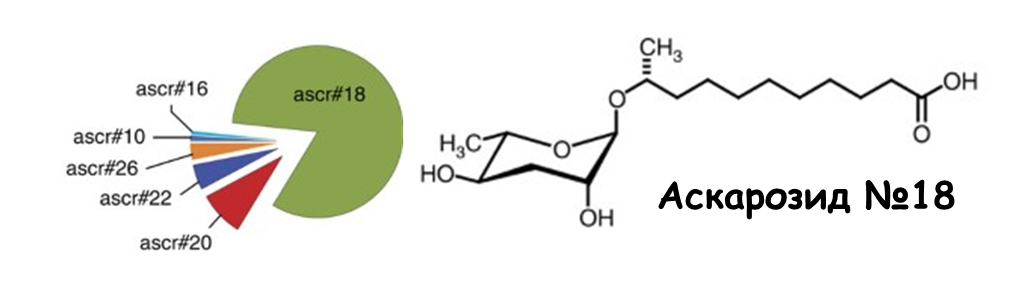
Рисунок 20. Диаграмма относительной количественной распространенности разных аскарозидов и структура ключевого аскарозида № 18.
адаптировано из [75]
Несмотря на разнообразную филогению и экологию нематод, биосинтез аскарозидов и пути передачи их сигналов очень консервативны. У всем известного модельного организма Caenorhabditis elegans и многих других видов аскарозиды участвуют в передаче социальных сигналов, развитии дауер-личинок при неблагоприятных условиях, поиске партнеров для спаривания и координации поведения. Аскарозид № 18 с 11-углеродной боковой цепью является наиболее распространенным среди трех главных видов паразитических фитонематод (рис. 20). Грунтование корней арабидопсиса с аскарозидом № 18 индуцировало общее сопротивление против бактерий, грибков и нематод. Аскарозид № 18 активирует типичные ответы растений, такие как митоген-активируемые протеинкиназы и пути передачи сигналов, опосредованные стрессорными гормонами, что указывает на неспецифический характер вызываемого иммунитета (рис. 21), [75], [76].
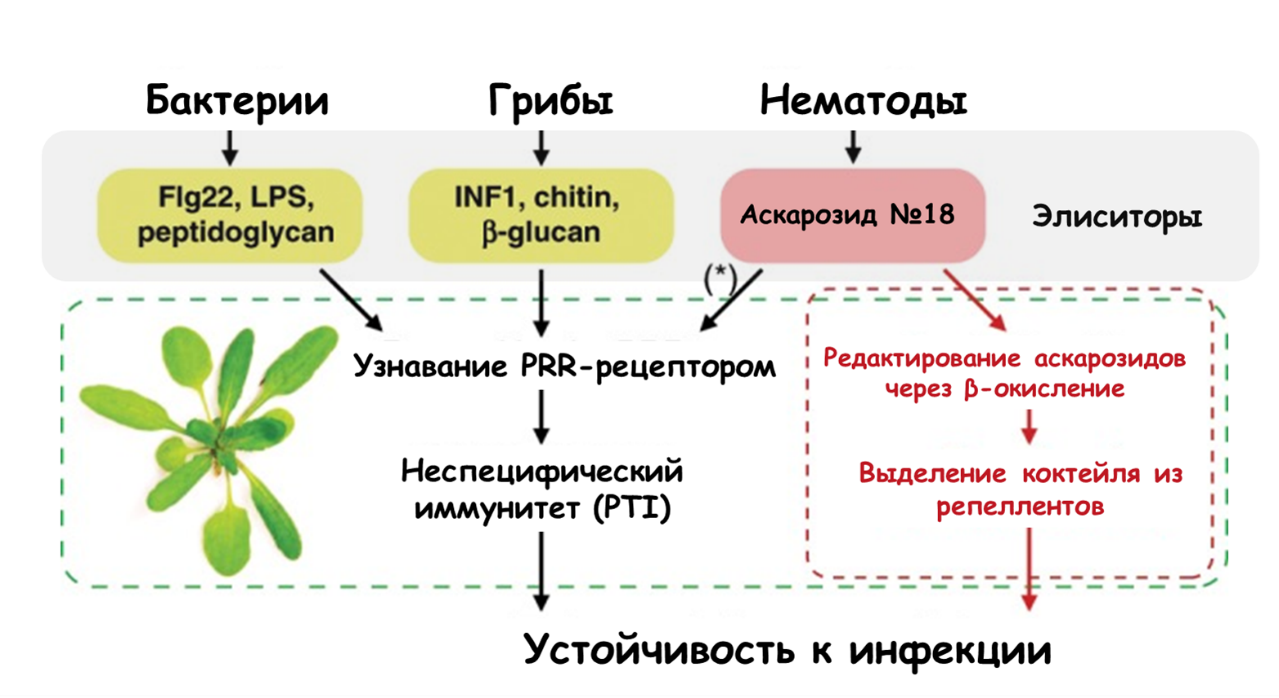
Рисунок 21. Виды вызываемого иммунитета. PTI — базовый иммунитет, вызывается различными фитопатогенами, а не только нематодами. (*) — PRR неизвестны.
адаптировано из [76]
Аскарозид № 18 также идентифицируется томатами, картофелем и ячменем, что позволяет предположить: его распознавание универсально как у однодольных, так и у двудольных. Аскарозиды, секретируемые нематодами, являются возможными NAMP, воспринимаемыми растениями для индукции защитных механизмов, но прямых доказательств распознавания этих феромонов растительными рецепторами еще нет [75]. Однако недавно был показан механизм защиты, при котором растения, обходясь без запуска реакций иммунитета, напрямую используют модифицированные в пероксисомах аскарозиды как репелленты, отпугивающие нематод (рис. 21, красный цвет; рис. 22) [76].
В любом случае, гипотетические NAMPs детектируются со стороны растения трансмембранными белками — так называемыми «паттерн-распознающими рецепторами» (PRRs). Рецепторы PRRs во внеклеточной части содержат домены LRRs (leucine‐rich repeats — лейцин-богатые повторы), вовлеченные в связывание ассоциированных с патогенами молекулярных паттернов (лигандов, то есть NAMPs) [77].
Первым идентифицированным PRR, участвующим в индукции иммунитета на фитонематод, был рецептор NILR1 (NEMATODE-INDUCED LRR-RLK 1), кодируемый у арабидопсиса одноименным геном Nilr1. Но пока NAMP, распознаваемый NILR1, не идентифицирован. Кроме того, ученые показали, что восприимчивость арабидопсиса к галловым нематодам усилена у мутантов по генам bak1-5 и bik1 [71], поскольку известно, что и BAK1 как корецептор для многих рецепторов (в том числе и фитогормонов), и BIK1 (рецептор-подобная киназа) часто служат для передачи сигналов базального иммунитета (рис. 22) [78], [79].
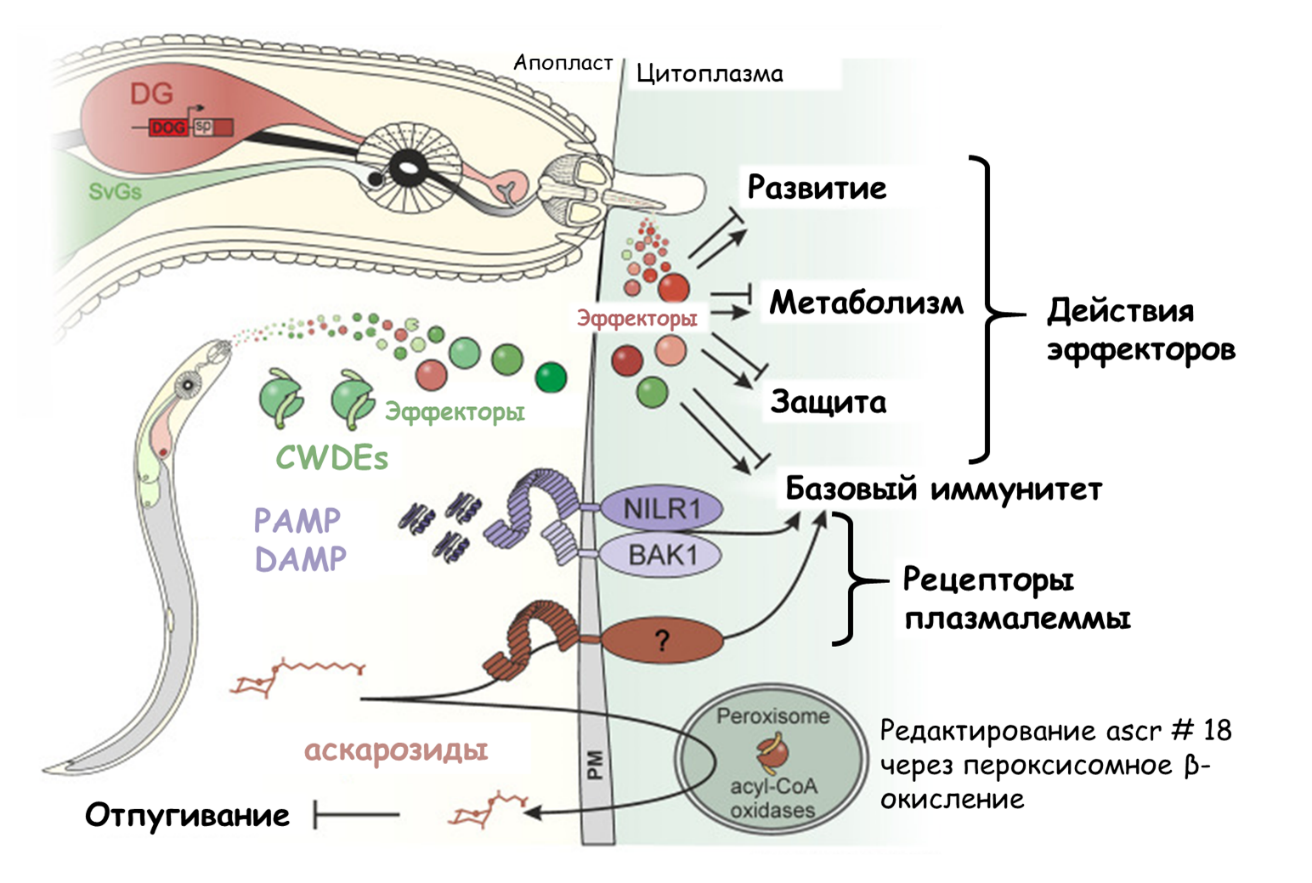
Рисунок 22. Схема запуска базового иммунитета при узнавании PAMP.
адаптировано из [79]
Однако кроме PAMPs, оказывается, существуют еще и DAMPs — молекулы, образующиеся из поврежденных клеток самого растения (damage‐associated molecular patterns, DAMPs). Например, когда черви вторгаются в корни растений и затем мигрируют в них, они неизбежно вызывают образование фрагментов клеточной стенки (олигосахаринов) — так сказать, мусора, который тоже выдает присутствие патогена и активирует защитные силы хозяина. К примеру, фитонематоды зачастую продуцируют ферменты, служащие для переваривания клеточной стенки, такие как полигалактуроназа [80]. Растениям это не нравится, поэтому большинство из них имеет белки-ингибиторы полигалактуроназы (PGIP), ослабляющие разложение пектина полигалактуроназой патогена. В результате того, что ферменту нематод не дают нормально выполнить свою работу, высвобождаются активные элиситоры: объедки клеточной стенки — олигогалактурониды. Так, у излюбленного лабораторного растения, арабидопсиса, была обнаружена группа из двух белков PGIP: PGIP1 и PGIP2, гены которых быстро активируются в ответ на инвазию цистообразующих нематод. Предполагается, что при заражении фитогельминтами PGIP1 высвобождает олигосахарины, запуская иммунные реакции, что подтверждается и сравнительным анализом мутантов с потерей функции и линий со сверхэкспрессией генов ингибиторов полигалатуроназы [81]. К числу рецепторов DAMP также относятся рецепторные киназы, PEPR1 и PEPR2, опознающие растительные элиситорные пептиды, а также рецептор DORN1 для внеклеточного АТФ, но эти данные еще требуют уточнения со стороны ученых [71].
PTI — что в имени тебе моем?
Что получается в итоге? Связывание тех или иных элиситоров с рецепторами растений приводит к индукции защитного сигнального каскада реакций внутри цитоплазмы клетки-хозяина, обозначаемого и для PAMP, и для DAMP обобщенно как PAMP-запускаемый иммунитет (PAMPs‐triggered immunity, или PTI), который является первой преградой для нематод и выражается в целом букете реакций (так называемых факторов фитоиммунитета): изменении концентрации ионов (Ca2+), активации митоген-активируемых протеинкиназ (MAPK), продукции активных форм кислорода и азота, индукции сигнальных путей салициловой и жасмоновой кислот, синтезе антимикробных молекул и так далее [5], [11]. О самых ярких из них поговорим детальнее.
Укрепление государственной границы
Погранохрана является залогом спокойствия государства. Аналогично и клетки растений — в случае инфекции они стремятся укрепить свою клеточную стенку. Например, у устойчивого к M. graminicola сорта риса были усилены биосинтез лигнина и отложение каллозы в клеточных стенках по сравнению с восприимчивыми растениями.
Лигнин здесь особенно важен. Доказательством этому служит тот факт, что у мутантов Arabidopsis с повышенным уровнем сирингил-лигнина (одной из трех структурных единиц лигнина) снижена скорость размножения M. incognita. Также заражение фитогельминтами индуцирует активацию генов биосинтеза сотоварища лигнина, суберина, в месте заражения [3], [15].
Более того, пояски Каспари (они есть у растений в норме в эндодерме), лентовидные утолщения клеточной стенки, содержащие лигнин и суберин, являются важными базальными физическими барьерами, не позволяющими фитогельминтам напрямую попадать в стелу. Это подтверждается повышенной восприимчивостью к галлообразующим нематодам мутантов арабидопсиса с дефектными поясками Каспари [82], [83]! Именно из-за поясков Каспари галлообразующие нематоды проникают в растение не абы где, а именно в кончике корня, поскольку там пояски еще не сформировались, а значит, есть возможность попасть в центральный цилиндр (рис. 23).
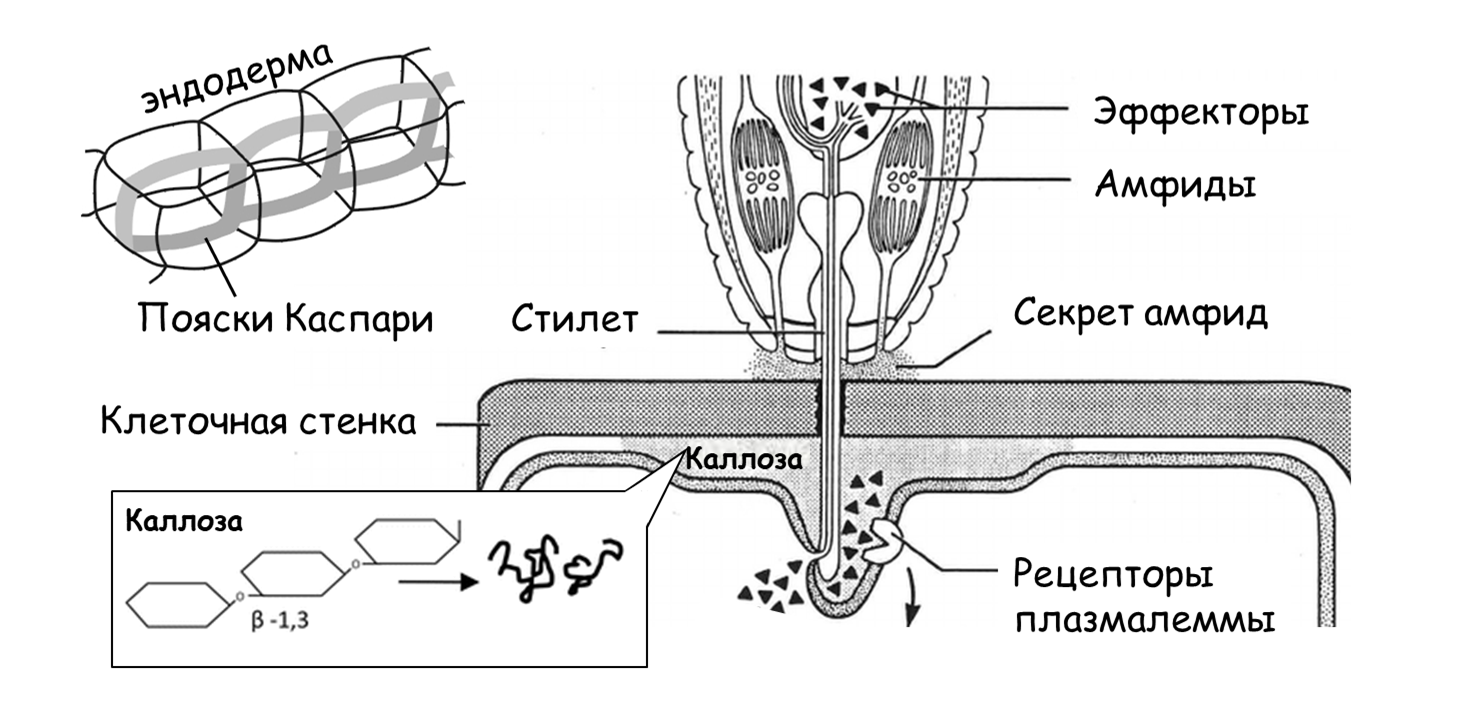
Рисунок 23. Пояски Каспари (лигнин+суберин) — важный фактор конститутивной устойчивости, а отложение каллозы в точке инвазии — индуцированной.
адаптировано из [83]
Вдобавок растения обычно откладывают каллозу (β-1,3-глюкан) для укрепления клеточных стенок в месте прикрепления стилета нематод. Неудивительно, что сверхэкспрессия фактора транскрипции RAP2.6 (ответственен за биосинтез каллозы) у устойчивых к цистообразующими нематодам растений арабидопсиса приводит к усиленному отложению каллозы в синцитиях [84]. Каллоза столь ненавистна червям, что у цистообразующих нематод существую специальные эффекторы, задача которых — подавить экспрессию RAP2.6 [85].
Кроме того, имеются еще и белки, ассоциированные с клеточной стенкой — так называемые лектины. Например, бобовое растение канавалия мечевидная продуцируют лектин конкавалин А (ConA) в ответ на инфицирование M. incognita [86], [87]. Особенно большую известность получил лектин GNA подснежника (Galanthus nivalis lectin or agglutinin), направленный против G. pallida, H. schachtii, P. neglectus [88], поскольку именно о нем в 1998 году вышла публикация о якобы токсичности для крыс генно-модифицированного картофеля со встроенным геном лектина GNA, которая впоследствии запустила миф об опасности ГМО [89].
Черный пиар
Еще довольно традиционным механизмом защиты является продукция PR-белков (от словосочетания pathogenesis-related proteins, то есть белки, индуцируемые патогенами), большинство из которых транспортируется в клеточную стенку и оказывает там прямое антипатогенное действие. Этих белков очень много, и они сложно классифицированы. Например, как уже упоминалось, у фитонематод хитин является основным компонентом скорлупы яйца и составляет часть стенок просвета глотки, поэтому секреция PR-белков хитиназ в апопласт рассматривается как защитное явление [3]. Еще отмечается роль в устойчивости растений к червям таких белков, как ингибиторы протеиназ (группа PR-6), включая ингибиторы трипсина и цистеиновых протеаз [33].
Dr. NO
Помимо крупных белков, защитным веществом растений является маленькая молекула оксида азота (NO), важного вторичного мессенджера. NO играет положительную роль и в фитоиммунитете, что было подтверждено обработкой чувствительных томатов нитропруссидом натрия, экзогенным донором NO, после которой наблюдалось усиление иммунитета и даже восстановление заингибированного нематодами роста [90]. Кроме того, установлено, что устойчивые растения томата после заражения M. incognita производили NO в больших количествах [91].
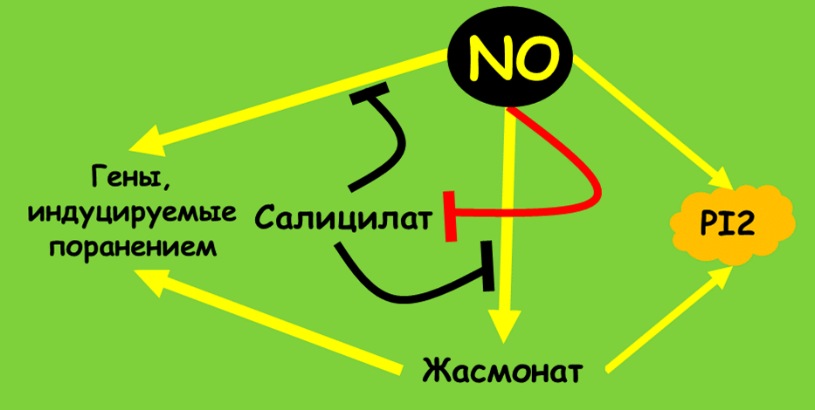
Рисунок 24. Влияние NO на антагонизм салицилатных и жасмонатных путей.
рисунок автора
Каким же способом лечит «доктор» NO? Ученые показали, что оксид азота работает вместе с жасмонатом, стрессовым гормоном растений, поскольку обладает способностью инициировать экспрессию ферментов биосинтеза жасмонатов (LOX3). Выделение NO помогает жасмоновой кислоте перетянуть на себя одеяло в известном антагонизме салицилатных и жасмотных путей [11]. Совместно со своим другом, жасмонатом, оксид азота способен после заражения галлообразующими нематодами индуцировать повышение экспрессии гена ингибитора фитонематодного фермента протеиназы 2 (то есть PR-белка), но какой именно, пока неизвестно (рис. 24), [33].
Быка за РНК
Не только газы играют защитную роль в растительных организмах. Не стоит забывать и о нуклеиновых кислотах. Так, РНК-интерференция — важная реакция растений на абиотические и биотические стрессы, в которых модуляторами являются микроРНК (miRNA). Глубокое секвенирование с целью сравнения профилей miRNA позволило идентифицировать 60 дифференциально экспрессируемых miRNA, ассоциированных с ответами против цистообразующих нематод, а также 20 microRNA с различным паттерном экспрессии в устойчивых и восприимчивых сортах сои.
Большинство этих miRNA (miR156, miR159, miR164 и miR396) преимущественно оказывается активировано в восприимчивых сортах, нежели в устойчивых. Так, miR396 взаимодействует с факторами, регулирующими рост (GRF1/GRF3), чтобы модулировать репрограммирование развития корня при атаке свекловичной нематоды. Имеющиеся данные позволяют предположить определенную роль miRNA в регуляции факторов транскрипции, ответственных за фитоиммунитет. Но более обширной информации о роли РНК в фитоиммунитете против нематод пока не имеется [26], [92].
Химическое оружие
И конечно, нельзя забывать о таком важном аспекте, как химическое оружие, которым растения в силу специфики своего существования научились весьма недурно пользоваться. В данном случае идет речь о продукции нематицидных и нематостатических соединений [3].
Говоря в общем, вещества, которыми растения защищают себя от болезней, делятся на 3 группы: во-первых, фитоантиципины (или, более привычно, фитонциды), ответственные, главным образом, за конститутивную устойчивость. Во-вторых, так называемые полуиндуцибельные соединения (тиогалактозиды, стероидные, цианогенные гликозиды), синтезирующиеся в виде предшественников и активирующиеся при стрессе. И, наконец, наиболее токсичные соединения, носящие название фитоалексины [11].
К числу конституционных соединений, присутствующих в тканях растений до заражения или продуцируемых после заражения из ранее присутствующих предшественников и ответственных за устойчивость растений к нематодам, относят фенолы, терпеноиды, гликозиды и некоторые другие вещества специализированного обмена. Количество этих соединений увеличивается при инвазии, особенно в устойчивых сортах. Например, выявлен механизм действия растительных адаптогенов, фуростаноловых гликозидов, выделенных из культуры клеток Dioscorea deltoidea, на иммунный потенциал растений, инвазированных фитогельминтами. Действие этих веществ связано с влиянием на внутриклеточные мембраны, в состав которых входят стерины (в цитоплазме) или изопреноидные пигменты (в пластидах). Оказалось, что фуростаноловые гликозиды поддерживают гомеостаз растительной клетки при инфекции [93].
Особенно любопытно действие экдистероидов. Известно, что нематоды относятся к группе Еcdysozoa, то есть животным линяющим, с телом, покрытым кутикулой (правда, без хитина), которая периодически сбрасывается и заменяется новой. Эти линьки осуществляются с помощью гормона экдизона. Растение Serratula coronata, не мудрствуя лукаво, решила нарушить спокойный онтогенез нематод. Она синтезирует фитоэкдизон сходный с естественным гормоном линьки и обладающий очень высокой гормональной активностью, что нарушает нормальный жизненный цикл паразита [15].
Пасленовыми, морковью, рисом вырабатываются фенилпропаноиды, например, хлорогеновая кислота, которая сама по себе слабо нематицидна, но в опытах ее продукция и накопление хорошо коррелирует с уровнем устойчивости к нематодам. Оказывается, продукты ее метаболизма обладают высокой нематицидной активностью в организме-мишени, но они слишком нестабильны или высокотоксичны для растений, поэтому они образуются только по мере необходимости: хлорогеновая кислота гидролизуется до хинной и кофейной кислот, причем последня, дополнительно окисляясь до ортохинона, оказывается весьма токсичной для фитогельминтов [3], [5].
Выступать как нематицидные и нематостатические вещества, репелленты или ингибиторы вылупления яиц могут и некоторые флавоноиды, такие как флавонолы, изофлавоноиды и птерокарпаны. Так, кемпферол подавляет вылупление яиц R. similis. Кверцетин и мирицетин являются репеллентами и немастатическими соединениями для M. incognita, медикарпин также ингибирует подвижность Pratylenchus penetrans. Патулетин, патулитрин, кверцетин и рутин являются нематицидными для личинок H. zeae [93], [94].
Рисунок 25. Широко известные фитоалексины.
рисунок автора
Серосодержащие же вещества используются растениями для сокращения популяции нематод в почве. Так, корни бархатцев выделяют α-тертиенил, эффективно проникающий в гиподерму нематод и индуцирующий окислительный стресс. Точно так же спаржа продуцирует аспарагусовую кислоту, подавляющую размножение H. glycines и G. rostochiensis [3]. А виды семейств Астровые и Зонтичные вырабатывают токсичные вещества ацетилены: пентаин, тиарубрин и производные полиацетилена [15].
С фитоантиципинами более-менее понятно. Еще существуют какие-то фитоалексины, спросят пытливые читатели? Да, и это очень важные индуцибельные соединения (рис. 25). Первые защитные метаболиты, ключевые компоненты фитоиммунитета, биосинтез которых индуцируется на начальных этапах взаимодействия растений с фитопатогенами, были получены при изучении взаимодействия растений с фитопатогенными грибами. А в 1971 г. было показано, что фитоалексины синтезируются при инвазии фитогельминтами, но ограниченно — только у представителей четырех семейств растений [95]. Если опуститься на молекулярный уровень, то следует отметить, что в запуске синтеза фитоалексинов часто участвует ранее упоминавшийся фактор транскрипции WRKY33. Его оверэкспрессия приводит к повышенной устойчивости к фитогельминтам [78].
Рисунок 26. Липидные капли с анигоруфоном внутри Radopholus similis.
сайт Max Planck Institute
Приведем примеры. В ответ на инвазию червей Ditylenchus dipsaci и D. destructor растения томата и картофеля синтезируют cесквитерпеноиды: ришитин, любимин, а хлопчатник в ответ на Meloidogyne incognita — госсипол и его производные. У устойчивого сорта банана в местах инфицирования роющей нематоды Radopholus similis (Musa sp.) накапливается фенилфеналенон, жирорастворимый анигоруфон [96], [97]. Анигоруфон обладает высокой нематицидной активностью из-за образования крупных липид-анигоруфоновых комплексов в телах R. similis, которые увеличиваются в размерах по мере слияния в капли и вытесняют внутренние органы, вызывая метаболическую дисфункцию и в конечном итоге убивая фитогельминта (рис. 26). Надо заметить, это соединение, помимо нематод, успешно борется с лейшманиями [98] и патогенным грибком Fusarium oxysporum [99].
Бобовые синтезируют производные изофлавоноидов — птерокарпаны, содержащие 2 фенольных кольца, соединяемые ферментом халконсинтазой, активность которой повышается при инвазии. Например, устойчивые к M. incognita сорта сои по сравнению с восприимчивыми накапливают больше глицеоллинов, которые подавляют подвижность нематод. Фасоль обыкновенная в ответ на Pratylenchus рenetrans продуцирует фазеоллины, а фасоль лима в ответ на Pratylenchus scribneri индуцирует синтез производных продуктов окисления куместана — куместерола и псоралидина [100-102].
Нематицидными соединениями в растениях семейства Капустные считаются глюкозинолаты (например, 2-фенилэтилглюкозинолат), а у маниоки Maniot esculenta — цианогенные глюкозиды (линамарин). Принцип действия у них одинаковый: первоначально пространственно отделенные от гидролизующих их ферментов вещества при повреждении тканей смешиваются с гидролазами, и тут происходит образование токсинов (часто летучих): изотиоцианата, аллилизотиоцианата, 2-фенилэтилизотиоцаната из глюкозинолатов или синильной кислоты из цианогенных гликозидов (рис. 27) [15]. С такими веществами мало кто хочет встречаться!
Рисунок 27. Механизм действия полуиндуцибельных соединений на примере линамарина.
адаптировано из [102]
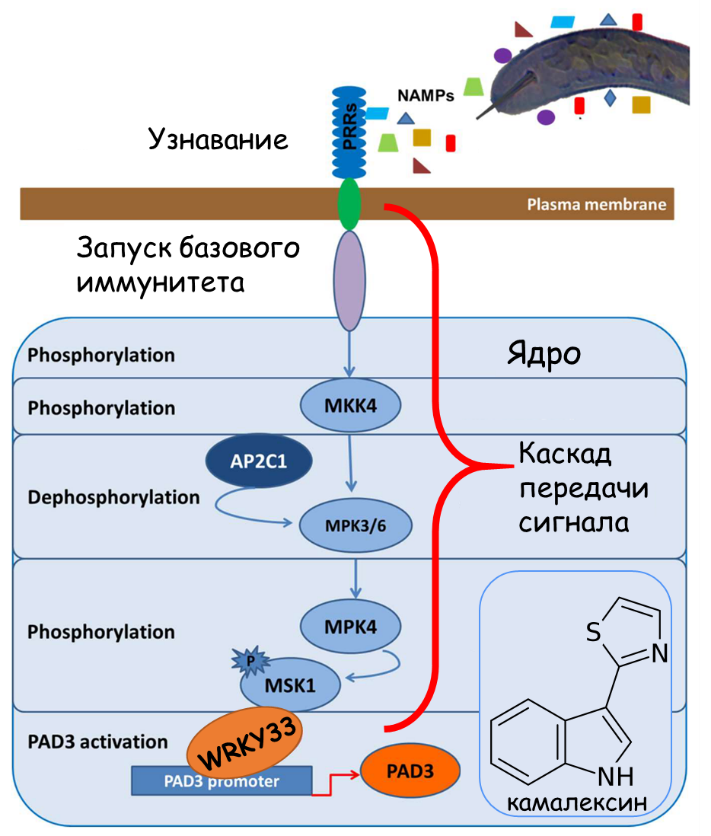
Рисунок 28. Схема запуска синтеза камалексина.
адаптировано из [26]
В частности, индуцируемый при инвазии фитонематод синтез индольного глюкозинолата, камалексина, катализируется тремя цитохром P450-зависимыми монооксигеназами, CYP79B2, CYP79B3 и PAD3, гены которых как раз и активируются уже знакомым нам фактором WRKY33 (рис. 28), [71].
Хлеба и зрелищ!
«Не следует множить сущее без необходимости», — гласит принцип Бритвы Оккама. Действительно, порой незачем усложнять. Это справедливо и для устойчивости растений к нематодам, которая, как оказалось, может быть связана с довольно банальной доступностью питательных веществ. Например, с наличием свободных незаменимых аминокислот в тканях хозяев, а также с доступностью соединений, жизненно необходимых для фитогельминтов, но не синтезируемых ими, таких как стерины. И вправду, какая выгода питаться теми, кто сам еле сводит с концы с концами?
Так, на примере широко известного «дуэта» томатов с южной галловой нематодой было показано, что инвазия корней изменяет качественный и количественный состав стеринов в устойчивых и восприимчивых сортах растений в противоположных направлениях: в первых наблюдалось снижение общей фракции стеринов и изменение их состава, а в других сортах — нет. Растение как бы информирует: «взять с меня нечего» [15].
Надстройка — вторичный иммунитет (ETI)
Базовый иммунитет, конечно, многообразен и хорош, ничего не скажешь. Но некоторые особо успешные нематоды разработали механизмы подавления базальной системы защиты растений с помощью выработки белков-эффекторов, которые, например, заставляют убиквитин прикрепляться к сигнальным белкам растений и, таким образом, снижать уровень их, как сейчас модно говорить, КPI в запуске иммунных ответов. Другими словами, фитонематоды обладают множественными эффекторами вирулентности, которые способны делать очень многое (о чем мы постоянно говорили выше), в том числе и подавлять базовый иммунитет.
К счастью, растения не опустили руки перед этим биологическим мошенничеством! В ответ на развитие механизма эффекторного подавления базового иммунитета появился другой способ восприятия сигналов у растений, а именно: узнавание с помощью рецепторов с нуклеотид-связывающим доменом и лейцин-богатым доменом NLR (NB-LRR).
Такие растительные рецепторы распознают уже не некий паттерн, ассоциированный с патогеном, а конкретные эффекторные молекулы — факторы авирулентности, кодируемые, между прочим, Avr-генами (т.е. генами авирулентности, потому что в данном случае определенные эффекторы нематод «предают» своих хозяев и вовсе не способствуют экспансии растения, а наоборот — делают червей невирулентными, грубо говоря, легко элиминируемыми), и активируют так называемый называемый иммунитет, запускаемый эффектором (ETI, или Effector‐triggered immunity) или, по-другому, устойчивость, опосредованную R-генами[103]! Почему именно R-гены?
Как вы, наверное, догадались, потому что рецепторы NLR, участвующие в распознавании нематодных эффекторов-элиситоров, собственно, и кодируются генами устойчивости (R), которые фактически и являются запускателями специфического иммунитета [104]! Вот такая вот головоломка.
Зуб за зуб
Как и во всяком дуэте «паразит-хозяин», специфика взаимоотношений нематод и растений на генетическом уровне определяется прямым или косвенным взаимодействием единственного R-гена растения-хозяина с одним Avr-геном авирулентности паразита, который кодирует эффектор-элиситор. Это называется взаимодействие «ген-на-ген». Причем каждый ген устойчивости (R-ген, от англ. resistance – устойчивость) представляет собой сложный локус в геноме, кодирующий несколько структурно сходных или идентичных белковых R-рецепторов [11], [103].
Вообще, эти R-белки растений распознают специфические детерминанты авирулентности различных фитопатогенных организмов (для каждого паразита свой R-ген, конечно), а не только нематод. Поэтому неудивительно, что все гены устойчивости к фитогельминтам принадлежат к классу NLR-генов и имеют сходство с ранее клонированными генами устойчивости к фитопатогенным вирусам, бактериям и грибам как по последовательностям, так и по структуре [11].
Важнейшей функцией, которую выполняют R-рецепторы, является индукция начальных этапов сигнальных каскадов, приводящих к устойчивости к болезни, а также запуск реакции сверхчувствительности, то есть локальной программируемой клеточной гибели.
Однозначно, R-белки сами по себе погоду не сделают. По-видимому, они образуют комплексы узнавания, которые еще и включают белок теплового шока Hsp90, Sgt1 и Rar1. Зачем? Связь с этим комплексом имеет решающее значение для сохранения R-белков в неактивном, но компетентном состоянии, готовыми к бою [5].
К сожалению, генетическая основа взаимоотношений между растениями и нематодами изучена только на малой толике паразитарных систем. Клонированы гены нематодоустойчивости у томатов, картофеля, пшеницы и некоторых других растений. Однако пока идентифицированы лишь несколько генов авирулентности и, соответственно, эффекторных молекул нематод, которые запускают специфический иммунитет. Поговорим о некоторых известных примерах.
Исследования структуры и функций генов, определяющих устойчивость к нематодам, начаты сравнительно недавно, и первые успехи были сделаны при исследовании гена томатов, определяющего устойчивость к Meloidogyne incognita [105]. Оказалось, что устойчивость томатов к галловым нематодам рода Meloidogyne (за исключением M. hapla) контролируется доминантным геном Mi1, кодирующим белок, как нетрудно догадаться, принадлежащий к классу рецепторов к эффекторным молекулам. Донором гена Mi1 у современных культурных томатов рассматривается их предок, дикорос Lycopersicon peruvianum. Интересен тот факт, что белковый продукт гена Mi-1.2, то бишь рецептор, теряет эффективность при температуре выше 28oС [30]. Это нужно принимать во внимание в сельском хозяйстве, особенно в тропиках.
По мере открытия генов устойчивости к круглым червям выяснилось их сходство с другими R-генами: так, ген томатов Mi близок к достаточно давно известным генам устойчивости к грибам — Cf2 и Cf5, и даже к гену Меu1, определяющему устойчивость к тлям. Ген устойчивости H1 картофеля к нематоде G. rostoсhiensis имеет большее сходство с геном Rx, определяющим устойчивость к вирусу [17].
Идентифицированы и гены авирулентности к открытым генам устойчивости. Так, уже нашли ген авирулентности у Globodera rostochiensis, который соответствует гену H1. Также обнаружены и кандидаты на роль гена авирулентности галловых нематод к гену Mi. С помощью сравнения растворимых белков вирулентных и авирулентных самок этих нематод показало наличие добавочного белка у авирулентных самок. Оказалось, что этот белок выделяется амфидами, а его ген может быть кандидатом на роль Avr-гена галловой нематоды. Предположительно, этим белком являются белок Cg-1 у нематоды M. javanica и белок MiMAP-1.2 у M. incognita, поскольку именно они взаимодействуют с рецептором Mi-1 томата, индуцируя специфический иммунитет. Вирулентные же штаммы нематод, к счастью для них, несут делетированный вариант Avr-гена, поэтому при заражении свое присутствие эффекторами не выдают [106-108].
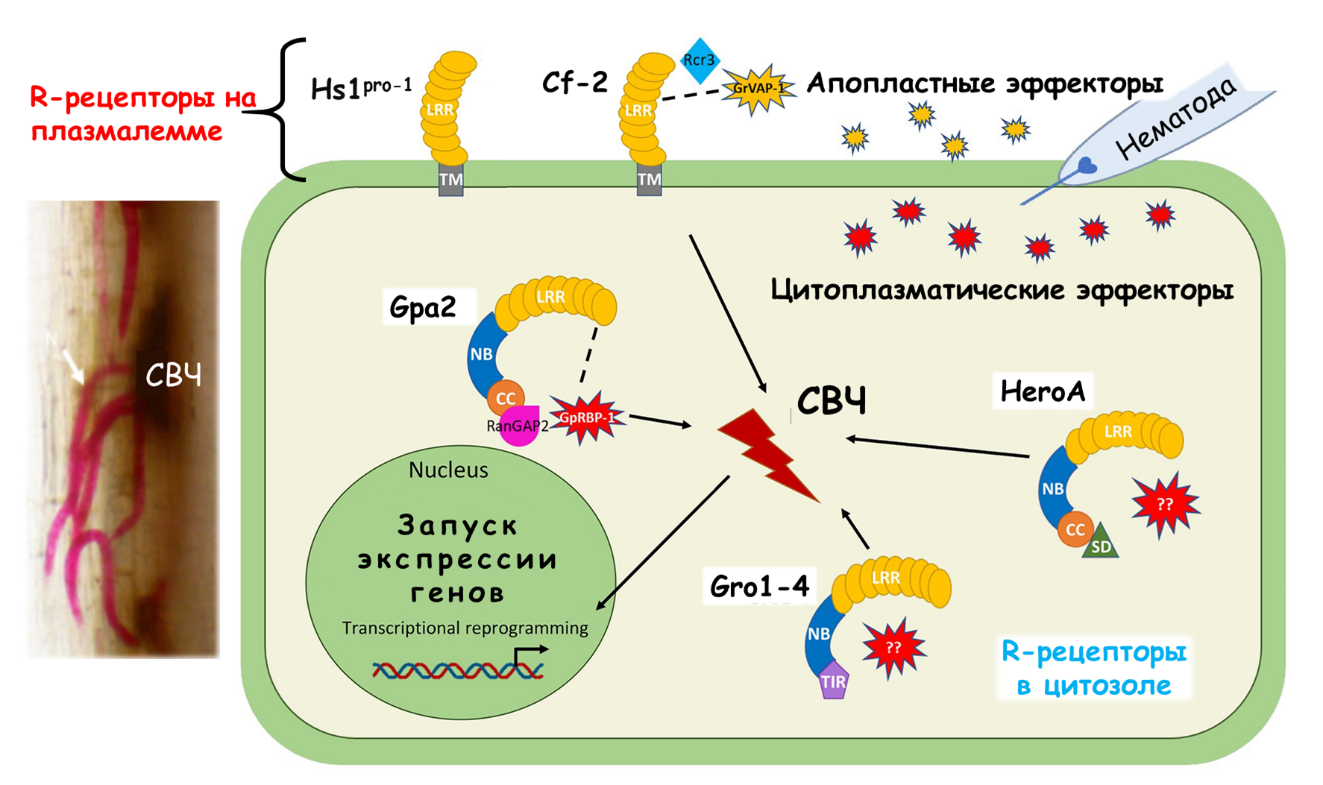
Рисунок 29. Обзор основных рецепторов устойчивости к нематодам, идентифицированных у видов сельскохозяйственных культур. Показаны и внеклеточные, и внутриклеточные R-рецепторы.
адаптировано из [108]
Охарактеризован любопытный эффектор SPRYSEC-19 из золотистой картофельной нематоды, который распознается рецептором томатов, кодируемым геном SW5-F. Однако удивительно, что SPRYSEC-19 не индуцирует реакцию сверхчувствительности в листьях табака [11]. Напротив, продукт другого гена из этого же семейства, SPRYSEC из нематоды G. pallida (Gp-Rbp-1) приводил к активации реакции сверхчувствительности при одновременной экспрессии с генами устойчивости картофеля, Gpa2 и RanGAP2 (Ran GTPase Activating Protein 2).
Перечислим другие хорошо изученные R-гены. Они включают Mi-9 и Hero-А гены томата, Gpa2 и Gro1-4 гены картофеля, CaMi ген перца. Причем гены Mi-1.2, а также Mi-9, CaMi и Ma обеспечивают сопротивление против галловых нематод, в то время как Hero-A, Gpa2 и Gro1-4 — против цистообразующих (рис. 29), [3], [108], [109].
Надо заметить, что связывание R-рецептора с элиситорами происходит, как правило, внутри клетки, в отличие от рецепторов базовой устойчивости, имеющих мембранную локализацию.
Клещи в клещи
Но есть и исключения. Например, R-рецептор, кодируемый геном Hs1pro-1 из Beta procumbens — дикого предка сахарной свеклы Beta vulgaris, определяющего устойчивость к свекловичной нематоде [110], локализуется в мембране, где и может происходить его связывание с элиситорами патогена (рис. 29).
Другой рецептор-подобный белок, локализованный на цитолемме, называется Cf-2. С ним особая история. Cf-2 распознает взаимодействие эффектора нематод Gr-VAP-1 с апопластической папаин-подобной цистеиновой протеазой (PLCP) Rcr3pim у томата (рис. 29, рис. 30). Оказывается, что папаиноподобные цистеиновые протеазы необходимы для устойчивости к нематодам. Поэтому фитогельминты создали эффекторы VAP (venom allergen-like protein — аллерген-подобные белки), нацеленные на ликвидацию этих протеаз.
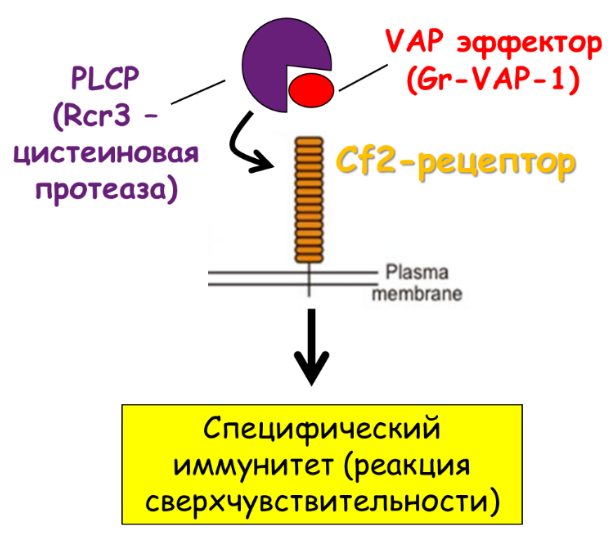
Рисунок 30. VAP-эффектор нематод стремится подавить растительный защитный механизм, апопластную протеазу, но сам попадается на крючок R-рецептора.
адаптировано из [112]
Один из таких эффекторов, Gr-VAP1, взаимодействует с протеазой Rcr3pim томата. Но это никак нематоде не помогает, а, наоборот, выявляет ее присутствие, что провоцирует Cf2-опосредованную защиту у устойчивых растений (рис. 30). Примечательно, что ген Cf-2 был первоначально идентифицирован как ген устойчивости к грибковому патогену Cladosporium fulvum, откуда и произошло название [111], [112]. Гриб секретирует эффектор AVR2, похожий на нематодный Gr-VAP1, и также узнается Cf-2 рецептором. Таким образом, рецептор Cf-2 распознает как грибковые, так и нематодные эффекторы (рис. 30).
В чем же разница?
Мы с головой погрузились в генетические аспекты, но остается непонятным, чем эта обусловленная R-генами качественная устойчивость отличается от предыдущей, базовой устойчивости? Зачем городить огород из белковых продуктов, если толком разницы-то нет.
Оказывается, специфическая устойчивость практически всегда накладывается на биохимические пути базовой количественной устойчивости. Несколько исследований показали, что растения генерируют ответы PTI и ETI, такие как активация митоген-активируемых протеинкиназ (MAPK), всплески апопластных АФК и передача сигналов жасмоната и салицилата, когда они сталкиваются с инфекциями нематод.
Представляется вероятным, что системы базовой и специфической защиты могут перекрываться (рис. 31). Пока остается неясным, какие именно из защитных реакций обусловлены R-геном, а какие обеспечивает базовая устойчивость. Ученые предполагают, что одной из функций генов устойчивости является просто более быстрая и эффективная активация тех же механизмов защиты, играющих роль и в базовой устойчивости [3], [11], [113].

Рисунок 31. Спектр защитных реакций растений подразумевает перекрывание путей базовой и специфической устойчивости.
адаптировано из [3]
Разница между базисом и надстройкой может заключаться в сигнальных системах, участвующих в формировании защитного ответа. Установлено, что в патосистеме «томат — M. Incognita» индуцированная хитозаном устойчивость реализуется при участии двух медиаторов — салицилата и жасмоната, тогда как в случае Mi-опосредованной опосредованной устойчивости в передаче сигнала участвует преимущественно салицилатный сигнальный путь, который запускается при содействии R-белков [5], [114].
Стоит оговориться, что салицилат и жасмонат являются ключевыми молекулами, участвующими в активации различных сигнальных путей в рамках защитных ответов, однако данные еще достаточно противоречивы. Существует парадигма, согласно которой салицилат обычно защищает от биотрофных патогенов, в то время как жасмонат подавляет некротрофных (у которых есть «лицензия на убийство» хозяина) и фитофагов. В частности, летучие оксилипины, такие как метилжасмонаты, играют первостепенную роль в ответе на механическое поранение или поедание, атаку патогенов и вредителей. Это, в общем, не совсем наш случай [11], [35].
В свою очередь, салицилат играет главенствующую роль в защите растений от биотрофных патогенов, в том числе и нематод. В ответ на внедрение гельминтов его уровень возрастает. Даже при механическом повреждении активизируется именно начальный фермент биосинтеза салицилата — фенилаланинаммиаклиаза (ФАЛ), а далее в ответ на салицилат запускается синтез PR-белков, одним из которых, как ни удивительно, является ФАЛ! То есть наблюдается положительная обратная связь: салицилат стимулирует собственный же биосинтез. Следует упомянуть, что ФАЛ участвует в регуляции биосинтеза не только салицилата, но и вообще большинства фенолов, и является центральной развилкой между первичным и вторичным метаболизмом, поэтому при ее активации начинают появляться еще и всякие защитные вещества (токсичные фитоалексины), роль которых мы уже рассмотрели [15].

Рисунок 32. Положительная обратная связь синтеза салицилата, а также роль салициловой кислоты в индукции АФК через ингибирование Fe-содержащих ферментов, прежде всего — каталазы.
рисунок автора
Кроме того, салициловая кислота связывается с железосодержащими белками и инактивирует их. Например, она связывается с каталазой, что вызывает мощный окислительный взрыв. Далее, накопление АФК ведет к индукции экспрессии защитных генов и гибели клеток, то есть реакции сверхчувствительности (СВЧ), о чем мы говорили, когда обсуждали манипулирование нематодами АФК-баланса. Высокий уровень салицилата в зараженных растениях также может привести к нарушению митохондриального окислительного фосфорилирования, что приводит еще и к некрозу клеток, вовлеченных в СВЧ [115], [116].
Еще салицилат способен транспортироваться по флоэме и локализовываться в органах, удаленных от места инфекции, тем самым активируя длительную резистентность в неинфицированных тканях и во всем растении. Это явление носит название системная приобретенная устойчивость. Вот такая благородная роль [11], [115].
Исследования показывают, что устойчивость томатов к M. incognita в первую очередь связана с передачей сигналов салицилата. Точно так же ответы на заражение картофельной нематодой на основе гена устойчивости HeroA у картофеля включают повышенную экспрессию именно салицилат-индуцированных PR-генов. Аналогичные результаты были получены на устойчивой линии пшеницы (имеющей ген Cre2) против нематоды H. avenae [3], [5], [15].
Можно подытожить, что отличительной чертой устойчивости, опосредованной R-генами, является запуск реакции гиперчувствительности, которая опосредуется как раз салицилатным сигналингом.
Высший альтруизм — реакция сверхчувствительности
Наконец, наступил подходящий момент расшифровать реакцию сверхчувствительности (или гиперчувствительности). Сверхчувствительность — такой тип запрограммированной гибели клеток, которая индуцируется после инвазии раскрывших себя авирулентных биотрофных патогенов для предотвращения их распространения и играет решающую роль в иммунитете против фитонематод [117].
Мы увидели, что активация R-рецепторов вызывает биосинтез и сигналинг АФК. Накопление свободных радикалов приводит к гиперчувствительному ответу, который выражается в чем? В запрограммированной смерти зараженных клеток: когда клетки, без мусора, аккуратно и жертвуя собой погибают, забирая с собой и фитопатогена, чтобы спасти все остальное растение [11].
Но всегда ли это того стоит? Оказывается, да. СВЧ-гибель клеток приводит к нарушению питания и развития седентарных эндопаразитарных нематод с последующей их локальной изоляцией и гибелью, потому что в некротических клетках накапливаются и всякие токсичные продукты (фенолы, фитоалексины, PR‐белки, ингибиторы протеиназ, перекиси) и увеличивается активность ферментов пероксидаз, полифенолоксидаз, фенилаланинаммиаклиазы, липоксигеназ. В общем, формируется просто адская смесь. И, как вы сами можете заметить, очень многое из этого делает салицилатный сигналинг [3], [117].
Существенно, что место и время встречи нематоды и реакции сверхчувствительности очень варьируют. Так, гибель растительных клеток наблюдается на трех различных фазах инфицирования:
- Реакция сверхчувствительности в коре и эпидермисе во время проникновения и миграции часто наблюдается и у устойчивых, и у восприимчивых растений, но у последних она менее быстрая и менее частая. Такая смерть клеток может ингибировать миграцию нематод, но неясно, останавливает ли она движение червей прямо или косвенно, высвобождая немастатические/нематицидные химические вещества или же DAMP для активации других иммунных ответов [118-120].
- Гибель клеток также индуцируется во время инициации развития питающих клеток. Например, устойчивые растения томата (имеющие R-ген Mi-1.2), вызывают запрограммированную гибель клеток во время индукции гигантских клеток, таким образом подавляя их развитие [121].
- Гибель в клетках, прилегающих к развивающимся питающим клеткам, функцией которых является создание физического разрыва между питающимися и окружающими клетками для блокирования подачи питательных веществ и воды. Например, в линиях томатов, несущих ген Hero, нематода G. rostochiensis вызывает образование синцития. Но индуцируемая в окружающих клетках реакция СВЧ приводит к отделению синцития от стеллярных тканей. Отключение питающих клеток от окружающей ткани также происходит у устойчивых растений после заражения корневыми галловыми нематодами. Диссоциация окружающих тканей приводит к плохому снабжению питательными веществами, что подавляет рост или даже вызывает гибель питающихся клеток, а с ними и паразитов [120].
Гонка вооружений
Чтобы на 100% развеять сомнения относительно важности реакции сверхчувствительности в фитоиммунитете, необходимо подчеркнуть, что она настолько не нравится биологическим мошенникам, нематодам, что они всеми силами пытаются ее избежать. Например, с помощью манипулирования Rboh-зависимым синтезом АФК, о чем говорилось выше. Но также оказалось, что ряд видов фитонематод уже «приобрели» новые специальные эффекторы, секретируемые пищеводными железами, которые подавляют сигналы специфической устойчивости или непосредственно саму запрограммированную гибель клеток. К таким эффекторам можно отнести хоризматмутазы, а также кальретикулин [122]. Так, кальретикулин M. incognita, Mi-CRT, был обнаружен в апопласте растительных клеток, где он задействован в репрессии обороны инфицированных растений арабидопсиса за счет подавления генов, участвующих в индукции и передачи сигналов салициловой кислоты и продукции каллозы. А трансгенные растения Arabidopsis со сверхэкспрессией Mi-CRT демонстрируют повышенную восприимчивость к фитонематодам.
Или взять другой эффектор, MiMsp40. Он является Meloidogyne-специфическим эффектором, который экспрессируется исключительно в клетках субвентральной части пищевода и инъецируется в растительные клетки ранними паразитическими стадиями нематоды, играя роль в подавлении сигналов любого иммунитета. ГМ-растения Arabidopsis, сверхэкспрессирующие MiMsp40, были более восприимчивы к инфекции нематод, чем растения дикого типа. MiMsp40 в ГМ-растениях подавлял отложение каллозы и экспрессию маркерных генов иммунитета, а также предотвращал запрограммированную клеточную гибель [78].
Также вспомним, например, уже ранее упоминавшийся загадочный фактор авирулентности SPRYSEC-19, присутствующий в секретах картофельной цистообразующей нематоды. Он подавляет гиперчувствительный ответ, несмотря на узнавание R-белком. Как же такое может быть, спросите вы? Оказывается, SPRYSEC-19 физически ассоциируется с LRR-доменом рецептора, кодируемого геном устойчивости у томатов, и такое взаимодействие напрочь блокирует дальнейший сигналинг. Кроме того, у этой же нематоды было идентифицировано два других эффектора, GrUBCEP12 и экспансин-подобный белок GrEXPB2, которые подавляли уже индуцированную в цитоплазме передачу сигналов от R-рецептора [110]!
А вот белок-эффектор Globodera pallida RHA1B представляет собой и вовсе убиквитин-лигазу E3, которая банально отправляет R-рецептор на деградацию в протеасому, используя стратегию: «нет рецептора — нет проблемы». Кстати, корневые галловые нематоды также не остаются в стороне и имеют свои эффекторы подавления реакции сверхчувствительности, такие как MiISE5 (M. incognit) и MeTCTP (M. enterolobii) [123].
Итоги: американские горки

Рисунок 33. Зигзаг-модель в растительно-нематодных взаимодействиях: HR — реакция сверхчувствительности, ETS — эффектор индуцируемая восприимчивость, ETI — эффектор индуцируемая устойчивость.
адаптировано из [73]
Выходит, что растения постоянно ищут новые способы детекции патогенов, а сами патогены, такие как нематоды, прячутся и изобретают все новые ухищрения, чтобы продолжать питаться растениями. На рисунке 33 представлена многокомпонентная зигзагообразная модель, суммирующая циклический эволюционный процесс взаимоотношений растений с нематодами. Первоначально высвобождение фитогельминтами элиситоров, таких как NAMP, запускает базовый фитоиммунитет, который снижает восприимчивость растений. Затем у нематод начинается продукция эффекторов, подавляющих неспецифическую устойчивость, а у растений, в свою очередь, на арену выходят R-белки, способные вызвать реакцию сверхчувствительности. Тогда взаимодействие растений и нематод начинает описываться «встречей» один на один R-белков и эффекторных белков, факторов авирулентности (белки Avr) [63], [73]. И далее все по новой: нематоды развивают новое поколение эффекторов, которые подавят уже специфическую устойчивость и реакцию сверхчувствительности, а растения... аж дух захватывает, что «изобретут» дальше.
Благодарности
Выражаю благодарность доценту кафедры микробиологии ИФМиБ К(П)ФУ, к.б.н. Зеленихину Павлу Валерьевичу за своевременный посыл в написании данного научно-популярного обзора в текущем году.
Литература
- Рысс А.Ю. (2019). Происхождение фитопаразитизма нематод и их коэволюция с хозяевами и переносчиками (на примере Афеленхоидных нематод). Энтомологическое обозрение. 98, 445–660;
- Вайшер Б., Браун Д.Д.Ф. Знакомство с нематодами: общая нематология (учебник для студентов). Pensoft Publishers, 2001. — 206 с.;
- Kazuki Sato, Yasuhiro Kadota, Ken Shirasu. (2019). Plant Immune Responses to Parasitic Nematodes. Front. Plant Sci.. 10;
- Родигин М. Н. Общая фитопатология (учебное пособие). М.: Высш. шк., 1978. — 369 с.;
- Зиновьева С.В. Фитопаразитические нематоды России. М.: КМК., 2013 — 386 с.;
- Вестхайде В., Ригер Р. Зоология беспозвоночных: от артропода до иглокожих и хордовых. М.: Т-во научных изданий КМК, 2008. — 430 с.;
- Wim Grunewald, Giel van Noorden, Gert Van Isterdael, Tom Beeckman, Godelieve Gheysen, Ulrike Mathesius. (2009). Manipulation of Auxin Transport in Plant Roots during Rhizobium Symbiosis and Nematode Parasitism. Plant Cell. 21, 2553-2562;
- Melissa G. Mitchum, Richard S. Hussey, Thomas J. Baum, Xiaohong Wang, Axel A. Elling, et. al.. (2013). Nematode effector proteins: an emerging paradigm of parasitism. New Phytol. 199, 879-894;
- Рупперт Э. Э. Зоология беспозвоночных: Функциональные и эволюционные аспекты. М.: «Академия», 2008. — 496 с.;
- Michael G. K. Jones, Derek B. Goto. (2011). Root-knot Nematodes and Giant Cells. Genomics and Molecular Genetics of Plant-Nematode Interactions. 83-100;
- Горшков В. Ю. Бактериозы растений: молекулярные основы формирования растительно-микробных патосистем. Казань: Изд-во Сергея Бузукина, 2017. — 296 с.;
- Зитте П. Ботаника. Учебник для вузов. М.: Издательский центр «Академия», 2008. — 496 с.;
- E Davis. (2004). Getting to the roots of parasitism by nematodes. Trends in Parasitology. 20, 134-141;
- Shahid Siddique, Zoran S. Radakovic, Carola M. De La Torre, Demosthenis Chronis, Ondřej Novák, et. al.. (2015). A parasitic nematode releases cytokinin that controls cell division and orchestrates feeding site formation in host plants. Proc Natl Acad Sci USA. 112, 12669-12674;
- Зиновьева С.В. Молекулярные механизмы взаимодействия растений и паразитических нематод. М: «Наука», 2004. — 50–85 с.;
- Władysław Golinowski, Christer Magnusson. (1991). Tissue response induced by Heterodera schachtii (Nematoda) in susceptible and resistant white mustard cultivars. Can. J. Bot.. 69, 53-62;
- Valerie M Williamson, Cynthia A Gleason. (2003). Plant–nematode interactions. Current Opinion in Plant Biology. 6, 327-333;
- Holger Bohlmann, Miroslaw Sobczak. (2014). The plant cell wall in the feeding sites of cyst nematodes. Front. Plant Sci.. 5;
- Jeng-Sheng Huang, Kenneth R. Barker. (1991). Glyceollin I in Soybean-Cyst Nematode Interactions. Plant Physiol.. 96, 1302-1307;
- V M Williamson, R S Hussey. (1996). Nematode pathogenesis and resistance in plants.. Plant Cell. 8, 1735-1745;
- D. G. Bartlem, M. G. K. Jones, U. Z. Hammes. (2014). Vascularization and nutrient delivery at root-knot nematode feeding sites in host roots. Journal of Experimental Botany. 65, 1789-1798;
- Sebastian Eves-van den Akker, Catherine J. Lilley, James R. Ault, Alison E. Ashcroft, John T. Jones, Peter E. Urwin. (2014). The Feeding Tube of Cyst Nematodes: Characterisation of Protein Exclusion. PLoS ONE. 9, e87289;
- N. Vovlas, N. J. O. Simões, N. Sasanelli, M. C. V. dos Santos, I. M. de O. Abrantes. (2004). Host-parasite relationships in tobacco plants infected with a root-knot nematode (Meloidogyne incognita) population from the Azores. Phytoparasitica. 32, 167-173;
- D. Greenbaum. (2001). Interrelating Different Types of Genomic Data, from Proteome to Secretome: 'Oming in on Function. Genome Research. 11, 1463-1468;
- Paulo Vieira, Cynthia Gleason. (2019). Plant-parasitic nematode effectors — insights into their diversity and new tools for their identification. Current Opinion in Plant Biology. 50, 37-43;
- Muhammad Ali, Muhammad Anjam, Muhammad Nawaz, Hon-Ming Lam, Gyuhwa Chung. (2018). Signal Transduction in Plant–Nematode Interactions. IJMS. 19, 1648;
- R S Hussey. (1989). Disease-Inducing Secretions of Plant-Parasitic Nematodes. Annu. Rev. Phytopathol.. 27, 123-141;
- Eric L. Davis, Richard S. Hussey, Thomas J. Baum, Jaap Bakker, Arjen Schots, et. al.. (2000). Nematode Parasitism Genes. Annu. Rev. Phytopathol.. 38, 365-396;
- Bingli Gao, R. Allen, Tom Maier, Eric L. Davis, Thomas J. Baum, Richard S. Hussey. (2003). The Parasitome of the PhytonematodeHeterodera glycines. MPMI. 16, 720-726;
- V. H. Dropkin. (1976). Nematode Parasites of Plants, Their Ecology and the Process of Infection. Physiological Plant Pathology. 222-246;
- 10.1042/0264-6021:3560387;
- Catherine J Lilley, Peter E Urwin, Howard J Atkinson, Michael J McPherson. (1997). Characterization of cDNAs encoding serine proteinases from the soybean cyst nematode Heterodera glycines1Note: Nucleotide sequence data reported in this paper are available in the EMBL, GenBank™ and DDJB data bases under the accession numbers Y13908, Y13907 and Y13906.1. Molecular and Biochemical Parasitology. 89, 195-207;
- Peter E. Urwin, Aurora Levesley, Michael J. McPherson, Howard J. Atkinson. (2000). . Molecular Breeding. 6, 257-264;
- Hongjiang Li, Deshu Lin, Pankaj Dhonukshe, Shingo Nagawa, Dandan Chen, et. al.. (2011). Phosphorylation switch modulates the interdigitated pattern of PIN1 localization and cell expansion in Arabidopsis leaf epidermis. Cell Res. 21, 970-978;
- Godelieve Gheysen, Melissa G. Mitchum. (2019). Phytoparasitic Nematode Control of Plant Hormone Pathways. Plant Physiol.. 179, 1212-1226;
- Melissa Goellner, Xiaohong Wang, Eric L. Davis. (2001). Endo-β-1,4-Glucanase Expression in Compatible Plant–Nematode Interactions. Plant Cell. 13, 2241-2255;
- Marie-Cécile Caillaud, Géraldine Dubreuil, Michaël Quentin, Laetitia Perfus-Barbeoch, Philippe Lecomte, et. al.. (2008). Root-knot nematodes manipulate plant cell functions during a compatible interaction. Journal of Plant Physiology. 165, 104-113;
- Jan De Meutter, Tom Tytgat, Erwin Witters, Greetje Gheysen, Henri Van Onckelen, Godelieve Gheysen. (2003). Identification of cytokinins produced by the plant parasitic nematodes Heterodera schachtii and Meloidogyne incognita. Molecular Plant Pathology. 4, 271-277;
- Thomas Spallek, Pamela Gan, Yasuhiro Kadota, Ken Shirasu. (2018). Same tune, different song — cytokinins as virulence factors in plant–pathogen interactions?. Current Opinion in Plant Biology. 44, 82-87;
- S. Hoth, R. Stadler, N. Sauer, U. Z. Hammes. (2008). Differential vascularization of nematode-induced feeding sites. Proceedings of the National Academy of Sciences. 105, 12617-12622;
- T. FESTER, R.H. BERG, C.G. TAYLOR. (2008). An easy method using glutaraldehyde-introduced fluorescence for the microscopic analysis of plant biotrophic interactions. Journal of Microscopy. 231, 342-348;
- M.G.K. JONES. (1981). The Development and Function of Plant Cells Modified by Endoparasitic Nematodes. Plant Parasitic Nematodes. 255-279;
- Shunsuke Miyashima, Jose Sebastian, Ji-Young Lee, Yka Helariutta. (2012). Stem cell function during plant vascular development. EMBO J. 32, 178-193;
- Guozhong Huang, Ruihua Dong, Rex Allen, Eric L. Davis, Thomas J. Baum, Richard S. Hussey. (2006). A Root-Knot Nematode Secretory Peptide Functions as a Ligand for a Plant Transcription Factor. MPMI. 19, 463-470;
- Christina E. Offler, David W. McCurdy, John W. Patrick, Mark J. Talbot. (2003). Transfer Cells: Cells Specialized for a Special Purpose. Annu. Rev. Plant Biol.. 54, 431-454;
- Ulrich Z. Hammes, Daniel P. Schachtman, R. Howard Berg, Erik Nielsen, Wolfgang Koch, et. al.. (2005). Nematode-Induced Changes of Transporter Gene Expression inArabidopsisRoots. MPMI. 18, 1247-1257;
- Heather H. Marella, Erik Nielsen, Daniel P. Schachtman, Christopher G. Taylor. (2013). The Amino Acid Permeases AAP3 and AAP6 Are Involved in Root-Knot Nematode Parasitism of Arabidopsis. MPMI. 26, 44-54;
- Friederike Ladwig, Mark Stahl, Uwe Ludewig, Axel A. Hirner, Ulrich Z. Hammes, et. al.. (2012). Siliques Are Red1 from Arabidopsis Acts as a Bidirectional Amino Acid Transporter That Is Crucial for the Amino Acid Homeostasis of Siliques. Plant Physiology. 158, 1643-1655;
- Li-Qing Chen, Bi-Huei Hou, Sylvie Lalonde, Hitomi Takanaga, Mara L. Hartung, et. al.. (2010). Sugar transporters for intercellular exchange and nutrition of pathogens. Nature. 468, 527-532;
- Li-Qing Chen, Xiao-Qing Qu, Bi-Huei Hou, Davide Sosso, Sonia Osorio, et. al.. (2012). Sucrose Efflux Mediated by SWEET Proteins as a Key Step for Phloem Transport. Science. 335, 207-211;
- David P. Puthoff, Dan Nettleton, Steven R. Rodermel, Thomas J. Baum. (2003). Arabidopsisgene expression changes during cyst nematode parasitism revealed by statistical analyses of microarray expression profiles. The Plant Journal. 33, 911-921;
- Marie-Cécile Caillaud, Philippe Lecomte, Fabien Jammes, Michaël Quentin, Sophie Pagnotta, et. al.. (2008). MAP65-3 Microtubule-Associated Protein Is Essential for Nematode-Induced Giant Cell Ontogenesis inArabidopsis. The Plant Cell. 20, 423-437;
- Janice de Almeida Engler, Kris Van Poucke, Mansour Karimi, Ruth De Groodt, Greetje Gheysen, et. al.. (2004). Dynamic cytoskeleton rearrangements in giant cells and syncytia of nematode-infected roots. The Plant Journal. 38, 12-26;
- Bruce L. Goode, Michael J. Eck. (2007). Mechanism and Function of Formins in the Control of Actin Assembly. Annu. Rev. Biochem.. 76, 593-627;
- David McK Bird. (2004). Signaling between nematodes and plants. Current Opinion in Plant Biology. 7, 372-376;
- Aurélien Boisson-Dernier, Andry Andriankaja, Mireille Chabaud, Andreas Niebel, Etienne-P. Journet, et. al.. (2005). MtENOD11 Gene Activation During Rhizobial Infection and Mycorrhizal Arbuscule Development Requires a Common AT-Rich-Containing Regulatory Sequence. MPMI. 18, 1269-1276;
- R. R. Weerasinghe, D. McK. Bird, N. S. Allen. (2005). Root-knot nematodes and bacterial Nod factors elicit common signal transduction events in Lotus japonicus. Proceedings of the National Academy of Sciences. 102, 3147-3152;
- Peter Marhavý, Andrzej Kurenda, Shahid Siddique, Valerie Dénervaud Tendon, Feng Zhou, et. al.. (2019). Single‐cell damage elicits regional, nematode‐restricting ethylene responses in roots. EMBO J. 38;
- Sarbottam Piya, Brad M. Binder, Tarek Hewezi. (2019). Canonical and noncanonical ethylene signaling pathways that regulate Arabidopsis susceptibility to the cyst nematode Heterodera schachtii. New Phytol. 221, 946-959;
- K Henkle-Dührsen. (2001). Antioxidant enzyme families in parasitic nematodes. Molecular and Biochemical Parasitology. 114, 129-142;
- G. Dubreuil, M. Magliano, E. Deleury, P. Abad, M. N. Rosso. (2007). Transcriptome analysis of root‐knot nematode functions induced in the early stages of parasitism*. New Phytologist. 176, 426-436;
- Lee Robertson, Walter M Robertson, Miroslaw Sobczak, Johannes Helder, Emmanuel Tetaud, et. al.. (2000). Cloning, expression and functional characterisation of a peroxiredoxin from the potato cyst nematode Globodera rostochiensis. Molecular and Biochemical Parasitology. 111, 41-49;
- Jones A.M.б Dangl, J.L. (2004). Longjam at the Styx: programmed cell death in plants. Trends Plant Sci. 1, 114–119;
- Tarek Hewezi, Peter J. Howe, Tom R. Maier, Richard S. Hussey, Melissa G. Mitchum, et. al.. (2010). Arabidopsis Spermidine Synthase Is Targeted by an Effector Protein of the Cyst Nematode Heterodera schachtii. Plant Physiology. 152, 968-984;
- Yoshihisa Kasukabe, Lixiong He, Kazuyoshi Nada, Shuhei Misawa, Izumi Ihara, Shoji Tachibana. (2004). Overexpression of Spermidine Synthase Enhances Tolerance to Multiple Environmental Stresses and Up-Regulates the Expression of Various Stress-Regulated Genes in Transgenic Arabidopsis thaliana. Plant and Cell Physiology. 45, 712-722;
- Borong Lin, Kan Zhuo, Shiyan Chen, Lili Hu, Longhua Sun, et. al.. (2016). A novel nematode effector suppresses plant immunity by activating host reactive oxygen species‐scavenging system. New Phytol. 209, 1159-1173;
- Y. Balmer, W. H. Vensel, N. Cai, W. Manieri, P. Schurmann, et. al.. (2006). A complete ferredoxin/thioredoxin system regulates fundamental processes in amyloplasts. Proceedings of the National Academy of Sciences. 103, 2988-2993;
- Kerstin Kirchsteiger, Julia Ferrández, María Belén Pascual, Maricruz González, Francisco Javier Cejudo. (2012). NADPH Thioredoxin Reductase C Is Localized in Plastids of Photosynthetic and Nonphotosynthetic Tissues and Is Involved in Lateral Root Formation in Arabidopsis. Plant Cell. 24, 1534-1548;
- Yasuhiro Kadota, Ken Shirasu, Cyril Zipfel. (2015). Regulation of the NADPH Oxidase RBOHD During Plant Immunity. Plant Cell Physiol. 56, 1472-1480;
- Глянько А.К., Ищенко, А.А. (2010). Структурные и функциональные особенности НАДФН-оксидазы растений. Прикладная биохимия и микробиология. 46, 509–518;
- Marcella A. Teixeira, Lihui Wei, Isgouhi Kaloshian. (2016). Root‐knot nematodes induce pattern‐triggered immunity in Arabidopsis thaliana roots. New Phytol. 211, 276-287;
- Shahid Siddique, Christiane Matera, Zoran S. Radakovic, M. Shamim Hasan, Philipp Gutbrod, et. al.. (2014). Parasitic Worms Stimulate Host NADPH Oxidases to Produce Reactive Oxygen Species That Limit Plant Cell Death and Promote Infection. Sci. Signal.. 7;
- Jonathan D. G. Jones, Jeffery L. Dangl. (2006). The plant immune system. Nature. 444, 323-329;
- Peter N. Dodds, John P. Rathjen. (2010). Plant immunity: towards an integrated view of plant–pathogen interactions. Nat Rev Genet. 11, 539-548;
- Patricia Manosalva, Murli Manohar, Stephan H. von Reuss, Shiyan Chen, Aline Koch, et. al.. (2015). Conserved nematode signalling molecules elicit plant defenses and pathogen resistance. Nat Commun. 6;
- Murli Manohar, Francisco Tenjo-Castano, Shiyan Chen, Ying K. Zhang, Anshu Kumari, et. al.. (2020). Plant metabolism of nematode pheromones mediates plant-nematode interactions. Nat Commun. 11;
- Freddy Boutrot, Cyril Zipfel. (2017). Function, Discovery, and Exploitation of Plant Pattern Recognition Receptors for Broad-Spectrum Disease Resistance. Annu. Rev. Phytopathol.. 55, 257-286;
- Badou Mendy, Mary Wanjiku Wang’ombe, Zoran S. Radakovic, Julia Holbein, Muhammad Ilyas, et. al.. (2017). Arabidopsis leucine-rich repeat receptor–like kinase NILR1 is required for induction of innate immunity to parasitic nematodes. PLoS Pathog. 13, e1006284;
- Sebastian Eves-van den Akker. (2021). Plant–nematode interactions. Current Opinion in Plant Biology. 62, 102035;
- Renato D'Ovidio, Benedetta Mattei, Serena Roberti, Daniela Bellincampi. (2004). Polygalacturonases, polygalacturonase-inhibiting proteins and pectic oligomers in plant–pathogen interactions. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1696, 237-244;
- Syed Jehangir Shah, Muhammad Shahzad Anjam, Badou Mendy, Muhammad Arslan Anwer, Samer S Habash, et. al.. (2017). Damage-associated responses of the host contribute to defence against cyst nematodes but not root-knot nematodes. Journal of Experimental Botany. 68, 5949-5960;
- Julia Holbein, Rochus B. Franke, Peter Marhavý, Satoshi Fujita, Mirosława Górecka, et. al.. (2019). Root endodermal barrier system contributes to defence against plant‐parasitic cyst and root‐knot nematodes. Plant J. 100, 221-236;
- Richard S. Hussey, Eric L. Davis, Thomas J. Baum. (2002). Secrets in secretions: genes that control nematode parasitism of plants. Braz. J. Plant Physiol.. 14, 183-194;
- Muhammad Amjad Ali, Amjad Abbas, David P Kreil, Holger Bohlmann. (2013). Overexpression of the transcription factor RAP2.6 leads to enhanced callose deposition in syncytia and enhanced resistance against the beet cyst nematode Heterodera schachtiiin Arabidopsis roots. BMC Plant Biol. 13;
- Balhadère P., Evans, A. (1995). Cytochemical investigation of resistance to root-knot nematode Meloidogyne naasi in cereals and grasses using cryosections of roots. Fund. Appl. Nematol. 18, 539–554;
- Marban-Mendoza N., Jeyaparakash А., Jansson Н.В., Damon R.A., Jr, Zuckerman B.M. (1987). Control of rootknot nematodes on tomato by lectins. Journal of Nematolog. 19, 331–335;
- Eric L Davis, Richard S Hussey, Melissa G Mitchum, Thomas J Baum. (2008). Parasitism proteins in nematode–plant interactions. Current Opinion in Plant Biology. 11, 360-366;
- Burrows P.R., Stone A.R. Heterodera glycines. CIH Descriptions of plant-parasitic nematodes, No. 118. Wallingford, UK, CAB International, 1998. — p. 4;
- Stanley WB Ewen, Arpad Pusztai. (1999). Effect of diets containing genetically modified potatoes expressing Galanthus nivalis lectin on rat small intestine. The Lancet. 354, 1353-1354;
- Jie Zhou, Feifei Jia, Shujun Shao, Huan Zhang, Guiping Li, et. al.. (2015). Involvement of nitric oxide in the jasmonate-dependent basal defense against root-knot nematode in tomato plants. Front. Plant Sci.. 6;
- Maria Teresa Melillo, Paola Leonetti, Antonella Leone, Pasqua Veronico, Teresa Bleve-Zacheo. (2011). ROS and NO production in compatible and incompatible tomato-Meloidogyne incognita interactions. Eur J Plant Pathol. 130, 489-502;
- Shawkat Ali, Maxime Magne, Shiyan Chen, Natasa Obradovic, Lubna Jamshaid, et. al.. (2015). Analysis of Globodera rostochiensis effectors reveals conserved functions of SPRYSEC proteins in suppressing and eliciting plant immune responses. Front. Plant Sci.. 6;
- Mahajan R., Singh P., Bajaj K.L. (1985). Nematicidal activities of some phenolic compounds against M. incognita. <Revue Nematology. 8, 161–164;
- Noé López-Martínez, Ma. Teresa Colinas-León, Cecilia B. Peña-Valdivia, Yolanda Salinas-Moreno, Patricia Fuentes-Montiel, et. al.. (2011). Alterations in peroxidase activity and phenylpropanoid metabolism induced by Nacobbus aberrans Thorne and Allen, 1944 in chilli (Capsicum annuum L.) CM334 resistant to Phytophthora capsici Leo.. Plant Soil. 338, 399-409;
- Abawi G.S., Ven Ellen H.D., Mai W.F. (1971). Phaseollin production induced by Pratylenchus penetrans in Phaseolus vulgaris. J. Nematol. 3, p. 301;
- Suganthagunthalam Dhakshinamoorthy, Kahpui Mariama, Annemie Elsen, Dirk De Waele. (2014). Phenols and lignin are involved in the defence response of banana (Musa) plants to Radopholus similis infection. Nematol. 16, 565-576;
- Dirk Hölscher, Suganthagunthalam Dhakshinamoorthy, Theodore Alexandrov, Michael Becker, Tom Bretschneider, et. al.. (2014). Phenalenone-type phytoalexins mediate resistance of banana plants (Musa spp.) to the burrowing nematode Radopholus similis. Proc Natl Acad Sci USA. 111, 105-110;
- Juan Román Luque-Ortega, Silvia Martínez, José María Saugar, Laura R. Izquierdo, Teresa Abad, et. al.. (2004). Fungus-Elicited Metabolites from Plants as an Enriched Source for New Leishmanicidal Agents: Antifungal Phenyl-Phenalenone Phytoalexins from the Banana Plant ( Musa acuminata ) Target Mitochondria of Leishmania donovani Promastigotes. Antimicrob Agents Chemother. 48, 1534-1540;
- Javier G. Luis, Winston Q. Fletcher, Fernando Echeverri, Teresa Abad, Martha P. Kishi, Aurea Perales. (1995). New Phenalenone-type Phytoalexins fromMusa acuminata(Colla AAA) Grand Nain. Natural Product Letters. 6, 23-30;
- Kaplan D. T., Thomason I. J., Van Gundy S. D. (1979). Histological study of the compatible and incompatible interaction of soybeans and M. incognita. J. Nematol. 11, 338–343;
- D.T. Kaplan, N.T. Keen, I.J. Thomason. (1980). Association of glyceollin with the incompatible response of soybean roots to Meloidogyne incognita. Physiological Plant Pathology. 16, 309-318;
- E. Rivadeneyra-Domínguez, J. F. Rodríguez-Landa. (2020). Preclinical and clinical research on the toxic and neurological effects of cassava (Manihot esculenta Crantz) consumption. Metab Brain Dis. 35, 65-74;
- Haitao Cui, Kenichi Tsuda, Jane E. Parker. (2015). Effector-Triggered Immunity: From Pathogen Perception to Robust Defense. Annu. Rev. Plant Biol.. 66, 487-511;
- Isgouhi Kaloshian, Olivia J. Desmond, Hagop S. Atamian. (2011). Disease Resistance-Genes and Defense Responses During Incompatible Interactions. Genomics and Molecular Genetics of Plant-Nematode Interactions. 309-324;
- G. Gheysen, J. T. Jones. (2006). Molecular aspects of plant-nematode interactions.. Plant nematology. 234-254;
- Cynthia A. Gleason, Qingli L. Liu, Valerie M. Williamson. (2008). Silencing a Candidate Nematode Effector Gene Corresponding to the Tomato Resistance Gene Mi-1 Leads to Acquisition of Virulence. MPMI. 21, 576-585;
- Stephen M. Gross, Valerie M. Williamson. (2011). Tm1: A Mutator/Foldback Transposable Element Family in Root-Knot Nematodes. PLoS ONE. 6, e24534;
- Qi Zheng, Vera Putker, Aska Goverse. (2021). Molecular and Cellular Mechanisms Involved in Host-Specific Resistance to Cyst Nematodes in Crops. Front. Plant Sci.. 12;
- Michel Claverie, Elisabeth Dirlewanger, Nathalie Bosselut, Cyril Van Ghelder, Roger Voisin, et. al.. (2011). The Ma Gene for Complete-Spectrum Resistance to Meloidogyne Species in Prunus Is a TNL with a Huge Repeated C-Terminal Post-LRR Region. Plant Physiology. 156, 779-792;
- Zucong Cai, Guangxi Xing, Xiaoyuan Yan, Hua Xu, Haruo Tsuruta, et. al.. (1997). . Plant and Soil. 196, 7-14;
- Henrietta C. E. Rooney, John W. van't Klooster, Renier A. L. van der Hoorn, Matthieu H. A. J. Joosten, Jonathan D. G. Jones, Pierre J. G. M. de Wit. (2005). Cladosporium Avr2 Inhibits Tomato Rcr3 Protease Required for Cf-2 -Dependent Disease Resistance. Science. 308, 1783-1786;
- Kanako Mitsumasu, Yoshiya Seto, Satoko Yoshida. (2015). Apoplastic interactions between plants and plant root intruders. Front. Plant Sci.. 6;
- Jeffery L. Dangl, Jonathan D. G. Jones. (2001). Plant pathogens and integrated defence responses to infection. Nature. 411, 826-833;
- Sergio Molinari. (2011). Natural genetic and induced plant resistance, as a control strategy to plant-parasitic nematodes alternative to pesticides. Plant Cell Rep. 30, 311-323;
- Molinari S. Bioassays on plant-nematode interactions. Science Publisher, Enfield (USA), 1990. Pp. 293–326;
- Molinari S., Abd-Elgawad M.M.M. (2007). Catalase inhibition as a biochemical marker of resistance to root-knot nematodes in tomato. Nematol. Medit. 35, 237–242;
- Marlies Huysmans, Saul Lema A, Nuria S Coll, Moritz K Nowack. (2017). Dying two deaths — programmed cell death regulation in development and disease. Current Opinion in Plant Biology. 35, 37-44;
- Thomason I. J., Rich J., O’Melia F. C. (1976). Pathology and histopathology of P. scribneri infecting snap bean and lima bean. J. Nematol. 8, 347–352;
- Miroslaw Sobczak, Anna Avrova, Justyna Jupowicz, Mark S. Phillips, Karin Ernst, Amar Kumar. (2005). Characterization of Susceptibility and Resistance Responses to Potato Cyst Nematode (Globoderaspp.) Infection of Tomato Lines in the Absence and Presence of the Broad-Spectrum Nematode ResistanceHeroGene. MPMI. 18, 158-168;
- M. Teresa Melillo, Paola Leonetti, Michel Bongiovanni, Philippe Castagnone‐Sereno, Teresa Bleve‐Zacheo. (2006). Modulation of reactive oxygen species activities and H 2 O 2 accumulation during compatible and incompatible tomato–root‐knot nematode interactions. New Phytologist. 170, 501-512;
- M. Jaouannet, M. Magliano, M. J. Arguel, M. Gourgues, E. Evangelisti, et. al.. (2013). The Root-Knot Nematode Calreticulin Mi-CRT Is a Key Effector in Plant Defense Suppression. MPMI. 26, 97-105;
- Shawkat Ali, Maxime Magne, Shiyan Chen, Olivier Côté, Barbara Gerič Stare, et. al.. (2015). Analysis of Putative Apoplastic Effectors from the Nematode, Globodera rostochiensis, and Identification of an Expansin-Like Protein That Can Induce and Suppress Host Defenses. PLoS ONE. 10, e0115042;
- Joanna Kud, Wenjie Wang, Rachel Gross, Youhong Fan, Li Huang, et. al.. (2019). The potato cyst nematode effector RHA1B is a ubiquitin ligase and uses two distinct mechanisms to suppress plant immune signaling. PLoS Pathog. 15, e1007720.