Иммуностимулирующие филаментные бактерии: наконец-то они приручены!
01 апреля 2015
Иммуностимулирующие филаментные бактерии: наконец-то они приручены!
- 2542
- 0
- 3
Ура! Ученые научились культивировать кишечных бактерий, которые умеют «тренировать» иммунные клетки.
Рисунок в полном размере.
рисунок с сайта ria.ru
-
Автор
-
Редакторы
Давным-давно, в 1849 году, американский биолог Джозеф Лейди обнаружил необычных нитевидных бактерий в кишечнике насекомых. Спустя много лет, в 1900-х годах, стало известно, что подобные бактерии обитают в кишечнике позвоночных животных. Не так давно выяснилось, что эти странные микроорганизмы обладают мощными иммуностимулирующими свойствами. В течение 50 лет ученым не удавалось вырастить сегментированных филаментных бактерий in vitro. И только сейчас, в 2015 году, это наконец свершилось!
Сегментированные филаментные (нитчатые) бактерии (СФБ) — особая группа анаэробных спорообразующих бактерий-комменсалов, родственных клостридиям и выделенных в два предполагаемых рода Candidatus Arthromitus и Candidatus Savagella. Эти морфологически уникальные бактерии обнаружены в кишечнике членистоногих, рыб, грызунов и кур. Предполагается, что есть они и у человека. Бактерии эти непростые, обладающие интересными свойствами — как выяснилось, они способны тренировать иммунитет: вызывать сильный иммунный ответ за счет интенсивной стимуляции созревания Т- и В-клеток. Также они провоцируют развитие нормального физиологического воспаления. Колонии этих бактерий способствуют созреванию лимфоидной ткани в слизистой кишечника, вызывают мощный выброс иммуноглобулина А (это один из первых белков, «просыпающихся» в ответ на инфекцию), активируют медиаторы врожденного иммунитета в кишечнике. Кроме того, колонизация этими бактериями оказывает адъювантное (усиливающее) действие на системный иммунный ответ, когда организм борется с какой-либо инфекцией или собственными тканями: у мышей, например, наблюдали обострение течения аутоиммунных энцефаломиелита и артрита. В то же время СФБ защищали мышей, генетически предрасположенных к такому аутоиммунному заболеванию, как сахарный диабет I типа, от развития этой патологии.
Недавний анализ геномов филаментных бактерий мышей и крыс показал, что СФБ являются ауксотрофными организмами, то есть они не способны синтезировать некоторые органические соединения, необходимые для роста и жизнедеятельности [1]. Значит, можно предположить, что часть питательных веществ бактерии получают в результате их взаимодействия с хозяином. Конечно же, ученые сразу задались целью — научиться культивировать этих бактерий вне организма-хозяина, в первую очередь для того, чтобы их было проще изучать. И научились... Правда, с первых попыток прошло полвека!
Культивировали, культивировали и... выкультивировали!
Эффективная методика культивирования СФБ была разработана группой ученых из Франции [2]. Было понятно, что каким-то образом надо «обмануть» клетки бактерий, создать такие условия, чтобы им казалось, что они всё еще тихо-мирно пребывают в хозяйском организме, в привычной для них среде — комфортной и наполненной полезными питательными веществами. Выражаясь научным языком, целью являлось мимикрирование репликативной ниши сегментированных филаментных бактерий.
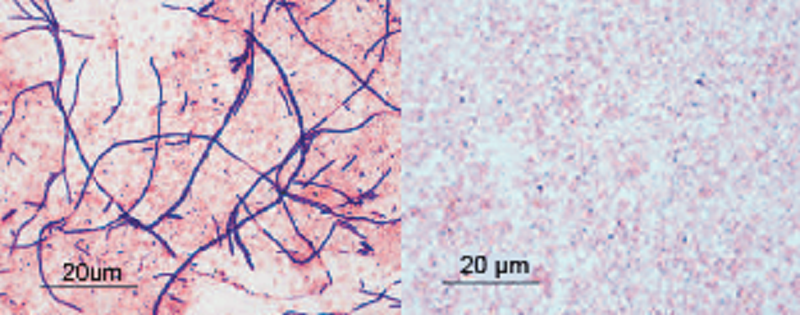
Ученые перепробовали множество хитростей и в конце концов попробовали совместно культивировать клетки бактерий и клетки хозяина. Клетки СФБ, выделенные из мышей, выращивали вместе с эукариотическими клеточными линиями в присутствии низкого, но физиологического уровня кислорода, в богатой среде для культуры тканей, содержащей дополнительные компоненты для лучшего роста бактерий. Конечно, процесс получения «подопытных» был далеко не самым эстетичным (бактерии-то кишечные), но, согласитесь, результат того стоил! Итак, ученые собирали бактерий, фильтруя биоматериал через 100-мкм фильтры, отделяли их от другого содержимого, простите, фекалий с помощью колонки и снова пропускали полученные клетки через 5-мкм фильтр для получения чистой (во всех смыслах этого слова!) культуры одиночных, еще не успевших сегментироваться, бактерий (рис. 1А). Далее комплекс СФБ-эукариотические клетки выращивали в специальной камере, где кислород отсутствовал или присутствовал в незначительных количествах. По истечении четырех дней методами количественной ПЦР и растровой электронной микроскопии (рис. 1Б) оценивался рост филаментных бактерий.
Было показано, что СФБ являются аэротолерантными анаэробами, и их рост положительно коррелирует с количеством (плотностью) клеток хозяина. Предполагается, что клетки хозяина могут выделять некие растворимые факторы, которые способствуют росту филаментных бактерий. Такие добавки, как сердечно-мозговой бульон, смесь дрожжевых, пептонных и казеиновых аминокислот, а особенно препараты железа, тоже оказались критичными для развития СФБ.
А дальше начали интенсивно изучать
Что касается жизненного цикла сегментированных филаментных бактерий, то он был описан еще в 1970 году благодаря просвечивающей электронной микроскопии [3]. Одним из самых интригующих открытий оказалось то, что эти микробы находятся в крайне тесной взаимосвязи с эпителиальными клетками подвздошной кишки хозяина. В процессе своего развития СФБ формируют многоклеточные нити длиной от 50 до 1000 мкм и дифференцируются. Инициаторы формирования филамента — фиксаторные клетки каплевидной формы, необходимые для того, чтобы бактерия могла прицепиться к эпителиальной клетке-хозяину. После фиксации бактерия начинает расти, в ее теле формируются перегородки, а затем образуется внутриклеточное потомство (рис. 2).
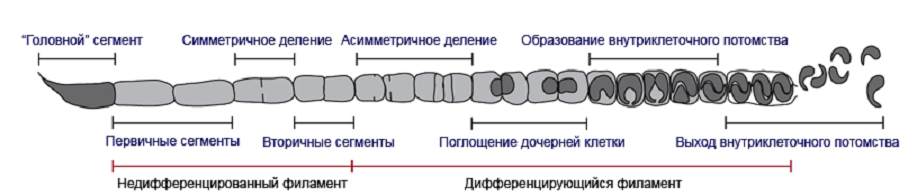
Рисунок 2. Схематическое изображение этапов роста и дифференцировки сегментированных филаментных бактерий. Исходная бактериальная клетка — «головной сегмент» — прикрепляется к эпителиальной клетке кишки с помощью выроста (сосочка). Клетка постепенно удлиняется, образуются поперечные перегородки (септы), разделяющие тело бактерии на первичные сегменты. В определенный момент в направлении от «хвостовых» сегментов к «головному» запускается процесс нового септообразования: первичные сегменты симметрично делятся, образуя вторичные сегменты. Начинается дифференцировка: вторичные сегменты тоже делятся, но уже асимметрично, формируя условно материнскую и дочернюю (меньшую по размеру) клетки. Материнская клетка поглощает дочернюю, которая затем делится надвое. Так формируется внутриклеточное потомство — две клетки с крепежным сосочком, т.е. будущие «головные» сегменты. Они могут прорвать клеточную стенку родительского филамента и «отрастить» новый, прикрепившись к кишке, а могут образовать эндоспору, которая при выходе из ЖКТ хозяина отправится колонизировать других особей.
Следующим шагом значилась проверка искусственно выращенных СФБ на жизнеспособность и инфекционность. Потомство СФБ, полученное in vitro, отделяли от родительских нитей с помощью 5-мкм фильтра и добавляли к новым культурам эукариотических клеток. После этой процедуры число бактериальных клеток росло, а вновь образованные бактериальные нити дифференцировались до стадии формирования внутриклеточного потомства. Это говорило о том, что потомство бактерий, полученных in vitro, вполне жизнеспособно.
Для определения способности к инфицированию СФБ для удобства разделили на два типа — СФБvivo и СФБvitro (естественного (фекального) и лабораторного происхождения соответственно) — и ввели в мышей. Как выяснилось, СФБvitro, в отличие от СФБvivo, значительно хуже колонизировали подвздошную кишку, однако довольно интенсивно росли в слепой кишке. Как и СФБvivo, СФБvitro оказались способны стимулировать В-клетки в Пейеровых бляшках, повышать уровень секреции IgA, а также увеличивать количество Th17-клеток и уровень мРНК IL-17A в тонком кишечнике [2].
Сравнение экспрессионных профилей эпителиальных клеток после колонизации СФБvitro или СФБvivo не выявило различий в ответной реакции на заражение бактериями разного происхождения. Также было показано, что рост СФБ приводит к сильной воспалительной реакции в организме хозяина и индукции таких медиаторов воспаления, как фактор некроза опухоли (ТNF), интерлейкин-1α (IL-1α) и сывороточный амилоидный белок A 1-3 (Saa1-3). Также филаментные бактерии способны индуцировать врожденный иммунный ответ (например, усиливать выработку лактоферрина), формировать среду, благоприятную для привлечения В-клеток, нейтрофилов, дендритных клеток и моноцитов, привлечения и активации Т-клеток.
Итак, каковы же выводы? Теперь в руках ученых имеется мощный инструмент, который можно использовать в благих целях для всего человечества. Во-первых, появилась возможность изучить сегментированные филаментные бактерии детально и открыть их новые удивительные свойства (которых, судя по всему, немало). Во-вторых, уже сейчас ясно, что СФБ — настоящая находка для иммунитета. Разработка лекарств и биодобавок на основе этих бактерий позволит получить новые мощные иммуномодулирующие средства, а это новая золотая жила для фармкомпаний (но хочется надеяться, что это будет помощник для реально нуждающихся в иммуностимуляции пациентов, то есть рецептурный препарат с четким списком показаний). Ну и в-третьих, история французских ученых в целом весьма поучительна — как говорится, не всё то золото, что блестит, а что не блестит, может оказаться и дороже золота: главное помнить, что грязная работа сегодня может привести к блестящим результатам завтра. Ведь всё в ваших руках!
Литература
- Sünje J. Pamp, Eoghan D. Harrington, Stephen R. Quake, David A. Relman, Paul C. Blainey. (2012). Single-cell sequencing provides clues about the host interactions of segmented filamentous bacteria (SFB). Genome Res.. 22, 1107-1119;
- Pamela Schnupf, Valérie Gaboriau-Routhiau, Marine Gros, Robin Friedman, Maryse Moya-Nilges, et. al.. (2015). Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520, 99-103;
- D G Chase, S L Erlandsen. (1976). Evidence for a complex life cycle and endospore formation in the attached, filamentous, segmented bacterium from murine ileum. J Bacteriol. 127, 572-583.