
Как и почему развивается цирроз печени и к каким последствиям это приводит
13 февраля 2026
Как и почему развивается цирроз печени и к каким последствиям это приводит
- 174
- 0
- 1
Рисунок в полном размере.
создано с помощью ИИ
-
Авторы
-
Редакторы
Постер на конкурс «Био/Мол/Текст»: При воздействии различных токсических факторов и нарушениях метаболизма происходит изменение клеточной структуры и, как следствие, архитектоники печени. Исходом этих процессов ставится цирроз печени. Нам предстоит выяснить, как и какие факторы могут привести к поражению клеток печени, как орган адаптируется и изменяется при постоянном воспалительном процессе и что происходит с организмом человека, когда компенсаторные функции печени исчерпаны.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Смотреть постер
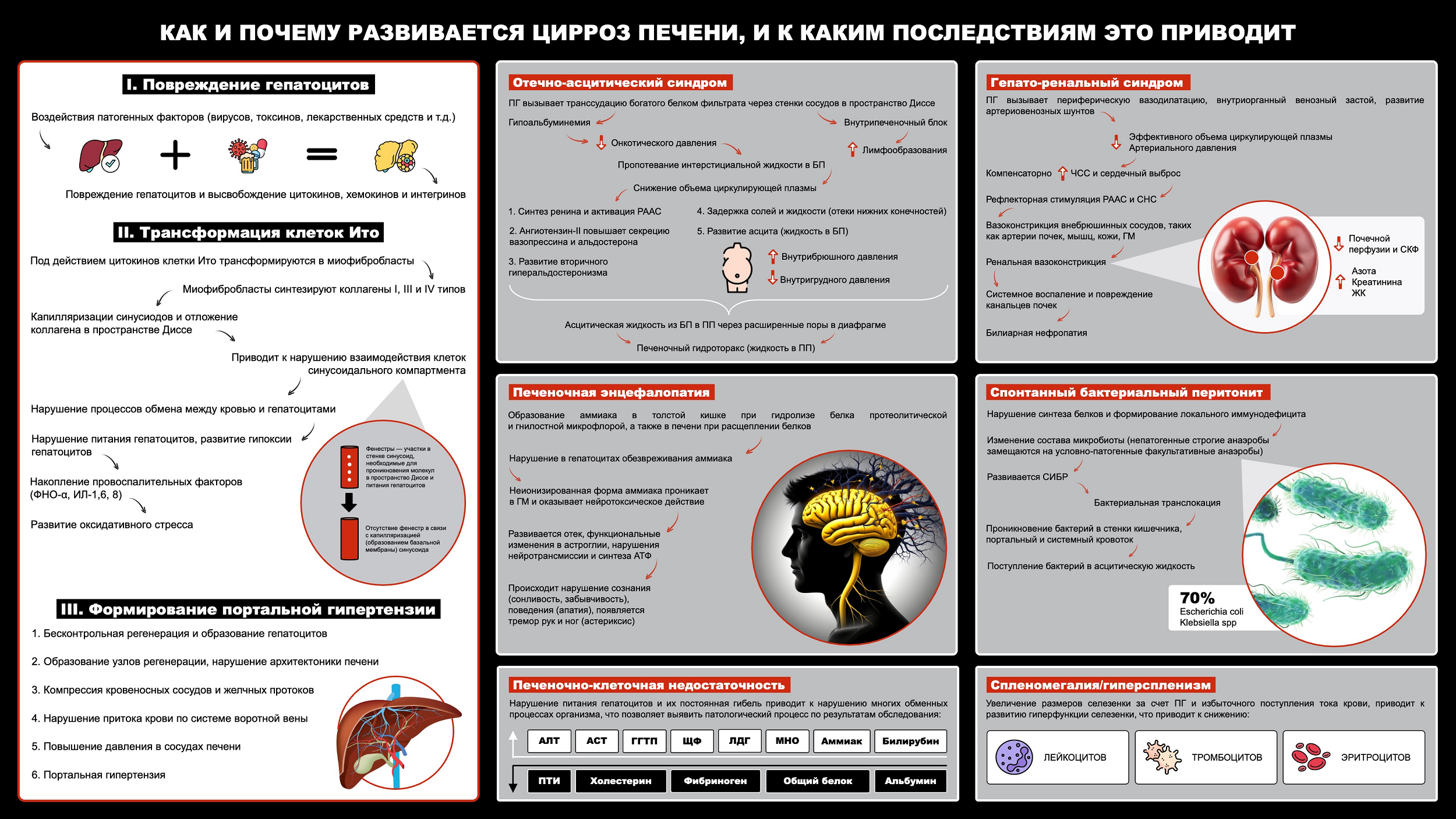
Общий патогенез цирроза печени
Из-за воздействия различных повреждающих факторов, таких как гепатотропные вирусы, токсины, гепатотоксические лекарственные средства и другие, клетки печени могут повреждаться.
Морфофункциональной единицей печени является печеночная долька, имеющая форму многогранной призмы. Дольки друг от друга отграничены тонкой прослойкой соединительной ткани, в которой располагаются печеночные триады (междольковая артерия, вена портальной системы, желчный проток), а также лимфатические сосуды и нервные волокна.
В свою очередь, дольки состоят из гепатоцитов — функционально активных клеток печени, между которыми расположены синусоидные капилляры, радиально сходящиеся к центру дольки. Эти капилляры несут кровь от периферии дольки к ее центру, где кровь поступает в печеночную вену (кавальная система печени). В синусоидах течет смешанная портальная венозная и артериальная кровь.
Само строение синусоида, обеспечивающего кровоснабжение гепатоцитов, уникально тем, что его стенки образованы эндотелиоцитами, не имеющими базальной мембраны. Эндотелиоциты снабжены множественными отверстиями — фенестрами, через которые, как через сито, плазма крови проникает в пространство Диссе. Пространство Диссе, или перисинусоидальное пространство, расположено между стенками синусоидных капилляров и гепатоцитами, где содержатся клетки Ито (звездчатые клетки), которые обеспечивают поддержание гомеостаза печени.
Когда в печени начинается патологический процесс, в результате разрушения гепатоцитов выделяется большое количество цитокинов (фактор некроза опухолей (TNF-α), фактор агрегации тромбоцитов (TGF-β1)), хемокинов и интегринов, под воздействием которых изменяются взаимодействия между клетками синусоидального компартмента: гепатоцитами, эндотелиоцитами, клетками Ито. При этом, подвергаясь воздействию цитокинов, хемокинов и интегринов, клетки Ито способны трансформироваться в миофибробласты. Они синтезируют коллаген типа I, III, IV, из которого состоят фибриллы, фибронектин и другие белки, которые откладываются в пространстве Диссе. За счет увеличения пространства Диссе происходит сдавление расположенных рядом структур.
Прогрессирование синусоидального фиброгенеза приводит к формированию базальной мембраны у эндотелиоцитов («капилляризация синусоидов»), происходит замещение отверстий синусоидальной мембраны, что приводит к нарушению поступления крови к гепатоцитам и нарушению обмена веществ между гепатоцитами и кровью. А нарушение процессов обмена приводит к развитию гипоксии гепатоцитов и вовлечению последних в процесс фиброгенеза.
При этом фиброгенез и процесс регенерации гепатоцитов протекают без должной координации: формируются участки избыточной регенерации печеночных клеток — узлы регенерации, которые нарушают архитектонику печени, сдавливают кровеносные сосуды и желчные протоки. Происходит нарушение поступления крови по системе воротной вены, повышается давление в воротной вене. В клинической медицине данное состояние имеет название «синдрома портальной гипертензии», который обеспечивает ряд клинических и патогенетических синдромов.
Отечно-асцитический синдром
Развитие отечно-асцитического синдрома обусловлено повышением синусоидального гидростатического давления при внутрипеченочной портальной гипертензии и вызывает транссудацию (пропотевание) богатого белком фильтрата через стенки сосудов в пространства Диссе. Снижение альбумина (гипоальбуминемия) развивается на фоне нарушения функции синтеза белка печенью и приводит к снижению онкотического давления, обеспечивающего удержание жидкости в сосудистом русле, что позволяет интерстициальной жидкости пропотевать в брюшную полость.
Как результат, снижается участвующий в циркуляции объем плазмы крови, так как она не задерживается в сосудах, а поступает и накапливается в брюшной полости. Снижение объема циркулирующей плазмы стимулирует синтез ренина в юкста-гломерулярном аппарате почек, что запускает каскад защитных реакций. Для начала активируется ренин-ангиотензин-альдостероновая система (РААС), и ангиотензин-II повышает секрецию вазопрессина и альдостерона, что ведет к задержке воды и натрия. Это приводит к выходу жидкости из кровеносного русла и ее накоплению не только в брюшной полости (асцитическая жидкость), но и в нижних конечностях, из-за чего образуются сильные отеки. Далее развивается печеночный гидроторакс (портоплевральный синдром), который представляет собой пропотевание через расширенные поры диафрагмы жидкости в плевральные полости у пациентов, не имеющих патологии сердца или легких.
Спонтанный бактериальный перитонит
Грозным осложнением асцита считается спонтанный бактериальный перитонит. Для начала развивается СИБР: в кишечнике непатогенные строгие анаэробы замещаются на условно-патогенные факультативные анаэробы. Так как факультативные анаэробы, в отличие от строгих анаэробов, способны выживать в оксигенированных тканях, при снижении барьерной функции кишечника, наблюдаемой при ЦП, эти микроорганизмы могут проникать распространяться куда не следует. Увеличение количества факультативных анаэробов в тонкой кишке при СИБР предрасполагает к их проникновению во внутреннюю среду организма, что называется бактериальной транслокацией, когда бактерии проникают в асцитическую жидкость, стенку кишечника, мезентериальные лимфатические узлы, портальный и системный кровоток.
Гепаторенальный синдром
На начальных этапах недостаток эффективного объема крови компенсируется увеличением сердечного выброса и частоты сердечных сокращений (ЧСС), однако в дальнейшем гипердинамический тип кровообращения оказывается уже не в состоянии поддерживать артериальное давление (АД) на нормальном уровне. Тогда рефлекторная стимуляция ренин-ангиотензин-альдостероновой системы (РААС) и симпатической нервной систем (СНС) обеспечивает повышение АД до нормальных величин. Однако, поскольку артерии брюшной полости становятся резистентными к действию ангиотензина II, норадреналина и вазопрессина для поддержания АД на нормальном уровне, организму вскоре требуется увеличить объем крови. В связи с этим происходит вазоконстрикция (сужение) внебрюшинных сосудов, таких как артерии почек, кожи и головного мозга. В свою очередь, ренальная (почечная) вазоконстрикция приводит к снижению почечной перфузии и скорости клубочковой фильтрации (СКФ), то есть замедляется скорость фильтрации почками, что приводит к накоплению токсических веществ, которые должны быть ими утилизированы. Как итог, развивается азотемия, нарастает уровень сывороточного креатинина и развивается повреждение почек, что является основным симптомом ГРС.
Спленомегалия и гиперспленизм
В связи с развитием ПГ осложняется поступление крови в систему портальной вены, поэтому кровь распределяется по портоковальным анастомозам. К ним относятся вены пищевода, вены передней брюшной стенки, селезеночная вена и вены прямой кишки. При избыточном поступлении крови к селезенке происходит ее увеличение (спленомегалия) и развитие гиперфункции (гиперспленизм). Это приводит к гемолизу (разрушению) форменных элементов крови, таких как эритроциты, лейкоциты и тромбоциты. Что, в свою очередь, приводит к развитию анемии, обусловленной гемолизом эритроцитов, к повышенному риску бактериальной инфекции и склонности к кровотечениям.
Печеночная энцефалопатия
Это нарушение работы головного мозга, обусловленное накоплением токсических веществ, которые образуются в результате нарушения детоксикационной функции печени при ее поражении. Точнее, возникновение печеночной энцефалопатии обусловлено нарушением обезвреживания аммиака гепатоцитами. Аммиак образуется в толстой кишке при гидролизе белка протеолитической и гнилостной микрофлорой, а также в печени — при расщеплении белков. Затем аммиак проникает в головной мозг и оказывает нейротоксическое действие, вызывая отек, функциональные изменения в астроглии (клетках головного мозга), нарушения нейротрансмиссии и синтеза АТФ.
Печеночно-клеточная недостаточность
Развивается при разрушении клеток печени и высвобождении ряда ферментов, которые можно обнаружить лабораторно. На сегодняшний день в медицине активно используется ряд методов диагностики, которые позволяет определить степень тяжести и объем повреждения. Однако интерпретацию результатов лабораторных исследований проводит только врач.
Литература
- Ермолова Т. В., Ермолов С. Ю., Сологуб Т. В., Карев В. Е., Добкес А. Л. (2018). Некоторые механизмы нарушений внутрипеченочной микроциркуляции при хронических заболеваниях печени на начальных стадиях фиброза и их коррекция. Экспериментальная и клиническая гастроэнтерология. 150, 183–191;
- Ивашкин В.Т., Маевская М.В., Жаркова М.С., Жигалова С.Б., Киценко Е.А., Манукьян Г.В., Трухманов А.С., Маев И.В., Тихонов И.Н., Деева Т.А. (2021). Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по диагностике и лечению фиброза и цирроза печени и их осложнений. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 31, 56–102;
- Cornelius Engelmann, Joan Clària, Gyongyi Szabo, Jaume Bosch, Mauro Bernardi. (2021). Pathophysiology of decompensated cirrhosis: Portal hypertension, circulatory dysfunction, inflammation, metabolism and mitochondrial dysfunction. Journal of Hepatology. 75, S49-S66;
- Kapil Gupta, Abhishek Bhurwal, Cindy Law, Scott Ventre, Carlos D Minacapelli, et. al.. (2021). Acute kidney injury and hepatorenal syndrome in cirrhosis. WJG. 27, 3984-4003;
- Adrià Juanola, Elisa Pose, Pere Ginès. (2025). Cirrosis hepática: enfermedad antigua, reto nuevo. Medicina Clínica. 164, 238-246;
- Shuyu Liu, Xilan Yang. (2023). Intestinal flora plays a role in the progression of hepatitis-cirrhosis-liver cancer. Front. Cell. Infect. Microbiol.. 13;
- Helbert Rondon-Berrios, Juan Carlos Q. Velez. (2022). Hyponatremia in Cirrhosis. Clinics in Liver Disease. 26, 149-164.







