
Как нонсенс-мутации ген обижали, и что потом было
13 ноября 2018
Как нонсенс-мутации ген обижали, и что потом было
- 2584
- 0
- 7
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Мутации часто появляются совсем некстати и обижают гены живых организмов, ухудшая им жизнь. К счастью, организмы научились с ними справляться благодаря огромной помощи естественного отбора и некоторых молекулярных механизмов. Но что же произойдет, если ген обидит самая вредная и коварная из мелких мутаций — нонсенс-мутация? И сумеет ли ген найти способ, чтобы перехитрить ее?
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В генах живых организмов постоянно происходят мутации. Чаще всего они связаны с ошибками, происходящими во время репликации, то есть удвоения ДНК, которое необходимо при делении клетки, и с ошибками при восстановлении повреждений ДНК, которые могут появиться по разнообразным причинам. Почти всегда они чинятся, но все же остаются случаи, когда вся молекулярная машинерия бессильна, и ошибка остается неисправленной. Тогда возникает мутация. Она может быть и в кодирующей, и в некодирующей частях генома, но давайте сосредоточим свое внимание только на первой, то есть на белок-кодирующих генах. Вдобавок, будем рассматривать только точечные мутации, которые заменяют лишь один нуклеотид.
Многие люди заведомо считают, что мутации всегда приносят только вред. На самом деле это верно, но не полностью. Есть «молчащие», или синонимичные мутации, которые не меняют кодируемую аминокислоту. Например, CGT, CGC, CGA, CGG кодируют аргинин и любая замена в третьей позиции кодона им не страшна. Такие мутации вреда не приносят. Другие мутации называются несинонимичными и меняют аминокислоту. Крайний, и как считается, самый вредный их вариант — нонсенс-мутация. О ней мы и будем говорить.
Но нужно начать с рассказа о самой сути нонсенс-мутаций. В начале транслируемой части каждого гена есть старт-кодон ATG (однако когда он расположен не в начале, то кодирует аминокислоту метионин), а в конце — стоп-кодон (один из трех: TAA, TAG или TGA), и для рибосомы они, словно дорожная разметка, обозначают откуда нужно начать синтезировать белок, а где — завершить. Поэтому синтез белка, трансляция, идет от старт-кодона до стоп-кодона. Но если из-за мутации любой кодон между настоящим стартом и стоп-кодоном превратится в стоп-кодон, то трансляция будет заканчиваться именно на этом, преждевременном стоп-кодоне. Так он и называется, «преждевременный стоп-кодон», или уже знакомым нам термином «нонсенс-мутация». По ее достижении трансляция обрывается и получается не хороший рабочий белок, а нефункциональный полипептид. Эффект от этого может и не проявиться в фенотипе, то есть не изменить никакой признак организма. Например, если организм по данному гену гетерозигота и одной функциональной копии гена для него достаточно. Но в некоторых случаях, в том числе если обе копии несут нонсенс-мутацию, или организм гаплоидный (второй копии гена у него попросту нет), или ген важный, то эффект виден невооруженным глазом.
В структуре белок-кодирующего гена можно выделить экзоны и интроны. Такое подразделение касается только ядерных организмов, а так как мы в статье говорим именно о них, то не станем обсуждать другие варианты строения гена. Информация о белке закодирована только в экзонах. Бывают гены, которые состоят всего из одного экзона, их меньшинство. А бывают гены, состоящие из нескольких десятков экзонов, которые при этом могут в разных сочетаниях давать разные белки — это называется «альтернативный сплайсинг». Например, если есть 5 экзонов [A, B, C, D, E], то они могут давать разные изоформы: и [A, B, C, D, E], и [A, B, C], и [B, C, E], и [A, C, D]. Таким образом достигается большое количество отличающихся по функциям белков, кодируемых одним геном.

Давно известно, что в геномах организмов присутствуют псевдогены — это участки, которые раньше были генами, но из-за мутации перестали таковыми быть и не кодируют функционирующий рабочий белок. Их еще называют мусорной ДНК [1]. Причиной может быть любая мутация — от однонуклеотидной, приводящей, например, к несинонимичной или нонсенс-мутации, до большой делеции, то есть удаления почти всего гена, или вставки в него транспозона, превращающего ген в псевдоген. В случае однонуклеотидной мутации или небольших делеции или инсерции можно посмотреть, как этот псевдоген появился и что с ним происходит. Нередко выяснялось, что после поломки ген начинал накапливать несинонимичные и синонимичные мутации с одинаковой скоростью. Это явление называется нейтральной эволюцией. Правда, по результатам было заметно, что в некоторых случаях из-за молодого возраста в псевдогене вообще не произошло никаких мутаций. А порой бывший ген просто не получалось найти, потому что он «старый» и сильно мутировал. Ученые описали нейтральную эволюцию для отдельных случаев, например, для семейств альфа- и бета-глобиновых генов [2], [3] или псевдогенов обонятельных рецепторов [4]. Но насколько наблюдаемое явление распространяется на все псевдогены, известно не было.
Ничто так не подстегивает ученых сделать обобщающее исследование, как противоречивость имеющейся информации. Разумеется, существует немало статей, в которых нонсенс-мутацию в гене ассоциировали с причиной развития заболевания [5], [6]. И стоит ожидать, что после такой поломки ген станет настоящим псевдогеном и начнет эволюционировать нейтрально. С другой стороны, есть статьи [7], в которых указывают на преимущество, получаемое организмом благодаря нонсенс-мутации. Выходит, здесь нонсенс-мутация благоприятна, и такой аллель не станет превращаться в псевдоген. А для некоторых генов вообще показали, что они — псевдо-псевдогены! [8] В них происходит редкое явление «чтение сквозь стоп-кодон», когда трансляция не обрывается, а продолжается дальше до настоящего стоп-кодона, и ген остается функциональным. Но это все же нечастое событие, и псевдогены в большинстве своем функций не несут.
Здесь мы, наконец, добрались до великой силы эволюции — естественного отбора. Он как раз и является силой, которая помогает генам не превратиться в бессмысленные бесполезные последовательности. Отбор очищает популяцию от вредных замен, в том числе и от интересных нам нонсенс-мутаций. Под столь возвышенной фразой имеется в виду лишь то, что особи с вредными мутациями либо не появляются на свет, потому что нежизнеспособны, либо не дают потомство. По очевидным причинам ген с «плохой» мутацией ну никак не может распространиться в популяции и удаляется из нее отбором.
В функционально важных генах естественный отбор поддерживает консервативность, потому как от их правильной работы зависит жизнь организма. И в них синонимичных мутаций накапливается намного больше, чем несинонимичных. В таких случаях говорят, что на ген действует отрицательный отбор, который как раз убирает несинонимичные замены. Повторю, многих генов с бóльшим числом несинонимичных мутаций мы не видим, потому как особи с ними не могут жить, либо не оставляют потомства. С другой стороны, есть меньшее число генов, в которых число несинонимичных замен больше числа синонимичных. Это указывает на работу положительного отбора, то есть наоборот хорошо, что ген сильно мутирует и аминокислоты в нем меняются. Например, так обстоит дело с генами главного комплекса гистосовместимости [9–11]. Третий вариант — равное соотношение синонимичных и несинонимичных замен. Это знак того, что отбору все равно, что происходит с геном, и он уже не ген вовсе, а псевдоген.
Зная о видах отбора и задумываясь о том, насколько противоречивы знания ученого мира о псевдогенах, мы решили установить порядок и понять, что же все-таки с ними происходит. И выбрали для этого модельный объект эволюционных биологов и генетиков — плодовую мушку Drosophila melanogaster. Поскольку она любимый объект биологов, о ней есть достаточно подходящей нам информации (что, на самом деле, даже в эпоху Больших данных иногда становится огромной проблемой и может заставить отложить исследование на некоторый срок). Поэтому решено было взять самый большой набор данных для одной замбийской популяции. Мы решили изучить случаи, когда стоп-кодон возникает из-за однонуклеотидной мутации. Скажем, был нормальный глутаминовый триплет CAA, а стал стоп-кодон TAA.
Чтобы узнать, что происходит с геном после появления нонсенс-мутации, мы решили посмотреть на силу естественного отбора в нем — на отношение несинонимичных замен к синонимичным, по-научному оно называется pN/pS. Здесь логика простая — если это значение будет равно 1, то мы наблюдаем искомую нейтральную эволюцию, и перед нами яркий пример псевдогенизации гена. А вот если оно будет ниже 1, то мы уже начинаем наблюдать отрицательный отбор, при котором несинонимичным мутациям не позволяется копиться с той же скоростью, что и синонимичным. А так как нас интересовало то, что происходит с геном после появления нонсенс-мутации, мы учитывали только те замены, которые появились именно после. Здесь слово «после» означает временные масштабы и указывает на то, что произошло с геном «потом». Это проще объяснить, глядя на рисунок ниже и объяснение в подписи к нему.
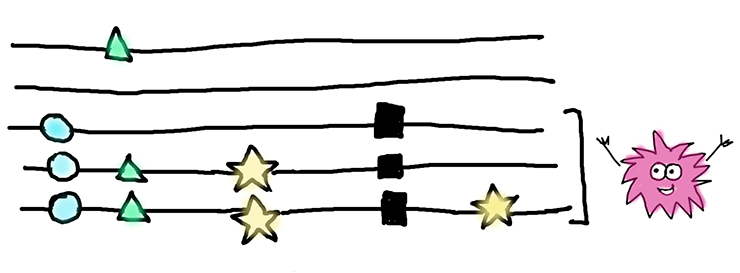
Перед нами — выравнивание для пяти последовательностей, или аллелей, одного гена. Черными квадратами отмечены нонсенс-мутации. Для нашей статистики интересны только замены, изображенные звездочками — именно они произошли после того, как в этих аллелях появилась нонсенс-мутация. Замены, изображенные кругами и треугольниками, скорее всего, произошли до нонсенс-мутации, и мы их в расчет не брали. Те, которые отмечены кругами встречаются во всех последовательностях, несущих нонсенс-мутацию, и, вероятнее всего, присутствовали в гене еще до нее. А мутации, обозначенные треугольниками, есть и у одной «здоровой» последовательности — они явно появились намного раньше нонсенса.
Казалось бы, у нас все есть — и данные, и статистика, которая поможет в подсчетах. Поэтому не терпится скорее приступить к анализу и получить ответ на терзающий душу ученого вопрос! И все же перед тем как брать все имеющиеся у нас нонсенс-аллели, то есть варианты гена с нонсенс-мутациями, и смотреть на замены внутри них, нужно эти аллели отфильтровать. Такой шаг может показаться странным, ведь нонсенс-аллелей и так мало (потому что они вредны и изымаются отрицательным отбором), куда еще фильтры использовать?! Но для того чтобы получить разумный результат, мы должны понимать, что работаем действительно с настоящими псевдогенами. Для генов, как мы уже обсудили, вообще-то нехорошо становиться псевдогенами. Поэтому все вредные мутации должны быть очень редкими в популяции, то есть, говоря научным языком, находиться на низкой частоте. А если мы видим потенциально вредную мутацию, но она присутствует у многих, то это говорит о том, что она безвредна, и организмам, у которых она есть, преспокойно живется. Иначе отрицательный отбор не позволил бы такой мутации добраться до высоких частот. Исходя из этого, в нашем исследовании мы брали во внимание только те нонсенс-мутации, которые встречались у небольшого количества мух, то есть были низкочастотными.
И, конечно, не нужно брать в расчет те нонсенс-мутации, которые расположены в самом начале и самом конце гена. Для расположенных в самом начале легко может оказаться так, что следующий за нонсенс-мутацией кодон будет метионином и сможет использоваться как альтернативный старт, а белок никакого вреда от этого не понесет. С расположением нонсенс-мутации в конце гена все еще проще — часто она находится в неважной для функции белка части и поэтому никакой роли не играет. Кстати, это не наше предположение: действительно, с большой частотой нонсенс-мутации предпочитают находиться в конце гена (это показывали во многих работах и на приматах, и на человеке, и мы — на плодовых мушках). Здесь внимательный читатель может возмутиться: «Что значит “предпочитают”? Они же не живые!». Все так, мы говорим «предпочитают», имея в виду, что нонсенс-мутаций там особенно много. Но это говорит лишь о том, что, находясь там, вреда они никакого не приносят, и поэтому не изымаются из популяции под действием отрицательного отбора.
И когда мы, наконец, отфильтровали ненужное и оставили только те гены, в которых нонсенс-мутация точно влияет на белок, то оказалось, что они действительно превратились в псевдогены и эволюционируют нейтрально [12]. Об этом нам рассказало соотношение pN/pS, которое равнялось 1, то есть несинонимичные замены накапливались с той же скоростью, что и синонимичные. Но ведь всегда хочется найти что-то интересное и неожиданное! И хоть у нас было совсем немного генов, мы решились и поделили их на две категории (к слову, больше мы выборку не подразделяли и глобальные выводы по двум–трем генам сделать не пытались). В первой категории были гены, которые состоят из одного экзона. Разумно, что если в них появился преждевременный стоп-кодон, то они должны сразу же превратиться в псевдоген. Так и оказалось. Чуть другой результат мы получили для генов из второй категории — для многоэкзонных генов. Мы заметили, что соотношение pN/pS в них меньше 1. Но в чем может быть причина? Во-первых, они длиннее одноэкзонных, а во-вторых, у них возможен альтернативный сплайсинг, с которым мы познакомились ранее. Поэтому некоторый экзон может присутствовать лишь в части изоформ. И, подсчитав pN/pS отдельно для экзона с нонсенс-мутацией и экзонов без нее, мы получили такой результат, о котором даже не мечтали!
Экзон, в котором появился преждевременный стоп-кодон, полностью ломался и начинал эволюционировать нейтрально. Его такая мутация «обижала», как и в случае одноэкзонного гена. А вот другие экзоны нонсенс-мутация, по-видимому, не затрагивала. Соотношение pN/pS в них было меньше 1, то есть мы наблюдаем воздействие на них отрицательного отбора, а вовсе не нейтральную эволюцию.
Вероятной причиной может быть рекомбинация, которая «разделяет» и «перемешивает» фрагменты генома. Поэтому даже если нонсенс-мутация «поразила» весь ген и другие экзоны тоже начали эволюционировать нейтрально, мы этого не увидим, потому что рекомбинация «принесла» эти самые другие экзоны из геномов мух без нонсенс-мутации. А у них они находятся под отрицательным отбором! Подробнее это изображено на рисунке ниже и разъяснено в подписи к нему.
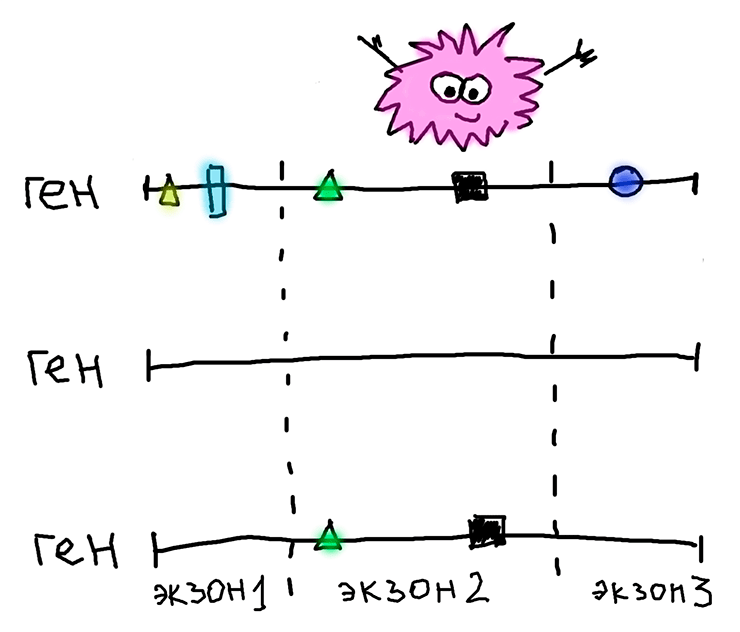
Три варианта одного и того же многоэкзонного гена, принадлежащие трем разным мухам. Первый (вверху) — ген, в котором после появления нонсенс-мутации «сломались» все экзоны, он целиком стал псевдогеном и начал эволюционировать нейтрально (накопившиеся замены изображены геометрическими фигурами). Второй (посередине) — тот же ген, но без нонсенс-мутации, то есть кодирующий нормальный функциональный белок. Никаких замен в нем нет. Третий (нижний) — результат, который получился после рекомбинации между геномами первой и второй мух. Накопившиеся замены остались только в пораженном нонсенс-мутацией экзоне, а экзон 1 и экзон 3 были «принесены» от «здоровой» мухи (средний вариант на рисунке) без такой вредной мутации. Поэтому, из-за рекомбинации, мы и можем наблюдать отрицательный отбор, который на самом деле воздействовал на геном «здоровой» мухи, а у мухи с нонсенс-мутацией его и в помине нет.
Другая сила, которая может быть причастна к такому эффекту, — альтернативный сплайсинг, из-за которого у гена могут быть разные изоформы: и с экзоном с вредной нонсенс-мутацией, и без него. Получается, что другие, не имеющие «сломанного» экзона изоформы, могут спокойно функционировать, и с них получается нормальный работающий белок. И на такие варианты гена будет воздействовать отрицательный отбор.
Здесь внимательный читатель может поинтересоваться, откуда же возникают изоформы с экзонами, расположенными после нонсенс-мутации, если такая мутация, скорее всего, останавливает транскрипцию? Все дело кроется именно в ней. В геномах живых организмов транскрипция может проходить и с кодирующих, и с некодирующих участков ДНК. Она совсем неизбирательна, поэтому нельзя говорить о том, что она остановится именно на нонсенс-мутации. Исходя из этого, ученый мир считает, что такие мутации не влияют на транскрипцию, и полученная в результате пре-мРНК полноценна. Поэтому в результате сплайсинга могут появляться изоформы, включающие в себя экзоны, расположенные после экзона с нонсенс-мутацией.
Кстати, а когда мы взяли данные транскриптомов для плодовых мушек D. melanogaster, то стало видно, что изоформы, включающие в свой состав экзоны с нонсенс-мутациями, редко используются. Что видится логичным, ведь если бы эти вредные нонсенс-мутации были в часто используемых экзонах, то мы скорее всего такого организма не увидели — он просто не смог бы существовать. А в редко используемых вариантах гена нонсенс-мутации, видимо, не так губительны.
Сложно точно сказать, что же именно является причиной того, что мы видим отбор в других экзонах, — рекомбинация или сплайсинг, но результат однозначно интересный!

Таким образом, в своей статье [12] мы свели вместе разрозненные знания об эволюции генов, которые становятся псевдогенами из-за вредной и хитрой нонсенс-мутации. Она и вправду их обижает, но оказалось, что многоэкзонные гены ловко с ней справляются, исключая из использования пораженный экзон. В таких псевдогенах (и баловливых нонсенс-мутациях) скрыто еще немало интересного для изучения, и мы активно продолжаем их исследовать!
Литература
- Сколько сора в нашей ДНК;
- Nicholas J. Proudfoot, Tom Maniatis. (1980). The structure of a human α-globin pseudogene and its relationship to α-globin gene duplication. Cell. 21, 537-544;
- Stephen Harris, Paul A. Barrie, Mark L. Weiss, Alec J. Jeffreys. (1984). The primate ψβ1 gene. Journal of Molecular Biology. 180, 785-801;
- Yoshihito Niimura, Atsushi Matsui, Kazushige Touhara. (2014). Extreme expansion of the olfactory receptor gene repertoire in African elephants and evolutionary dynamics of orthologous gene groups in 13 placental mammals. Genome Res.. 24, 1485-1496;
- Mathula Thangarajh, Gary L. Elfring, Panayiota Trifillis, Joseph McIntosh, Stuart W. Peltz, on behalf of the Ataluren Phase 2b Study Group. (2018). The relationship between deficit in digit span and genotype in nonsense mutation Duchenne muscular dystrophy. Neurology. 91, e1215-e1219;
- Rita Guerreiro, José Brás, Aleksandra Wojtas, Rosa Rademakers, John Hardy, Neill Graff-Radford. (2014). A nonsense mutation in PRNP associated with clinical Alzheimer's disease. Neurobiology of Aging. 35, 2656.e13-2656.e16;
- Bryndis Yngvadottir, Yali Xue, Steve Searle, Sarah Hunt, Marcos Delgado, et. al.. (2009). A Genome-wide Survey of the Prevalence and Evolutionary Forces Acting on Human Nonsense SNPs. The American Journal of Human Genetics. 84, 224-234;
- Lucia L. Prieto-Godino, Raphael Rytz, Benoîte Bargeton, Liliane Abuin, J. Roman Arguello, et. al.. (2016). Olfactory receptor pseudo-pseudogenes. Nature. 539, 93-97;
- Краткая история открытия и применения антител;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Maciej Jan Ejsmond, Jacek Radwan. (2015). Red Queen Processes Drive Positive Selection on Major Histocompatibility Complex (MHC) Genes. PLoS Comput Biol. 11, e1004627;
- Nadezhda A Potapova, Maria A Andrianova, Georgii A Bazykin, Alexey S Kondrashov. (2018). Are Nonsense Alleles of Drosophila melanogaster Genes under Any Selection?. Genome Biology and Evolution. 10, 1012-1018.






