
Как преодолеть PARIS с помощью тРНК
02 июня 2025
Как преодолеть PARIS с помощью тРНК
- 327
- 0
- 2
Авторы нового исследования, опубликованного в Nature, детально изучили еще одну противовирусную бактериальную систему — PARIS, а также разобрались, как вирусы могут ей противостоять.
-
Автор
-
Редакторы
За последние годы описаны не только многочисленные противовирусные защитные системы бактерий, но и пути противодействия вирусов этим системам. Авторы недавней работы, опубликованной в Nature, детально описали механизм действия бактериальной защитной системы PARIS. Кроме того, они выявили и охарактеризовали способ, с помощью которого вирусы могут уклоняться от действия PARIS — а именно, благодаря наличию собственных вариантов молекул тРНК.
«Гонка вооружений» бактерий и архей и заражающих их вирусов идет много миллиардов лет и, похоже, вовсе не думает заканчиваться. Ученые постоянно описывают не только все новые и новые защитные системы прокариот, но и механизмы, которые позволяют вирусам нейтрализовать оборону. Международная команда исследователей недавно разгадала, как вирусы могут обходить защитную бактериальную систему, известную как PARIS. Результаты исследования опубликованы в Nature [2].
Гены, кодирующие компоненты защитных систем бактерий и архей, проявляют тенденцию к колокализации в геноме и, кроме того, нередко локализуются внутри мобильных элементов, в том числе профагов и вирусов-сателлитов. Компоненты системы PARIS (от Phage Anti-Restriction Induced System), в частности, были обнаружены в сателлитах фага P2, которые внедрились в геном E. coli. Основной принцип работы PARIS, фундаментально отличающий эту систему от тех же систем CRISPR, — обнаружение чужеродных белков, а не вирусных нуклеотидных последовательностей. Так, у кишечной палочки E. coli PARIS выявляет фаг T7 по белку Ocr, который подавляет две защитные системы — систему рестрикции-модификации и систему BREX [2]. Таким образом, PARIS можно считать «второй линией обороны» — системой, которая научилась специфически распознавать фагов, уже вооруженных анти-рестрикционными белками, — красивая иллюстрация концепции гонки вооружений.
В состав системы PARIS входят два белка — AriA и AriB. AriA относится к группе ABC АТФаз, а функции AriB однозначно не были определены, хотя он содержит нуклеазный домен TOPRIM. Что интересно, такая архитектура крайне популярна среди бактерий, и ABC- и TOPRIM-домены встречаются еще в десятке других иммунных систем прокариот. Но как вообще устроен PARIS? Авторы исследования предположили, что AriA и AriB формируют комплекс — сенсор вирусной инфекции, и не ошиблись: совместная преципитация AriA и AriB и последующий анализ выделенного комплекса показали, что белки действительно образуют крупный олигомер массой 430 кДа. Для детального описания его структуры ученые воспользовались криоэлектронной микроскопией и показали, что в состав комплекса входит шесть молекул AriA и три субъединицы AriB (рис. 1) [2].
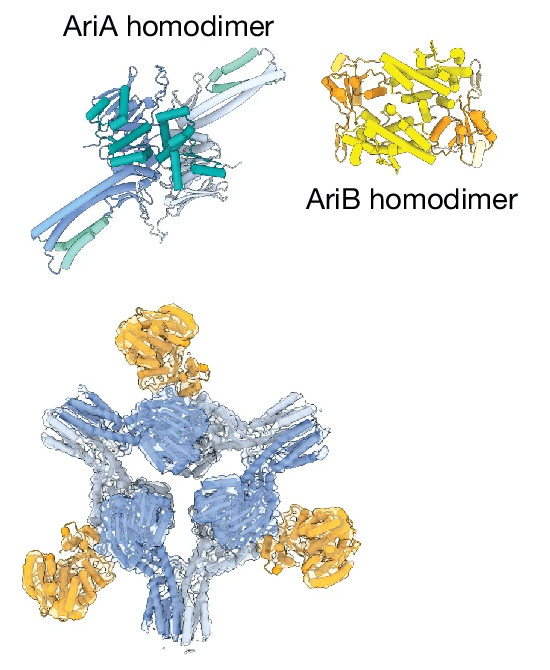
Рисунок 1. Гомодимер AriA, гомодимер AriB и общий вид комплекса. AriA собираются в димеры, которые затем тримеризуются, образуя что-то вроде трех лопастей пропеллера. Субъединицы AriB присоединяются к AriA рядом с сайтами связывания АТФ на AriA. Димер AriA устроен по типу «голова к хвосту», а AriB присоединяются к комплексу, связываясь с AriA прямо поверх области, где два мономера AriA взаимодействуют друг с другом. В этом же месте (на границе двух мономеров AriA) располагаются два нуклеотид-связывающих домена, в которых и происходит гидролиз АТФ. Было также показано, что взаимодействие между AriA и AriB критически необходимо для работы защитной системы: при нарушении этого взаимодействия PARIS перестает работать.
Из предыдущих исследований известно, что систему PARIS может активировать антирестрикционный белок Ocr фага T7, в результате чего бактериальная клетка либо погибает, либо переходит в покоящееся состояние. Но какой из компонентов PARIS взаимодействует с Ocr, ясно не было. Чтобы ответить на этот вопрос, авторы исследования одновременно экспрессировали в бактериальных клетках AriA, нефункциональную форму AriB с мутацией в активном центре и модифицированный Ocr, за который в случае его взаимодействия с другим белком можно «вытащить» весь белковый комплекс. Оказалось, что Ocr взаимодействует с гексамером AriA; при этом, как было показано далее, AriB покидает комплекс [2].
Если сенсором вирусных белков является AriA, то какова функция AriB? Было показано, что сам по себе AriB при экспрессии в отсутствие AriA противовирусную защиту не дает и проявляет лишь умеренную токсичность. Гораздо токсичнее димерная форма AriB, которая освобождается после того, как AriA узнал белок-триггер. Кроме того, мутации в AriA, делающие его неспособным к взаимодействию с AriB, сводят на нет и противовирусные свойства PARIS. Авторы работы заключают, что для функционирования AriB критически необходимо его первоначальное взаимодействие с AriA; это достаточно необычно и отличает PARIS от классических систем, работающих по принципу токсин-антитоксин [2].
Оставалось выяснить, как именно активированный AriB приводит к клеточной гибели. Подойти к этой проблеме удалось с неожиданной стороны: если посмотреть на клетки после активации PARIS в микроскоп, то обнаружится, что у них сильно компактизуется нуклеоид, а такой фенотип характерен для клеток, у которых остановлена трансляция [3]. Чтобы оценить, действительно ли при работе PARIS подавляется трансляция, ученые оценивали скорость синтеза белка по поглощению 3H-меченного метионина. При активной PARIS поглощение 3H-меченного метионина снижается, а поглощение 3H-меченного тимидина немного повышается. Эта картина в целом характерна для ингибирования трансляции: синтез белка останавливается, а гены рРНК транскрибируются. Авторы заключают, что действие PARIS in vivo обусловлено подавлением трансляции, но при этом у нуклеазного TOPRIM домена AriB может быть много мишеней: мРНК, рРНК или тРНК [2].
Противоборство бактерий и вирусов нельзя было бы назвать гонкой вооружений, если бы вирусы не изобретали всё новые и новые пути для противодействия бактериальным защитным системам: например, уже упоминавшийся Ocr направлен против систем рестрикции-модификации. Вот и фаг T5 обладает способностью противостоять PARIS. Авторы работы предположили, что тут замешаны собственные вирусные тРНК, которых у T5 целых 23. Для подтверждения своей гипотезы ученые проверяли делеционные мутанты T5 на чувствительность к PARIS. В то время как фаг с полноценным геномом устойчив к PARIS, был найден мутант с маленькой делецией в области генов тРНК, который приобретал чувствительность к PARIS. Тот фрагмент генома, который этот фаг утратил, исследователи разделили на три части, которые были вставлены в плазмиды и внедрены в бактериальные клетки с активной системой PARIS. Выяснилось, что возвращение делеционному мутанту гена лизиновой тРНК давало полную устойчивость к PARIS при условии ее повышенной экспрессии.
Таким образом, именно лизиновая тРНК защищает фаг T5 от PARIS [2]. Однако у фага с делецией лизиновой тРНК оставалась еще много других генов тРНК, и нельзя было исключать их роль в борьбе с PARIS-опосредованным иммунитетом. Уже в ходе дальнейшей работы при помощи РНК-секвенирования авторы смогли установить, что PARIS атакует целую серию молекул тРНК (лизиновую, треониновую и аспарагиновую), и фаг Т5 вооружен полным набором собственных вариантов этих тРНК. Они помогают ему спасти клетку лишь для того, чтобы вскоре самому ее убить [4]. Эта работа впервые показала новую неожиданную функцию для молекул тРНК в качестве ингибиторов иммунного ответа и ответила на вопрос, зачем в принципе вирусы часто кодируют собственные гены тРНК.
Оставалось напрямую показать, что нуклеазная функция AriB специфична к клеточной тРНК. Анализируя РНК, выделенную из клеток с активной PARIS и экспрессирующих лизиновую тРНК фага T5, ученые пришли к выводу, что AriB разрушает клеточные тРНК, а лизиновую тРНК фага не трогает. Дело в том, что AriB распознает антикодоновую шпильку в тРНК, а лизиновая тРНК фага несет в этой области мутации, которые делают невозможным ее распознавание AriB. Таким образом, мишени AriB у фага могут быть модифицированы, что обеспечивает ему защиту от PARIS [2].
Наконец, авторы исследования обратили внимание на разнообразие систем PARIS и их возможную связь с другими защитными системами, в основе которых лежит ABC-АТФаза. Первоначальный филогенетический анализ на основе последовательностей AriA и AriB позволил выделить 11 различных групп систем, причем в двух из них произошло слияние генов с образованием единого гена AriAB. Анализ аминокислотных позиций, ответственных за разные функции, показал, что системы PARIS консервативны по компонентам, задействованным в передаче сигнала, и эффекторным элементам. В то же время участки, необходимые для распознавания разных вирусных триггеров, в разных системах различаются [2].
На вопросы «Биомолекулы» ответил последний автор статьи — Артем Исаев, PhD, к.б.н., заведующий Лабораторией анализа метагеномов Сколтеха
— Возможно ли как-то сравнить эффективность разных защитных систем?
— Конечно, есть достаточно очевидный способ — померить, насколько каждая система снижает способность фага к образованию бляшек на бактериальном газоне, что называется EOP (Efficiency of Plating)-анализом. Однако нужно учитывать эволюционный контекст и наличие гонки вооружений. Мы в лаборатории проверяем конкретный вариант иммунной системы и конкретный штамм фага, в то время как в природе белки-триггеры и белки-сенсоры видоизменяются с огромной скоростью: стоит только фагу внести мутации в белок, который активирует иммунную систему, как он тут же захватит популяцию, и бактериям придется полагаться или на то, что удастся где-то «раздобыть» новую иммунную систему, или на вариант иммунной системы с мутацией в белке-сенсоре, который теперь сможет узнавать «убегающего» фага.
Таким образом, эффективность иммунной системы — это параметр крайне непостоянный, что, видимо, и приводит к тому, что разнообразие различных иммунных систем настолько огромно: это самая разнообразная группа генов во всем «пангеноме» микроорганизмов. Стоит еще учитывать, что у медали есть две стороны, и если система окажется слишком эффективной, это приведет к развитию аутоиммунных заболеваний: она начнет срабатывать, даже если в клетке нет вируса. Так что работа иммунных систем требует крайне тонкой настройки.
— Есть ли преобладание тех или иных систем в разных группах прокариот? Иными словами, бывает ли так, что представители какой-то группы прокариот почти всегда используют одну или несколько защитных систем?
— Это область достаточно активных исследований, красиво было бы предполагать, что у разных бактерий разные вирусы, а значит, и разные иммунные системы, но на практике оказывается, что это не так. Некоторые иммунные системы распознают настолько фундаментальные особенности биологии вирусов, что распространены и в бактериях, и в археях, и даже у человека. Это одно из крайне важных открытий последних лет — многие системы врожденного иммунитета эукариот возникли когда-то в бактериальных островках защиты. Даже если проводить параллели с нашей работой, у человека есть белки-нуклеазы SAMD9 [5] и Schlafen [6], которые начинают расщеплять клеточную тРНК в ответ на заражение вирусом, а некоторые вирусы герпеса кодируют собственные тРНК, хотя их функция еще не показана. Бывают исключения, когда необычные микроорганизмы, такие как археи, экстремофильные бактерии или многоклеточные стрептомицеты начинают предпочитать какие-то конкретные иммунные системы, но, в целом, различные гены, связанные с противовирусным иммунитетом, равномерно перемешиваются не только между разными геномами, но и между разными системами. Такие гены крайне мобильны и сами переносятся вирусами, плазмидами и транспозонами; к тому же иммунные системы похожи на конструктор: можно менять части местами и постоянно получать новые рабочие варианты.
Литература
- Stewart L. (2024). Malta hosts groundbreaking 7th World Conference on Targeting Phage Therapy 2024. The Microbiologist;
- Nathaniel Burman, Svetlana Belukhina, Florence Depardieu, Royce A. Wilkinson, Mikhail Skutel, et. al. (2024). A virally encoded tRNA neutralizes the PARIS antiviral defence system. Nature. 634, 424-431;
- Christoph Spahn, Stuart Middlemiss, Estibaliz Gómez-de-Mariscal, Ricardo Henriques, Helge B. Bode, et. al. (2025). The nucleoid of rapidly growing Escherichia coli localizes close to the inner membrane and is organized by transcription, translation, and cell geometry. Nat Commun. 16;
- Svetlana Belukhina, Baptiste Saudemont, Florence Depardieu, Tom Lorthios, Tinashe P. Maviza, et. al. Specificity and Mechanism of tRNA cleavage by the AriB Toprim nuclease of the PARIS bacterial immune system. — Cold Spring Harbor Laboratory;
- Fushun Zhang, Quanquan Ji, Juhi Chaturvedi, Marisol Morales, Yuanhui Mao, et. al. (2023). Human SAMD9 is a poxvirus-activatable anticodon nuclease inhibiting codon-specific protein synthesis. Sci. Adv.. 9;
- Kunlakanya Jitobaom, Thanyaporn Sirihongthong, Chompunuch Boonarkart, Supinya Phakaratsakul, Ornpreya Suptawiwat, Prasert Auewarakul. (2023). Human Schlafen 11 inhibits influenza A virus production. Virus Research. 334, 199162.





