Как проинсулиновые гранулы могут спасти клетки от голода
23 марта 2015
Как проинсулиновые гранулы могут спасти клетки от голода
- 516
- 0
- 0
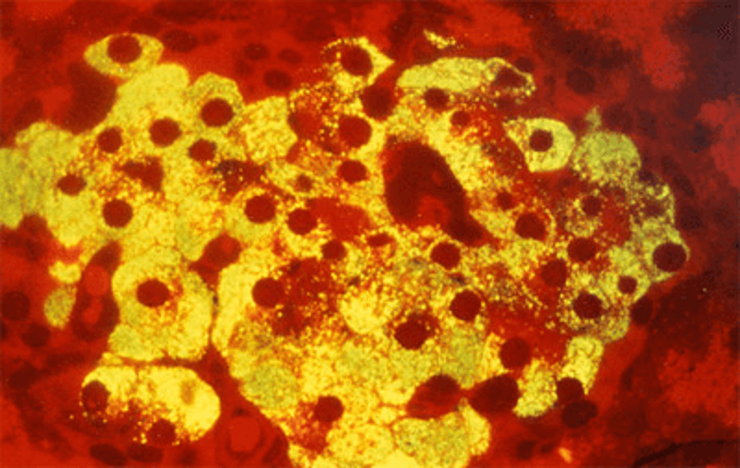
Микрофотография β-клеток островков Лангерганса поджелудочной железы млекопитающих. Темно-красные круги — ядра β-клеток. Желтое свечение — инсулин, связанный с меченными флуоресцентным красителем антителами.
Рисунок в полном размере.
рисунок с сайта Science Photo Library
-
Автор
-
Редакторы
Темы
Ученые обнаружили, что «голодающие» β-клетки поджелудочной железы ведут себя совсем иначе, чем другие клетки млекопитающих в условиях недостатка питательных веществ. Вместо того чтобы переваривать собственные органеллы с целью получить дополнительные питательные вещества, они «поедают» то, что сами производят — проинсулиновые гранулы.
Главная задача β-клеток поджелудочной железы состоит в том, чтобы производить инсулин — гормон, снижающий уровень глюкозы в крови и оказывающий влияние на обмен веществ во всех тканях. В случае ограниченного поступления в эти клетки питательных веществ секреция инсулина уменьшается. Однако чтобы не погибнуть, клетке недостаточно прикрыть «заводик» по производству инсулина.
Как правило, клетки млекопитающих в таком случае запускают процесс макроаутофагии — они переваривают обломки собственных органелл, а иногда и целые органеллы (рис. 1) [1]. Однако было замечено, что β-клетки поджелудочной железы таким механизмом не пользуются.
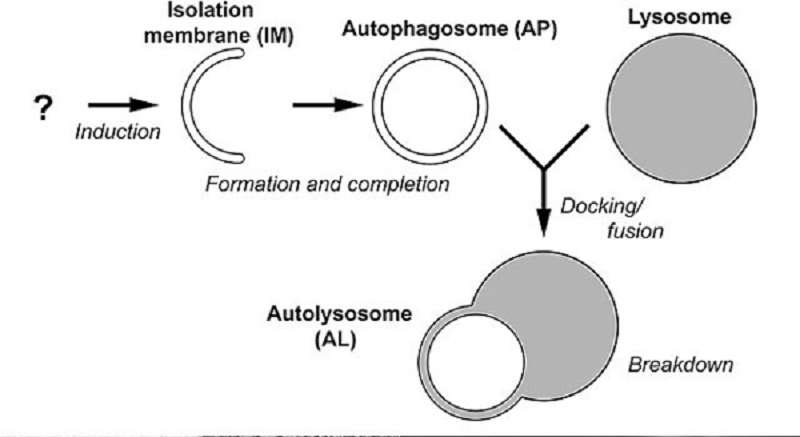
Рисунок 1. Макроаутофагия. Клеточные органеллы окружаются изолирующей мембраной и оказываются заключенными в аутофагосому. Затем к аутофагосоме подбирается лизосома, мембраны их сливаются, содержимое лизосомы (кислые гидролазы) выплескивается в аутофагосому и переваривают всё внутри.
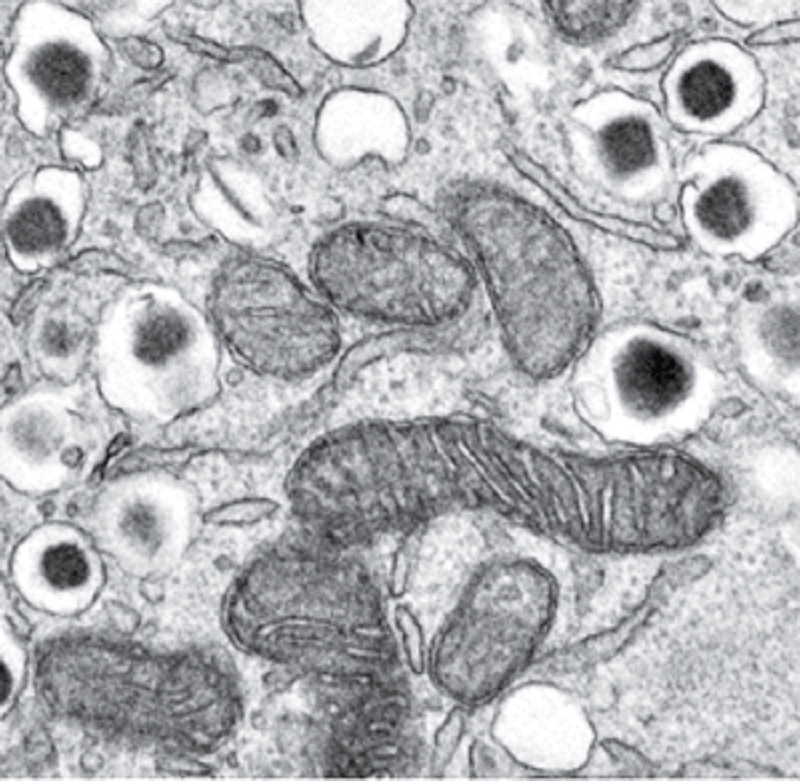
Рисунок 2. Микрофотография цитоплазмы β-клетки поджелудочной железы мыши при голодании. Видны темные структуры, окруженные двойной мембраной — митохондрии, пустые пузырьки — лизосомы, много проинсулиновых гранул в секреторных пузырьках. Аутофагосомы отсутствуют.
Выяснилось это благодаря наблюдениям за маркерным белком аутофагии LC3B (легкая цепь 3 бета ассоциированного с микротрубочками белка 1; убиквитин-подобный модификатор), который встраивается в мембрану аутофагосомы [2]. Его удалось визуализировать в клетках крыс INS1, родственных β-клеткам поджелудочной железы. При голодании количество светящихся точек LC3B, меченного флуоресцентными белками, уменьшалось. Кроме того, в электронный микроскоп было видно, что при нехватке питательных веществ в β-клетках поджелудочной железы мышей аутофагосом действительно становилось меньше (рис. 2).
В то же время при голодании, как у крыс, так и у мышей в клетках поджелудочной железы обнаружили лизосомы, которые содержали секреторные гранулы с предшественником инсулина (проинсулином) (рис. 3). Было также замечено, что во время голодания гранул проинсулина в клетках становилось меньше, то есть их поглощали лизосомы. Но если клетки обрабатывали ингибиторами лизосом, то количество проинсулина частично возрастало [3]. Получается, для спасения от голода клетки поджелудочной железы «придумали» поглощать то, что сами производят.
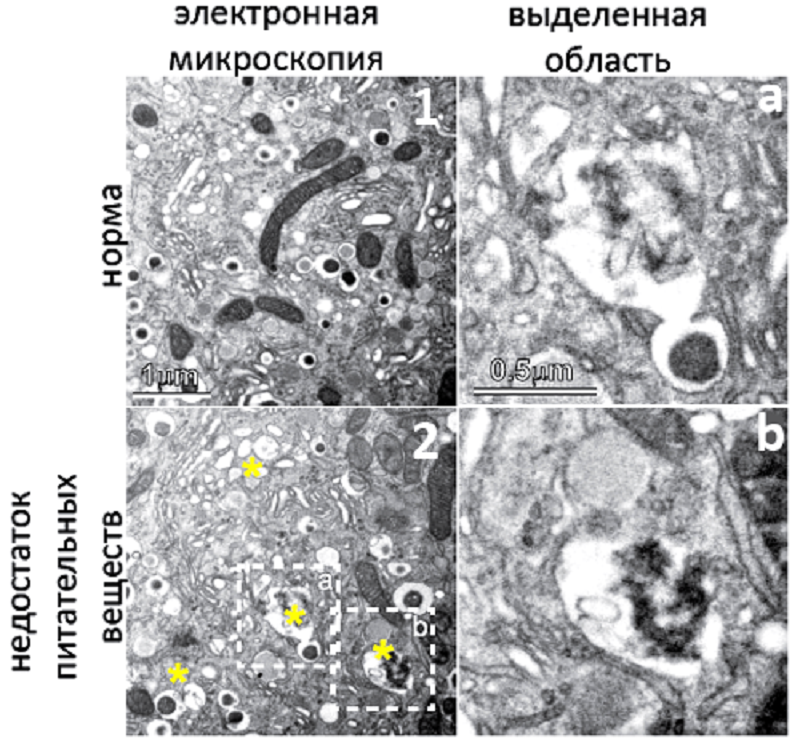
Рисунок 3. Лизосомы поглощают гранулы с предшественниками инсулина при недостатке питательных веществ. На электронномикроскопической фотографии показаны части клетки поджелудочной железы мыши в нормальных условиях (1) и при голодании (2). Видны темные вытянутые митохондрии, пустые пузырьки — лизосомы и пузырьки, содержащие темные гранулы округлой формы. Видно, что при голодании лизосомы сливаются с пузырьками, содержащими гранулы. Выделенные области а и b — увеличенные изображения лизосом, поглощающих гранулы проинсулина.
Ученые выяснили, что такую «хитрость» β-клетки используют неспроста. Если обработать голодающие β-клетки мышей и человека активатором образования аутофагосом (Tat-beclin 1), то секреция инсулина возрастает [3]. То есть процесс получения питательных веществ путем аутофагии, столь характерный для большинства клеток млекопитающих, «обманывает» β-клетки поджелудочной железы. Он ошибочно дает им понять, что питательных веществ достаточно и пора производить инсулин. Хотя на самом деле питательные вещества в этот момент неплохо было бы сэкономить, а синтез инсулина отложить до лучших времен.
Оказалось, что механизмы торможения аутофагии, поглощения проинсулиновых гранул и остановка производства инсулина связаны между собой и регулируются протеинкиназой D (PKD). Количество PKD падает при голодании. Уменьшение количества PKD ведет к запуску спасительного механизма потребления проинсулиновых гранул и запрещает аутофагию. Если искусственно увеличить количество образующейся PKD в голодающих клетках, то лизосом, содержащих проинсулиновые гранулы, становится значительно меньше [3].
Получается, что уменьшение количества PKD запускает процесс спасения β-клеток поджелудочной железы от голодной смерти и запрещает им синтезировать инсулин во время голодания (рис. 4). Возможно, это и есть самая оптимальная стратегия для секреторных клеток при нехватке питательных веществ. Процесс поедания проинсулин-содержащих гранул при голодании в разных культурах β-клеток начинается в разное время. Показано, что когда гранулы кончаются, в некоторых случаях клетки всё же переходят к аутофагии [4].
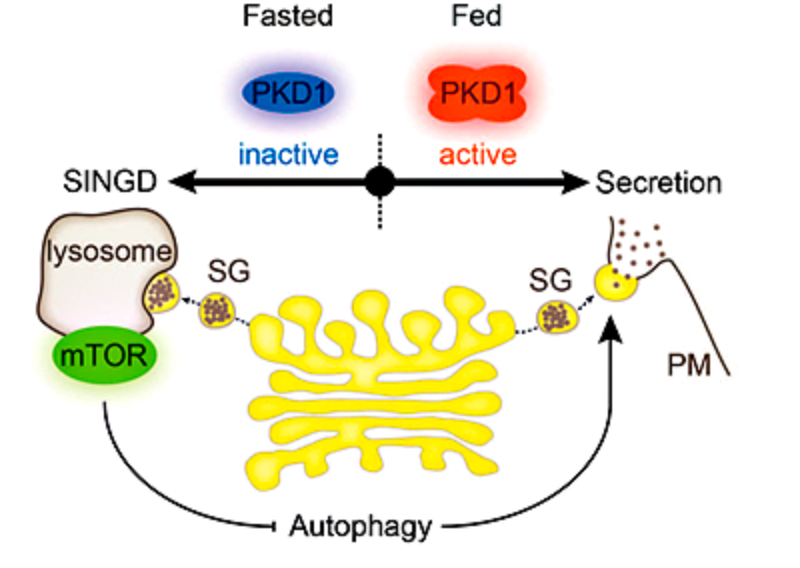
Рисунок 4. Регуляция синтеза инсулина в норме и при голодании. Количество протеинкиназы PKD при достаточном поступлении в клетку питательных веществ увеличивается, что приводит к запуску синтеза проинсулина. Проинсулин образуется в аппарате Гольджи, перемещается в составе секреторных пузырьков (secretory granules, SG) к плазматической мембране (PM) и выбрасывается из клетки (правая часть рисунка). Во время голодания количество протеинкиназы PKD уменьшается, синтез проинсулина приостанавливается, запускается процесс поглощения проинсулиновых гранул лизосомами. Одновременно с этим (при участии протеинкиназы mTOR) запрещается аутофагия (левая часть рисунка).
Открытие механизма поглощения β-клетками проинсулиновых гранул во время голодания само по себе очень существенно. Однако не меньший интерес представляет ставшее очевидным влияние аутофагии на увеличение секреции инсулина. Возможно, этот процесс связан с необходимостью быстрого выброса инсулина, например, после приема пищи.
Литература
- Avignat S. Patel, Ling Lin, Alexander Geyer, Jeffrey A. Haspel, Chang Hyeok An, et. al.. (2012). Autophagy in Idiopathic Pulmonary Fibrosis. PLoS ONE. 7, e41394;
- Элементы: «Как клетки выбирают путь спасения при стрессе»;
- Alexander Goginashvili, Zhirong Zhang, Eric Erbs, Coralie Spiegelhalter, Pascal Kessler, et. al.. (2015). Insulin secretory granules control autophagy in pancreatic β cells. Science. 347, 878-882;
- Kei Fujimoto, Piia T. Hanson, Hung Tran, Eric L. Ford, Zhiqiang Han, et. al.. (2009). Autophagy Regulates Pancreatic Beta Cell Death in Response to Pdx1 Deficiency and Nutrient Deprivation. Journal of Biological Chemistry. 284, 27664-27673.