Как синтезируются лассо-пептиды
23 июля 2019
Как синтезируются лассо-пептиды
- 565
- 0
- 2
Общая схема биосинтеза лассо-пептида у Thermobifida fusca
-
Автор
-
Редактор
Список необычных пептидов, которые синтезируют разнообразные живые организмы (особенно бактерии), постоянно пополняется: это и кольцевые пептиды, и пептиды, содержащие D-аминокислоты, и так называемые лассо-пептиды, у которых через N-концевое макролактамное кольцо «продета» линейная C-концевая часть молекулы. За превращение обычного линейного пептида, синтезируемого рибосомами, в лассо-пептид, отвечает синтетаза лассо-пептида, которая состоит из двух белковых субъединиц: B и C (или B1, B2 и C, если в состав субъединицы B входят два отдельных полипептида). Белок B1 отвечает за распознавание лидерной последовательности будущего лассо-пептида, фермент B2 лидерную последовательность отрезает, а белок С формирует макролактамное кольцо на N-конце лассо-пептида. Однако все детали этого трехступенчатого процесса остаются неясными. Исследователи из Центра наук о жизни Сколковского института науки и технологий совместно с японскими коллегами получили кристаллическую структуру белка B1 термофильной актинобактерии Thermobifida fusca в комплексе с соответствующим лидерным пептидом и с помощью мутационного анализа выявили, какие именно остатки фермента B1 и самого пептида играют решающую роль в его созревании. Тонкостям синтеза необычных лассо-пептидов и посвящена наша новость.
Биологическая активность лассо-пептидов весьма разнообразна, хотя очень часто их природные функции неясны. Среди них есть пептиды с антибактериальными свойствами (например, микроцин J25 и капиструин), которые ингибируют РНК-полимеразу у грамотрицательных бактерий. Некоторые бактериальные лассо-пептиды могут подавлять репликацию ВИЧ-1 и размножение клеток рака легких человека. В фармакологии лассо-пептиды начинают использовать для получения искусственных пептидов с противораковыми свойствами. Кроме того, лассо-пептиды могут выступать в роли строительных блоков для создания более сложных наноструктур, что делает их привлекательным объектом для нанотехнологии.
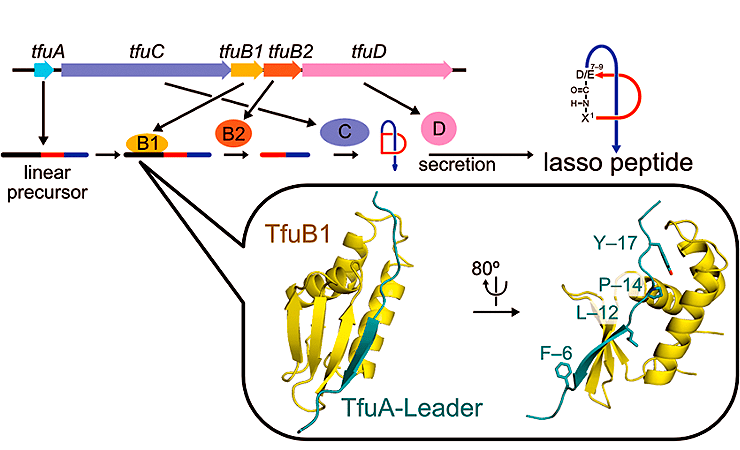
Аминокислотные последовательности лассо-пептидов широко варьируют, хотя системы для их биосинтеза очень консервативны. В типичном случае пептид-предшественник превращается в зрелый лассо-пептид под действием трех белков: B1, B2 и C. Еще один белок, D, отвечает за секрецию лассо-пептида во внешнюю среду. Лидерная N-концевая последовательность будущего лассо-пептида распознается белком B1 и отрезается белком B2, обладающим протеазной активностью. Иногда B1 и B2 синтезируются в виде единого полипептида — B. После отрезания лидерной последовательности на N-конце предшественника лассо-пептида остается свободная аминогруппа, которая образует связь со свободной карбоксильной группой кислой аминокислоты (аспартата или глутамата), входящей в состав той же пептидной цепочки (эта реакция катализируется белком C). Белки B и C работают в тесной связи друг с другом и формируют единый комплекс — синтетазу лассо-пептидов. Этот сценарий описывает лишь основные шаги в синтезе лассо-пептидов. Как именно происходят химические превращения, дающие такой необычный продукт, на данный момент неизвестно.
Синтез лассо-пептидов обнаружен у бактерий разных неродственных групп. В частности, у актинобактерии Thermobifida fusca линейный предшественник лассо-пептида кодируется геном tfuA и синтезируется на рибосомах (рис. 1). В тот же оперон, где находится tfuA, входят гены, кодирующие ферменты созревания лассо-пептида — tfuB1, tfuB2 и tfuC, а также ген tfuD, белковый продукт которого отвечает за секрецию лассо-пептида из клетки. Необычная форма лассо-пептида связана с тем, что его N-концевая аминогруппа связана изопептидной связью с боковой карбоксильной группой кислой аминокислоты (аспартата или глутамата), располагающейся в позиции 7–9. Так формируется характерное для лассо-пептидов макролактамное кольцо. Оставшаяся линейная C-концевая часть молекулы проходит через макролактамное кольцо, как нитка через игольное ушко. Благодаря своей необычной структуре лассо-пептиды обладают термостабильностью и устойчивы к протеолизу.

Рисунок 1. Биосинтез лассо-пептида. а — Схема строения лассо-пептида. б — Строение оперона, ответственного за синтез и созревание лассо-пептида у T. fusca. в — Аминокислотная последовательность лассо-пептида T. fusca — фузиллазина (фусканодина).
Группа исследователей из Центра наук о жизни (Сколтех) совместно с японскими коллегами детально изучила синтез лассо-пептида фузиллазина (фусканодина) на примере термофильной актинобактерии Thermobifida fusca, получив кристаллическую структуру ее белка B1 (TfuB1) в комплексе с лидерной последовательностью будущего лассо-пептида (TfuA) (рис. 2).
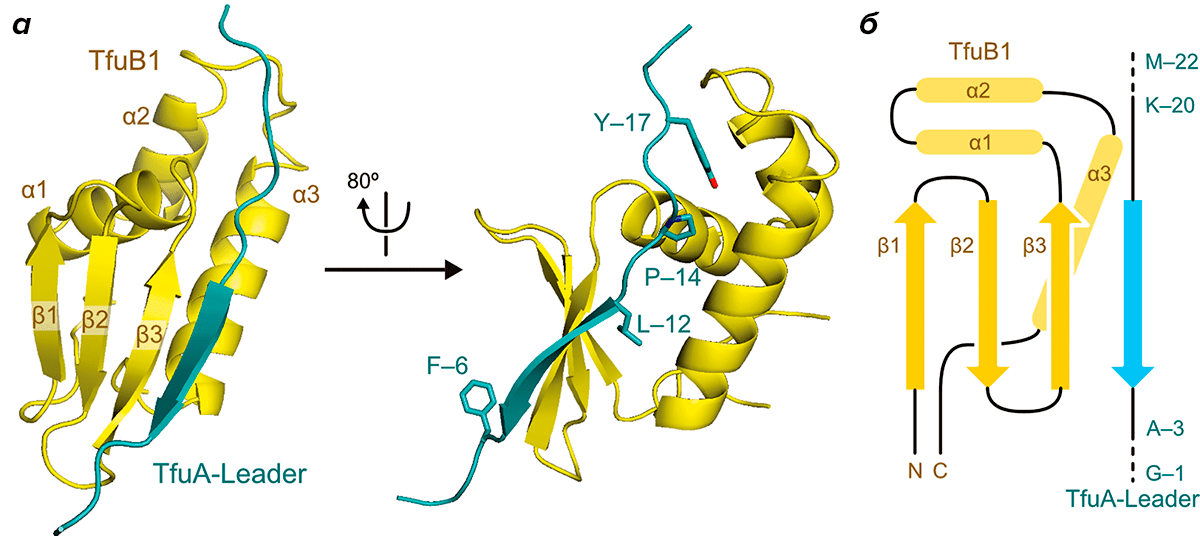
Рисунок 2. Пространственная структура комплекса TfuB1 и TfuA. а — Общий вид. б — Схема. Условные обозначения: Y-17 — тирозин-17; P-17 — пролин-14; L-12 — лейцин-12; F-6 — фенилаланин-6; K-20 — лизин-20.
Система синтеза лассо-пептида у T. fusca — одна из самых хорошо охарактеризованных систем такого рода. Ученым удалось экспериментально наблюдать образование лассо-пептида с ее помощью в гетерологичных условиях как in vitro, так и in vivo. Авторы обсуждаемой работы сумели получить в кристаллическом виде комплекс TfuB1 и лидерной последовательностьи TfuA с разрешением в 1,7 ангстрем. Вероятнее всего, TfuB1 функционирует как мономер, хотя после кристаллизации обнаружили некоторое число димеров его комплексов с лидерным пептидом. Возможно, димеры TfuB1 — просто кристаллографический артефакт, однако поверхность взаимодействия двух мономеров в одном димере включает гидрофобные остатки и TfuB1, и TfuA, поэтому, возможно, эти димеры необходимы для взаимодействия с другими компонентами системы биосинтеза лассо-пептидов.
Так как же устроен комплекс TfuB1 и TfuA и на чем основано распознавание лидерной последовательности? Оказалось, что TfuB1 — это однодоменный белок, у которого имеется три N-концевых β-листа (β1–β3) и три концевые α-спирали (α1–α3). TfuA формирует протяженный β-лист, который взаимодействует с третьим (β3) листом TfuB1, образуя единый межмолекулярный антипараллельный β-слой (рис. 2). В собственно распознавании лидерной последовательности участвуют три ее консервативных аминокислотных остатка — тирозин-17 (Tyr-17), пролин-14 (Pro-14) и лейцин-12 (Leu-12).
Tyr-17 окружен гидрофобными остатками спиралей α2 и α3 и соединяющих их петель. Он формирует водородную связь с довольно консервативным остатком аспартата-74 TfuB1, причем, как показали ранние эксперименты на похожих системах других бактерий, замена аспартата на аланин снижает сродство лидерного пептида к TfuB1 в восемь раз. Pro-14 находится на N-конце протяженного β-листа в составе лидерного пептида и вызывает небольшой изгиб его молекулы. Он входит в специальный гидрофобный карман TfuB1, а изгиб в лидерном пептиде, вызванный остатком пролина, дополнительно стабилизируется водородными связями между TfuB1 и лидерным пептидом.
Описанные остатки тирозина и пролина входят в состав консервативного мотива YxxP, который обеспечивает взаимодействие лидерного пептида с белком B1 в других системах синтеза лассо-пептидов. Авторы обсуждаемой работы получили мутантные версии TfuA, в которых Tyr-17 или Pro-14 были заменены на остаток аланина. Такие мутации уменьшали сродство лидерного пептида к TfuB1 более чем в десять раз, что указывает на их критическую роль в распознавании TfuA.
Еще один консервативный остаток, важный для распознавания лидерного пептида, Leu-12, входит в гидрофобную полость между бета-листом β3 и альфа-спиралью α3 TfuB1 и закрепляется там за счет гидрофобных взаимодействий. Замена этого остатка на аланин также более чем в десять раз понизила сродство лидерного пептида к TfuB1. Кроме того, гидрофобные остатки TfuB1, непосредственно взаимодействующие с Leu-12, также отличаются консервативностью, что подчеркивает их важность для распознавания лидерного пептида.
Но взаимодействия между лидерным пептидом и TfuB1 не исчерпываются описанными выше примерами. Как оказалось, между этими молекулами формируется дополнительная сеть водородных связей, сконцентрированная вокруг остатка лизина-20 (Lys-20) TfuA. Таким образом, распознавание лидерного пептида обеспечивается не только гидрофобными, но и электростатическими взаимодействиями.
Как упоминалось выше, лидерный пептид TfuA имеет конформацию, похожую на протяженный β-лист. Он взаимодействует с бета-листом β3, формируя межмолекулярный антипараллельный β-слой (рис. 2). Оказалось, что этот межмолекулярный β-слой представляет собой гидрофобную поверхность, которая и принимает участие в образовании димеров комплексов TfuB1 с лидерным пептидом, появлявшихся при кристаллизации. Однако в водном растворе комплекс TfuB1 с лидерным пептидом существует исключительно в виде мономера. Кроме того, замена на аланин консервативного среди актинобактерий остатка фенилаланина-6 (Phe-6) в составе TfuA, который является одним из ключевых остатков гидрофобной поверхности, практически не сказалась на сродстве лидерного пептида к TfuB1. Да и замена остатков TfuB1, взаимодействующих с Phe-6, почти не сказалась на сродстве двух молекул друг к другу. Так что гидрофобная поверхность, формируемая межмолекулярным β-слоем, не играет роли в распознавании лидерного пептида. Но для чего же она может быть нужна?
Как показали авторы статьи, гидрофобная поверхность комплекса TfuB1 с лидерным пептидом играет роль «посадочной площадки» для еще одного белка созревания лассо-пептида — B2, который отрезает лидерный пептид от молекулы будущего лассо-пептида. Как показало сравнение с другими системами синтеза лассо-пептидов, с TfuB2 взаимодействуют остатки глицина-31 и тирозина-33, которые входят в состав TfuB1 и гидрофобной поверхности его комплекса с лидерным пептидом. Таким образом, формирование межмолекулярного β-слоя может быть необходимо для вступления в игру следующего фермента процессинга пептида — фермента B2.
А что происходит в других системах синтеза лассо-пептидов? Является ли описанный механизм распознавания лидерного пептида если не универсальным, то по крайней мере широко распространенным? Авторы статьи провели моделирование взаимодействия белков-гомологов предшественника лассо-пептида и B1 у совершенно неродственной T. fusca бактерии — Bacillus pseudomycoides из типа фирмикут. Оказалось, что у B. pseudomycoides не только схожий механизм распознавания предшественника лассо-пептида, но и так же сформированная гидрофобная поверхность для посадки белка B2. Более того, для обоих процессов необходимы те же консервативные аминокислотные остатки, что и у T. fusca. Кроме этого, пространственное выравнивание комплекса лидерного пептида с белком B1 T. fusca и аналогичного комплекса бактерии Thermobaculum terrenum из типа Chloroflexi показало близкое сходство их структур. Поэтому можно полагать, что механизм созревания лассо-пептидов и принципиально, и структурно консервативен среди бактерий самых разных, филогенетически далеких друг от друга типов.
Литература
- Tomomi Sumida, Svetlana Dubiley, Brendan Wilcox, Konstantin Severinov, Shunsuke Tagami. (2019). Structural Basis of Leader Peptide Recognition in Lasso Peptide Biosynthesis Pathway. ACS Chem. Biol.. 14, 1619-1627.