
Как толщина миелина и эпигенетика помогают устойчивости к стрессу
21 ноября 2019
Как толщина миелина и эпигенетика помогают устойчивости к стрессу
- 3696
- 1
- 12
Результаты экспериментов Валентины Боннефил и коллег показывают, что толщина миелина влияет на устойчивость к стрессу — истончение волокна ведет к социальному поражению у мышей
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В недавней работе Валентины Боннефил и коллег были получены новые данные касательно молекулярных и опосредованных ими морфологических различий в мозге. По предположениям исследователей, именно они обусловливают различия реакций на сильный стресс. Для изучения этого явления была использована модель социального поражения, когда к испытуемой мыши подводят агрессивную мышь. После десяти дней исследуемые грызуны начинают вести себя по-разному — одни продолжают проявлять интерес к общению с другими особям, в то время как другие «замыкаются» в себе. Авторы работы показали, что вторая группа мышей характеризуется более высоким уровнем нарушений в нервной ткани из-за медленного ее восстановления, что, по-видимому, связано с эпигенетическими особенностями.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Согласно опросу 2017 года, проведенному Американской психологической ассоциацией, три из четырех американцев сообщают о симптомах стресса в течение тридцати дней, предшествующих опросу [1]. Мы сталкиваемся со всевозможными стрессами — личными, финансовыми, карьерными, новостными и т.д. — все чаще и чаще. Более того, с популярностью интернета появляются и новые виды потребностей и связанных с ними стрессов, например, в 2016 году было проведено исследование по изучению «синдрома упущенной выгоды» (fear of missing out) у подростков. Результаты показали, что увеличившаяся потребность в популярности связана с возросшим использованием Facebook и что эта связь опосредована страхом пропустить какое-либо событие. Появление этого страха, в свою очередь, вызывает повышение уровня стресса [2].
Но растет научное понимание влияния избыточного стресса в долгосрочной перспективе. Исследования показывают, что воздействие стрессовых факторов, начиная от физического насилия и заканчивая социальными конфликтами, значительно увеличивает риск возникновения нарушений психики, таких как депрессия или посттравматическое стрессовое расстройство (ПТСР).
Однако люди по-разному реагируют на один и тот же уровень стресса: некоторые могут проявить устойчивость и быстро восстановиться, в то время как другие борются за выживание и ощущают себя подавленными и потерянными. Механизмы этого различия всё еще вызывают вопросы. Кроме того, исследователи всё еще оценивают, как развиваются долгосрочные последствия индивидуального воздействия стресса.
В работе Валентины Боннефил и коллег 2019 года показано, что поведение, характерное для депрессии, может быть выявлено после социального поражения (рис. 1) в виде повторных атак агрессивных мышей по пять минут в день в течение десяти дней, а также после очаговой демиелинизации в медиальной префронтальной коре [3].
Миелин — защитное покрытие из отростков ненервных клеток (олигодендроцитов), которое изолирует нейроны, а также способствует увеличению скорости проведения сигнала между ними. Разрушение миелина (иначе — демиелинизация) связывают с прогрессией нарушения координации и равновесия и многими другими заболеваниями. Подробнее можно почитать в статье на «Биомолекуле» «Обертка для аксона» [4].
Рисунок 1. Модель социального поражения основана на различной реакции мышей на агрессора.
иллюстрация автора статьи
Ученые, в основном сосредоточившись на роли нейронов, давно проводят исследования того, как различия в реакции на стресс могут найти объяснение в биологических процессах. Тем не менее нейроны представляют собой только один тип клеток головного мозга, и появляется все больше доказательств того, что взаимодействия между нейронными и ненейронными клетками играют важную роль в ответе на стресс.
Исследования выявили, что умеренный уровень ацетилирования гистонов требуется для дифференцировки олигодендроцитов, в то время как высокие уровни ацетилирования гистонов связаны с нарушением миелинизации (из-за отсутствия молодых олигодендроцитов, создающих миелин) [5], [6]. Позднее обнаружили, что уровень миелинизации связан с приспосабливаемостью к изменяющимся условиям (в статье — к социальной изоляции) [7]. В той же работе показано, что истончение миелина связано с незрелым ядерным хроматином, а также повышенным уровнем ацетилирования и пониженным уровнем метилирования. Все изменения в данном исследовании были зафиксированы в префронтальной коре.
Что было сделано?
Сотрудники Центра перспективных научных исследований (ASRC) выяснили, что олигодендроциты, которые образуют миелиновые оболочки в центральной нервной системе, являются ключевыми факторами, определяющими, влияет ли на нас стресс. Эпигенетика позволяет объяснить всё больше вещей, которые ранее не смогла объяснить генетика (подробнее в статье «Эпигенетика: невидимый командир генома» [8]). И дифференцировка олигодендроцитов может зависеть от понижения уровня метилирования (а конкретно, метки H3K9me3 — метилирования гистона H3 в положении 9), сопряженного с разрыхлением (снижением плотности) хроматина и запуском экспрессии генов, специфичных для взрослых олигодендроцитов [9].
Исследователи подвергли мышей (10 — в экспериментальной группе; и 8 — в контрольной) воздействию социального поражения [3]. В итоге мышь либо оставалась социально вовлеченной (активно контактировала с другими особями) и потому была классифицирована как «устойчивая», либо избегала социальных контактов после встречи с агрессором, что позволяло отнести ее к группе «восприимчивых» животных. При этом невосприимчивые мыши были практически неотличимы от контрольной группы, которая не контактировала с агрессором.
Пристальное внимание было уделено прилежащему ядру (NAc) и медиальной префронтальной коре (mPFC), поскольку результаты предыдущих исследований свидетельствуют, что именно эти зоны определяют реакцию на стресс [10].
Что это за области мозга и что про них известно?
Прилежащее ядро является частью взаимосвязанной системы вентральной области — прилежащего ядра (VTA—NAc). Эта система имеет решающее значение для получения «наград» за счет выделения дофамина. VTA-дофаминергические нейроны также иннервируют несколько областей префронтальной коры (PFC), центральной миндалины, базолатеральной миндалины (BLA) и гиппокампа, а также другие области (рис. 2). Все эти так называемые области вознаграждения мозга сложным образом взаимосвязаны: например, NAc получает плотную глутаматергическую иннервацию из PFC, миндалины и гиппокампа; PFC, миндалина и гиппокамп образуют взаимные глутаматергические связи друг с другом. Функциональный выход каждой из этих областей модулируется несколькими типами ГАМКергических интернейронов.
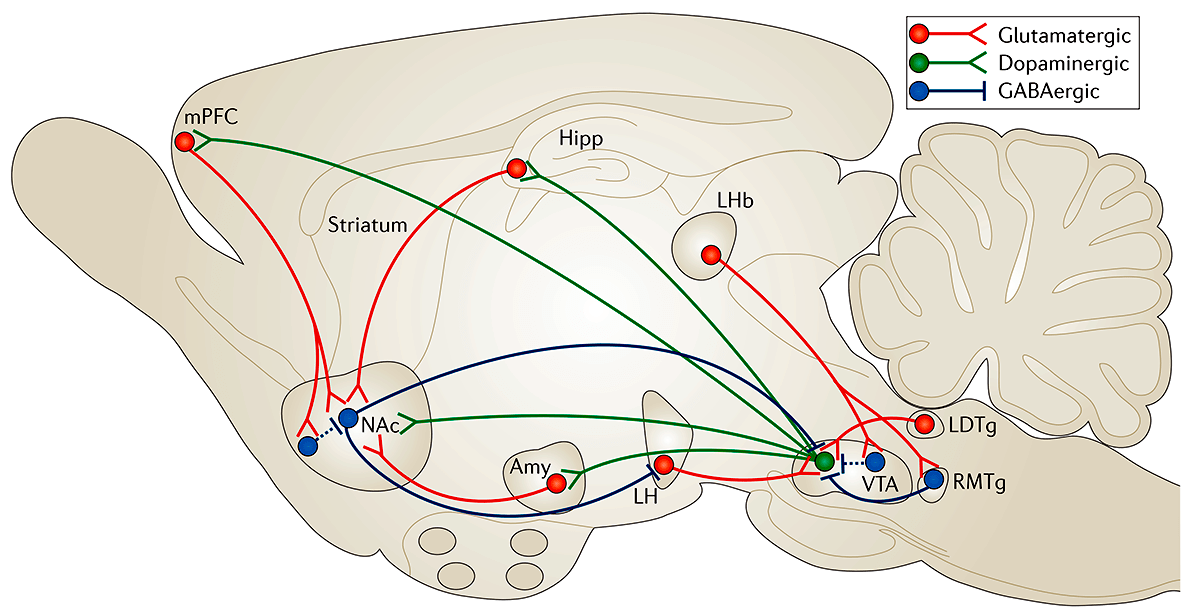
Рисунок 2. Схема системы вознаграждения вентральной области — прилежащего ядра (VTA—NAc). Упрощенная схема основных дофаминергических, глутаматергических и ГАМКергических связей вокруг вентральной области (VTA) и прилежащего ядра (NAc) в головном мозге грызунов. Первичная схема системы вознаграждения включает дофаминергические связи из VTA в NAc, которые высвобождают дофамин в ответ на стимулы, связанные с вознаграждением (и в некоторых случаях стимулы, связанные с отвращением). Есть также ГАМКергические проекции от NAc до VTA; NAc также получает плотную иннервацию из глутаматергических моносинаптических контуров медиальной префронтальной коры (mPFC), гиппокампа (Hipp) и миндалины (Amy), а также из других областей. VTA получает глутаматергические стимулы от латерального дорсального сегмента (LDTg), латерального поводка эпиталамуса (LHb) и латерального гипоталамуса (LH). Эти различные глутаматергические входы контролируют аспекты восприятия и памяти, связанные с вознаграждением. Пунктирные линии показывают внутренние тормозные проекции. Красные линии — глутаматергические связи; зеленые — дофаминергические; синие — ГАМКергические.
Выделение дофамина в прилежащее ядро — это способ, с помощью которого мозг получает сигналы удовольствия. Чувство удовольствия побуждает нас повторять поведение, жизненно важное для выживания [11], а нарушения в получении дофаминовой награды связаны с такими симптомами, как ангедония и нарушение восприятия и воспоминаний, связанных с вознаграждением [12].
Медиальная префронтальная кора — часть префронтальной коры, которая также связана с системой вознаграждений, как было показано выше. Согласно результатам исследований, пациенты с депрессией имеют меньший объем коры, включая уменьшенный объем белого вещества в этой области, что и ведет к нарушению восприятия событий, которые раньше приносили радость [13].
Что обнаружили и какие сделали выводы?
В обсуждаемой работе было показано, что поведение, связанное с социальным избеганием, может быть выявлено после социального поражения, а также после очаговой демиелинизации в mPFC, и поэтому может быть вызвано гипомиелинизацией. Обнаружили также, что миелин в прилежащем ядре истончается у обеих групп мышей (рис. 3). Но только у «восприимчивых» мышей выявили меньшее количество зрелых олигодендроцитов, а охват миелином оказался короче и тоньше.
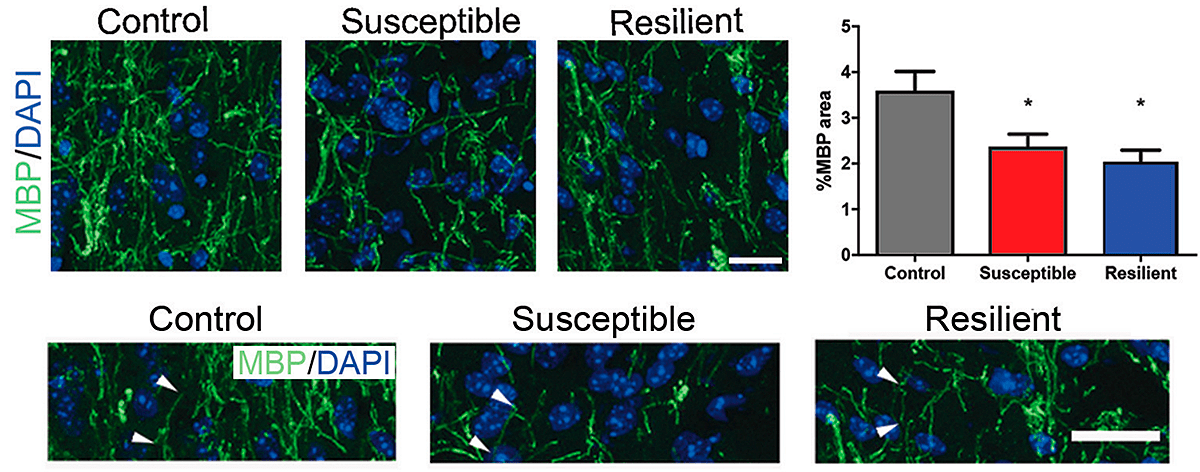
Рисунок 3. Изображения с конфокального микроскопа и количественные оценки, показывающие иммуногистохимию основного белка миелина (МВР), контрастирующего с DAPI (4′,6-диамидино-2-фенилидолом, флюоресцентным красителем), 20-кратное увеличение. Control — контрольная группа; susceptible — «восприимчивая» группа; resilient — «устойчивая» группа. Статистический анализ проведен по одностороннему ANOVA с тестом Тьюки.
Более того, исследователи обнаружили снижение уровня метилирования гистонов (а именно метки H3K9me3, связанной с дифференцировкой незрелых олигодендроцитов) в предшественниках олигодендроцитов у «восприимчивых» мышей.
Метилирование гистонов представляет собой присоединение метильных групп к положительно заряженной аминокислоте лизину или аргинину с целью нейтрализации заряда. Связывание происходит с помощью фермента гистонметилтрансферазы. Это универсальный эпигенетический механизм, так как он приводит к активации или репрессии гена в зависимости от функции последнего. Метилирование гистонов в разных остатках служит маркером для связывания различных белковых активаторов/репрессоров, которые регулируют экспрессию гена.
Снижение уровня метилирования гистонов у предшественников олигодендроцитов, по-видимому, указывает на то, что эпигенетическая модификация может быть как причиной нарушения программы дифференцировки, так и ее следствием. Полученные данные позволяют нам говорить только о корреляции этих двух наблюдений, но не о причинно-следственной связи. Авторы говорят о возможности существования механизма эпигенетического переключения. Согласно этой концепции, стресс способен влиять на эпигенетическую модификацию предшественников олигодендроцитов, контролируя их развитие, а также отражается в миелиновых паттернах человека. В пользу этого говорит тот факт, что при образовании нового миелина его характеристики возвращаются к норме. Это свидетельствует о том, что изменения в результате этого стресса зачастую не вызывают повреждения ДНК, а только (обратимые) эпигенетические изменения.
Однако наличие причинно-следственной связи показано между истончением миелинового волокна и стремлением уклониться от социальных контактов. Был проведен эксперимент по введению лизолецитина , что повлекло за собой ожидаемое истончение миелина и последующее возникновение реакции социального избегания. Спустя три недели после этого структура волокна пришла в норму, и поведение мышей стало неотличимо от контрольной группы.
Лизолецитин (иначе — лизофосфатидилхолин) является сильнодействующим растворяющим мембрану химическим веществом, которое обычно вводят в белое вещество мозга в виде 1%-ного раствора, чтобы вызвать очаговую демиелинизацию. В 1972 г. Сьюзан Холл была первой, кто продемонстрировал использование лизолецитина для создания демиелинизирующих поражений в белом веществе спинного мозга взрослой мыши [14].
Таким образом, мы можем говорить о том, что дефектная миелинизация воспринимается как дезадаптивный механизм (нарушение адаптации), возникающий только у «восприимчивых» мышей после воздействия повторяющегося социального стресса. Ранее было обнаружено, что дефекты миелинизации появляются у социально изолированных взрослых мышей еще до проявлений поведения социального избегания, что связано с нарушениями в системе получения удовольствия, вплоть до ангедонии [7].
Ангедония — неспособность чувствовать удовольствие, по определению французского физиолога Теодюля Рибо [15]. Сейчас определение включает также пониженную мотивацию к действиям, которые раньше вызывали радость [16]. Это различие важно, например, для животных моделей ангедонии, в которых эмоциональный опыт удовольствия сложно измерить, но мотивацию получения вознаграждения гораздо легче исследовать [17]. Ангедонию встречают у людей с различными психическими заболеваниями и состояниями — депрессией, шизофренией, болезнью Альцгеймера; она также играет важную роль в посттравматическом стрессовом синдроме и расстройствах пищевого поведения.
Почему у мышей различная устойчивость к стрессу?
По-видимому, потому что у них различно число зрелых олигодендроцитов. Снижение уровня метилирования гистонов в предшественниках олигодендроцитов связано с нарушением дифференцировки (превращению в функциональные клетки), которая связана (коррелирует, по неподтвержденной гипотезе, ведет к) с истончением миелиновых волокон, что, в свою очередь, приводит к отсутствию адаптации к стрессу. Вот картинки с одной из гипотез о том, как все устроено (рис. 4).
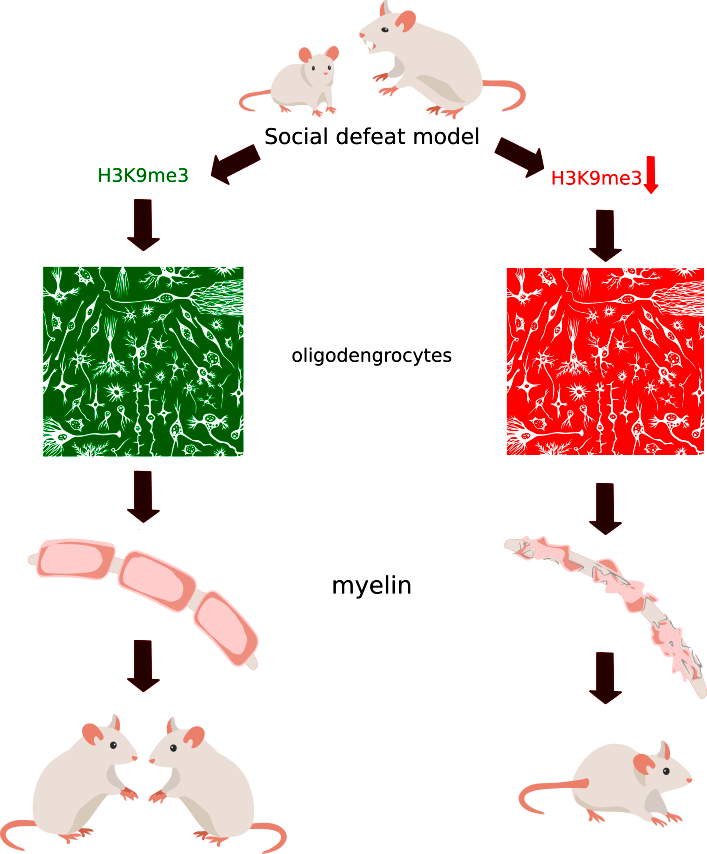
Рисунок 4. Возможная схема различий реакции на социальное поражение, когда у одних мышей наблюдается пониженный уровень метилирования гистона H3 в положении 9, сниженный уровень зрелых олигодендроцитов и истончение миелина, а потому и избегание контактов с другими особями. В это же время другие мыши имели неотличимый от контрольных уровень метилирования гистона, их миелин не подвергся сильным изменениям, и они продолжали выражать интерес к общению с другими мышами. Social defeat model — модель социального поражения; oligodendrocytes — олигодендроциты; myelin — миелин.
иллюстрация автора статьи
Устойчивость к стрессу может возникнуть в результате активных стратегий преодоления, а не пассивного бездействия, определяемого как отсутствие адаптивного ответа. Одна из возможностей образования нового миелина в качестве стратегии преодоления связана с повышенной нейронной активностью у устойчивых мышей в нейронах префронтальной коры после социального поражения. Было показано, что оптогенетическая стимуляция префронтальной коры помогает формированию «устойчивого» фенотипа у мышей с социальным поражением.
Оптогенетическая стимуляция — использование света для контроля клеток на участке нервной ткани. Подконтрольные клетки предварительно генетически модифицированы для экспрессии светочувствительных ионных каналов. Метод позволяет осуществить оптическую модуляцию нейронной активности с высокой временной и пространственной разрешающей способностью, доходящей до размера единичного нейрона.
В то же время снижение качества и количества олигодендроцитов не является постоянным. Это говорит о том, что также вовлечен какой-то другой механизм, помимо обусловленного генетически, который централизованно регулирует развитие олигодендроцитов.
Молекулярная основа устойчивости была тщательно изучена в контексте нейронных клеток, иммунной и нейроэндокринной систем [18]. Авторы обсуждаемой статьи предлагают альтернативное, хотя и не исключающее существующие, объяснение, ставящее в центр миелинизирующую глию . Возможность образования нового миелина (как стратегия преодоления) связана с повышенной нейронной активностью у устойчивых мышей, о чем свидетельствует большая степень экспрессии определенных белков в глутаматергических нейронах mPFC устойчивых мышей после социального поражения [19].
Глия — ненейронные клетки нервной системы, осуществляющие поддержание гомеостаза нейронов, обеспечивая их защиту и питание, а также формирование миелина. В центральной нервной системе к глиальным клеткам относят, например, олигодендроциты, астроциты и микроглию.
А что про воспаление, связанное со стрессом?
Альтернативный механизм может быть основан на различиях в воспалительных компонентах между двумя группами. Изучение интерлейкинов при расстройствах настроения ведется уже более двадцати лет [20]. Центральный вопрос заключается в том, в какой из частей нервной системы — периферической или центральной — синтезируются цитокины, играющие главную роль в формировании воспалительного компонента расстройств настроения.
Интерлейкины — группа цитокинов, изначально известных как часть иммунного воспалительного ответа; но также найдено, что они регулируют нейронную функцию в центральной и периферической нервных системах.
Анализ маркеров периферического воспаления последовательно выявляет увеличение интерлейкинов-6 (IL-6), интерлейкинов-1β (IL-1β) и фактора некроза опухолей-α (TNFα) у пациентов с расстройствами настроения. Измененные центральные уровни этих факторов также были определены.
Известно, что снижение уровня синтеза IL-6 во всем организме или только в лейкоцитах способствует развитию «устойчивого» фенотипа [21]. Используя компьютерное моделирование, Скотт Руссо с коллегами показал, что одновременная тревожность, уменьшение объема гиппокампа и повышение уровня системного интерлейкина-6 характеризовали восприимчивый фенотип, у которого развились поведенческие и нейробиологические нарушения после социального поражения [22].
Однако следует учесть, что системные изменения IL-6 не могут объяснить регион-специфические различия в миелинизации у «восприимчивых» и «устойчивых» мышей. Интерлейкин-6 (IL-6) может продуцироваться глией центральной нервной системы [23], а предшественники олигодендроцитов экспрессируют рецепторы IL-6. Авторы обсуждаемой статьи предполагают, что уровень IL-6 может быть повышен в структурах, влияющих на дифференцировку предшественника олигодендроцитов и образование нового миелина в специфических областях мозга взрослого человека. В клетках запускаются каскады биохимических реакций, которые опосредуют эти эффекты. Например, ядерный фактор κB (NF-κB) представляет собой фактор транскрипции , наиболее известный своей ролью в периферических иммунных и воспалительных реакциях. Но он также является хорошо известной нисходящей мишенью для интерлейкина-6, интерлейкина-1β и TNFα в головном мозге и периферических тканях. Последние данные свидетельствуют о том, что сигнальный путь NF-κB регулирует систему вознаграждения в моделях депрессии [24].
Транскрипционный фактор — белок, связывающий ДНК в особых участках и регулирующий или инициирующий транскрипцию гена.
Например, в гиппокампе активация NF-κB участвует в нарушении нейрогенеза и индукции ангедонии [25]. В NAc хронический стресс после социального поражения увеличивает уровни киназы ингибитора NF-κB (IKK), что способствует активации NF-κB, который связывается с ДНК и изменяет транскрипцию группы генов. Одновременно меняется и эпигенетика — снижается уровень метилирования и повышается уровень ацетилирования. Это стимулирует образование новых незрелых шипиков на дендритах NAc. Данный процесс происходит только у восприимчивых животных, но не наблюдается у устойчивых особей (рис. 5). Прямое ингибирование IKK в NAc «обрезает» эти новые синапсы и обращает вспять связанные с ними депрессивные фенотипы [26]. Текущие исследования фокусируются на внутриклеточных сигнальных путях, посредством которых цитокины регулируют активность NF-κB, связанную со стрессом, а также нацелены на выявление транскрипционных мишеней NF-κB, которые опосредуют эти эффекты.
Шипики — выросты мембраны дендритов, играют важную роль в формировании и регуляции глутаматного синапса.
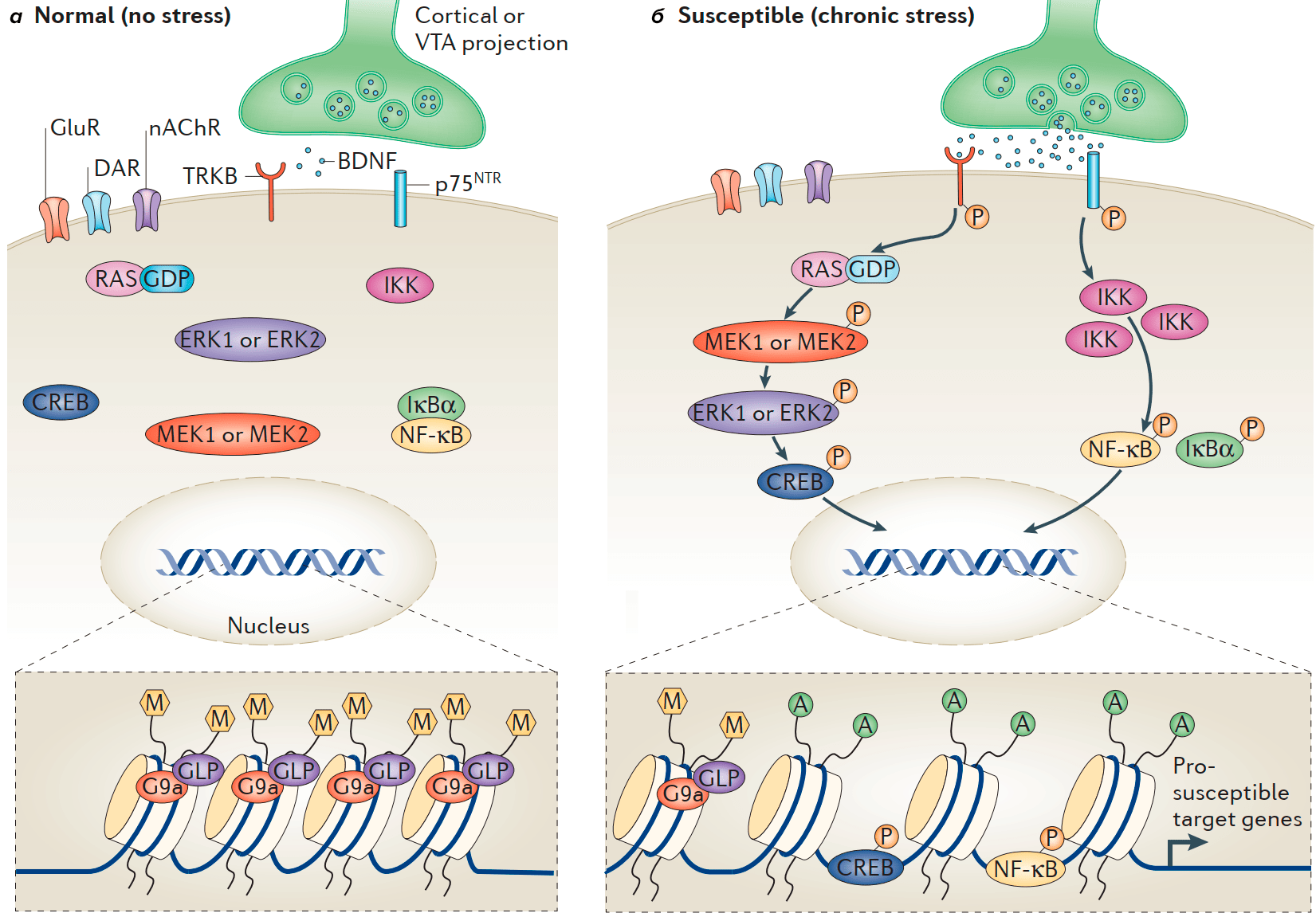
Рисунок 5. Пониженная устойчивость к стрессу через изменение транскрипции в NAc. Повышенная уязвимость к депрессии вследствие хронического социального поражения происходит отчасти благодаря передаче сигналов нейротрофического фактора мозга (BDNF) в прилежащем ядре (NAc). В контрольных условиях (а) активация рецепторной тирозинкиназы TRKB с помощью BDNF ограничена. Однако после предшествующего стимула, который увеличивает восприимчивость (например, повторный стресс — б), передача сигналов BDNF—TRKB в NAc увеличивается, вызывая повышение уровня фосфорилирование (обозначено P) и активность нескольких нижестоящих посредников передачи сигналов, включая циклический АМФ-чувствительный элемент-связывающий белок (CREB). Этот дезадаптивный ответ происходит не только через повышенное высвобождение BDNF в NAc из вентральной области (VTA), но также через эпигенетические модификации, которые дополнительно стимулируют сигнальные каскады BDNF. Например, хронический стресс увеличивает синтез RAS в NAc восприимчивых животных, вызывая снижение уровня репрессивного H3K9me2. На рисунке также показана индукция другого пути, опосредованного BDNF, включая ядерный фактор κB (NF-κB) и киназу ингибитора NF-κB (IKK) в NAc после хронического социального поражения стрессом у восприимчивых животных. Условные обозначения: А — ацетилирование; DAR — дофаминовый рецептор; ERK — внеклеточная сигнальная регулируемая киназа; IκBα — ингибитор NF-κB-α; MEK — ERK/MAPK киназа.
Другим механизмом, связывающим воспаление с развитием депрессивной симптоматики, является влияние цитокинов на гипоталамо-гипофизарную ось (HPA). Цитокины могут действовать на глюкокортикоидные рецепторы и косвенно активировать синтез кортикотропин-рилизинг-гормона (CRH), адренокортикотропного гормона (ACTH) и кортизола [27]. Степень, в которой цитокины индуцируют высвобождение ACTH и кортизола, является прогностическим фактором развития симптомов депрессии [28]. Это означает, что чувствительность оси HPA к воспалительной стимуляции особенно важна для развития аффективно-когнитивных симптомов депрессии.
Заключение
Отцом исследований стресса считают Ганса Селье, который определял стресс как «неспецифическую реакцию организма на любую потребность» и впервые предположил о наличии связи между стрессом и развитием заболеваний. Сейчас исследования стресса базируются на стыке фармакологии, патологии и нейронаук и направлены на изучение на молекулярном уровне.
Понимание изменений, которые вызывают стресс в организме, позволяет исследователям начать составлять карту потенциальных клинических вмешательств с конечной целью снижения его негативных последствий и предотвращения психических расстройств. Большинство современных методов лечения фокусируются на здоровье нейронов, но это исследование подтверждает возможность вмешательства в глиальные клетки, по крайней мере, в случае психических заболеваний, связанных со стрессом.
Несмотря на то, что данная статья добавляет ясности в наше понимание формирования двух групп в реакциях на социальное поражение, при переносе результатов на людей мы должны помнить о невозможности полностью смоделировать депрессию у животного по ряду причин. Во-первых, депрессия у людей — это не одно заболевание, а очень неоднородный синдром. Во-вторых, ключевые симптомы человеческой депрессии (то есть вина, суицидальность и грусть) не могут быть оценены (и могут не существовать вовсе в зависимости от того, как мы эти эмоции определяем [29]) у животных. И в-третьих, биология, лежащая в основе многих типов человеческой депрессии, остается плохо изученной. Однако ясно, что воздействие стресса увеличивает риск депрессии у людей, и, следовательно, большинство моделей депрессии грызунов полагаются на стрессовые факторы окружающей среды, чтобы вызвать симптомы, подобные депрессии, которые можно изучать механически.
Важное предостережение в отношении работы, описанной в этой статье (и в большинстве работ, использующих мышиные модели), заключается в том, что было использовано небольшое количество мышей, недостаточное для высокой достоверности результатов. Более того, исследование проводили исключительно на самцах грызунов, несмотря на тот факт, что в человеческом мире женщины в два раза чаще страдают расстройством настроения, чем мужчины [30]. И модели грызунов демонстрируют, что особи женского пола испытывают более депрессивное поведение после хронического стресса [31]. Было высказано предположение, что различия в развитии связанных с вознаграждением нейронных цепей могут предрасполагать женщин к депрессии [32]. Кроме того, прямое воздействие циркулирующих половых гормонов на систему вознаграждения может изменить чувствительность женщины к стрессу во время менструального цикла [33]. Исследования на грызунах действительно показали, что гормоны яичников изменяют пороги вознаграждения за стимуляцию мозга, что означает, что во время определенных фаз эстрального цикла женщины более склонны к ангедонии [34]. Это должно быть чрезвычайно высоким приоритетом для будущих исследований; мы должны определить, в какой степени рассмотренные выше механизмы применимы к моделям женской депрессии.
Важно также помнить, что наши реакции часто обусловлены опытом наших предков, который закодирован в эпигеноме (на «Биомолекуле» этому посвещена статья «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах» [35]), что позволяет напомнить о важности поддержания психического здоровья во всех поколениях. И самый простой, ставший почти скучным совет (который все еще работает): достаточное количество сна, отдых и режим питания — это то, что мы уже сейчас можем сделать для улучшения своей эпигенетики.
Литература
- Winerman L. (2017). By the numbers: Our stressed-out nation. Monitor on Psychology. 11, 80;
- Ine Beyens, Eline Frison, Steven Eggermont. (2016). “I don’t want to miss a thing”: Adolescents’ fear of missing out and its relationship to adolescents’ social needs, Facebook use, and Facebook related stress. Computers in Human Behavior. 64, 1-8;
- Valentina Bonnefil, Karen Dietz, Mario Amatruda, Maureen Wentling, Antonio V Aubry, et. al.. (2019). Region-specific myelin differences define behavioral consequences of chronic social defeat stress in mice. eLife. 8;
- Обёртка для аксона;
- Siming Shen, Juan Sandoval, Victoria A Swiss, Jiadong Li, Jeff Dupree, et. al.. (2008). Age-dependent epigenetic control of differentiation inhibitors is critical for remyelination efficiency. Nat Neurosci. 11, 1024-1034;
- Feng Ye, Ying Chen, ThaoNguyen Hoang, Rusty L Montgomery, Xian-hui Zhao, et. al.. (2009). HDAC1 and HDAC2 regulate oligodendrocyte differentiation by disrupting the β-catenin–TCF interaction. Nat Neurosci. 12, 829-838;
- Jia Liu, Karen Dietz, Jacqueline M DeLoyht, Xiomara Pedre, Dipti Kelkar, et. al.. (2012). Impaired adult myelination in the prefrontal cortex of socially isolated mice. Nat Neurosci. 15, 1621-1623;
- Эпигенетика: невидимый командир генома;
- Dario Nicetto, Greg Donahue, Tanya Jain, Tao Peng, Simone Sidoli, et. al.. (2019). H3K9me3-heterochromatin loss at protein-coding genes enables developmental lineage specification. Science. 363, 294-297;
- Mitra Heshmati, Hossein Aleyasin, Caroline Menard, Daniel J. Christoffel, Meghan E. Flanigan, et. al.. (2018). Cell-type-specific role for nucleus accumbens neuroligin-2 in depression and stress susceptibility. Proc Natl Acad Sci USA. 115, 1111-1116;
- Md Sahab Uddin, Sadeeq Muhammad Sheshe. (2017). Hijacking the Progress of Addiction: Looking at β-Arrestin 1 and β-Arrestin 2 to Cognize Drugs of Abuse. J Psychiatry. 21;
- Scott J. Russo, Eric J. Nestler. (2013). The brain reward circuitry in mood disorders. Nat Rev Neurosci. 14, 609-625;
- Sheila C. Caetano, Simerjit Kaur, Paolo Brambilla, Mark Nicoletti, John P. Hatch, et. al.. (2006). Smaller Cingulate Volumes in Unipolar Depressed Patients. Biological Psychiatry. 59, 702-706;
- Hall S.M. (1972). The effect of injections of lysophosphatidyl choline into white matter of the adult mouse spinal cord. J. Cell Sci. 2, 535–546;
- Ribot T. La psychologie des sentiments. L'Harmattan, 1896. — 450 p.;
- Michael T. Treadway, David H. Zald. (2011). Reconsidering anhedonia in depression: Lessons from translational neuroscience. Neuroscience & Biobehavioral Reviews. 35, 537-555;
- Masud Husain, Jonathan P. Roiser. (2018). Neuroscience of apathy and anhedonia: a transdiagnostic approach. Nat Rev Neurosci. 19, 470-484;
- Scott J Russo, James W Murrough, Ming-Hu Han, Dennis S Charney, Eric J Nestler. (2012). Neurobiology of resilience. Nat Neurosci. 15, 1475-1484;
- M. L. Lehmann, M. Herkenham. (2011). Environmental Enrichment Confers Stress Resiliency to Social Defeat through an Infralimbic Cortex-Dependent Neuroanatomical Pathway. Journal of Neuroscience. 31, 6159-6173;
- Andrew H. Miller. (1998). NEUROENDOCRINE AND IMMUNE SYSTEM INTERACTIONS IN STRESS AND DEPRESSION. Psychiatric Clinics of North America. 21, 443-463;
- Yekta Dowlati, Nathan Herrmann, Walter Swardfager, Helena Liu, Lauren Sham, et. al.. (2010). A Meta-Analysis of Cytokines in Major Depression. Biological Psychiatry. 67, 446-457;
- Carla Nasca, Caroline Menard, Georgia Hodes, Benedetta Bigio, Catherine Pena, et. al.. (2019). Multidimensional Predictors of Susceptibility and Resilience to Social Defeat Stress. Biological Psychiatry. 86, 483-491;
- María Erta, Albert Quintana, Juan Hidalgo. (2012). Interleukin-6, a Major Cytokine in the Central Nervous System. Int. J. Biol. Sci.. 8, 1254-1266;
- Daniel J Christoffel, Sam A Golden, Mitra Heshmati, Ami Graham, Shari Birnbaum, et. al.. (2012). Effects of Inhibitor of κB Kinase Activity in the Nucleus Accumbens on Emotional Behavior. Neuropsychopharmacol. 37, 2615-2623;
- J. W. Koo, S. J. Russo, D. Ferguson, E. J. Nestler, R. S. Duman. (2010). Nuclear factor- B is a critical mediator of stress-impaired neurogenesis and depressive behavior. Proceedings of the National Academy of Sciences. 107, 2669-2674;
- D. J. Christoffel, S. A. Golden, D. Dumitriu, A. J. Robison, W. G. Janssen, et. al.. (2011). I B Kinase Regulates Social Defeat Stress-Induced Synaptic and Behavioral Plasticity. Journal of Neuroscience. 31, 314-321;
- Charles L. Raison, Andrew H. Miller. (2003). When Not Enough Is Too Much: The Role of Insufficient Glucocorticoid Signaling in the Pathophysiology of Stress-Related Disorders. AJP. 160, 1554-1565;
- Lucile Capuron, Charles L. Raison, Dominique L. Musselman, David H. Lawson, Charles B. Nemeroff, Andrew H. Miller. (2003). Association of Exaggerated HPA Axis Response to the Initial Injection of Interferon-Alpha With Development of Depression During Interferon-Alpha Therapy. AJP. 160, 1342-1345;
- Ralph Adolphs, Leonard Mlodinow, Lisa Feldman Barrett. (2019). What is an emotion?. Current Biology. 29, R1060-R1064;
- Darlene Deecher, Terrance H. Andree, Diane Sloan, Lee E. Schechter. (2008). From menarche to menopause: Exploring the underlying biology of depression in women experiencing hormonal changes. Psychoneuroendocrinology. 33, 3-17;
- Jennifer Joeyen-Waldorf, Nicole Edgar, Etienne Sibille. (2009). The roles of sex and serotonin transporter levels in age- and stress-related emotionality in mice. Brain Research. 1286, 84-93;
- Mary C. Blehar. (2006). Women's Mental Health Research: The Emergence of a Biomedical Field. Annu. Rev. Clin. Psychol.. 2, 135-160;
- E Young, A Korszun. (2010). Sex, trauma, stress hormones and depression. Mol Psychiatry. 15, 23-28;
- Elizabeth P. Bless, Kelley A. McGinnis, Amy L. Mitchell, Amy Hartwell, John B. Mitchell. (1997). The effects of gonadal steroids on brain stimulation reward in female rats. Behavioural Brain Research. 82, 235-244;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?.






