
Клетки под давлением
08 декабря 2015
Клетки под давлением
- 2361
- 0
- 8
Аллегория механорецепции.
Рисунок в полном размере.
рисунок с сайта media.senscritique.com
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Вы не задумывались, что привычные нам животные, да и мы сами, могли бы выглядеть иначе? Жизнь началась с того, что образовалась клетка — единица всего живого, развитие которой происходило под действием внешних физических полей: гравитационного и электромагнитного. Изменение внешнего воздействия приводит к изменению механического напряжения внутри клетки, которое должно сопровождаться адекватной реакцией клетки без потери способности к самовоспроизведению и полноценной жизнедеятельности. Выраженность и последствия деформаций будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров, на роль которых претендуют различные структуры. Рассмотрим, что же известно о четырех из них: внеклеточном матриксе, механочувствительных ионных каналах, подмембранном и внутреннем цитоскелете.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клетка — структурная единица всего живого — развивается под постоянным действием внешних стимулов — тепла, пищи, регуляторных гормонов. Однако есть еще один тип стимуляции, который должна воспринимать живая клетка — механическое напряжение. Изменение внешнего воздействия (его вектора, амплитуды) закономерно должно приводить к изменению механического напряжения внутри клетки. Степень выраженности и последствия этих деформаций для жизнедеятельности клетки будут зависеть от собственных механических характеристик клетки и чувствительности ее механосенсоров [1], в роли которых могут выступать различные структуры, способные чувствовать механическую стимуляцию и реагировать на нее. Можно выделить четыре основных типа механосенсоров: внеклеточный матрикс, механочувствительные ионные каналы, подмембранный цитоскелет и комплексы компонентов внутреннего цитоскелета. Рассмотрим, что же известно на сегодня о каждом из них.
Внеклеточный матрикс и мембранные белки
Первый претендент на роль механосенсора — внеклеточный матрикс и связанные с ним мембранные белки (рис. 1). Одной из причин такого предположения послужила реакция этих структур на внешнее механическое воздействие. Было показано, что приложение растягивающей силы к культуре нейронов или гладкомышечных клеток через внеклеточный матрикс приводит к увеличению полимеризации микротрубочек [2], [3].
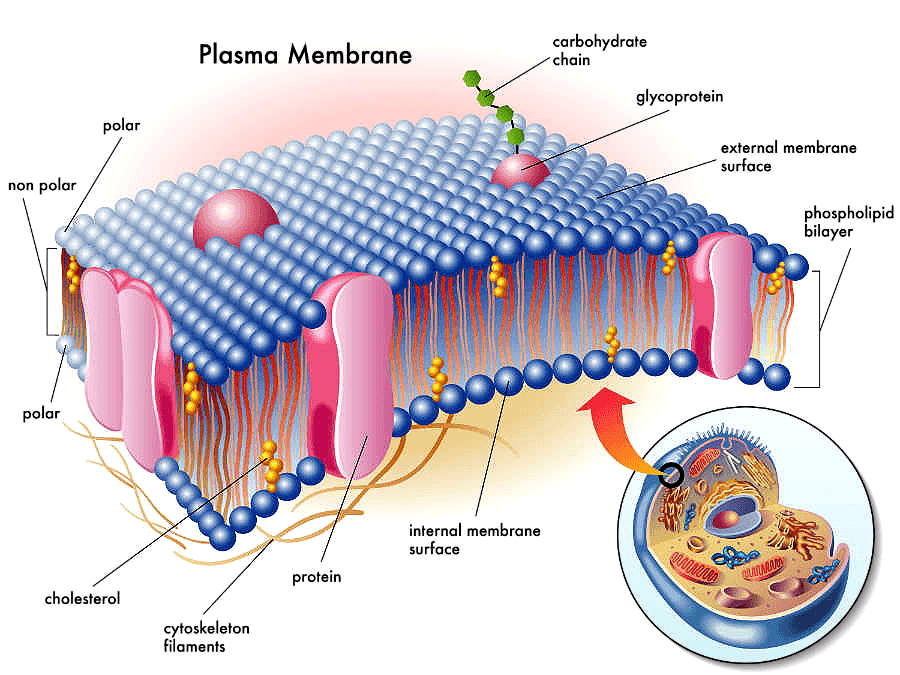
Рисунок 1. Мембранные белки в составе плазматической мембраны.
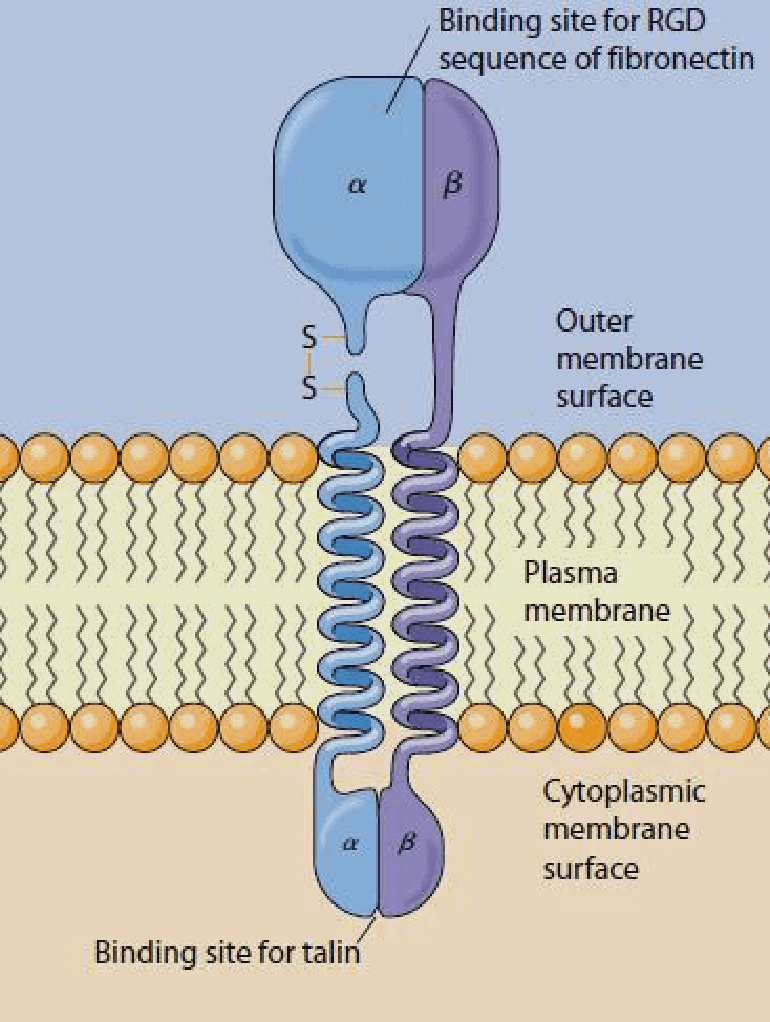
Рисунок 2. Схема строения молекулы интегрина. Трансмембранные участки обеих субъединиц белка представлены α-спиралями, крупные внеклеточные домены связывают лиганды (в данном случае — молекулы фибронектина), внутриклеточные — принимают активирующие сигналы, поступающие из клетки. Считается, что на последнем этапе активирующего сигналинга белок цитоскелета талин особым образом связывается с небольшим цитоплазматическим «хвостиком» β-субъединицы, меняя конформацию интегрина. В результате прочность связывания рецептора с лигандом резко возрастает, и сигнал из внеклеточного матрикса передается в клетку. Обычно интегрины активны во время клеточной миграции, тромбообразования (агрегации тромбоцитов при повреждении сосудистой стенки), выхода лейкоцитов из кровеносной системы, построении внеклеточного матрикса.
Каким же образом это могло произойти? Попробуем рассмотреть этот процесс на молекулярном уровне. Интегрины — трансмембранные гетеродимерные клеточные рецепторы, формирующие связи с различными белками внеклеточного матрикса (фибронектином, витронектином, коллагеном, ламинином) и передающие межклеточные сигналы, образуют первичный участок трансдукции и поэтому могут рассматриваться как механосенсор. Что совсем не удивительно, ведь интегрины — неотъемлемые участники процессов клеточной адгезии, пролиферации и перемещения.
Интегриновые рецепторы — это гетеродимеры, состоящие из одной α- и одной β-субъединицы (рис. 2). У человека синтезируется как минимум 18 α- и 8 β-субъединиц, из которых в разных комбинациях строится 24 типа интегрина [4], различающихся по специфичности взаимодействия с лигандами. Субъединицы α определяют специфичность интегрина к лиганду, а β связаны со структурами цитоскелета и обеспечивают передачу сигнала внутри клетки. Интегрины присутствуют в мембране постоянно, но для связывания лиганда они должны активироваться, а это происходит, например, при взаимодействии других клеточных рецепторов с цитокинами [5].
У внутренней поверхности клеточной мембраны в зонах образования интегриновых контактов с адгезивными белками внеклеточного матрикса целый ряд белков собирается в фокально-адгезивный комплекс. Это существенно затрудняет анализ вклада каждого из них в механотрансдукцию и пока не позволяет выявить ведущую роль какого-либо из них. Однако представляется очевидным, что внешняя механическая сила может приводить к конформационным изменениям одного или нескольких белков фокально-адгезивного комплекса, запуская далее каскад нижележащих сигнальных путей [6].
Механочувствительные ионные каналы
Второй претендент — механочувствительные ионные каналы. В настоящее время они являются самым малоизученным классом ионных каналов и представляют особый интерес для понимания механизмов клеточной сигнализации.
Впервые такие каналы были обнаружены в электрофизиологических экспериментах с использованием метода патч-кламп (patch-clamp). Было выявлено, что при растягивании мембраны меняется катион-транспортная активность механочувствительного канала — в результате конформационных изменений липидного бислоя [6], [7] или воротных доменов самогό канала.
Наглядно это было представлено на наиболее просто устроенных живых организмах — бактериях. А именно — на механочувствительном канале MscL, представляющем собой пору большого диаметра с низкой ионной селективностью. Эксперименты показали, что увеличение натяжения мембраны, контролируемое путем варьирования глубины всасывания в пипетку, вызывает увеличение проводимости канала в случае, когда силы, действующие на канал, превышают определенную величину [8]. Авторы отметили, что напряжение в этом случае оказывалось чуть ниже (10-2 Па·м), чем напряжение, приводящее к разрыву (6 × 10-2 Па·м), что может иметь большое физиологическое значение, например, при разбухании бактериальной клетки вследствие осмотического шока.
В эукариотических клетках в качестве механочувствительных каналов можно рассматривать эпителиальные натриевые каналы ENaCs (рис. 3) — семейство ионных каналов из суперсемейства дегенрин/ENaC (DEG/ENaC), — обнаруженные в клетках различных натрий-абсорбирующих типов эпителия [9].
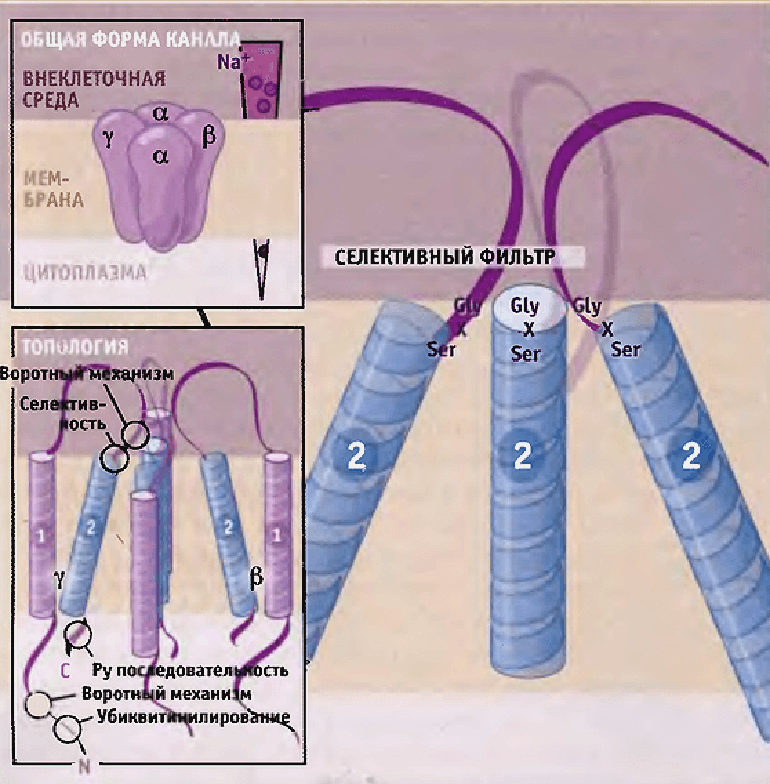
Рисунок 3. Схема строения эпителиальных Na+-каналов. Предполагается, что каждая субъединица состоит из двух трансмембранных участков, выпетливания на поверхности клетки и N- и C-концевых доменов, находящихся внутри клетки.
Накапливается всё больше доказательств того, что ENaC могут активироваться механическими силами; как минимум напряжение сдвига при ламинарном течении жидкости может быть адекватным стимулом, имеющим физиологическое значение [10], [11]. Также косвенным аргументом в пользу механочувствительности может служить тот факт, что гены этих высокоселективных Na+-каналов экспрессируются в тканях, которые наиболее подвержены механическим воздействиям, а именно — на которые действует напряжение сдвига: дистальный отдел нефрона [10], [12], эпителий легкого [13], сосудистая ткань [14–16], чувствительные нервные окончания, включая те, что участвуют в механосенсорных процессах [17]. Активность этих каналов служит лимитирующим фактором поглощения натрия и скорости трансэпителиального движения воды (осмоса) [18]. Таким образом, ENaC является регулятором транспорта ионов в почке, и именно с ним могут быть связаны механозависимые адаптивные ответы, существенные для обеспечения ионного гомеостаза.
Подмембранный цитоскелет
Третий претендент — подмембранный цитоскелет (рис. 4), роль которого в регуляции ионных каналов доказана в ряде исследований. Рассмотрим некоторые из них.
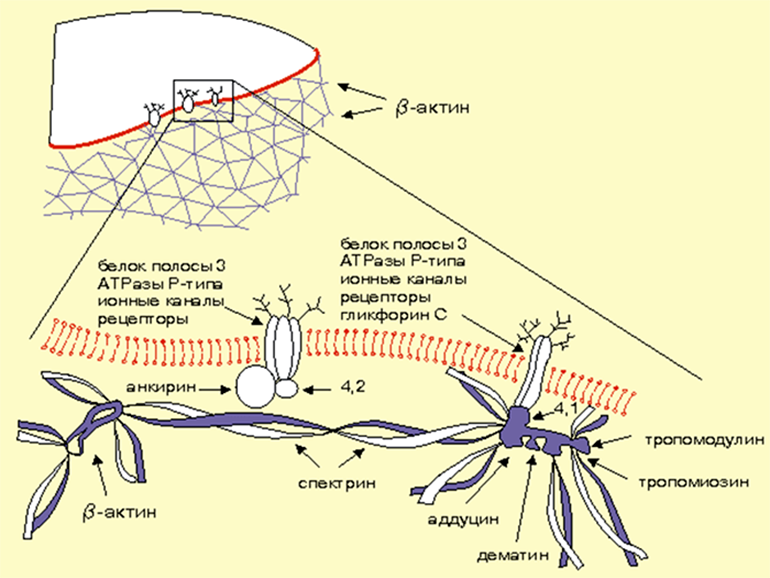
Рисунок 4. Схема, иллюстрирующая организацию примембранного актин-спектринового цитоскелета эритроцитов.
В эксперименте при обработке культуры клеток (например, К562) цитохалазином D происходит активация натриевых каналов, а полимеризация актина на цитоплазматической стороне клеточной мембраны вызывает их инактивацию [19]. При этом в клетках линии К562 фрагментация актиновых филаментов, ассоциированных с плазматической мембраной, может быть основным фактором, влияющим на активность натриевых каналов в ответ на повышение внутриклеточной концентрации ионов кальция [20].
Цитохалазины — группа структурно родственных метаболитов плесневых грибов. Они связываются с быстро растущим концом актинового филамента и блокируют (иногда не полностью) как присоединение, так и отсоединение субъединиц на этом конце.
С помощью метода патч-кламп было показано, что актиновые микрофиламенты принимают участие в регуляции хлорных каналов [21], [22], Na+-K+-АТФазы [23], электровозбудимых натриевых каналов в клетках мозга [24], натриевых каналов в клетках реабсорбирующего эпителия [25].
Авторы работ, посвященных изучению богатых холестерином липидных микродоменов плазматической мембраны (рафтов) как фактора, определяющего активность интегральных мембранных белков и ионных каналов [26–31], считают, что нарушения структуры рафтов, обусловленные снижением уровня мембранного холестерина, препятствуют реализации клеточных функций, включающих перестройки актиновой сети [29], [32].
В клетках с пониженным содержанием холестерина наблюдалось повышение порога активации и снижение вероятности открытого состояния каналов. При этом измерения механозависимых токов в разных условиях и комплементарные данные флуоресцентной микроскопии свидетельствовали о том, что подавление активности механочувствительных каналов опосредовано реорганизацией актина, инициированной, по мнению ученых, нарушением целостности рафтов из-за снижения уровня мембранного холестерина [33], [34].
Внутриклеточные структуры
И последний по счету, но не по значимости претендент — внутриклеточные структуры. Хорошо известно, что внешнее силовое воздействие может привести к изменениям уровня экспрессии генов. При приложении силы через мембраносвязанные рецепторы в некоторых случаях деформируется ядро [35], то есть можно предположить прямое влияние внешних сил на хроматин, а значит, и на уровень экспрессии генов [36]. Силы в этом случае могут трансдуцироваться через цитоскелетную сеть к ядерной оболочке, а затем через ламининовую сеть (рис. 5) к хроматину. Кроме того, внешнее силовое воздействие может передаваться на микротрубочки, приводить к их разрыву, деполимеризации и запуску сигнальных путей.
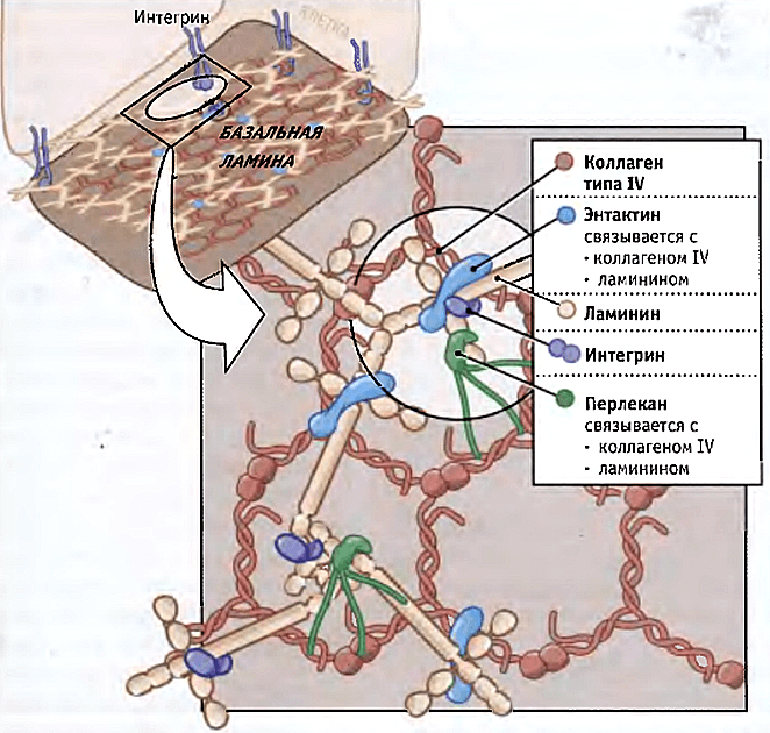
Рисунок 5. Схема полимеризации ламинина в базальной мембране. Ламинин связан по меньшей мере с тремя другими белками внеклеточного матрикса, образуя сеть в базальной ламине. Ламинины также связываются с интегриновыми рецепторами, которые вытягиваются от поверхности клеток, прикрепленных к базальной ламине.
Следует отметить, что конформационные изменения различных белков могут претендовать на роль механосенсора, но прямых доказательств этого практически нет. Хотя существует как минимум один пример того, что биохимическая реакция обусловлена конформационными изменениями белков. Свернутые домены фибронектина могут быть выявлены при действии силы, растягивающей молекулу и провоцирующей формирование фибрилл. Этот процесс исследовался экспериментально, а также методами динамического молекулярного моделирования [37], [38], и в результате было показано, что сила 3–5 пН достаточна для разворачивания доменов, а дальнейшее увеличение силы до 5 пН может привести к удлинению исходной молекулы в пять раз [38], [39]. Эти уровни силы сравнимы с теми, которые, согласно оценкам, могут инициировать механотрансдукцию.
По сути, любой белок, участвующий в механотрансдукции от внеклеточных контактов внутрь клетки, может быть механосенсором и стимулировать разворачивание интегринов [40] и ассоциированных с ними белков [41].
Согласно теории Дональда Ингбера [42], цитоскелет в целом реагирует на изменения механического напряжения, передающиеся посредством внеклеточного матрикса и ассоциированных с ним интегринов, реорганизуя микрофиламенты и микротрубочки. В то же время кортикальный цитоскелет, как жесткий 3D-каркас, поддерживающий плазматическую мембрану, находится в напряженном состоянии во внешнем механическом поле [43]. Поэтому можно полагать, что практически все вероятные механизмы первичной механотрансдукции зависят от состояния подмембранного кортикального цитоскелета, целостность которого обусловливает механические свойства (жесткость) того или иного типа клеток.
Заключение
Участие клеточной механочувствительности во множестве физиологических процессов и довольно скудное количество безусловно установленных фактов делают рассматриваемую область исследований очень привлекательной для молекулярных биологов, цитологов и физиологов. Механозависимая регуляция процессов жизнедеятельности клетки может по праву считаться новым механизмом негуморальной регуляции. Выяснение вклада каждого возможного механосенсора будет способствовать расшифровке основ морфогенеза живого организма на ранних стадиях развития и при различных внешних параметрах.
Литература
- Огнева И.В. (2015). Раннее развитие в условиях микрогравитации. Биофизика. 60, 1024–1035;
- T J Dennerll, H C Joshi, V L Steel, R E Buxbaum, S R Heidemann. (1988). Tension and compression in the cytoskeleton of PC-12 neurites. II: Quantitative measurements.. The Journal of cell biology. 107, 665-674;
- A. J. Putnam, K. Schultz, D. J. Mooney. (2001). Control of microtubule assembly by extracellular matrix and externally applied strain. American Journal of Physiology-Cell Physiology. 280, C556-C564;
- Yoshikazu Takada, Xiaojing Ye, Scott Simon. (2007). The integrins. Genome Biol. 8, 215;
- Saskia Thomas, Daniel C. Baumgart. (2012). Targeting leukocyte migration and adhesion in Crohn’s disease and ulcerative colitis. Inflammopharmacol. 20, 1-18;
- Sergei Sukharev, David P. Corey. (2004). Mechanosensitive Channels: Multiplicity of Families and Gating Paradigms. Sci. STKE. 2004;
- Rosario Maroto, Albert Raso, Thomas G. Wood, Alex Kurosky, Boris Martinac, Owen P. Hamill. (2005). TRPC1 forms the stretch-activated cation channel in vertebrate cells. Nat Cell Biol. 7, 179-185;
- Owen P. Hamill, Boris Martinac. (2001). Molecular Basis of Mechanotransduction in Living Cells. Physiological Reviews. 81, 685-740;
- Льюин Б. Клетки / под ред. Ченцова Ю.С. М.: БИНОМ. Лаборатория знаний, 2011. — 951 с.;
- Lisa M. Satlin, Shaohu Sheng, Craig B. Woda, Thomas R. Kleyman. (2001). Epithelial Na+ channels are regulated by flow. American Journal of Physiology-Renal Physiology. 280, F1010-F1018;
- Marcelo D. Carattino, Shaohu Sheng, Thomas R. Kleyman. (2004). Epithelial Na+ Channels Are Activated by Laminar Shear Stress. Journal of Biological Chemistry. 279, 4120-4126;
- Rahul Prasad, Xingjian Jin, Surya Nauli. (2014). Sensing a Sensor: Identifying the Mechanosensory Function of Primary Cilia. Biosensors. 4, 47-62;
- Robert Tarran, Brian Button, Maryse Picher, Anthony M. Paradiso, Carla M. Ribeiro, et. al.. (2005). Normal and Cystic Fibrosis Airway Surface Liquid Homeostasis. Journal of Biological Chemistry. 280, 35751-35759;
- HEATHER A. DRUMMOND, MICHAEL J. WELSH, FRANÇOIS M. ABBOUD. (2001). ENaC Subunits Are Molecular Components of the Arterial Baroreceptor Complex. Annals of the New York Academy of Sciences. 940, 42-47;
- Heather A. Drummond, Debebe Gebremedhin, David R. Harder. (2004). Degenerin/Epithelial Na + Channel Proteins. Hypertension. 44, 643-648;
- Nikki L. Jernigan, Heather A. Drummond. (2005). Vascular ENaC proteins are required for renal myogenic constriction. American Journal of Physiology-Renal Physiology. 289, F891-F901;
- H.A. Drummond, F.M. Abboud, M.J. Welsh. (2000). Localization of β and γ subunits of ENaC in sensory nerve endings in the rat foot pad. Brain Research. 884, 1-12;
- Mike Althaus, Roman Bogdan, Wolfgang G. Clauss, Martin Fronius. (2007). Mechano‐sensitivity of epithelial sodium channels (ENaCs): laminar shear stress increases ion channel open probability. FASEB j.. 21, 2389-2399;
- Y A Negulyaev, E A Vedernikova, A V Maximov. (1996). Disruption of actin filaments increases the activity of sodium-conducting channels in human myeloid leukemia cells.. MBoC. 7, 1857-1864;
- Vedernikova E.A., Maksimov A.V., Neguliaev Iu.A. (1997). Functional properties and cytoskeletal-dependent regulation of sodium channels in leukemia cell membranes. Tsitologiia. 39, 1142–1151;
- Makoto Suzuki, Keiko Miyazaki, Masato Ikeda, Yoshindo Kawaguchi, Osamu Sakai. (1993). F-actin network may regulate a Cl? channel in renal proximal tubule cells. J. Membarin Biol.. 134;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- P Devarajan, D A Scaramuzzino, J S Morrow. (1994). Ankyrin binds to two distinct cytoplasmic domains of Na,K-ATPase alpha subunit.. Proc. Natl. Acad. Sci. U.S.A.. 91, 2965-2969;
- Yogambal Srinivasan, Lawrence Elmer, Jonathan Davis, Vann Bennett, Kimon Angelides. (1988). Ankyrin and spectrin associate with voltage-dependent sodium channels in brain. Nature. 333, 177-180;
- D.J. Benos, M.S. Awayda, I.I. Ismailov, J.P. Johnson. (1995). Structure and function of amiloride-sensitive Na+ channels. J. Membarin Biol.. 143;
- Thomas Harder, Kai Simons. (1999). Clusters of glycolipid and glycosylphosphatidylinositol-anchored proteins in lymphoid cells : accumulation of actin regulated by local tyrosine phosphorylation. Eur. J. Immunol.. 29, 556-562;
- Deborah A. Brown, Erwin London. (2000). Structure and Function of Sphingolipid- and Cholesterol-rich Membrane Rafts. Journal of Biological Chemistry. 275, 17221-17224;
- Thomas Nebl, Kersi N. Pestonjamasp, John D. Leszyk, Jessica L. Crowley, Sang W. Oh, Elizabeth J. Luna. (2002). Proteomic Analysis of a Detergent-resistant Membrane Skeleton from Neutrophil Plasma Membranes. Journal of Biological Chemistry. 277, 43399-43409;
- Deborah A. Brown. (2006). Lipid Rafts, Detergent-Resistant Membranes, and Raft Targeting Signals. Physiology. 21, 430-439;
- Irena Levitan, Aimee E. Christian, Thomas N. Tulenko, George H. Rothblat. (2000). Membrane Cholesterol Content Modulates Activation of Volume-Regulated Anion Current in Bovine Endothelial Cells. The Journal of General Physiology. 115, 405-416;
- Vadim G. Shlyonsky, Frédérique Mies, Sarah Sariban-Sohraby. (2003). Epithelial sodium channel activity in detergent-resistant membrane microdomains. American Journal of Physiology-Renal Physiology. 284, F182-F188;
- Michael Edidin. (2003). The State of Lipid Rafts: From Model Membranes to Cells. Annu. Rev. Biophys. Biomol. Struct.. 32, 257-283;
- Sudarikova A.V., Negulyaev Y.A., Morachevskaya E.A. (2006). Cholesterol depletion affects mechanosensitive channel gating coupled with F-actin rearrangement. Proc. Physiol. Soc. 95–96;
- Elena Morachevskaya, Anastasiya Sudarikova, Yuri Negulyaev. (2007). Mechanosensitive channel activity and F‐actin organization in cholesterol‐depleted human leukaemia cells. Cell Biology International. 31, 374-381;
- Andrew J. Maniotis, Christopher S. Chen, Donald E. Ingber. (1997). Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc. Natl. Acad. Sci. U.S.A.. 94, 849-854;
- Hayden Huang, Roger D. Kamm, Richard T. Lee. (2004). Cell mechanics and mechanotransduction: pathways, probes, and physiology. American Journal of Physiology-Cell Physiology. 287, C1-C11;
- David Craig, André Krammer, Klaus Schulten, Viola Vogel. (2001). Comparison of the early stages of forced unfolding for fibronectin type III modules. Proc. Natl. Acad. Sci. U.S.A.. 98, 5590-5595;
- Mu Gao, David Craig, Viola Vogel, Klaus Schulten. (2002). Identifying Unfolding Intermediates of FN-III10 by Steered Molecular Dynamics. Journal of Molecular Biology. 323, 939-950;
- Viola Vogel, Wendy E Thomas, David W Craig, André Krammer, Gretchen Baneyx. (2001). Structural insights into the mechanical regulation of molecular recognition sites. Trends in Biotechnology. 19, 416-423;
- Marina E. Chicurel, Robert H. Singer, Christian J. Meyer, Donald E. Ingber. (1998). Integrin binding and mechanical tension induce movement of mRNA and ribosomes to focal adhesions. Nature. 392, 730-733;
- Cuiling Zhong, Magdalena Chrzanowska-Wodnicka, James Brown, Amy Shaub, Alexey M. Belkin, Keith Burridge. (1998). Rho-mediated Contractility Exposes a Cryptic Site in Fibronectin and Induces Fibronectin Matrix Assembly. The Journal of Cell Biology. 141, 539-551;
- Donald E. Ingber. (2006). Cellular mechanotransduction: putting all the pieces together again. The FASEB Journal. 20, 811-827;
- Carlos Vera, Robert Skelton, Frederic Bossens, Lanping Amy Sung. (2005). 3-D Nanomechanics of an Erythrocyte Junctional Complex in Equibiaxial and Anisotropic Deformations. Ann Biomed Eng. 33, 1387-1404.







