Кочующие трикстеры и охота на них
17 июня 2024
Кочующие трикстеры и охота на них
- 373
- 0
- 5
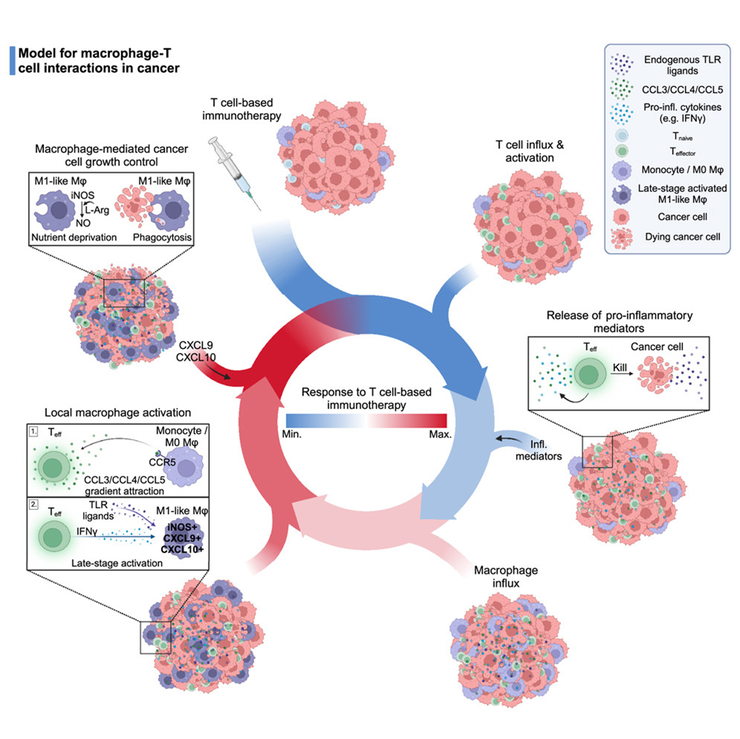
Иммунотерапия злокачественных новообразований (ЗНО) зачастую направлена на привлечение цитотоксических CD8+ Т-лимфоцитов. Оказывается, они, в свою очередь, привлекают макрофагов и поляризуют их в М1 состояние, которое важно для эффективного контроля опухоли со стороны иммунной системы [1].
-
Автор
-
Редакторы
Геном человека кодирует около 20 тысяч белков, количество же активных молекул РНК, судя по всему, еще в несколько раз больше. О большинстве этих молекул не известно почти ничего. Роль других в норме и при онкологических заболеваниях постепенно проясняется. Но и в «старых» и, казалось бы, хорошо изученных биомолекулах порой открываются новые важные черты.
Рецептор TREM2, согласно Атласу Ракового Генома (Cancer Genome Atlas, TCGA), сверхэкспрессирован во многих злокачественных опухолях. Это рецептор миелоидных клеток; высоким уровнем экспрессии этого рецептора характеризуются опухоль-ассоциированные макрофаги, которые подавляют иммунную систему. Сигнальный путь, регулируемый TREM2, приводит к снижению экспрессии генов, связанных с воспалением, а также цитокинов, которые привлекают CD8+ Т-лимфоциты. Комбинация антител к TREM2 и PD-1 (известный иммунный чекпоинт) показала многообещающие эффекты при нескольких различных видах рака, включая саркому, колоректальный рак и рак молочной железы.
Предположив, что этот рецептор может также способствовать развитию опухолей центральной нервной системы, китайские ученые создали мышей с гомозиготным нокаутом по гену TREM2 (причем оказалось, что на основные популяции иммунных клеток это никак не повлияло). Чтобы создать модель глиобластомы, животным в мозг ввели клетки глиобластомы. Однако, вопреки ожиданиям, опухоли у мышей, нокаутных по TREM2, росли не медленнее, а быстрее. Более того, та же картина наблюдалась даже после того, как TREM2-нокаутных мышей скрестили с животными со спонтанной генетической глиобластомой, и в параллельном эксперименте — с фармакологическим блокированием TREM2 у мышей с перевиваемой опухолью.
И наоборот, сверхэкспрессия TREM2 подавляла развитие глиобластомы и способствовала иммунотерапии блокадой иммунных чекпоинтов. Эта работа в очередной раз показывает, что роль одного и того же белка в раке может зависеть от микроокружения опухоли и общего молекулярного контекста. Как микроокружение центральной нервной системы определяет различные роли TREM2, читайте в статье в журнале Cancer Cell [2].
Одним из важнейших явлений, сопровождающих развитие злокачественных новообразований, является изменение метаболизма трансформированных клеток — и центральное место занимает «эффект Варбурга». Раковые клетки даже в присутствии кислорода предпочитают аэробный гликолиз митохондриальному дыханию. Это приводит к активной выработке лактата — опухоль как бы «закисляет» пространство вокруг себя. Несмотря на то, что эффект Варбурга известен уже сотню лет, вокруг него до сих пор много неясности. В частности, как ускоренный метаболизм глюкозы с образованием лактата связан с ростом опухоли и метастазированием.
В новом исследовании [3], опубликованном в журнале Molecular Cancer, ученые выявили связь между кольцевой РНК circSIPA1L3 и метаболизмом глюкозы. Как утверждается, эта кольцевая РНК является одним из центральных посредников в процессе адаптации метаболизма раковых клеток при трижды отрицательном раке молочной железы (TNBC) к энергетическому стрессу. Авторы продемонстрировали, что она оказывает существенный вклад в «стволовость» раковых клеток при TNBC и в развитие опухоли как in vitro в культурах клеток, так и in vivo в мышиных моделях с пересаженной опухолью.
Регуляция метаболизма глюкозы происходит через взаимодействие с белком IGF2BP3 (связывающий мРНК инсулиноподобного фактора роста 2 белок 3). Высокий уровень экспрессии этого белка обычно ассоциируется с худшим прогнозом, и ученым удалось показать, что в случае нокдауна этого белка кольцевая РНК circSIPA1L3 берет на себя часть функции этого белка в развитии опухоли. И что интереснее — эта кольцевая РНК также способна блокировать деградацию белка IGF2BP3 в случае его убиквитинирования. Кроме того, circSIPA1L3 повышал стабильность мРНК таких белков, участвующих в транспорте глюкозы, как LC16A1 и RAB11A. Так что ее вклад в метаболические процессы можно назвать комплексным.
Мутация в Янус-киназе (JAK2) с заменой валина на фенилаланин в 617 положении вносит вклад в развитие изрядного спектра миелопролиферативных заболеваний. Ученые из Германии, работая вместе с институтом стволовых клеток Кембриджа, исследовали, как мутантный JAK2, экспрессируемый исключительно в нейтрофилах, будет влиять на воспалительные сигналы. Надо отметить, что мутации в JAK2 часто сопровождаются мутациями в гене кальретикулина (CALR) у больных с миелопролиферативным заболеваниями. Ключевой характеристикой злокачественных перерождений с мутациями JAK2 и CALR является хроническое воспаление, которое способствует клональной эволюции опухоли. Целью ученых было установить вклад каждого из двух сигнальных путей в этот патологический процесс. Нелегкая задача!
Дело в том, что сигнальный путь JAK2-STAT обладает довольно широкой спецификой, но и кальретикулин обладает не менее широким влиянием, поскольку связывает ионы кальция — один из основных вторичных мессенджеров в клетке.
Результаты экспериментов, проведенных на генно-модифицированых мышах, показали, что специфическая экспрессия в нейтрофилах мутантного JAK2 активирует синтез воспалительных цитокинов, в том числе интерлейкина 1 (IL-1), в то время как мутантный кальретикулин — нет. То же с тромбоцитозом и гиперплазией мегакариоцитов. Таким образом, именно мутации в JAK2 являются драйверами патологического воспаления в миелопролиферативных заболеваниях.
Обе мутации, рассмотренные изолировано друг от друга, оказывают различное воздействие на метаболизм, а кроме того — по-разному перепрограммируют характеристики белков адгезии лейкоцитов ICAM-1 и VCAM-1. На этом результаты исследования не исчерпываются — с подробностями можно ознакомиться в Journal of Hematology and Oncology [4].
Больше статей:
- Tumor cells impair immunological synapse formation via central nervous system-enriched metabolite [5] — белок NAT8L катализирует реакцию с формированием N-ацетиласпартата (NAA). Активнее всего он экспрессируется в жировой ткани и в нервной системе, производя NAA при воспалении головного мозга. Но, проанализировав мультиомиксные данные пациентов с HER2+ раком груди, ученые обнаружили, что NAT8L ослабляет иммунный ответ на опухоль, подавляя деятельность естественных киллеров и CD8+ Т-лимфоцитов.
- Cell surface CD55 traffics to the nucleus leading to cisplatin resistance and stemness by inducing PRC2 and H3K27 trimethylation on chromatin in ovarian cancer [6] — в норме CD55 — заякоренный снаружи клеточной мембраны белок, который оберегает клетки от лизиса, опосредованного комплементом. Но при ЗНО CD55 может быть направлен в ядро, в результате чего он может вызывает устойчивость к химиотерапии цисплатином при раке яичников. Делеция серин-треонинового домена CD55 достаточна для того, чтобы восстановить уязвимость раковых клеток перед цисплатином.
- Clinical validation of a cell-free DNA fragmentome assay for augmentation of lung cancer early detection [7] — машинное обучение в применении к ДНК-фрагментомике, чтобы найти подходящие маркеры рака легкого.
- Exposure of benzo[a]pyrene induces HCC exosome-circular RNA to activate lung fibroblasts and trigger organotropic metastasis [8] — при гепатоцеллюлярной карциноме интеркалирующий агент бензапирен индуцирует доставку кольцевых РНК в легкие, где те посредством микроРНК активируют фибробласты. Это провоцирует формирование преметастатической ниши в легких. Обратный сигнальный каскад, направленный к опухоли, индуцирует метастазирование.
- Premature thymic functional senescence is a hallmark of childhood acute lymphoblastic leukemia survivorship [9] — о старении вилочковой железы у выживших после детской острой лимфобластной лейкемии.
- Ultrasensitive and multiplexed tracking of single cells using whole-body PET/CT [10] — высокочувствительная позитронно-эмиссионная томография с возможностью отслеживать до 20 единичных клеток.
Литература
- Marit J. van Elsas, Jim Middelburg, Camilla Labrie, Jessica Roelands, Gaby Schaap, et. al.. (2024). Immunotherapy-activated T cells recruit and skew late-stage activated M1-like macrophages that are critical for therapeutic efficacy. Cancer Cell. 42, 1032-1050.e10;
- Jian Zhong, Xudong Xing, Yixin Gao, Lei Pei, Chenfei Lu, et. al.. (2024). Distinct roles of TREM2 in central nervous system cancers and peripheral cancers. Cancer Cell. 42, 968-984.e9;
- Yiran Liang, Fangzhou Ye, Dan Luo, Li Long, Yajie Wang, et. al.. (2024). Exosomal circSIPA1L3-mediated intercellular communication contributes to glucose metabolic reprogramming and progression of triple negative breast cancer. Mol Cancer. 23;
- Tobias Ronny Haage, Emmanouil Charakopoulos, Vikas Bhuria, Conny K. Baldauf, Mark Korthals, et. al.. (2024). Neutrophil-specific expression of JAK2-V617F or CALRmut induces distinct inflammatory profiles in myeloproliferative neoplasia. J Hematol Oncol. 17;
- Yihong Li, Min Huang, Minger Wang, Yi Wang, Peng Deng, et. al.. (2024). Tumor cells impair immunological synapse formation via central nervous system-enriched metabolite. Cancer Cell. 42, 985-1002.e18;
- Rashmi Bharti, Goutam Dey, Debjit Khan, Alex Myers, Olivia G. Huffman, et. al.. (2024). Cell surface CD55 traffics to the nucleus leading to cisplatin resistance and stemness by inducing PRC2 and H3K27 trimethylation on chromatin in ovarian cancer. Mol Cancer. 23;
- Peter J. Mazzone, Peter B. Bach, Jacob Carey, Caitlin A. Schonewolf, Katalin Bognar, et. al.. (2024). Clinical validation of a cell-free DNA fragmentome assay for augmentation of lung cancer early detection. Cancer Discovery;
- Wei Mu, Pengfei Gu, Huating Li, Jinjin Zhou, Yulun Jian, et. al.. (2024). Exposure of benzo[a]pyrene induces HCC exosome‐circular RNA to activate lung fibroblasts and trigger organotropic metastasis. Cancer Communications;
- Tibila Kientega, Sophie Marcoux, Jessica Bourbonnais, Jade Montpetit, Maxime Caru, et. al.. (2024). Premature thymic functional senescence is a hallmark of childhood acute lymphoblastic leukemia survivorship. Blood Cancer J.. 14;
- Hieu T. M. Nguyen, Neeladrisingha Das, Matthew Ricks, Xiaoxu Zhong, Eri Takematsu, et. al.. (2024). Ultrasensitive and multiplexed tracking of single cells using whole-body PET/CT. Sci. Adv.. 10.