Короче говоря: сокращение генетического кода бактерии
17 февраля 2026
Короче говоря: сокращение генетического кода бактерии
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Генетический код — это своего рода «язык», на котором записана информация о том, как устроены живые организмы. Почти у всех организмов этот язык устроен одинаково. В работе Escherichia coli with a 57-codon genetic code, опубликованной в журнале Science в 2025 году, о которой пойдет речь в этой статье, ученые показали, что этот язык можно существенно переписать.
Генетический «язык» содержит много синонимов: одну и ту же аминокислоту могут кодировать разные кодоны. Авторы статьи задались вопросом: можно ли переписать геном так, чтобы часть этих синонимов исчезла? Для этого они создали бактерию Escherichia coli с полностью синтетическим геномом, в котором несколько кодонов были заменены синонимичными вариантами. В результате количество используемых кодонов сократилось с 64 до 57. Полученный организм назвали Syn57.
С практической точки зрения такая перекодировка позволяет «освободить» часть кодонов и использовать их для задач биотехнологии и фармацевтики, например, для включения в белки новых, необычных аминокислот. Но не менее важно и фундаментальное значение этой работы: эксперимент показывает, что генетический код гораздо гибче, чем считалось раньше, и помогает лучше понять, как он мог возникнуть в ходе эволюции.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Генетический код: великий и универсальный
Что объединяет человека, бактерий, китов, вомбатов, утконосов и всех остальных живых существ? На самом деле больше, чем может показаться. И одна из самых общих черт — это генетический код (рис. 1).
Рисунок 1. Генетический код объединяет разных живых существ.
рисунок автора
Информация о том, как должен выглядеть и работать организм, содержится в его генах. На практике это значит, что, зная, какие гены есть у организма, мы можем восстановить биохимические реакции в его клетках. Эти реакции в основном выполняются белками. Гены можно сравнить с чертежами, а белки — с деталями машины, построенной по этим чертежам. Генетический код — это правила, по которым из генов-чертежей строятся детали-белки. И эти правила, за несколькими исключениями, универсальны для всех живых существ.
Метафора хорошая, но давайте посмотрим на гены и белки чуть реалистичнее. Каждый ген — это кусочек длинной молекулы ДНК в клетках живых организмов. Эта длинная молекула состоит из небольших блоков, как бусы из бусин (рис. 2). Блоки эти называются «нуклеотиды», и их бывает 4 вида, которые принято обозначать: A, G, T, C. Белки устроены похоже: это тоже молекулы-бусы, которые состоят из блоков. Однако химическая природа у этих блоков другая: это аминокислоты. В составе белков обычно встречается 20 видов аминокислот.
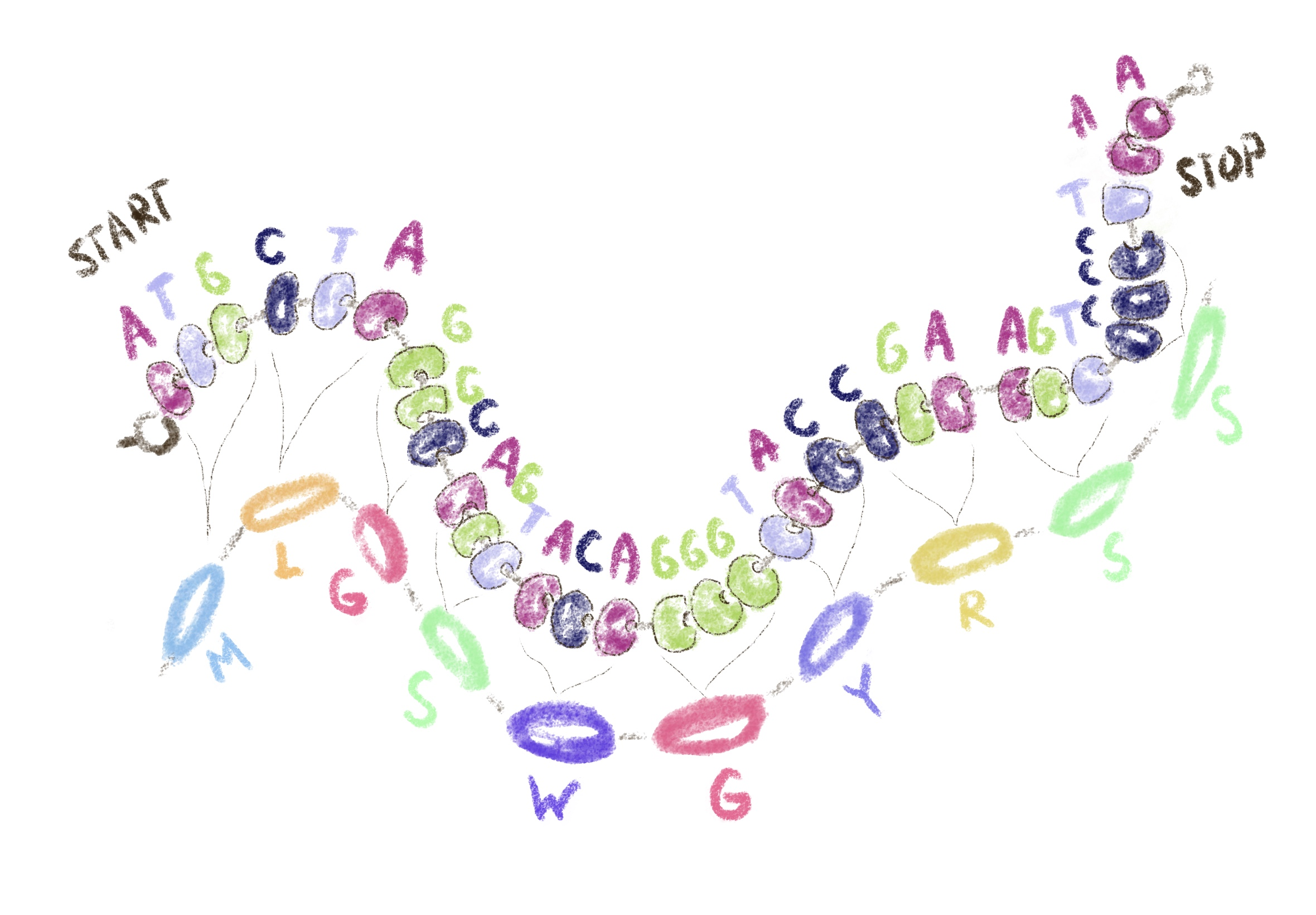
Рисунок 2. Гены состоят из нуклеотидов, каждая тройка которых соответствует одной аминокислоте белка. Отдельные тройки нуклеотидов (старт- и стоп-кодоны) обозначают начало и конец гена.
рисунок автора
Словарь для молекул
Гены написаны на языке нуклеотидов, а белки — на языке аминокислот. И языки эти не очень-то похожи. Там, где у генов только 4 «слова», у белков их целых 20! Чтобы прочитать ген-чертеж и сделать по нему белок-деталь, нужны какие-то правила перевода, что-то вроде словаря. Вот эти правила и называются «генетический код». Каждой аминокислоте соответствует тройка (или «триплет») нуклеотидов, точнее говоря, несколько альтернативных триплетов (рис. 2).
В словаре жизни много синонимов
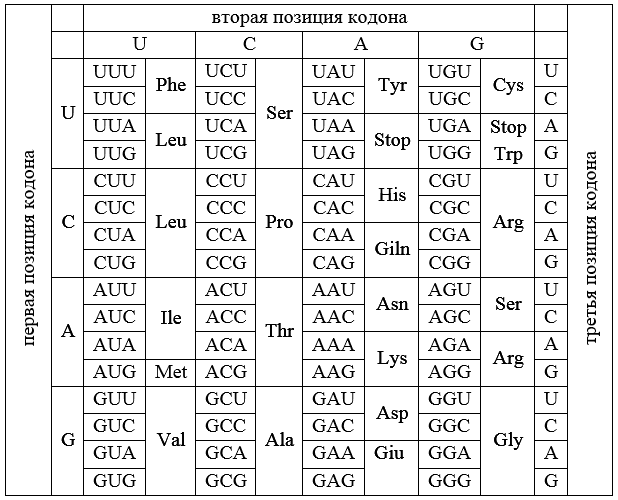
Рисунок 4. Стандартный генетический код.
Чтобы записать 20 слов языка белков, на языке нуклеотидов (в которым только 4 слова) нужно использовать сочетания слов. Если взять сочетания по два нуклеотида из четырех, получается 16 — мало. А если взять по три из четырех — получается 64. Очень хорошо, даже с избытком! Хватает и на кодирование аминокислот, и на знак «точка», позволяющий определить, где заканчивается «предложение» для кодирования одного белка. Каждую такую тройку нуклеотидов называют «кодоном». Знак «точки» принято называть «стоп-кодоном». Кроме того, один из кодонов совмещает две функции. Во-первых, кодирует аминокислоту метионин. Во-вторых, обозначает начало той части гена, в которой записана последовательность для синтеза белка. Этот кодон-совместитель называют «старт-кодон».
Некоторые слова языка белков имеют аж по шесть соответствий в языке нуклеотидов, для многих — четыре. Скажем, для аминокислоты аланин есть четыре триплета. Они все начинаются на GC, а третья буква может быть любая. Только две аминокислоты кодируются единственным триплетом (то есть тройкой) из нуклеотидов. Под знак «точки», стоп-кодон, забронировано три триплета. Таблица соответствия триплетов и аминокислот показана на рисунке 4.
Почему ученых интересует сокращение генетического кода?
Избыточность генетического кода — то, что на двадцать аминокислот приходится 64 триплета — на самом деле, довольно интригующее свойство. Можно представить ситуацию, когда в ходе эволюции остается соответствие один к одному. Интересно и то, что некоторые аминокислоты соответствуют только одному кодону, а для некоторых забронировано шесть. То, откуда генетический код взялся, как сформировался и насколько он пластичен — отдельная область эволюционной науки.
Довольно часто для того, чтобы изучить, как что-то работает, нужно аккуратно это сломать. А что, если создать организм, который будет использовать более экономичную схему кодирования? Например, для аланина можно оставить только два триплета из четырех. Если такой организм будет нежизнеспособен, факт того, что избыточность кода зачем-то нужна, направит исследование на поиски неизвестных свойств генетического кода. Если сокращение генетического кода возможно на практике, исследование конкретных вариантов сокращенного кода поможет лучше понять то, как он сформировался. Кроме теоретического интереса, это может быть полезно для создания антибиотиков или белков с удобными для фармацевтической промышленности свойствами. В следующем разделе мы поговорим о том, как именно можно использовать такие организмы для создания лекарств.
Практические перспективы сокращения генетического кода
Использование ненатуральных (они же неканонические или нестандартные) аминокислот в синтезе белка у бактерий бывает полезно по нескольким причинам. С их помощью можно добавлять в белки функциональные группы, которых нет в природе (например, флуорофоры, азиды, металло-связывающие группы), что позволяет метить белки или изменять их свойства. Например, если белок с неизвестной функцией пометить флуоресцентной меткой, то, используя флуоресцентную микроскопию, можно отследить его локализацию внутри клетки и предположить его функцию.
Если бактерии становятся зависимыми от ненатуральной аминокислоты, они не смогут выжить вне лабораторных условий и не смогут передавать свои гены другим организмам. Это может быть очень полезным для контроля распространения лабораторных штаммов, устойчивых к антибиотикам [1], [2].
Использование таких аминокислот в составе белков может повысить их стабильность, устойчивость к разрушению, изменить биохимические свойства или снизить иммуногенность — это полезно в промышленности и медицине. Например, таким образом удалось увеличить термостабильность белка гомосерин-О-сукцинилтранферазы, ключевого в синтезе аминокислоты метионина у кишечной палочки [3]. Это может быть полезно для промышленной наработки метионина. Более близкий к человеку пример — создание лекарства против рака на основе антител, содержащих ненатуральные аминокислоты, которые позволяют им необратимо связываться с раковыми клетками, что не позволяет им «спрятаться» от иммунной системы [4].
Другое важное применение расширения генетического кода для биотехнологий — создание бактерий, устойчивых к вирусам-бактериофагам. Дело в том, что вирусы используют механизмы биосинтеза клетки-жертвы для создания своих белков. Использование генетического кода, отличного от универсального, защищает клетку от вируса [1], [5].
Предыдущие подходы к расширению генетического кода
Ученым уже удавалось расширять генетический код: например, заставлять системы клетки использовать два из трех стоп-кодонов для распознавания двух неприродных аминокислот [6]. В таких работах в клетки бактерий вводится тРНК, способная распознавать один из трех стоп-кодонов, но при этом несущая на себе не используемую в обычном синтезе аминокислоту. Впрочем, этот метод оказался малоэффективен из-за того, что новая тРНК не выдерживает конкуренции с естественной системой, которая использует стоп-кодон для завершения синтеза белка [7]. Альтернативой этому методу является использование тРНК, специфичной не к стоп-кодону, а к одному из редко используемых кодонов. В разных организмах использование альтернативных триплетов для одной и той же аминокислоты — например, шесть кодонов для серина — не одинаково по частоте. Обычно клетки предпочитают конкретные кодоны, другие же принято называть редкими. Для редких кодонов синтезируется меньше тРНК, и конкуренция для искусственно введенной тРНК ниже [7], [8]. Однако расширение за счет дополнительных тРНК не предполагает фундаментального изменения геномной организации клетки. Несмотря на практическую значимость, эти работы не поднимают фундаментальных вопросов о происхождении и эволюции генетического кода. В работе Escherichia coli with a 57-codon genetic code, опубликованной в журнале Science в 2025 году [9], прокладываются пути для понимания того, является ли избыточность генетического кода необходимостью или случайностью.
Шаг за шагом
Теоретически, 43 из 64 кодонов избыточны и могут быть высвобождены для новых аминокислот. Однако на практике это пока никому не удавалось. Проблема в том, что организация генома значительно сложнее, чем набор генов, идущих друг за другом. Любые изменения в последовательности могут иметь вредные для жизнеспособности клетки последствия, и, разумеется, чем больше подобных изменений вносится, тем выше шанс нарваться на губительную мутацию.
С наскока такую цель не взять, поэтому история перекодирования геномов — это история небольших шагов. В 2011 году была опубликована статья, где показано введение 314 мутаций в геноме кишечной палочки [10]. В 2016 году была предпринята одна из первых попыток создать штамм Escherichia coli с 57-кодонным генетическим кодом [11]. Для этого из генома убрали один стоп-кодон, а также по два кодона, кодирующих лейцин, аргинин и серин, заменив их синонимическими вариантами. Эта попытка оказалась не вполне успешной, поскольку сохранилась функциональность около 90% генома (более подробно об этом можно узнать в оригинальной статье).
В 2019 году другая группа ученых сделала «шаг назад» и создала 61-кодонную кишечную палочку Syn61, у которой оставили только один триплет для точки, а для аминокислоты серин словарик сократили с 6 до 4 триплетов [12], [13]. Геном Syn61 был получен с помощью 18 000 изменений. Эта попытка была достаточно успешной. Модифицировав разработанный метод, в описываемой мною статье ученым удалось ввести уже 101 тысячу замен и сократить генетический до 57 кодонов, освободив 7 кодонов для потенциального использования [9]. Триплетов для серина стало два из шести, для аланина — два из четырех, для точки — два из трех. Полученную бактерию назвали Syn57. Она вполне жизнеспособна, хотя скорость ее роста в четыре раза ниже, чем у обычной кишечной палочки. Авторы статьи уже определили, как в целом изменилась работа генов у Syn57, но пока что конкретные причины замедленного роста неясны и остаются направлением дальнейшей работы.
Сто тысяч и одна замена
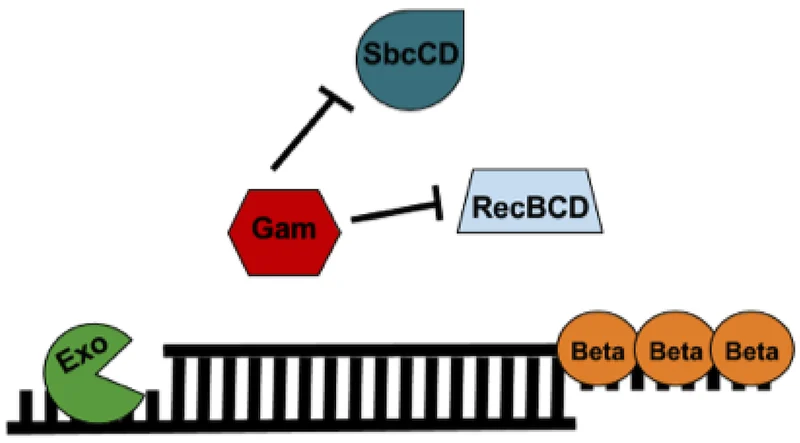
Рисунок 5. Компоненты системы lambda red recombination.
Как же происходит создание бактерии с сокращенным генетическим кодом? Конечно, это огромная, кропотливая работа.
Для того, чтобы понять суть подхода, давайте посмотрим на другие способы манипуляции с генами. Один из базовых методов генетической инженерии — клонирование (наработка большого количества идентичных ДНК-молекул) с помощью рестриктаз. Рестриктазы — это белки, которые способны узнавать конкретную последовательность ДНК и разрезать ее в этом месте. В основе метода заложено его ограничение: если в той последовательности ДНК, с которой мы хотим работать, нет кусочка, узнаваемого рестриктазой, внести изменение не получится. К счастью, существует и метод, у которого этого ограничения нет — lambda red recombination. Как же он работает?
Для работы этой системы необходимо четыре компонента: кусочек ДНК, который ученые хотят вставить в геном бактерии, и три белка, которые обеспечивают вставку (рис. 5).
Линейная ДНК, вообще говоря, воспринимается клеткой как угроза — это может быть ДНК вируса или признак разрыва в геноме — поэтому ДНК-вставку нужно защитить от разрушения внутренними защитами. Это обеспечивает белок Gam. Для того, чтобы двухцепочечная ДНК-вставка могла присоединиться к геному, у нее должен быть так называемый «липкий конец» — одноцепочечный участок на конце. Белок Exo откусывает одноцепочечный участок вставки, создавая такой «липкий конец». Однако этот липкий конец тоже может быть мишенью для белков клетки, и его защитой занимается белок Beta. Он же способствует тому, чтобы вставка встроилась в геном бактерии.
Откуда берутся эти белки? Обычно в подобных экспериментах используют заранее модифицированные штаммы бактерий, которые умеют синтезировать их в достаточных количествах. В клетку такого штамма с помощью специальных процедур вводится линейная ДНК-вставка, и белки Gam, Exo и Beta делают свое дело. Иногда используемая вставка создается одноцепочечной. Тогда достаточно присутствия белка Beta.
Обычно метод lambda red recombination используют для вставок длиной не более 2–3 тысяч нуклеотидов, поскольку его эффективность падает с увеличением длины вставляемой последовательности. Предположительно, это связано с тем, что длинные дцДНК трудно доставить в клетки без повреждений. Для задачи введения изменений в масштабах генома — а это около 3 800 000 нуклеотидов — гипотетически потребовалось бы около 1,3 млн процедур по методу lambda red! Это, разумеется, неосуществимо.
В описываемой статье эту проблему решили так: нужную ДНК длиной более 100 000 нуклеотидов встраивали в кольцевую молекулу ДНК (эписому), переносили эписому с помощью в бактерию, и уже из эписомы с помощью метода CRISPR/Cas вырезали нужный кусок ДНК и интегрировали его в основной геном благодаря рекомбинации. Такой подход ученые назвали REXER (Replicon EXcision Enhanced Recombination) [14]. Такие большие участки, перенесенные через эписомы, позволили провести полногеномную модификацию (по сути, синтез) за 38 раундов, что, как видно, существенно меньше, чем 1,3 миллиона (см. рис. 6). Так и была создана Syn57.
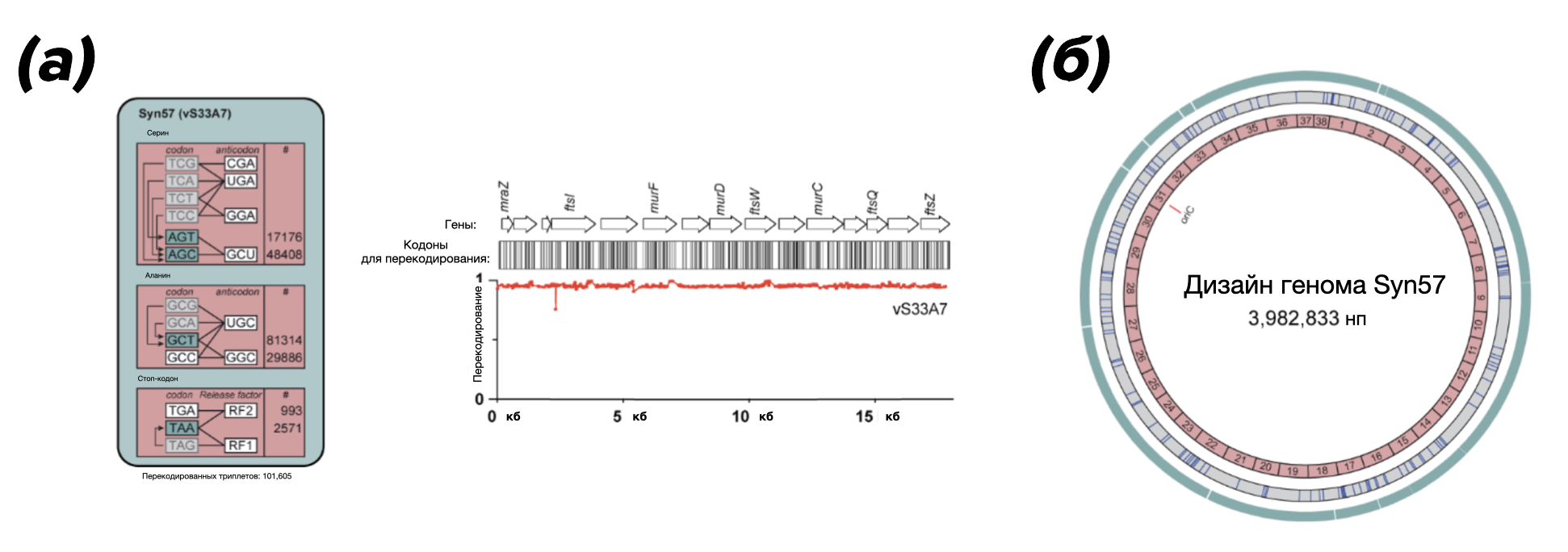
Рисунок 6. Дизайн исследования. (а) — применение одной из схем компрессии генетического кода с сокращением до 7 кодонов (vS33A7) к геному E. coli MDS42 приводит к созданию перекодированного генома с генетическим кодом из 57 кодонов. Числа рядом с кодонами обозначают их общее количество в спроектированном геноме. Ландшафт перекодирования после применения REXER по схеме vS33A7 демонстрирует полное перекодирование в пределах участка длиной 20 тысяч нуклеотидов. (б) — карта синтетического генома с 57-кодонным генетическим кодом, в котором полностью удалены кодоны TCG, TCA, TCC, TCT, GCA, GCG и TAG. Внешнее кольцо указывает положение всех событий перекодирования. Синие полосы в сером среднем кольце обозначают случаи, когда ученым требовалось использовать дополнительные методы для достижения перекодирования. Розовое внутреннее кольцо означает 38 фрагментов по 100 тысяч нуклеотидов (конечный геном собирался из этих фрагментов, см. раздел «Сто тысяч и одна замена»).
адаптировано из [9]
«Синонимичны, но не идентичны»
Синонимические мутации — это мутации, которые не меняют аминокислотную последовательность белка, то есть именно те, которые вводят для перекодирования генетического кода. Несмотря на то, что они не затрагивают последовательность аминокислот, такие мутации не обязательно безвредны. Известно, что от кодонного состава зависит, насколько эффективно рибосома может связаться с началом мРНК, а следовательно — начнет ли она синтез белка [15].
Кроме того, гены редко работают поодиночке. В бактериях они часто объединены в функциональные блоки (опероны), и изменение кодонов в одном месте может неожиданно нарушить согласованную работу сразу нескольких генов. Это означает, что замена кодонов может влиять работу соседних генов [16].
Во время самой трансляции выбор кодонов тоже имеет значение: некоторые последовательности внутри гена взаимодействуют с рибосомой и заставляют ее замедляться или делать паузы. Эти паузы меняют темп сборки белка и могут влиять на его формирование уже в процессе синтеза [17]. Эти и другие наблюдения подсказывают, что последствия перекодирования трудно предсказуемы [18].
Неудивительно, что при создании Syn57 (напомню, что авторам пришлось ввести более ста тысяч мутаций, чтобы достигнуть своей цели) ученые столкнулись со сложностями. Перекодирование некоторых участков оказалось невозможным в рамках стандартной процедуры: бактерии с такими заменами показывали очень низкую скорость роста. Для решения этой проблемы авторы работы применили более тонкую настройку замен.
Геном ручной работы
Известно, что первые 2–8 кодонов влияют на эффективность начала трансляции [19]. Авторы протестировали разнообразные варианты перекодирования начальных участков в тех генах, которые было невозможно перекодировать в рамках стандартной процедуры. Для других участков сработало использование перекодирования по альтернативной схеме (которая, впрочем, не увеличивала число используемых кодонов). В случаях, когда замена кодона нарушала регуляторные участки ДНК, они корректировались путем дополнительных мутаций. Наконец, если перекодирование затрагивало перекрывающиеся гены (такое тоже случается, когда кончик одного гена одновременно является началом другого), эти участки искусственно удлинялись. Всего таких тонких настроек потребовалось около 200, что довольно немного при общем объеме введенных мутаций!
Биологические инсайты
Какие гены «отказывались» перекодироваться?
Какие же гены потребовалось настраивать? Это участки, включающие консервативные, то есть мало изменяющиеся в ходе эволюции, гены, а именно гены, отвечающие за синтез элементов рибосомы и белков, важных для энергетического обмена клетки (АТФ-синтазы и НАДH-дегидрогеназы). Консервативность этих генов подсказывает, что даже небольшие изменения в них могут оказать существенное влияние на клетку, поэтому это наблюдение не противоречит биологической интуиции. Помимо описанных генов, настройки потребовали два гена, кодирующих белки, без которых клетка не может выжить: ген ДНК-лигазы, без которой невозможно удвоение ДНК при делении клетки, и ген zipA, также необходимый для деления клетки.
Как перекодирование повлияло на жизнеспособность клеток?
Несмотря на масштаб введенных изменений и сложности с отдельными участками, Syn57 оказалась жизнеспособной. Основной параметр, который измеряют, когда хотят оценить жизнеспособность бактерии — это скорость роста. Относительно бактерии дикого типа скорость роста Syn57 упала в 4 раза, но, тем не менее, этого достаточно. Мне было бы очень интересно посмотреть на эксперимент по эволюции в пробирке для полученного штамма. Проявится ли отбор на восстановление «природного» генетического кода, или же эволюция пойдет каким-то иным путем? Будем надеяться, что авторы скоро опубликуют такое исследование.
Генетический код: случайность или необходимость?
Создание организмов с сокращенным генетическим кодом и, следовательно, с потенциалом использования высвобожденных кодонов для нестандартных аминокислот, несет огромное практическое значение. Производство новых лекарств, методик лабораторного анализа и предотвращение распространение генов устойчивости к антибиотикам — лишь самые очевидные из них. Однако эта работа несет и важнейшее фундаментальное значение для изучения происхождения и эволюции генетического кода.
Происхождение универсального генетического кода до сих остается по большому счету загадкой. Существуют четыре основные гипотезы:
- Генетический код эволюционировал таким образом, чтобы минимизировать эффект мутаций, то есть он является оптимальным. У этой гипотезы есть сильный контраргумент: в теории могут существовать и более оптимальные варианты; например, для триптофана есть только один кодон, мутация в котором легко превращает его в знак точки, стоп-кодон.
- Генетический код эволюционировал вместе с эволюцией путей биосинтеза аминокислот. У этой гипотезы есть свои «за» и «против», однако решающего аргумента в ее пользу пока нет. Более подробно об этой и следующей в списке гипотезе читатель может узнать из книги Михаила Никитина «Происхождение жизни: от туманности до клетки» [20].
- Генетический код сформировался на ранних стадиях происхождения биомолекул и отражает прямые химические соответствия между триплетами ДНК и аминокислотами. Опять-таки, эта гипотеза имеет свои аргументы, но недостаточно сильные.
- Гипотеза «застывшей случайности», выдвинутая Фрэнсисом Криком еще в 1968 году. Согласно этой гипотезе, генетический код сформировался случайно и закрепился в эволюции, поскольку оказался хоть и не идеальным, но достаточно хорошо работающим.
Работы по перекодированию кодонов показывают, что живые организмы могут выживать и размножаться с измененным генетическим кодом, то есть этот код не является единственно возможным. По мнению первого автора статьи Уэса Робертсона, результаты их работы склоняют его считать верной гипотезу «застывшей случайности».
Заключение
Гаргантюанская по масштабу работа по созданию бактерии с сокращенным генетическим кодом продолжает захватывать страницы истории синтетической биологии. Практическое и фундаментальное значение этой работы — новые подходы к созданию бактерий с полезными свойствами и очередной шаг на пути к пониманию природы генетического кода — очень велико. Пока что проблемой остается низкая скорость роста Syn57, однако авторы работы надеются решить и ее. Думаю, что в ближайшее время появятся и публикации, описывающие свойства и особенности Syn57, которые могут помочь нам лучше понимать работу генетического кода и историю его происхождения.
Литература
- Akos Nyerges, Svenja Vinke, Regan Flynn, Siân V. Owen, Eleanor A. Rand, et. al.. (2023). A swapped genetic code prevents viral infections and gene transfer. Nature. 615, 720-727;
- Jérôme F. Zürcher, Wesley E. Robertson, Tomás Kappes, Gianluca Petris, Thomas S. Elliott, et. al.. (2022). Refactored genetic codes enable bidirectional genetic isolation. Science. 378, 516-523;
- Jack C. Li, Tao Liu, Yan Wang, Angad P. Mehta, Peter G. Schultz. (2018). Enhancing Protein Stability with Genetically Encoded Noncanonical Amino Acids. J. Am. Chem. Soc.. 140, 15997-16000;
- Qingke Li, Qu Chen, Paul C. Klauser, Mengyuan Li, Feng Zheng, et. al.. (2020). Developing Covalent Protein Drugs via Proximity-Enabled Reactive Therapeutics. Cell. 182, 85-97.e16;
- Wesley E. Robertson, Louise F. H. Funke, Daniel de la Torre, Julius Fredens, Thomas S. Elliott, et. al.. (2021). Sense codon reassignment enables viral resistance and encoded polymer synthesis. Science. 372, 1057-1062;
- Lei Wang, Ansgar Brock, Brad Herberich, Peter G. Schultz. (2001). Expanding the Genetic Code of Escherichia coli. Science. 292, 498-500;
- Jason W. Chin. (2017). Expanding and reprogramming the genetic code. Nature. 550, 53-60;
- Wenlong Ding, Wei Yu, Yulin Chen, Lihui Lao, Yu Fang, et. al.. (2024). Rare codon recoding for efficient noncanonical amino acid incorporation in mammalian cells. Science. 384, 1134-1142;
- Wesley E. Robertson, Fabian B. H. Rehm, Martin Spinck, Raffael L. Schumann, Rongzhen Tian, et. al.. (2025). Escherichia coli with a 57-codon genetic code. Science. 390;
- Farren J. Isaacs, Peter A. Carr, Harris H. Wang, Marc J. Lajoie, Bram Sterling, et. al.. (2011). Precise Manipulation of Chromosomes in Vivo Enables Genome-Wide Codon Replacement. Science. 333, 348-353;
- Nili Ostrov, Matthieu Landon, Marc Guell, Gleb Kuznetsov, Jun Teramoto, et. al.. (2016). Design, synthesis, and testing toward a 57-codon genome. Science. 353, 819-822;
- Julius Fredens, Kaihang Wang, Daniel de la Torre, Louise F. H. Funke, Wesley E. Robertson, et. al.. (2019). Total synthesis of Escherichia coli with a recoded genome. Nature. 569, 514-518;
- SciNat за май 2019 #3: синтетический геном для E. coli, нейрогенез в опухолях и клетки головастика, управляющие регенерацией;
- Kaihang Wang, Julius Fredens, Simon F. Brunner, Samuel H. Kim, Tiongsun Chia, Jason W. Chin. (2016). Defining synonymous codon compression schemes by genome recoding. Nature. 539, 59-64;
- Grzegorz Kudla, Andrew W. Murray, David Tollervey, Joshua B. Plotkin. (2009). Coding-Sequence Determinants of Gene Expression in Escherichia coli. Science. 324, 255-258;
- Byung-Kwan Cho, Karsten Zengler, Yu Qiu, Young Seoub Park, Eric M Knight, et. al.. (2009). The transcription unit architecture of the Escherichia coli genome. Nat Biotechnol. 27, 1043-1049;
- Gene-Wei Li, Eugene Oh, Jonathan S. Weissman. (2012). The anti-Shine–Dalgarno sequence drives translational pausing and codon choice in bacteria. Nature. 484, 538-541;
- Joshua B. Plotkin, Grzegorz Kudla. (2011). Synonymous but not the same: the causes and consequences of codon bias. Nat Rev Genet. 12, 32-42;
- Ilya A Osterman, Zoe S Chervontseva, Sergey A Evfratov, Alena V Sorokina, Vladimir A Rodin, et. al.. (2020). Translation at first sight: the influence of leading codons. Nucleic Acids Research. 48, 6931-6942;
- Никитин М. Происхождение жизни: От туманности до клетки. Москва: «Альпина нон-фикшн», 2016. — 657 с..