Лечебные препараты из живых микроорганизмов
22 ноября 2015
Лечебные препараты из живых микроорганизмов
- 25684
- 1
- 7
В некоторых случаях множественная резистентность бактерий к антибиотикам побуждает перепробовать все классы, формы и комбинации препаратов, при этом микроб может еще и позлорадствовать, настроившись на извлечение из препарата пользы. Отчасти поэтому гуляет в научно-медицинских кругах идея накормить пациента ложками пробиотиков вместо антибиотиков.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Существуют ли лекарственные средства, не вызывающие побочных эффектов и осложнений, высокоэффективные и безопасные? Ближе всего к этим идеальным характеристикам подобрались пробиотические препараты (из живых микроорганизмов — симбионтов человека) и бактериофаги (вирусы бактерий). При введении в организм человека они вступают в борьбу за существование с возбудителями инфекционных заболеваний или, в случае бактериофагов, по-партизански разлагают их изнутри. Пробиотики и фаги с разной специфичностью влияют на патогенные бактерии, все процессы развиваются в пределах микробиоценоза определенной области человеческого тела и направлены на сохранение среды обитания, иначе говоря, на подержание гомеостаза. Пробиотики и фаги обычно применяют по отдельности, но перспективным может оказаться их совместное использование.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Клин клином выбивают.
Народная мудрость
Биотехнология — медицине
В современной медицинской практике используется большое количество средств, получаемых благодаря жизнедеятельности микроорганизмов. Сюда относятся витамины, ферменты, генно-инженерные гормоны и интерфероны, заменители крови и, конечно же, антибиотики. Собственно, даже медицинский спирт — этот универсальный антисептик, народный анальгетик и антидепрессант — является продуктом бродильного метаболизма дрожжевых грибков. Традиционные и новые высокоэффективные, различные по структуре и механизму действия природные и химически модифицированные лекарственные препараты, в создании которых участвовали микроорганизмы, применяются для лечения различных заболеваний.
Когда лекарство опаснее болезни
В практике применения лекарственных средств врачу приходится встречаться с так называемыми побочными явлениями, которые могут развиваться наряду с основным действием лекарства и ограничивать возможности его применения. Побочные реакции особенно часто возникают в случаях применения лекарств, обладающих многосторонним фармакологическим эффектом (вспомним тот же этиловый спирт), тогда как цель лечения достигается благодаря использованию лишь некоторых сторон фармакодинамики данного лекарства.
Особенного внимания заслуживают в этом смысле антибиотики, поскольку они являются препаратами выбора при лечении большинства инфекционных заболеваний, а назначению антибиотиков далеко не всегда предшествует проведение необходимых микробиологических исследований. Нередки случаи нерационального применения антибиотиков широкого спектра действия, нарушения пациентами схем приема препаратов, а то и вовсе бесконтрольного самолечения. И даже при правильном использовании антибактериальное действие антибиотиков распространяется не только на патогенную, но и на нормальную микробную флору организма. Под действием антибиотиков гибнут бифидобактерии, лактобациллы, симбиотические штаммы кишечной палочки и другие полезные микробы. Освободившиеся экологические ниши тут же заселяют условно-патогенные бактерии и грибки (как правило, обладающие резистентностью к антибиотикам), которые до этого присутствовали на коже и в нестерильных полостях организма в незначительном количестве — их размножение сдерживалось нормальной микрофлорой. Антибиотикотерапия, например, может способствовать превращению мирных сапрофитных дрожжеподобных грибков Candida albicans (рис. 1), обитающих на слизистых оболочках полости рта, трахеи и кишечника, в бурно размножающиеся микроорганизмы, вызывающие ряд местных и общих поражений.
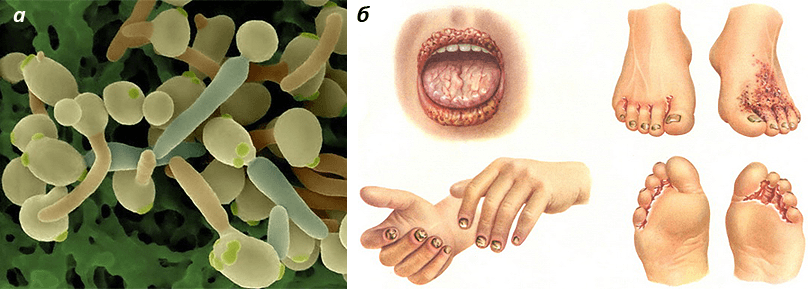
Рисунок 1. Дрожжеподобные грибки Candida albicans и последствия их активного размножения. а — Клетки Candida albicans под электронным микроскопом. б — Проявления кандидоза.
В основе других побочных эффектов могут лежать индивидуальные особенности взаимодействия организма с антибиотиком: непереносимость препарата может иметь аллергическую или псевдоаллергическую природу, быть следствием ферментопатий или попадать в загадочную категорию идиосинкразий (до выяснения механизма непереносимости).
Пробиотики вместо антибиотиков?
В настоящее время перед медицинской наукой и органами охраны здоровья всего мира стоит ответственная задача — создание эффективных антибактериальных препаратов, вызывающих как можно менее выраженные побочные реакции.
Одним из возможных решений проблемы является разработка и широкое фармакотерапевтическое использование препаратов на основе живых культур представителей нормальной микрофлоры (пробиотиков) для коррекции микробиоценозов человека и для лечения патологических состояний. Применение бактериальных препаратов основано на понимании роли нормальной микрофлоры организма в процессах, обеспечивающих неспецифическую резистентность к инфекциям, в формировании иммунного ответа, а также на установлении антагонистической роли нормофлоры и ее участия в регуляции метаболических процессов [1].
Основоположником теории пробиотиков считают И.И. Мечникова. Он полагал, что сохранение здоровья человека и продление молодости во многом зависит от обитающих в кишечнике молочнокислых бактерий, способных подавлять процессы гниения и образования токсичных продуктов. Еще в 1903 году Мечников предложил практическое использование микробных культур—антагонистов для борьбы с болезнетворными бактериями.
По некоторым данным, термин «пробиотики» был введен Вернером Коллатом в 1953 году, затем его неоднократно и по-разному толковали как ученые, так и регулирующие организации. Коллат назвал пробиотиками вещества, необходимые для развития здорового организма, своего рода «промоторы жизни» — в противоположность антибиотикам. С концовкой этого утверждения соглашались также Лилли и Стилвелл, которым часто приписывают изобретение термина, однако они уточняли, что пробиотики представляют собой вещества, вырабатываемые одними микроорганизмами и стимулирующие рост других. Подавляющее же большинство определений вращалось вокруг принятия жизнеспособных микробов с целью модуляции кишечной микрофлоры. Согласно консенсусной трактовке экспертного совета ВОЗ и ФАО, пробиотики представляют собой живые микроорганизмы, которые при принятии в достаточном количестве приносят пользу здоровью. Существенный вклад в развитие современной концепции пробиотиков внес известный биохимик, специалист по питанию животных Марсель Ванбелле [2]. Т.П. Лайонс и Р.Дж. Фэллон в 1992 году назвали наше время «наступающей эпохой пробиотиков» (и не ошиблись, судя по невероятному росту их продаж — Ред.) [1].
По сравнению с традиционными антибактериальными препаратами пробиотики имеют ряд преимуществ: безвредность (однако не при всех диагнозах и не для всех пациентов — Ред.), отсутствие побочных реакций, аллергизации и отрицательного воздействия на нормальную микрофлору. В то же время авторы ряда исследований связывают прием этих биопрепаратов с выраженным клиническим эффектом при лечении (долечивании) острых кишечных инфекций. Важной особенностью пробиотиков, по некоторым данным, является их способность модулировать иммунные реакции, оказывать в ряде случаев противоаллергическое действие, регулировать пищеварение.
В настоящее время в медицине широко используют ряд подобных бактериальных препаратов. Одни из них содержат бактерии, постоянно обитающие в организме человека («Лактобактерин», «Бифидумбактерин», «Колибактерин», «Бификол»), другие состоят из микроорганизмов, не являющихся «резидентами» человеческого тела, но способных на определенное время колонизировать слизистые оболочки или раневые поверхности, создавая на них защитную биопленку (рис. 2) и вырабатывая вещества, губительные для патогенных бактерий. К таким препаратам относятся, в частности, «Биоспорин» на основе сапрофитной бактерии Bacillus subtilis и «А-бактерин», состоящий из живых клеток зеленящего аэрококка — Aerococcus viridans [1].
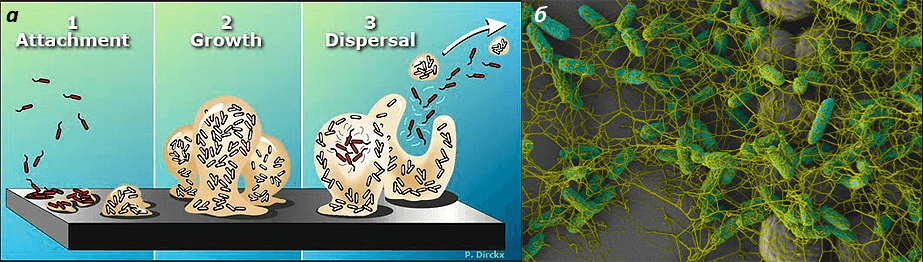
Рисунок 2. Биопленка. а — Формирование биопленки. б — Биопленка под электронным микроскопом.
Полезный микроб — аэрококк
Некоторых аэрококков (рис. 3) относят к условно-патогенным микробам, поскольку они способны вызывать заболевания у животных (например, гаффкемию у омаров) и людей с иммунодефицитами. Аэрококки часто обнаруживаются в воздухе больничных палат и на предметах медицинского назначения, выделяются от больных со стрептококковыми и стафилококковыми инфекциями и к тому же имеют определенное морфологическое сходство с этими опасными бактериями.

Рисунок 3. Клетки и колонии аэрококков. а — Бактерии под обычным световым микроскопом. б — Бактерии под электронным микроскопом. Видны округлые клетки, расположенные парами и тетрадами. в — Колонии аэрококков на питательной среде с добавлением крови. Зеленое окрашивание вокруг колоний — результат частичного разрушения гемоглобина.
фото (а) с сайта ICD 9 Codes List, (б) и (в) — сделаны авторами статьи
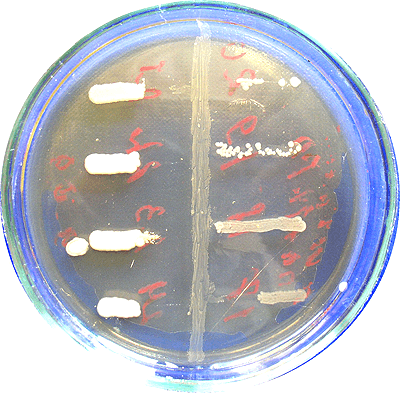
Рисунок 4. Подавление аэрококками роста патогенных бактерий. Зоны значительной задержки роста зарегистрированы при культивировании вибрионов, стафилококков, дифтерийной палочки, провиденции. Синегнойная палочка (Pseudomonas aeruginosa) к антагонистическому действию аэрококков устойчива.
фото авторов статьи
Но коллективу кафедры микробиологии Днепропетровской медицинской академии удалось выявить среди аэрококков штамм не просто безвредный для человека, но и проявляющий выраженную антагонистическую активность в отношении широкого спектра возбудителей инфекционных болезней. Так был разработан и внедрен препарат, не имеющий аналогов в мировой практике, — пробиотик «А-бактерин» для наружного и перорального применения, который не уступает по своему воздействию на микрофлору человека дорогостоящим препаратам антибиотического направления (рис. 4).
Антагонистические свойства аэрококков связаны с продукцией перекиси водорода (вещества, широко применяемого в медицине в качестве антисептика) — стабильным признаком производственного штамма А. viridans, из которого готовится «А-бактерин». Другим бактерицидным веществом, продуктом метаболизма аэрококков, является супероксидный радикал (рис. 5), образуемый этими бактериями при окислении молочной кислоты. Причем способность аэрококков окислять молочную кислоту очень важна в случае применения препарата в стоматологии, так как одной из причин кариеса является молочная кислота, образуемая стрептококками.
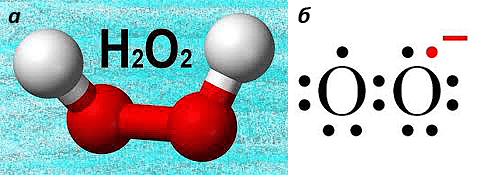
Рисунок 5. Бактерицидные вещества, образуемые аэрококками: перекись водорода (а) и супероксидный радикал (б).
В культуральной жидкости аэрококков был выявлен низкомолекулярный кислотоустойчивый и термостабильный пептид виридоцин, обладающий широким спектром антагонистической активности в отношении тех микроорганизмов, которые чаще всего вызывают госпитальные инфекции и участвуют в формировании физиологического и патологического микробиоценоза кишечника человека [3]. Кроме того, А. viridans продуцирует во внешнюю среду пептид аэроцин , способный убивать дрожжеподобные грибки. Использование «А-бактерина» с йодидом калия и этонием эффективно при урогенитальных кандидозах, так как обеспечивает направленное повреждение мембран кандид [4], [5]. Тот же эффект достигается в случае применения препарата как средства профилактики кандидозов, возникающих, например, вследствие угнетения иммунитета при ВИЧ-инфекции [1], [6], [7].
Наряду с продукцией перекиси водорода (за счет НАД-независимой лактатдегидрогеназы), а в присутствии иодида калия и образованием гипойодида (за счет глутатионпероксидазы) с более выраженным, чем у пероксида водорода, бактерицидным действием, аэрококки располагают и неоксидными компонентами антагонистической активности. Они образуют низкомолекулярный термостабильный пептид аэроцин, относящийся к классу микроцинов, активный в отношении протеев, стафилококков, эшерихий и сальмонелл. Аэроцин был выделен из культуральной жидкости методами высаливания, электродиализа и бумажной хроматографии, после чего был установлен его аминокислотный состав и показана терапевтическая эффективность при экспериментальной сальмонеллезной инфекции у мышей [8]. Аэрококкам также свойственна адгезия к эпителиальным и некоторым другим клеткам, то есть противодействие патогенным бактериям идет в том числе на уровне биопленок и колонизационной резистентности.
Кроме способности подавлять размножение патогенных бактерий, «А-бактерин» способствует регенерации поврежденной ткани, проявляет адъювантное действие, стимулирует фагоцитоз и может быть рекомендован больным, сенсибилизированным к антибиотикам и химиотерапевтическим средствам. Сегодня «А-бактерин» успешно применяется для лечения ожоговых и хирургических ран, для профилактики и лечения диареи, а также в стоматологической, урологической и гинекологической практике. Перорально «А-бактерин» используется для коррекции микрофлоры кишечника, профилактики и лечения кишечных инфекций, коррекции отдельных биохимических показателей (холестеринового профиля и уровня молочной кислоты) и активации иммунитета [1]. Другие пробиотики тоже широко применяются для лечения и профилактики кишечных инфекций, особенно у детей раннего возраста, находящихся на искусственном вскармливании [9]. Пользуются популярностью и пищевые продукты, содержащие живые пробиотические культуры.
Лечебные вирусы
Как оказалось, в терапевтических целях может быть использовано не только явление микробного антагонизма, но и паразитизма. Патогенные бактерии паразитируют в организме человека, но и они, в свою очередь, являются хозяевами для еще более мелких паразитов — бактериофагов. Применение фагов в медицине основано на их высокой специфичности. Каждый вид фагов способен размножаться только в клетках определенной группы бактерий (рис. 6). Бактериофаги принципиально не способны повреждать человеческие клетки, и кроме того, бактерии-симбионты человека и патогенные бактерии обычно восприимчивы к разным фагам.
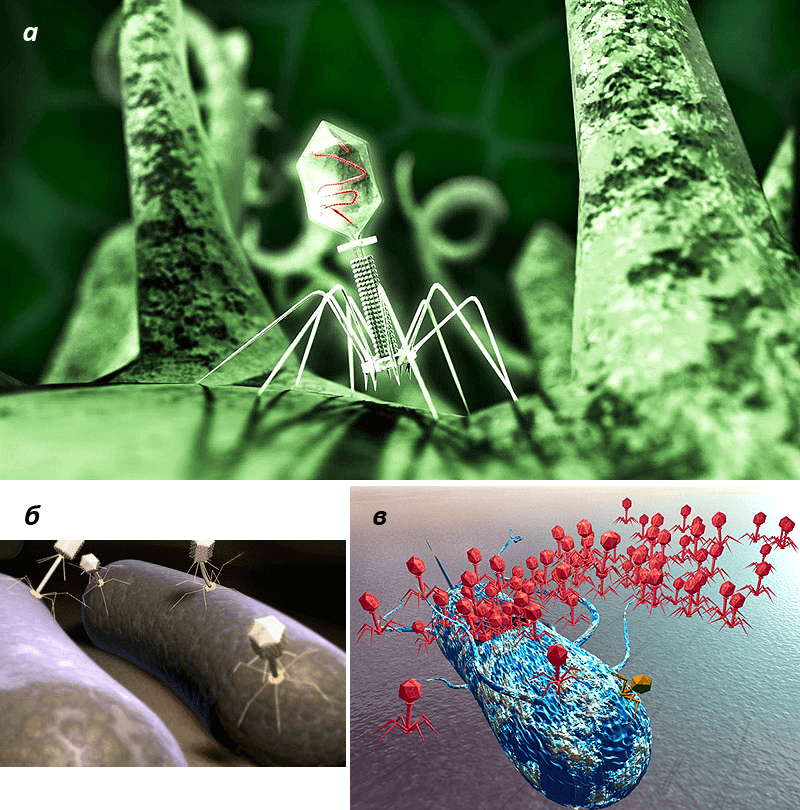
Рисунок 6. Паразитизм во благо. а — Специфичность фагов зависит от их способности адсорбироваться на определенных структурах бактериальной клетки. б — Прикрепившись к поверхности бактерии, фаги могут перемещаться вместе с ней. в — Выход фагового потомства из пораженной бактерии. В одной клетке может образоваться более 1000 новых бактериофагов.
При лечении инфекций важно создать высокую концентрацию антимикробного препарата именно в месте локализации возбудителя. Применяя антибиотики в виде таблеток или инъекций, добиться этого довольно трудно. Но в случае фаготерапии достаточно, если в инфекционный очаг доберутся хотя бы одиночные бактериофаги. Обнаружив патогенные бактерии и проникнув в них, фаги начинают очень быстро размножаться. С каждым циклом размножения, который длится около получаса, количество фагов возрастает в десятки, а то и сотни раз. После разрушения всех клеток возбудителя фаги более не способны размножаться и, благодаря своим мелким размерам, беспрепятственно выводятся из организма вместе с другими продуктами распада.
Пробиотики и фаги вместе
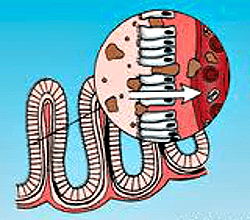
Рисунок 7. Транслокация бактерий из кишечника в кровяное русло.
Бактериофаги хорошо зарекомендовали себя в профилактике и лечении кишечных инфекций и гнойно-воспалительных процессов. Возбудители этих заболеваний часто приобретают устойчивость к антибиотикам, но остаются чувствительными к фагам [10]. В последнее время ученых заинтересовала перспектива совместного использования бактериофагов и пробиотиков. Предполагается, что при назначении такого комплексного препарата сначала фаг уничтожает патогенные бактерии, а потом освободившуюся экологическую нишу заселяют полезные микроорганизмы, формируя стабильный микробиоценоз с высокими защитными свойствами. Такой подход уже был опробован на сельскохозяйственных животных [11]. Вероятно, он войдет и в медицинскую практику.
Возможно и более тесное взаимодействие в системе «бактериофаг + пробиотик». Известно, что бактерии — представители нормальной микрофлоры человека — способны адсорбировать на своей поверхности различные вирусы, не позволяя им проникнуть в клетки человека [9]. Оказалось, что таким же образом могут адсорбироваться и бактериофаги: они не способны внедриться в клетку устойчивой к ним бактерии, но используют ее как «транспортное средство» для перемещения в организме человека. Такое явление получило название транслокации бактериофагов.
Внутренняя среда организма, его ткани и кровь считаются стерильными. На самом деле через микроскопические повреждения слизистых оболочек бактерии-симбионты периодически проникают в кровяное русло (рис. 7), хотя и быстро там уничтожаются клетками иммунной системы и бактерицидными веществами [12]. При наличии инфекционного очага барьерные свойства окружающих тканей часто нарушены, их проницаемость возрастает. Это повышает вероятность проникновения туда циркулирующих пробиотических бактерий вместе с прикрепившимися к ним фагами [13], [14]. В частности, у людей с инфекциями мочевыводящих путей, принимающих «А-бактерин» перорально, аэрококки обнаруживались в моче, причем их количество было стабильно низким, что говорило именно о переносе аэрококков, а не об их размножении в этих органах [15]. Аэрококки и наиболее распространенные возбудители урологических инфекций относятся к совершенно разным группам бактерий, а значит, чувствительны к разным бактериофагам. Это открывает интересные перспективы для создания комплексного препарата, например, на основе А. viridans и фагов, поражающих кишечные бактерии [16]. Такие разработки ведутся на кафедре микробиологии Днепропетровской медицинской академии, однако они пока не вышли за стадию лабораторного исследования.
Статья написана при участии Юргель Л.Г. и Кременчуцкого Г.Н.
Литература
- Кременчуцкий Г.Н., Рыженко С.А., Волянский А.Ю., Молчанов Р.Н., Чуйко В.И. А-бактерин в лечении и профилактике гнойно—воспалительных процессов. Днепропетровск: Пороги, 2000. — 150 с.;
- Vanbelle M., Teller E., Focant M. (1990). Probiotics in animal nutrition: a review. Arch. Tierernahr. 40, 543–567;
- Риженко С.А., Кременчуцький Г.М., Бредихіна М.О. (2008). Вплив рідкого пробіотику «А-бактерину» на мікробіоту кишечника. Медичні перспективи. 2, 47–50;
- Акилов О.А. (2000). Современные методы лечения кандидоза. Сайт «Русский Медицинский Сервер».;
- Edwards J.E. Jr., Bodey G.P., Bowden R.A., Büchner T., de Pauw B.E., Filler S.G. et al. (1997). International conference for development of consensus on the management and prevention of severe candidal infections. Clin. lnfect. Dis. 25, 43–59;
- Antoniskis D., Larsen R.A., Akil B., Rarick M.U., Leedom J.M. (1990). Seronegative disseminated Coccidioidomycosis in patients with HIV infection. AIDS. 4, 691–693;
- Jones J.L., Fleming P.L., Ciesielski C.A., Hu D.J., Kaplan J.E., Ward J.W. (1995). Coccidioidomycosis among persons with AIDS in the United States. J. Infect. Dis. 171, 961–966;
- Степанский Д.А., Рыженко С.А., Кременчуцкий Г.Н., Шарун О.В., Юргель Л.Г., Крушинская Т.Ю., Кошевая И.П. (2012). Неоксидные компоненты антагонистической активности аэрококков (НКА). Аннали Мечниковського інституту. 4, 9–10;
- Ардатская М.Д. (2011). Пре- и пробиотики в коррекции микроэкологических нарушений кишечника. Фарматека. 12, 62–68;
- Бехтерева М.К., Иванова В.В. (2014). Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта. Педиатрия. 2, 24–29;
- Григорьева Г.И., Гордеева И.В., Кульчицкая М.А., Аникина Т.А. (2006). Эффективное применение биологических препаратов (пробиотики и бактериофаги) при лечении коров с острым течением эндометрита. Ветеринарная патология. 1, 52–56;
- Бондаренко В.М. (2013). Механизмы транслокации бактериальной аутофлоры в развитии эндогенной инфекции. Бюллетень оренбургского научного центра УРО РАН (электронный журнал). 3;
- Кременчуцкий Г.Н., Рыженко С.А., Юргель Л.Г. (2008). Явление транслокации E.coli (Hem+, Strr). Труды XVI Международной конференции «Новые информационные технологии в медицине, биологии, фармакологии, экологии». 250–251;
- Кутовий А.Б., Василишин Р.Й., Мешалов В.Д., Кременчуцкий Г.Н. (2002). Ентерально органа транслокація бактерій і генералізація інфекційного процесу в експерименті. Вісник наукових досліджень. 2, 121–123;
- Шарун А.В., Нікуліна О.О., Кременчуцький Г.М. (2005). Порівняльний аналіз біологічних властивостей аерококів, виділених із різних екологічних ніш організму людини. Медичні перспективи. 3, 72–78;
- Зимин А.А., Васильева Е.А., Васильева Е.Л., Фишман К.С., Скобликов Н.Э., Кременчуцкий Г.Н., Мурашев А.Н. (2009). Биобезопасность в фаговой и пробиотической терапии: проблемы и решения. Вестник новых медицинских технологий. 1, 200–202..