
LTP: маленькие виновники больших неприятностей
06 ноября 2018
LTP: маленькие виновники больших неприятностей
- 5569
- 0
- 5
Грустный ребенок, которому нельзя есть апельсин
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Аллергию называют болезнью XXI века. Иммунитет призван защищать организм, но в этом случае он дает сбой. В чем причина? Статья знакомит с одним из сильнейших пищевых аллергенов — растительными липид-транспортирующими белками, их структурой и функциями.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
Как вы отреагируете на сообщение, что в мире возникла новая «эпидемия»? По данным ВОЗ, от нее страдает 20% населения Европы. Это заболевание занимает третье место по распространенности в мире. Наверное, вы уже догадались, что речь идет об аллергии. Если открыть учебник по биологии и посмотреть определение данного недуга, то сразу станет ясно, что причина аллергии скрывается в некоем сбое иммунной системы. Иммунная система является главным защитником нашего организма от вирусов, бактерий, простейших, гельминтов — одним словом, от патогенов. Основными игроками иммунитета являются специальные клетки организма — лейкоциты.
Лейкоциты подразделяются на несколько групп [1]:
- Нейтрофилы — составляют около 70% от количества всех лейкоцитов [2]. Они способны мигрировать через стенки капилляров к очагам инфекции. Основная их функция — это «съесть» и переварить бактерию, то есть фагоцитировать [1], [2].
- Моноциты и макрофаги. Первые курсируют по кровотоку около 30–40 часов с момента образования в красном костном мозге, затем выходят через стенки капилляров в межклеточное пространство, превращаясь в макрофагов. Макрофаги — это крупные клетки, которые находятся в разных частях организма [2]. Они не только фагоцитируют патогены, но и способствуют развитию иммунного ответа [1].
- Дендритные клетки — по функциям аналогичны макрофагам. Их можно встретить во всех тканях и органах. При фагоцитозе патогена дендритные клетки активируются. Они способны сохранить внутри себя фрагменты врага и далее представить их лимфоцитам. С другой стороны дендритные клетки выделяют специальные химические сигналы — цитокины, которые влияют на дальнейший ход развития иммунной реакции, опосредованной Т-лимфоцитами [1], [2].
- Эозинофилы и базофилы — клетки, которые в норме содержатся в небольшом количестве в крови. Число эозинофилов увеличивается при заражении гельминтами. Эти клетки содержат специальные пузырьки — везикулы с биологически активными веществами. При определенных условиях они способны выделять содержимое этих пузырьков в межклеточную среду. Именно базофилы и эозинофилы участвуют в возникновении аллергических реакций [1].
- Лимфоциты — это большая группа лейкоцитов, которая подразделяется на Т- и В-лимфоциты. Эти две подгруппы имеют собственные маркеры на клеточной мембране, различаются местом дифференцировки и ролью в иммунитете. Т-лимфоциты подразделяются на три группы: Т-киллеры — распознают и обезвреживают патогенны; Т-хелперы — распознают патогены и выделяют специальные вещества, помогающие другим клеткам бороться с этим патогенном; регуляторные Т-лимфоциты — способны ослабить или вовсе подавить иммунную реакцию. В-лимфоциты при контакте с патогеном превращаются в плазматические клетки, которые вырабатывают специальные белки — антитела. Эти белки способны связываться с антигеном, привлекая макрофагов и других, а также активировать различные каскады иммунных реакций, приводящих к гибели патогена. Также часть В-лимфоцитов при определенных условиях превращается в клетки памяти. При повторной атаке патогена они быстро активируются, делятся и идут устранять врага [1].
Собственно в первом приближении борьба иммунной системы с патогеном выглядит так: при попадании патогена в организм происходит активация первой линии защиты — нейтрофилов и макрофагов. Макрофаги, а также дендритные клетки способны активировать лимфоциты, которые начинают направленно убивать патогенов-чужаков. Более подробно с лимфоцитами и иммунным ответом можно ознакомиться в статье «Иммунитет: борьба с чужими и... своими» [1].
Строение и классификация антител
Антитела — это Y-образные молекулы из суперсемейства белков иммуноглобулинов, содержащие два участка связывания с антигеном [3].
Антиген — это молекула на поверхности патогена, способная к связыванию с антителом.
Антитело состоит из четырех полипептидных цепей: двух идентичных легких цепей и двух идентичных тяжелых (рис. 1). Между собой цепи соединены с помощью электростатических, ван-дер-ваальсовых и ковалентных дисульфидных связей [3]. Не связанная с легкими цепями часть тяжелых цепей образует шарнирные области и хвост (Fc-фрагмент) антитела.
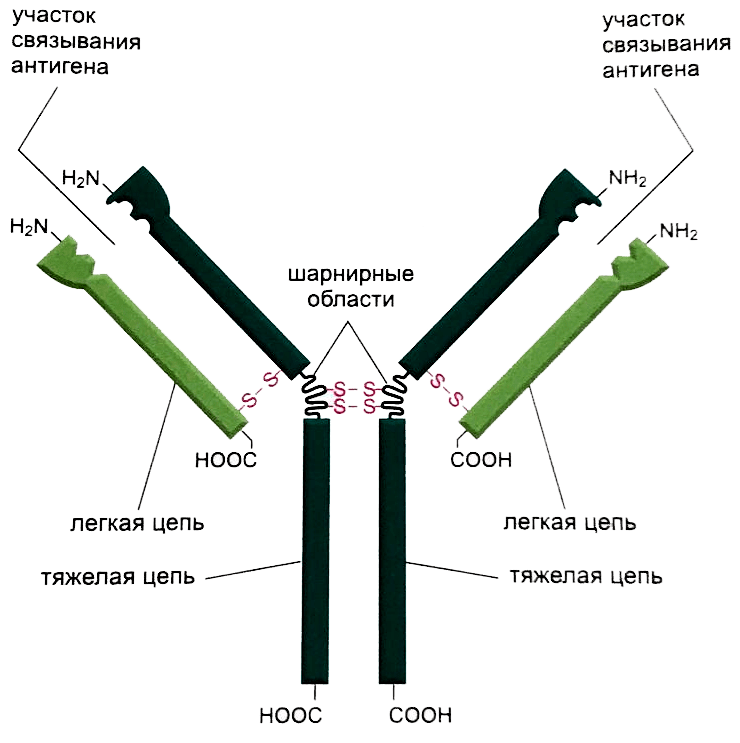
Рисунок 1. Строение антитела
Шарнирная область — это достаточно гибкое место молекулы, за счет которого расстояние между двумя связывающими антиген участками может изменяться, что значительно повышает эффективность взаимодействия с антигеном [3].
У млекопитающих выделяют пять классов антител: IgA, IgD, IgE, IgG, IgM. Каждый класс имеет свой тип тяжелой цепи, а значит свой уникальный Fc-фрагмент, что придает молекулам одного класса характерные свойства. Строение хвостовой части антитела влияет на такие свойства, как связывание с фагоцитирующими клетками, пересечение плацентарного барьера и другие. Специальные Fc-рецепторы, расположенные на мембране лейкоцитов распознают Fc-фрагмент антитела определенного класса и затем связываются с ним. Другими словами, для каждого типа антител будет свой Fc-рецептор [3]. Таким образом, получается, что разные классы антител эффективны в различных ситуациях. Но для аллергии наибольшее значение представляют IgE.
IgE — это класс антител, которой практически отсутствует в свободном виде в крови здорового человека. Хвостовая часть молекулы имеет высокое сродство к Fc-рецепторам, расположенным на поверхности тучных клеток, базофилов и эозинофилов. Считается, что IgE защищают организм человека от паразитов, а также обусловливают аллергические реакции [3]. Более подробно ознакомиться с антителами можно в статье «Антитело: лучший способ распознать чужого» [19].
Существует теория, что аллергия — это сверхинтенсивная реакция организма на борьбу с паразитами. Такие симптомы, как зуд, чихание, интенсивное выделение слизи и других секретов — не что иное, как механизмы, помогающие избавиться от них.
В современном мире переход к соблюдению норм гигиены предотвращает контакт организма со многими антигенами [4]. Нагрузка на иммунную систему снижается. В таком случае организм начинает реагировать на «безобидные антигены», и возникает аллергия (видео 1) [5]. Антигены, вызывающие аллергию, называют аллергенами. Часто меру аллергической настроенности организма определяют по количеству IgE в крови.
Видео 1. Теория происхождения аллергии
Механизм возникновения аллергической реакции, типы аллергенов
Первая встреча аллергена с иммунной системой стимулирует выработку IgE в кровоток. Эти антитела связываются хвостовой частью с Fc-рецепторами тучных клеток и базофилов. При повторной встрече аллерген связывается с IgE на поверхности тех же самых тучных клеток и базофилов, вызывая их активацию и дегрануляцию (рис.2) [3].
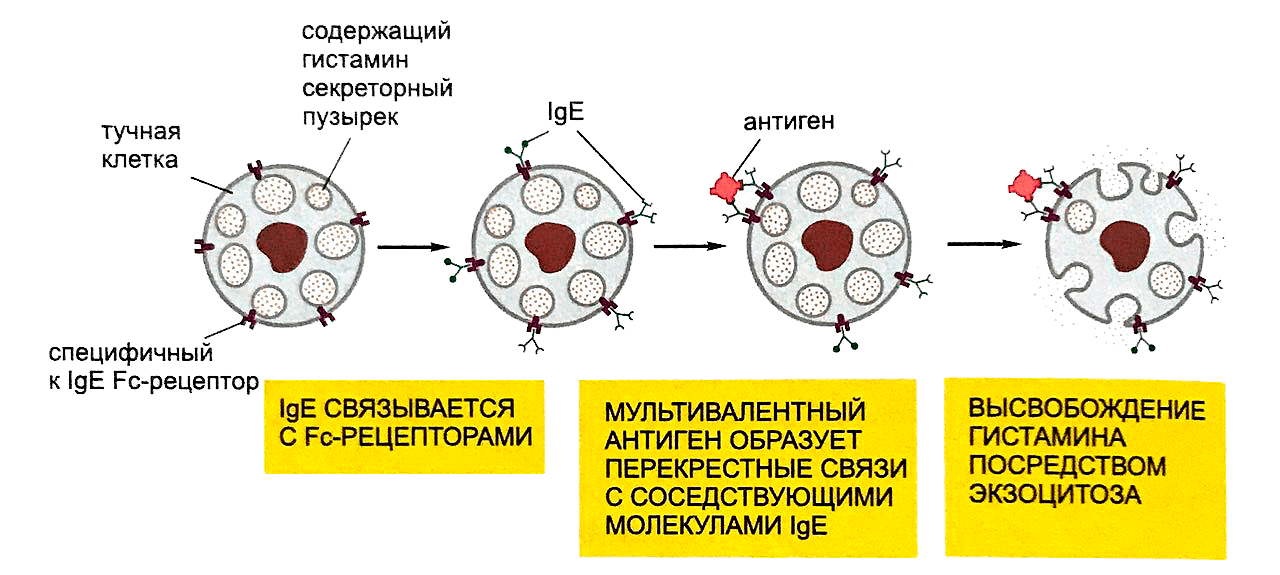
Рисунок 2. Механизм возникновения аллергической реакции
Таким образом тучные клетки и базофилы выделяют в организм человека биологически активные вещества, в том числе гистамин [3]. Гистамин — это биоорганическая молекула, производное аминокислоты гистидина. Гистамин обладает комплексным действием. При попадании в межклеточную среду он сразу же воздействует на стенки капилляров, увеличивая их проницаемость, понижает артериальное давление и вызывает спазм гладкой мускулатуры. Из кровяного русла жидкость выходит в ткани и накапливается там. Образуется отек. Если аллергическая реакция возникла в дыхательных путях, то высвобождение гистамина приведет к резкому спазму бронхов, что является причиной возникновения астмы [3].
В других случаях это приводит к отеку слизистой носа, различных кожных высыпаний, конъюнктивиту. Гистамин также влияет на процесс воспаления, то есть является медиатором воспаления — защитной реакции организма, направленной на устранение патогена и его продуктов жизнедеятельности.
Аллергия может возникнуть практически на любое вещество. Поэтому, для удобства аллергены можно подразделять на группы по происхождению. Это бытовые, лекарственные, эпидермальные (клетки эпидермиса и его производные человека и животных), грибковые, пыльцевые, пищевые и так далее [4].
Одними из сильнейших аллергенов являются представители липид-транспортирующих белков (Lipid Transfer Proteins, LTP) растений. LTP вызывают развитие иммунных реакций на пыльцу и растительные пищевые продукты. Считается, что эти белки играют одну из важнейших ролей в жизнедеятельности растений [6].
Строение и функции LTP
LTP были открыты в 1992 году группой испанских ученых под руководством Рамона Ллеонарта (Ramon Lleonart). Эти маленькие положительно заряженные белки весом около 7–10 кДа обнаружены только у высших растений [6]. У водорослей же они отсутствуют. Возможно, что появление именно этих белков помогло растениям выйти на сушу (рис. 3) [7].
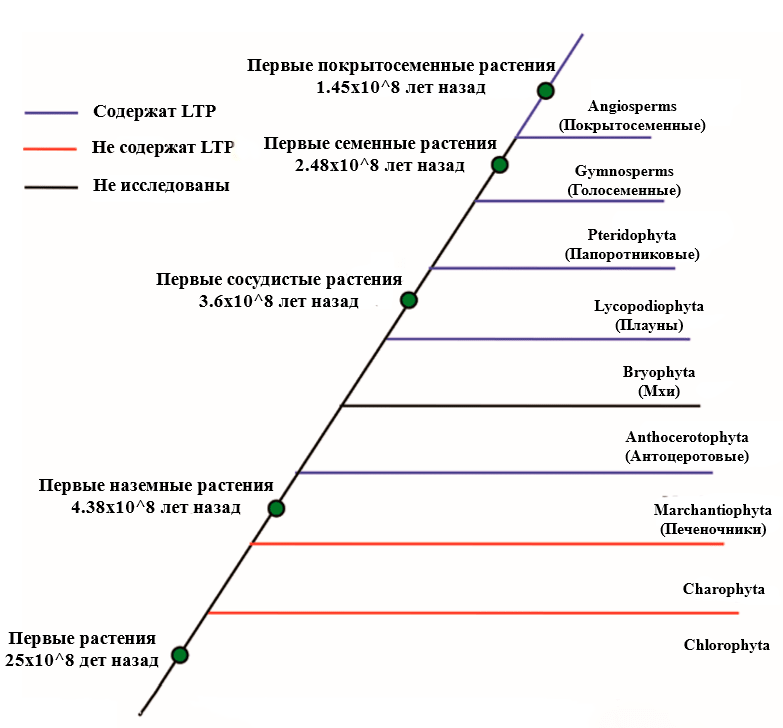
Рисунок 3. Филогенетическое древо, на котором показано наличие или отсутствие LTP в различных группах растений
Все LTP имеют гидрофобную полость, в которой расположен сайт связывания с гидрофобными молекулами, такими как жирные кислоты, фосфолипиды и др [9].
Помимо гидрофобной полости, структура LTP содержит четыре дисульфидных мостика. Эти четыре связи между атомами серы поддерживают стабильность молекулы в пространстве, придавая ей прочность. Они делают это настолько хорошо, что даже ни ферменты желудочно-кишечного тракта, ни термическая обработка до 100 градусов не могут разрушить белок полностью [9].
Существует несколько типов классификации LTP.
- На основе молекулярной массы и гомологии аминокислотных последовательностей эти белки подразделяют на два класса: LTP1, который содержит около 90 аминокислотных остатков, и LTP2, содержащий чуть меньше — примерно 70 [6].
- На основании наличия гликозилфосфатидилинозитного якоря (GPI-якоря) — гликолипида, присоединенного к белку в процессе посттрансляционной модификации, с помощью которого LTP может закрепиться в мембране, белки делятся также на две группы. LTP, имеющие GPI-якорь, обозначаются как LTPg.
- На основании внутригенной локализации интронов и гомологии аминокислотных последовательностей LTP разбивают на 10 подклассов: LTP1, LTP2, LTPс, LTPd, LTPg (главные подклассы), LTPe, LTPf, LTPh, LTPj, LTPk (второстепенные подклассы) [6].
LTP кодируются в растениях мультисемейством генов, в состав которого входят три кластера (3–8 генов в каждом). Белки, кодируемые каждым кластером, характеризуются специализацией по тканям, синтезом на определенной стадии онтогенеза и различием по функциям. Синтез LTP в клетках активируется под влиянием стрессовых факторов и фитогормонов. Стрессовыми факторами могут быть УФ-излучение, осмотический шок, отсутствие влажности, низкие температуры, вторжение различных патогенов [9].
Теперь перейдем к функциям LTP в растениях. Большинство из них основано на проявленных ими активностях в экспериментах in vitro (рис. 4).
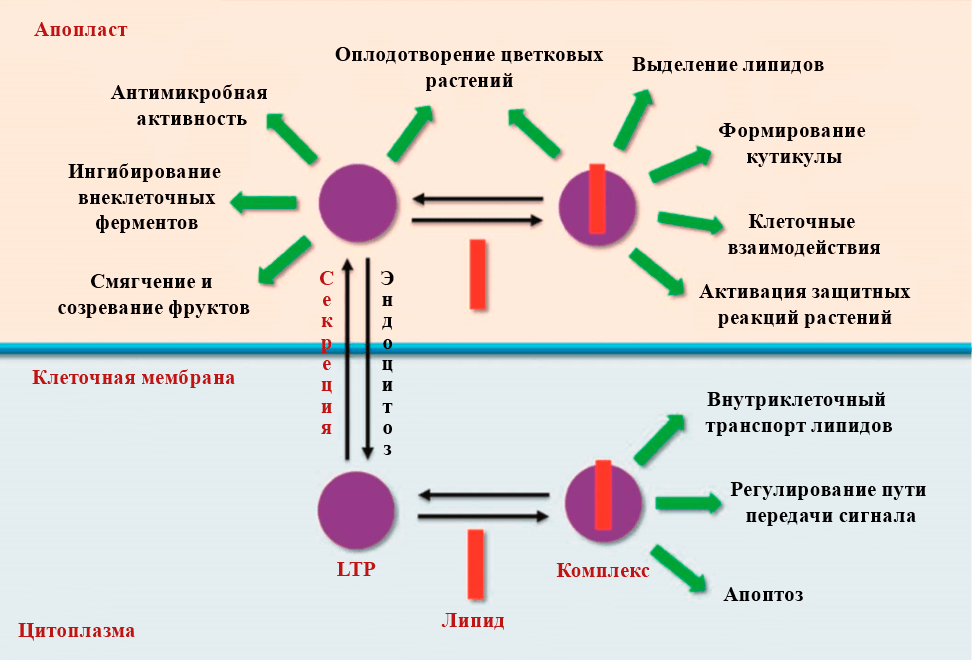
Рисунок 4. Функции растительных липид-транспортирующих белков
Было установлено, что LTP способны связывать и переносить липиды через биомембраны в лабораторных экспериментах. Собственно, из этого вытекает одна из предполагаемых функций — перенос гидрофобных молекул, участие в метаболизме липидов [6], [7]. LTP содержатся в высокой концентрации в покровных тканях растений, и это безусловно наталкивает на мысль об их вовлеченности в синтез поверхностного кутикулярного слоя (рис. 5) [9]. У мутантов растений Brassica napus с повышенным синтезом белка BrLTPd1 наблюдается нарушение секреции воска [8].
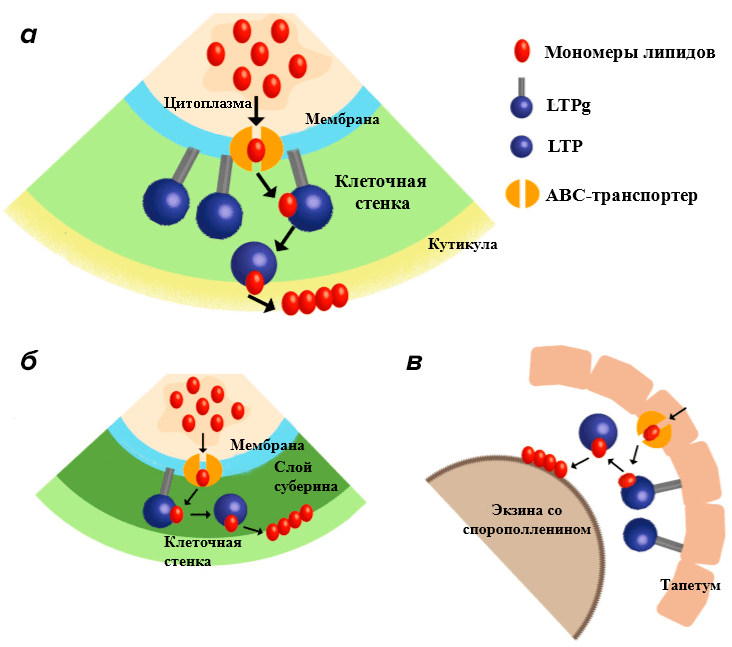
Рисунок 5. Предполагаемый механизм переноса липидов через мембрану и их участие в синтезе кутикулы. а — В зеленых тканях. б — В корнях. в — В пыльце.
Это происходит так: мономеры липидов через специальный ABC-транспортер попадают в пространство клеточной стенки. Там происходит их связывание с прикрепленными к наружней стороне мембране LTPg. Те, в свою очередь, передают липид на свободный LTP, который транспортирует гидрофобную молекулу в место синтеза кутикулы. Но до сих пор остается неясным механизм переноса липида по клеточной стенке [9].
Многие LTP препятствуют росту патогенных бактерий и грибов. Чаще всего такие взаимодействия являются избирательными, скорее всего, это связано с разным составом липидов в клеточных мембранах бактерий, грибов, млекопитающих и растений. Также некоторые исследования отмечают, что LTP из перца и кофе подавляют активность грибов рода Candida, которые являются патогенами человека. Механизм такой антимикробной активности не ясен. Возможно, он обеспечивается за счет электростатических взаимодействий с мембранами патогенов. Есть данные, что при разрушении дисульфидных мостиков антимикробная активность пропадает, поскольку нарушается процесс связывания белков с липидами. В то же время, антимикробная активность никак не связана с процессами взаимодействия с гидрофобными молекулами [9].
И еще одно интересное свойство у определенных LTP, не связанное с аллергией, выявленное в ходе экспериментов, — это наличие противораковой активности [9]. Проведенные исследования показали, что LTP из полевой капусты и нарцисса препятствуют размножению и пролиферации раковых клеток in vitro, а также подавляют активность респираторно-синцитиального вируса человека и ВИЧ (механизм остается неизвестным) [11]. Остальные функции LTP (рис. 4) изучены очень слабо и в этой статье рассматриваться не будут.
LTP — аллергены
LTP обладают аллергенностью — способностью вызывать аллергию, что напрямую связано с особенностями их структуры. Четыре дисульфидных мостика обеспечивают устойчивость к разрушению ферментами желудочно-кишечного тракта. Получается, что LTP попадают в неизменном виде в тонкий кишечник и затем через ворсинки всасываются в кровь, где встречаются с иммунной системой человека [9]. В отличие от других аллергенов, 40% поверхности LTP способно связываться с иммуноглобулинами. Часто у страдающих пищевой аллергией на LTP может проявляться LTP-синдром, заключающийся в перекрестных аллергических реакциях на LTP различных видов растений, в том числе и таксономически далеких [12].
Был описан интересный случай на одном из складов в Европе. Работа сотрудников требовала ежедневного контакта с персиками. Известно, что кожура персиков содержит высокую концентрацию растительных липид-транспортирующих белков, а LTP Pru p 3 — это один из самых распространенных пищевых аллергенов. Через какое-то время один из служащих начал страдать ринитами. А через шесть месяцев у него возникла тяжелая пищевая аллергия на персики, сливы, фундук, арахис и т.д. Исследователи сделали вывод, что контакт пациента с кожурой персика мог спровоцировать возникновение аллергической чувствительности через дыхательные пути и дальнейшее развитие пищевой аллергии [12].
По данным Европейской академии аллергии и клинической иммунологии, 150 миллионов европейцев страдают от хронической аллергии. Из них у семи миллионов обнаруживается пищевая аллергия, а 100 миллионов в той или иной степени столкнулись с аллергическими ринитами [13]. В Испании 11% людей имеют аллергию на пыльцу. Из них от 10% до 40% также имеют аллергию на LTP персика [14].
В Северной Европе аллергия на LTP чаще всего представлена в виде оральной аллергии на входящий в состав пыльцы березы белок Bet v 1. А от пищевой аллергии на LTP больше страдают жители Средиземноморья [12].
Такое неравномерное географическое распределение до сих пор обсуждается, поскольку растительные продукты в Северной Европе также имеют высокое содержание LTP, однако частота возникновения аллергии на них значительно ниже. Возможное объяснение — это разные диетические привычки и способы термической обработки продуктов [12].
Методы лечения аллергии
Одним из самых простых и действенных методов борьбы с аллергией является, конечно же, ограничение контакта с аллергеном. В случае аллергии на пыль необходимо использовать воздушные фильтры для очистки воздуха, в случае пищевой аллергии — перестать употреблять продукт.
Для того чтобы не заставлять больного полностью исключать аллергенный продукт из рациона, можно методами генной инженерии разработать его гипоаллергенные аналоги. Так, уже созданы генномодифицированные томаты с LTP, измененные с помощью методов сайт-направленного мутагенеза и химических модификаций. Модифицированные белки снизили аллергическую реакцию при кожных тестах у пациентов [12].
Для избавления от симптомов аллергии, в том числе вызванных LTP, применяют фармакотерапию. Используемые для этого средства можно разделить на три группы.
К первой относится лечение антигистаминными препаратами. Действующие вещества блокируют рецепторы, с которыми связывается гистамин и, следовательно, препятствуют развитию аллергической реакции. Они не подходят для лечения аллергии в долгосрочной перспективе. Антигистаминные препараты обладают побочными эффектами, например, сонливостью, негативно влияют на сердечную мышцу [15].
Другая группа препаратов воздействует на мембраны тучных клеток, блокируя выброс везикул с гистамином. Это устраняет отеки слизистой носа и предупреждает появление астмы. Но опять же механизм работы направлен на блокирование симптомов, что не решает проблему полностью.
При серьезных случаях для быстрого облегчения острых симптомов принимают препараты на основе глюкокортикоидов — гормонов надпочечников. Глюкокортикоиды обладают противовоспалительной активностью [15].
Однако на данный момент одним из самых эффективных методов борьбы с аллергией является аллергенспецифическая иммунотерапия. Этот метод основан на продолжительном введении одного аллергена пациенту для постепенного уменьшения восприимчивости [16]. Его применяют при аллергии на LTP арахиса, персика, фундука, вишни и т.д. [17]. Подробности механизма действия, эффективность работы описаны в статье «Как победить аллергию за четыре инъекции?» [16].
Эффективность данной терапии налицо, но доказано, что такое лечение сопровождается анафилактическими побочными эффектами. Для их предотвращения в случае LTP разрабатывают замены экстрактов LTP на гипоаллергенные рекомбинантные аналоги [17].
Также врачи в качестве лечения назначают сублингвальную терапию. Данная терапия очень похожа по принципу действия на аллергенспецифическую, а отличие в том, что здесь используются не один, а несколько аллергенов [17], [18]. В этом методе пациенту индивидуально подбирают «коктейль» из аллергенов, которые наносится под язык каждый день по нескольку капель в течение продолжительного времени (3–5 лет). В результате спустя какое-то время организм пациента перестает остро реагировать на контакт с этими аллергенами [17], [18]. С помощью этой терапии борются с аллергией на LTP персиков, абрикосов, груш, слив и др. [12].
Растительные липид-транспортирующие белки, без сомнения, интересный биологический объект для изучения аллергической реакции, как с фундаментальной, так и с практической точки зрения. Бóльшая часть механизмов их действия на организм человека до сих пор не исследована, а точные функции в растениях не установлены. Количество людей, страдающих от аллергии на LTP, увеличивается с каждым годом, что указывает на необходимость их активного изучения. Кто знает, к каким новым открытиям могут привести эти маленькие катионные белки!
Литература
- Иммунитет: борьба с чужими и… своими;
- Тейлор Д., Грин Н., Стаут У. Биология в 3-х томах (т. 2, 4-е изд., испр.). М.: «БИНОМ. Лаборатория знаний», 2013. — 435 с.;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки в 3-х томах (т. 3). М.--Ижевск: НИЦ «Регуляторная и хаотическая динамика», Институт компьютерных исследований, 2013. — 1052 с.;
- Willett E. (2000). The hygiene hypothesis. Edward Willett;
- Атауллаханов Р. (2017). Теория происхождения аллергии. «Постнаука»;
- Tiina A. Salminen, Kristina Blomqvist, Johan Edqvist. (2016). Lipid transfer proteins: classification, nomenclature, structure, and function. Planta. 244, 971-997;
- Fang Liu, Xiaobo Zhang, Changming Lu, Xinhua Zeng, Yunjing Li, et. al.. (2015). Non-specific lipid transfer proteins in plants: presenting new advances and an integrated functional analysis. EXBOTJ. 66, 5663-5681;
- Tiina Salminen, D. Eklund, Valentin Joly, Kristina Blomqvist, Daniel Matton, Johan Edqvist. (2018). Deciphering the Evolution and Development of the Cuticle by Studying Lipid Transfer Proteins in Mosses and Liverworts. Plants. 7, 6;
- Finkina E.I., Melnikova D.N., Bogdanov I.V., Ovchinnikova T.V. (2016). Lipid transfer proteins as components of the plant innate immune system: structure, functions, and applications. Acta Naturae. 8, 47–61;
- Sandrine Jégou, Jean-Paul Douliez, Daniel Mollé, Patrick Boivin, Didier Marion. (2000). Purification and Structural Characterization of LTP1 Polypeptides from Beer. J. Agric. Food Chem.. 48, 5023-5029;
- Peng Lin, Lixin Xia, Jack H. Wong, T. B. Ng, Xiuyun Ye, et. al.. (2007). Lipid transfer proteins fromBrassica campestris and mung bean surpass mung bean chitinase in exploitability. J. Pept. Sci.. 13, 642-648;
- R. Christopher Van Winkle, Christopher Chang. (2014). The Biochemical Basis and Clinical Evidence of Food Allergy Due to Lipid Transfer Proteins: A Comprehensive Review. Clinic Rev Allerg Immunol. 46, 211-224;
- Tackling the allergy crisis in Europe — concerted policy action needed. (2015). EAACI;
- Besler M., Cuesta Herranz J., Fernandez-Rivas M. (2000). Peach (Prunus persica). Internet symposium on food allergens. 2, 185–201;
- Таблетки от аллергии. Список эффективных препаратов разных поколений. Полный обзор. Chi Cerca — Trova;
- Как победить аллергию за четыре инъекции?;
- Laurian Zuidmeer-Jongejan, Montserrat Fernandez-Rivas, Lars K Poulsen, Angela Neubauer, Juan Asturias, et. al.. (2012). FAST: towards safe and effective subcutaneous immunotherapy of persistent life-threatening food allergies. Clinical and Translational Allergy. 2, 5;
- Сублингвальная иммунотерапия при аллергии: интервью с экспертом. (2018). MedBe.ru;
- Антитело: лучший способ распознать чужого.







