
Микробиота женского организма: как бактерии определяют судьбу беременности
18 февраля 2026
Микробиота женского организма: как бактерии определяют судьбу беременности
- 264
- 0
- 3
Микробиом: где решается судьба женского здоровья.
Рисунок в полном размере.
сгенерировано Midjourney
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Эта статья посвящена вагинальной микробиоте — ключевому игроку в репродуктивном здоровье женщины. В ней мы рассмотрим ее состав и молекулярные механизмы, с помощью которых бактерии влияют на иммунитет своего хозяина — человека. Особое внимание уделим роли дисбиоза в развитии серьезных осложнений: преждевременных родов, выкидышей и неудачных процедур ЭКО. А еще поговорим о методах коррекции микробного сообщества, включая персонализированную терапию и трансплантацию вагинальной микробиоты.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Представьте, что вероятность успеха беременности зависит от того, какие бактерии живут во влагалище. Звучит странно? Но именно об этом говорит современная наука. Например, вагинальный дисбиоз многократно повышает риск преждевременных родов [1]. При этом его ключевая проблема — частое бессимптомное течение, что делает целенаправленный скрининг, особенно на этапе планирования беременности, важным инструментом превентивной медицины.
При этом многие женщины даже не знают, что у их микробиоты какой-то не такой состав. Анализ на дисбиоз, то есть нарушение бактериального баланса во влагалище, сдают обычно при подозрении на инфекцию. Если в половых путях преобладают условные патогены, риск воспаления выше. Но вот влияние микробных сообществ на беременность — вопрос куда менее тривиальный, и даже сложный.
Мы решили разобраться, почему одни бактерии помогают, а другие — вредят будущей маме, и какие сигналы передают микроорганизмы нашей иммунной системе.
Единообразна ли микробиота женской репродуктивной системы, и какой она должна быть?
Представьте, что репродуктивная система женщины — это многоэтажная крепость. И у каждого ее «этажа» своя критически важная миссия и, соответственно, свой «гарнизон».
Влагалище — это мощная внешняя стена. В норме здесь доминируют лактобактерии, составляя до 90–95% населения. Они создают кислую среду (pH < 4,5), вырабатывают антимикробные вещества и формируют барьер, который служит первым и главным фильтром для патогенов из внешнего мира [2].
Но по мере продвижения вглубь — к шейке матки и эндометрию — картина меняется: начинает расти разнообразие микробной флоры, а лактобациллы могут не играть доминирующую роль. Наряду с ними там в норме присутствуют представители Bacteroides, Pseudomonas, Acinetobacter и другие таксоны [3]. Возникает вопрос: почему эволюция создала такую «неоднородную» оборону?
Ответ кроется в разных задачах этих отделов. Влагалище — это «буферная зона», которая должна активно сражаться с постоянным наплывом внешних угроз. А вот эндометрий матки — это место, куда внешние патогены не проникают напрямую. Главная его миссия — подготовить идеальные условия для имплантации эмбриона. Это требует тонкого баланса: одновременно защищать от инфекции, но и проявлять иммунную толерантность к плоду. Разнообразная микробиота эндометрия, вероятно, именно этот баланс и поддерживает, стимулируя развитие эндометриальной рецептивности — состояния, при котором эндометрий готов принять эмбрион и создает нужные иммунные условия для его развития.
Таким образом, микробиота репродуктивного тракта — сложная, стратифицированная экосистема, где каждый уровень выполняет свою задачу. Однако даже в рамках одного «уровня», такого как влагалище, представления о норме оказались гораздо сложнее, чем просто доминирование лактобактерий. Ученые обнаружили, что здоровая микрофлора может принимать разные формы, которые были систематизированы в концепцию пяти основных типов.
Пять типов микробиоты
Ученые изучили микробиом влагалища тысяч женщин и обнаружили интересный факт: для влагалищной микробиоты не существует единой «нормы». Вместо этого выделили пять основных типов микробного состояния влагалища (Community State Types, CST) [4]. Они приведены на рисунке 1.
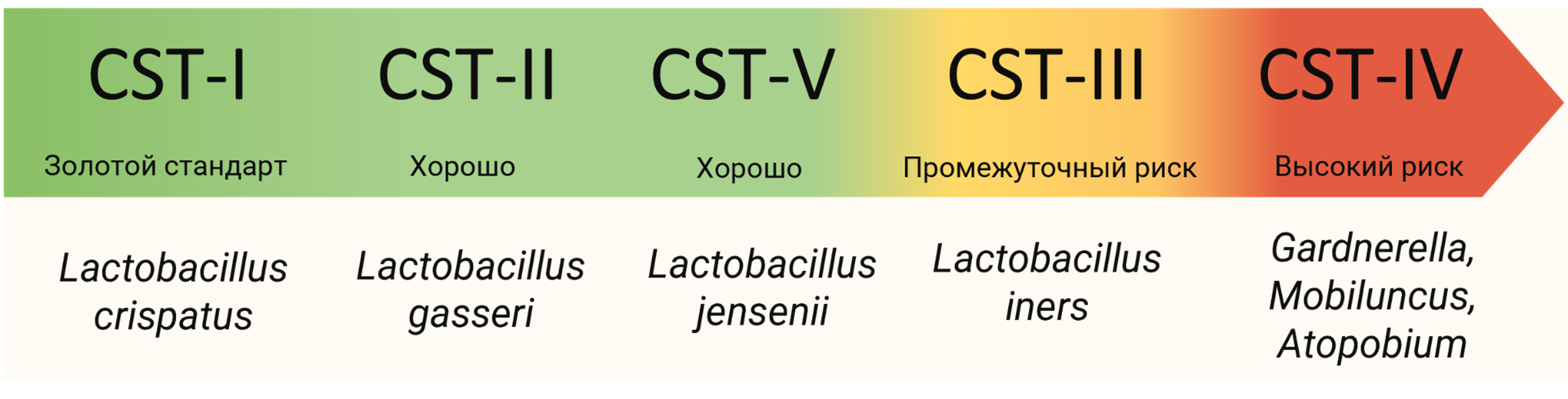
Рисунок 1. Типы микробного состояния (Community State Types, CST) во влагалище в зависимости от преобладающих видов бактерий.
рисунок автора статьи
При этом CST I считается идеалом. Для этого типа характерно преобладание лактобацилл Lactobacillus crispatus — главных защитников влагалищной экосистемы. Эти лактобактерии активно производят молочную кислоту, поддерживая низкий уровень pH, подавляют рост патогенов и «общаются» с иммунной системой, обеспечивая стабильность, защиту и готовность к беременности [5], [6]. Аналогичные защитные свойства с низким pH характерны и для типов CST II (L. gasseri) и CST V (L. jensenii) [7].
Существует и другой вид — L. iners, который, хоть и является лактобациллой, но обладает более слабыми защитными свойствами. L. iners производят меньше молочной кислоты (pH обычно выше, чем у защитных типов), обладают менее выраженными иммуномодулирующими свойствами и формируют более нестабильное сообщество (CST III), которое сильно зависит от питательных веществ хозяина и восприимчиво к изменениям окружающей среды. Всё это делает CST III непредсказуемым — он потенциально может нести как защитную, так и вредную функцию [7]. Таким образом, женщины с доминированием L. iners (CST III) имеют промежуточный риск осложнений — ниже, чем при CST IV, но выше, чем при CST I, II или V [8], [9].
На противоположной от CST I чаше весов находится CST IV — состояние дисбиоза, тесно связанное с клинической картиной бактериального вагиноза и других нарушений женской репродуктивной системы. При CST IV количество лактобактерий низко, а их место занимают разнообразные анаэробные бактерии, такие как Gardnerella, Prevotella, Atopobium, Mobiluncus и другие [10]. Они (а особенно Gardnerella) создают провоспалительную среду, что и лежит в основе осложнений [6], [11]. Подробный молекулярный механизм этого процесса будет рассмотрен далее.
Итак, наиболее неблагоприятным для репродуктивного здоровья является тип CST IV. Последствия формирования такой микрофлоры многократно подтверждены исследованиями.
Последствия CST IV
Дисбиоз, характерный для типа CST IV, создает условия, при которых риск преждевременных родов возрастает в 3,5 раза. Особенно критичным этот риск становится при угрозе очень ранних родов — до 32 недель [1], [12].
Но и это еще не все. Среди других «подарков» от CST IV:
- Бактериальный вагиноз — это состояние, при котором здоровая влагалищная микробиота с доминированием лактобацилл замещается избыточным ростом анаэробных бактерий. Именно микробиота типа CST IV является ключевым признаком бактериального вагиноза: исследования показывают, что до 93% случаев заболевания связаны с этим микробным профилем. Типичные симптомы — однородные жидкие выделения с неприятным «рыбным» запахом, иногда зуд или жжение [13].
- Повышенный риск инфекций, передающихся половым путем — хламидиоза, гонореи, даже вируса иммунодефицита человека (ВИЧ): женщины с CST IV в 1,5–2 раза более уязвимы к ВИЧ-инфекции [14–16].
- Неудачи ЭКО — снижение эффективности имплантации [17].
- Выкидыш — риск повышен в 2–3 раза [9], [18].
- Хроническое воспаление — повышенный риск эндометриоза и синдрома поликистозных яичников [19], [20].
Перечисленные риски усугубляет ключевая проблема, подтвержденная данными исследований: более чем у 50% женщин бактериальный вагиноз протекает бессимптомно, что приводит к большому числу не диагностированных случаев. Бессимптомный дисбиоз ассоциирован с теми же серьезными репродуктивными последствиями, включая потерю беременности и преждевременные роды [21]. Это делает рутинный скрининг вагинальной микробиоты, особенно на этапе планирования беременности, не просто полезным, а необходимым инструментом превентивной медицины.
Так надо ли лечить бессимптомный дисбиоз? Это центральный вопрос клинической практики. Распространенность бактериального вагиноза (основного проявления CST IV) среди женщин репродуктивного возраста составляет от 23% до 29% в зависимости от региона [22]. Однако международные руководства (например, от CDC США) не рекомендуют рутинный скрининг и лечение бессимптомного варианта этого заболевания у всех беременных, так как массовые исследования не показали, что это снижает частоту преждевременных родов в общей популяции [23]. Ключевое слово — «в общей популяции». Современный подход — персонализация риска. Целевой скрининг (предпочтительно молекулярными методами, такими как секвенирование гена 16S рРНК) и рассмотрение вопроса о превентивной коррекции бессимптомного дисбиоза абсолютно оправданы у женщин из групп высокого риска: при отягощенном анамнезе (преждевременные роды, выкидыши) [17].
При этом важно понимать, что последствия CST IV — прямое следствие сдвига не только в составе, но и в функциях микробиоты. Разные бактерии производят разные молекулярные сигналы, которые кардинально меняют работу иммунной системы. Чтобы понять, как дисбиоз приводит к столь тяжелым осложнениям, давайте заглянем вглубь этого процесса.
Молекулярная война: как бактерии управляют иммунитетом
Оказывается, бактерии не просто живут во влагалище — они постоянно «разговаривают» с нашей иммунной системой через специальные молекулы. И то, какие послания они отправляют, сильно влияет на здоровье, включая протекание беременности (рис. 2).
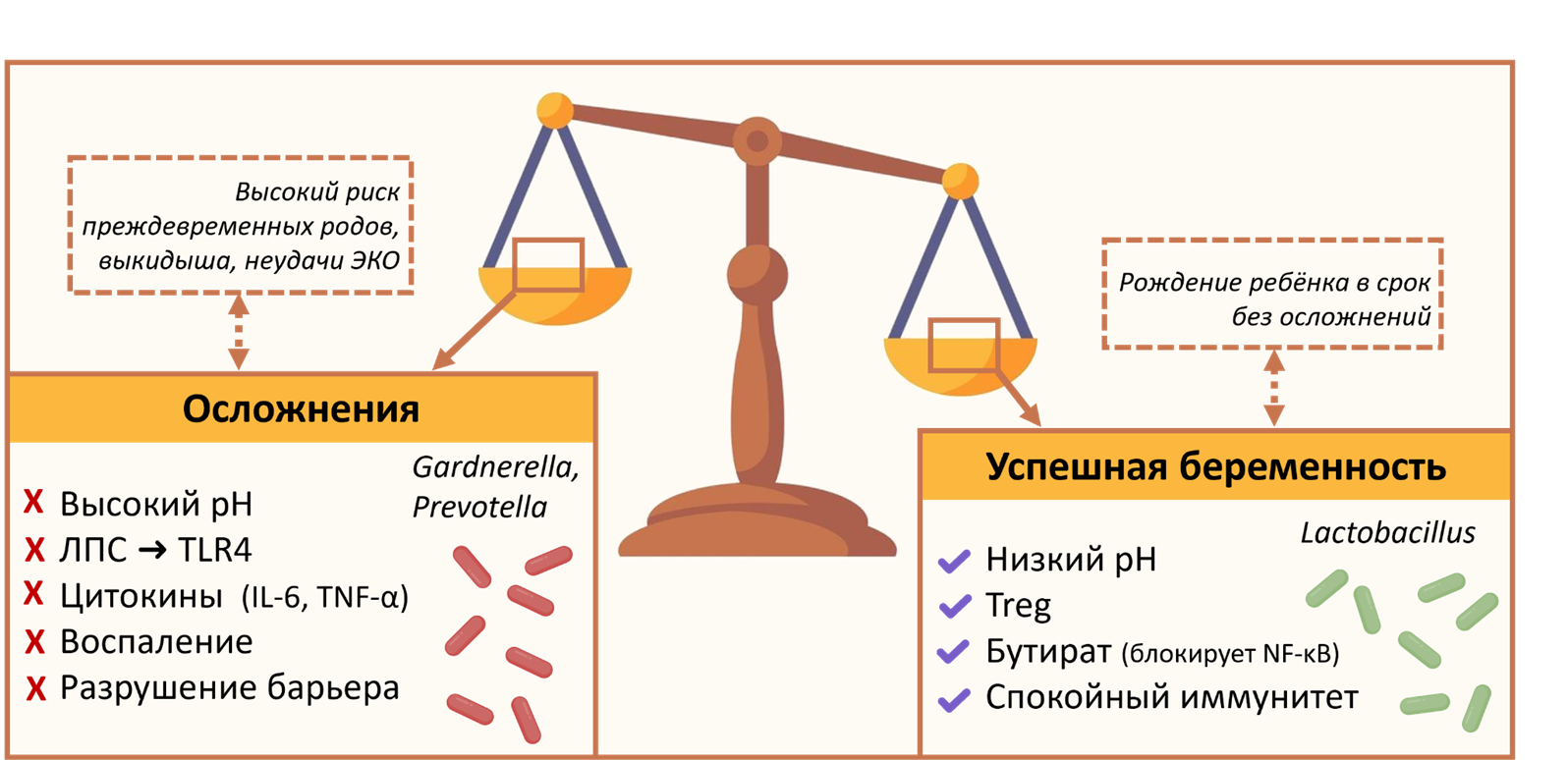
Рисунок 2. Как микробиота определяет исход беременности. Состав вагинальной микробиоты влияет на иммунный ответ и клинические исходы беременности. Доминирование лактобактерий (справа) поддерживает мирную иммунную среду через выработку бутирата и работу T-регуляторных лимфоцитов, что способствует успешному вынашиванию. В то же время, дисбиоз с преобладанием анаэробных бактерий (слева) запускает каскад воспаления через липополисахариды (ЛПС) и провоспалительные цитокины, приводя к разрушению эпителиального барьера и акушерским осложнениям.
рисунок автора статьи
Полезные послания: что производят хорошие лактобактерии?
Молочная кислота — главное оружие
L. crispatus производит молочную кислоту из гликогена. Эта молекула делает несколько вещей одновременно [5], [24], [25]:
- снижает pH до 3,8–4,5 (враждебная среда для патогенов),
- блокирует NF-κB путь — главный «включатель» воспаления в клетках,
- прямо убивает многие грамотрицательные бактерии.
Диалог через TLR2/6 рецепторы
Клетки иммунитета (дендритные клетки) несут на себе TLR2/6—рецепторы, которые распознают компоненты лактобактерий. Но вот интересный момент: эти рецепторы распознают лактобактерии как «своих» и запускают спокойный, толерантный ответ, а не воспаление [26]. В результате этого диалога рождаются специальные клетки — T-регуляторные лимфоциты. Эти клетки работают как «полицейские» иммунной системы, подавляя избыточные воспалительные реакции [27], [28].
Производство короткоцепочечных жирных кислот (КЖК)
Представьте, что в клетках есть сигнальная кнопка NF-κB, которая включает тревогу и запускает воспаление. КЖК, в особенности бутират, производимый лактобактериями, действуют как блокатор этой кнопки [29], [30]. Помимо этого, КЖК напрямую укрепляют защитный барьер слизистой. Эпителиальные клетки скреплены между собой плотными контактами — особыми структурами, образованными белками, которые можно сравнить с молекулами-«липучками». Бутират усиливает производство этих «липучек», делая барьер более плотным, что значительно затрудняет проникновение вредных бактерий [31].
Лактобактерии также способны «разговаривать» с нашей иммунной системой через КЖК, перепрограммируя поведение ключевых иммунных клеток. Например, они влияют на макрофаги, заставляя их переключаться из агрессивного, провоспалительного режима (М1) в мирный, противовоспалительный режим (М2) [32]. Одновременно КЖК действуют как регулировщики для нейтрофилов — первых солдат, прибывающих на место инфекции. При воспалении их мощный, но часто разрушительный поток может усугубить повреждение. КЖК ограничивают эту чрезмерную миграцию, помогая держать воспалительный ответ под контролем [33]. Таким образом, действие КЖК представляет собой комплексную стратегию: блокирование воспаления на молекулярном уровне, укрепление физического защитного барьера и тонкая регуляция иммунного ответа.
Враждебные послания от «плохих» бактерий
Как уже упоминалось, при CST IV доминируют анаэробные бактерии, такие как G. vaginalis, Prevotella и другие. Их патогенное действие реализуется через несколько типов молекул.
Бактериальные ферменты и токсины
G. vaginalis, Prevotella и их соседи разрушают защитный слой слизи, покрывающий эпителий влагалища, с помощью специальных ферментов — сиалидаз [34]. Но сиалидазы также «убирают» защитный слой сиаловых кислот с иммуноглобулинов A (IgA), тем самым подавляя иммунную защиту [35], [36].
Другие ферменты «плохих» бактерий — гиалуронидазы и протеазы — разрушают компоненты внеклеточного матрикса, скрепляющего между собой клетки эпителия [35], [37], [38]. Это способствует разрушению белков плотных контактов между клетками и облегчает проникновение бактериальных клеток, липополисахаридов и токсинов в подлежащие ткани.
Стоит отметить, что сиалидаза-положительные штаммы G. vaginalis активно образуют устойчивые к антибиотикам биопленки на влагалищном эпителии, что объясняет рецидивы бактериального вагиноза [39]. В этих биопленках G. vaginalis выступают в роли «каркаса»: они первыми прикрепляются к клеткам, создавая защитный внеклеточный матрикс. В эту готовую структуру затем встраиваются другие ключевые анаэробы, такие как Atopobium vaginae и различные виды Prevotella. Внутри биопленки бактерии вступают в активный метаболический обмен: одни виды, расщепляя муцин, поставляют питательные субстраты для других. Это создает самоподдерживающуюся дисбиотическую систему, которая не только физически защищает бактерии от действия иммунной системы и антибиотиков, но и постоянно продуцирует патогенные факторы [40].
Особого внимания заслуживает вагинолизин — токсин, вырабатываемый G. vaginalis. Он образует поры в клеточных мембранах и лизирует эпителиальные и иммунные клетки (нейтрофилы), разрушая барьер и подрывая защиту [41], [42].
Липополисахариды
Одну из главных ролей играют липополисахариды — молекулы на поверхности грамотрицательных бактерий, таких как Prevotella и Gardnerella [11]. Иммунная система воспринимает эти вещества как сигнал опасности. Начинается каскадное воспаление через активирование клеточных рецепторов TLR4, что приводит к выбросу провоспалительных цитокинов, таких как IL-6, IL-8 и TNF-α [43].
Биогенные амины
Параллельно анаэробные бактерии производят биогенные амины (кадаверин, путресцин и т.д.). Эти вещества являются метаболическими маркерами бактериального вагиноза. Они ответственны за появление характерного «рыбного запаха» и повышение pH, что, как мы уже знаем, способствует усилению дисбиоза [44].
Избыток КЖК
КЖК в неправильном количестве могут оказаться вредны: повышенные уровни КЖК в цервикальной среде ассоциируются с воспалительной реакцией и повреждением эпителия у женщин с бактериальным вагинозом [45].
Комбинированное действие этих факторов создает патологическую цепь событий, угрожающую нормальному течению беременности.
От молекул к трагедии: как дисбиоз убивает мечту о материнстве
Теперь давайте проследим, как молекулярные послания от «плохих» бактерий могут приводить к серьезным последствиям.
Эпителиальные клетки влагалища и эндометрия скреплены между собой «плотными контактами». Но анаэробные бактерии умеют разрушать эту связь. Бактериальные ферменты (муциназы, сиалидазы и протеазы) разрушают слизистый слой и белки плотных контактов. Одновременно бактериальные токсины и биогенные амины вызывают локальное воспаление, которое усугубляет повреждение тканевого барьера [46].
Через поврежденный барьер бактерии и их компоненты (липополисахариды и другие PAMP — pathogen-associated molecular patterns) получают возможность продвигаться вверх — в полость матки, к плодным оболочкам и плаценте [47], [48]. Это называется восходящей инфекцией. В этих тканях их распознают резидентные иммунные клетки (макрофаги, дендритные клетки) через TLR-рецепторы [49]. В ответ в очаге инфекции локально запускается мощный иммунный ответ с выработкой провоспалительных цитокинов IL-6, TNF-α, IL-1β [48], [50].
Эти провоспалительные молекулы действуют непосредственно в тканях матки. Они являются частью мощного воспалительного ответа на инфекцию, который в конечном итоге приводит к структурным и функциональным изменениям, несовместимым с продолжением беременности. Воспаление в шейке матки индуцирует экспрессию специфических протеаз (матриксных металлопротеиназ), разрушающих каркас ткани — коллагеновые волокна и эластин. Это вызывает преждевременную потерю механической прочности [51]. В плодных оболочках и плаценте активный воспалительный процесс ассоциируется с повреждением тканей и является установленным фактором риска для преждевременного разрыва плодных оболочек [47]. Как результат, это может привести к преждевременным родам [48].
Этот же самый воспалительный механизм может стать препятствием и для женщин, проходящих процедуру ЭКО. Хроническое воспаление эндометрия (хронический эндометрит), поддерживаемое бактериальными компонентами, создает в полости матки иммунологически враждебную среду. Повышенные уровни провоспалительных цитокинов (IL-6, TNF-α, IL-1β) и дисбаланс иммунных клеток (сдвиг в сторону Th1/Th17) нарушают нормальное функционирование эндометрия, делая его нерецептивным — неспособным принять и поддержать эмбрион. Это состояние напрямую ассоциировано с повторными неудачами имплантации, когда генетически полноценные эмбрионы не могут прижиться в воспаленной слизистой оболочке матки, и долгожданная беременность так и не наступает [52].
Аналогично, женщины с выкидышами часто демонстрируют преобладание потенциально патогенных бактерий (G. vaginalis, Ureaplasma, Atopobium, Prevotella, Streptococcus и Mycoplasma), в отличие от женщин с успешными беременностями [9], [53]. При этом низкое количество или отсутствие разных видов Lactobacillus в первом триместре может быть связано с повышенным риском потери беременности во втором триместре [18].
Итак, дисбаланс вагинальной микрофлоры может запускать воспалительные процессы, которые повреждают ткани репродуктивной системы. Это создает условия, препятствующие как успешной имплантации эмбриона, так и вынашиванию беременности, повышая риски неудач ЭКО, выкидышей и преждевременных родов.
Учитывая установленную связь между дисбиозом и репродуктивными осложнениями, закономерным становится вопрос о методах коррекции микробиоты. Современные подходы направлены на восстановление ее здорового баланса.
Есть ли спасение?
Пришло время перестать воспринимать вагинальную микробиоту как врага, которого нужно уничтожить, и начать видеть в ней партнера, требующего понимания и грамотной поддержки. Современные исследования открывают новые многообещающие пути коррекции дисбиоза, среди которых можно выделить несколько ключевых направлений.
Пробиотики как вспомогательная терапия
Бороться с вагинальным дисбиозом необходимо комплексно. Исторически основным оружием были антибиотики, направленные на подавление инфекций и условно-патогенной флоры, но стало очевидно, что одной лишь антимикробной терапии часто недостаточно для устойчивого результата. Нужна помощь полезных бактерий — пробиотиков. И, хотя пробиотики и демонстрируют определенную эффективность в качестве монотерапии (особенно при местном применении) [54], их истинный потенциал раскрывается именно в комбинации с антибактериальными препаратами.
Этот подход получил убедительное подтверждение в крупном метаанализе, обобщившем данные 25 научных работ и 57 прямых сравнений разных методов. Исследование не только подтвердило высочайшую эффективность комбинированной терапии, но и ранжировало конкретные схемы лечения [55]. Наилучшие результаты продемонстрировала схема, которая сочетает прием антибиотика внутрь (таблетки клиндамицина), одновременное местное применение другого антибиотика (вагинальный гель метронидазола) и завершающий этап — интравагинальное введение пробиотиков с конкретными штаммами лактобактерий, такими как L. acidophilus и L. rhamnosus. Второй по эффективности (и более удобной для многих пациенток) оказалась схема с пероральным приемом и антибиотика (например, метронидазола), и пробиотиков на основе комбинации штаммов L. rhamnosus GR-1 и L. reuteri RC-14).
Почему комбинированная терапия работает так хорошо? Антибиотики действуют сообща, подавляя вредные бактерии как через кровоток, так и непосредственно в очаге инфекции. Пробиотики, введенные местно (в самой эффективной схеме) или принятые перорально (во второй схеме), активно восстанавливают здоровую микрофлору и снижают местное и общее воспаление. Такой двойной удар не только быстро устраняет симптомы, но и создает естественный защитный барьер, что очень важно для снижения высокого риска рецидивов — главной проблемы в лечении бактериального вагиноза.
Но здесь важно понять сам принцип действия пробиотиков. Ключевой парадокс заключается в том, что введенные извне лактобациллы часто не становятся постоянными жителями вагинальной экосистемы. Например, даже после полного курса терапии L. crispatus CTV-05 лишь около половины женщин сохраняли его в микрофлоре спустя три месяца после окончания приема [56]. В остальных случаях устойчивый положительный эффект был достигнут не за счет колонизации «чужим» штаммом, а благодаря восстановлению собственной эндогенной микрофлоры пациентки. Это открытие меняет сам подход к терапии: пробиотики работают как стратегический катализатор. Они временно занимают экологическую нишу, подавляя остаточные патогены и снижая воспаление. В этот период собственная микробиота женщины получает возможность для восстановления. Таким образом, истинная цель — не подселить в организм новый штамм, а грамотно использовать пробиотик как инструмент, который помогает запустить и поддержать естественные процессы самовосстановления.
Трансплантация вагинальной микробиоты: когда пробиотиков недостаточно
бактериального вагиноза исчезли. Но через месяц болезнь вернулась. Затем еще раз. И снова. Антибиотики работают, но микробиота не восстанавливается — система «сломана».
На молекулярном уровне происходит следующее: патогенные анаэробы (G. vaginalis, Prevotella, Mobiluncus) восстанавливают биопленку быстрее, чем лактобациллы успевают заселить нишу. В этой ситуации на помощь приходит трансплантация вагинальной микробиоты (ТВМ) — перенос здорового микробного сообщества от донора. Например, в исследовании 2019 года у 4 из 5 женщин с трудноизлечимым бактериальным вагинозом, получивших ТВМ после стандартной антибиотикотерапии, наблюдалась ремиссия в течение 21 месяца, и при этом не было зарегистрировано побочных эффектов [58].
Почему ТВМ зачастую работает лучше? Потому что это не одна молекула и не один штамм — это вся экосистема: десятки видов лактобацилл и их разнообразные метаболиты (молочная кислота, перекись водорода, бактериоцины). Донорская микробиота буквально «завоевывает» влагалище, создавая среду, где патогены физически не могут выжить [59].
Но и у ТВМ есть ограничения: большинство исследований все еще находятся на ранних стадиях, долгосрочные данные за пределами 24 месяцев редки, и ТВМ остается перспективой для тяжелых случаев бактериального вагиноза или женщин, планирующих беременность.
Таким образом, надежда действительно есть. Современная медицина движется от универсальных схем к персонализированным стратегиям, где восстановление и поддержание здоровой микрофлоры становится краеугольным камнем репродуктивного здоровья.
При чем тут кишечник
Репродуктивное здоровье женщины зависит не только от состояния микробиоты влагалища, но и от микробиома кишечника. Нарушение его состава ассоциировано с развитием таких патологий, как синдром поликистозных яичников и эндометриоз [60]. Влияние кишечных бактерий на репродуктивную систему женщин осуществляется через несколько основных механизмов. Во-первых, кишечная микробиота участвует в метаболизме эстрогенов через секрецию фермента β-глюкуронидазы, который превращает связанный эстроген в активную форму, всасывающуюся в кровь. При дисбиозе этот процесс нарушается, что приводит к изменению уровня циркулирующего гормона и нарушению нормальной регуляции репродуктивной функции [61]. Одновременно дисбиоз способствует повышению проницаемости кишечной стенки, что приводит к попаданию бактериальных токсинов в системный кровоток и поддерживает хроническое воспаление, негативно влияющее на эндометрий и яичники [62], [63].
Для поддержания репродуктивного здоровья важна сбалансированная микробиота, способствующая целостности кишечного барьера и оказывающая противовоспалительное действие. К наиболее полезным микроорганизмам относятся пробиотические лакто- и бифидобактерии, а также бактерии, продуцирующие КЖК. Особое значение имеет бутират, который способствует регуляции уровня половых гормонов и снижению системного воспаления [64]. С другой стороны, дисбаланс определенных бактериальных таксонов наблюдается при заболеваниях репродуктивной системы. Например, у пациенток с эндометриозом выявлены изменения в уровнях родов Coprococcus и Oscillospira [60]. В то же время, повышенное содержание бактерий, таких как Escherichia/Shigella, может усиливать воспаление и ассоциировано с тяжестью течения синдрома поликистозных яичников и эндометриоза, а избыточный рост Bacteroides vulgatus коррелирует с нарушениями метаболизма желчных кислот и инсулинорезистентностью при синдроме поликистозных яичников [60], [64].
Кроме системного воздействия, воспаление, исходящее из кишечника, изменяет среду непосредственно во влагалище. Этот процесс подавляет рост защитных лактобактерий, создавая благоприятные условия для анаэробных бактерий, таких как Gardnerella и Prevotella [65]. В результате здоровый тип микробиоты (CST I, II или III) может сместиться в сторону дисбиотического CST IV, для которого, как мы уже выяснили, характерны повышенные риски осложнений беременности.
Итак, баланс кишечной микробиоты важен для регуляции воспаления, гормонального баланса и, опосредованно, для поддержания здоровой вагинальной микрофлоры. Как же можно поддержать оптимальный состав кишечной микробиоты? Основной стратегией является сбалансированное питание [65], которое должно включать следующие компоненты:
- Пищевые волокна. Рацион, богатый клетчаткой (овощи, фрукты, цельнозерновые, бобовые) стимулирует рост продуцентов КЖК, включая бутират, который обладает системным противовоспалительным действием, что важно для репродуктивного здоровья [66], [67].
- Омега-3 полиненасыщенные жирные кислоты. Их источники — жирная рыба, морские водоросли, льняное и чиа семена. Содержащиеся в них эйкозапентаеновая и докозагексаеновая кислоты помогают снизить общий уровень воспаления в организме. Исследования показывают, что достаточное потребление омега-3 матерью ассоциировано со снижением риска преэклампсии, преждевременных родов и улучшением нейрокогнитивного развития плода [68], [69].
- Антиоксиданты и полифенолы. Эти соединения содержатся в ягодах (черноплодная рябина, ежевика, смородина, черника), зелени (шпинат, капуста), какао, гранате. Поскольку большая часть этих веществ не усваиваются в тонком кишечнике, они достигают толстой кишки, где служат субстратом для ферментации полезными бактериями. В процессе их метаболизма стимулируется рост пробиотических бактерий Lactobacillus и Bifidobacterium и вырабатываются дополнительные КЖК, что усиливает противовоспалительный эффект и укрепляет кишечный барьер [70], [71].
Заключение
Мы выяснили, что вагинальная микробиота — это динамичная экосистема, чей качественный и количественный состав напрямую влияет на женское репродуктивное здоровье. Дисбиоз, характеризующийся сменой лактобактерий на анаэробные сообщества, запускает каскад молекулярных событий (от локального повреждения барьера до системного воспаления), что создает основу для широкого спектра осложнений — от бактериального вагиноза и неудач ЭКО до потери беременности. Поскольку дисбиоз часто протекает без ярких симптомов, профилактическая диагностика и своевременная коррекция становятся важными элементами в комплексном подходе к поддержанию репродуктивного здоровья.
Этот подход требует учета и системного влияния кишечного микробиома, баланс которого можно поддерживать через питание. Таким образом, углубленное понимание механизмов взаимодействия между микробами и иммунной системой не только объясняет природу многих нарушений, но и формирует основу для новых, более эффективных стратегий в профилактике и восстановлении женского здоровья.
Литература
- Dharti C. (2025). Impact of Early Pregnancy Vaginal Microbiome Composition on Preterm Birth Risk: A Prospective Cohort Study. European Journal of Cardiovascular Medicine. 15, 283–286;
- Jacques Ravel, Pawel Gajer, Zaid Abdo, G. Maria Schneider, Sara S. K. Koenig, et. al.. (2011). Vaginal microbiome of reproductive-age women. Proc. Natl. Acad. Sci. U.S.A.. 108, 4680-4687;
- Bernadett Balla, Anett Illés, Bálint Tobiás, Henriett Pikó, Artúr Beke, et. al.. (2024). The Role of the Vaginal and Endometrial Microbiomes in Infertility and Their Impact on Pregnancy Outcomes in Light of Recent Literature. IJMS. 25, 13227;
- Zhanshan (Sam) Ma, Lianwei Li. (2017). Quantifying the human vaginal community state types (CSTs) with the species specificity index. PeerJ. 5, e3366;
- Laura M. Breshears, Vonetta L. Edwards, Jacques Ravel, Marnie L. Peterson. (2015). Lactobacillus crispatus inhibits growth of Gardnerella vaginalis and Neisseria gonorrhoeae on a porcine vaginal mucosa model. BMC Microbiol. 15;
- Wenzheng Guan, Sitong Dong, Wei Liu, Siyuan Liu, Jiao Jiao, Xiuxia Wang Effects of the Lactobacillus Crispatus Dominant Cervical Microbiome on the Outcomes of in Vitro Fertilization-Embryo Transfer in Infertile Women: A Prospective Observational Cohort Study — Elsevier BV;
- Yi-Chun Chen, Yi-Fen Chiang, Ko-Chieh Huang, Kai-Lee Wang, Yun-Ju Huang, et. al.. (2025). The Vaginal Microbiome: Associations with Vaginal pH, Menopause and Metabolic Parameters. Microorganisms. 13, 1317;
- Kilian Vomstein, Maria C. Krog, Tine Wrønding, Henriette Svarre Nielsen. (2024). The microbiome in recurrent pregnancy loss – A scoping review. Journal of Reproductive Immunology. 163, 104251;
- Marwa Saadaoui, Parul Singh, Osman Ortashi, Souhaila Al Khodor. (2023). Role of the vaginal microbiome in miscarriage: exploring the relationship. Front. Cell. Infect. Microbiol.. 13;
- Mahsa Gholiof, Emma Adamson-De Luca, Jocelyn M. Wessels. (2022). The female reproductive tract microbiotas, inflammation, and gynecological conditions. Front. Reprod. Health. 4;
- Alla Aroutcheva, Zaodung Ling, Sebastian Faro. (2008). Prevotella bivia as a source of lipopolysaccharide in the vagina. Anaerobe. 14, 256-260;
- Caizhi Huang, Craig Gin, Jennifer Fettweis, Betsy Foxman, Bizu Gelaye, et. al.. (2023). Meta-analysis reveals the vaginal microbiome is a better predictor of earlier than later preterm birth. BMC Biol. 21;
- Hayden N. Brochu, Qimin Zhang, Kuncheng Song, Ling Wang, Emily A. Deare, et. al.. (2025). Characterization of vaginal microbiomes in clinician-collected bacterial vaginosis diagnosed samples. Microbiol Spectr. 13;
- Rebecca M. Brotman, Mark A. Klebanoff, Tonja R. Nansel, Kai F. Yu, William W. Andrews, et. al.. (2010). Bacterial Vaginosis Assessed by Gram Stain and Diminished Colonization Resistance to Incident Gonococcal, Chlamydial, and Trichomonal Genital Infection. J INFECT DIS. 202, 1907-1915;
- Xiao Li, Zhaomei Tian, Ran Cui, Jiale Lv, Xin Yang, et. al.. (2023). Association between Pregestational Vaginal Dysbiosis and Incident Hypertensive Disorders of Pregnancy Risk: a Nested Case-Control Study. mSphere. 8;
- Julius Atashili, Charles Poole, Peter M Ndumbe, Adaora A Adimora, Jennifer S Smith. (2008). Bacterial vaginosis and HIV acquisition: a meta-analysis of published studies. AIDS. 22, 1493-1501;
- Milica Maksimovic Celicanin, Thor Haahr, Peter Humaidan, Axel Skafte-Holm. (2024). Vaginal dysbiosis – the association with reproductive outcomes in IVF patients: a systematic review and meta-analysis. Current Opinion in Obstetrics & Gynecology. 36, 155-164;
- Deborah B. Nelson, Scarlett Bellamy, Irving Nachamkin, Roberta B. Ness, George A. Macones, Lynne Allen-Taylor. (2007). First trimester bacterial vaginosis, individual microorganism levels, and risk of second trimester pregnancy loss among urban women. Fertility and Sterility. 88, 1396-1403;
- Xuemei Qing, Min Xie, Ping Liu, Ou Feng, Hong Leng, et. al.. (2024). Correlation between dysbiosis of vaginal microecology and endometriosis: A systematic review and meta-analysis. PLoS ONE. 19, e0306780;
- Maria P Pereira, Sydney Jones, Joshua M Costin. (2024). Association of Polycystic Ovarian Syndrome (PCOS) With Vaginal Microbiome Dysbiosis: A Scoping Review. Cureus;
- Eleni Dubé-Zinatelli, Luna Cappelletti, Nafissa Ismail. (2025). The vaginal microbiome in bacterial vaginosis: Pathogenesis, reproductive impacts, and emerging therapies. Journal of Reproductive Immunology. 172, 104804;
- Kathryn Peebles, Jennifer Velloza, Jennifer E. Balkus, R. Scott McClelland, Ruanne V. Barnabas. (2019). High Global Burden and Costs of Bacterial Vaginosis: A Systematic Review and Meta-Analysis. Sexual Trans Dis. 46, 304-311;
- Kimberly A. Workowski, Laura H. Bachmann, Philip A. Chan, Christine M. Johnston, Christina A. Muzny, et. al.. (2021). Sexually Transmitted Infections Treatment Guidelines, 2021. MMWR Recomm. Rep.. 70, 1-187;
- Deirdre Elizabeth O’Hanlon, Richard A. Come, Thomas R. Moench. (2019). Vaginal pH measured in vivo: lactobacilli determine pH and lactic acid concentration. BMC Microbiol. 19;
- Deirdre E. O’Hanlon, Thomas R. Moench, Richard A. Cone. (2013). Vaginal pH and Microbicidal Lactic Acid When Lactobacilli Dominate the Microbiota. PLoS ONE. 8, e80074;
- Chengcheng Ren, Qiuxiang Zhang, Bart J. de Haan, Hao Zhang, Marijke M. Faas, Paul de Vos. (2016). Identification of TLR2/TLR6 signalling lactic acid bacteria for supporting immune regulation. Sci Rep. 6;
- Benoit Foligne, Georgia Zoumpopoulou, Joelle Dewulf, Amena Ben Younes, Fabrice Chareyre, et. al.. (2007). A Key Role of Dendritic Cells in Probiotic Functionality. PLoS ONE. 2, e313;
- Solat Eslami, Jamshid Hadjati, Elahe Motevaseli, Reza Mirzaei, Samad Farashi Bonab, et. al.. (2016). Lactobacillus crispatus strain SJ‐3C‐US induces human dendritic cells (DCs) maturation and confers an anti‐inflammatory phenotype to DCs. APMIS. 124, 697-710;
- Xi Yue, Sun Wen, Ding Long-kun, Yan Man, Sun Chang, et. al.. (2022). Three important short-chain fatty acids (SCFAs) attenuate the inflammatory response induced by 5-FU and maintain the integrity of intestinal mucosal tight junction. BMC Immunol. 23;
- Kallie E. Hays, Jacob M. Pfaffinger, Rebecca Ryznar. (2024). The interplay between gut microbiota, short-chain fatty acids, and implications for host health and disease. Gut Microbes. 16;
- Roberta Saleri, Paolo Borghetti, Francesca Ravanetti, Valeria Cavalli, Luca Ferrari, et. al.. (2022). Effects of different short-chain fatty acids (SCFA) on gene expression of proteins involved in barrier function in IPEC-J2. Porc Health Manag. 8;
- Yongsen Wang, Wei Dou, Xin Qian, Hao Chen, Yi Zhang, et. al.. (2025). Advancements in the study of short-chain fatty acids and their therapeutic effects on atherosclerosis. Life Sciences. 369, 123528;
- Gengfeng Li, Jian Lin, Cui Zhang, Han Gao, Huiying Lu, et. al.. (2021). Microbiota metabolite butyrate constrains neutrophil functions and ameliorates mucosal inflammation in inflammatory bowel disease. Gut Microbes. 13;
- Paula Pelayo, Fatima A. Hussain, Caroline A. Werlang, Chloe M. Wu, Benjamin M. Woolston, et. al.. (2024). Prevotella are major contributors of sialidases in the human vaginal microbiome. Proc. Natl. Acad. Sci. U.S.A.. 121;
- Warren G. Lewis, Lloyd S. Robinson, Nicole M Gilbert, Justin C. Perry, Amanda L. Lewis. (2013). Degradation, Foraging, and Depletion of Mucus Sialoglycans by the Vagina-adapted Actinobacterium Gardnerella vaginalis. Journal of Biological Chemistry. 288, 12067-12079;
- Lloyd S. Robinson, Jane Schwebke, Warren G. Lewis, Amanda L. Lewis. (2019). Identification and characterization of NanH2 and NanH3, enzymes responsible for sialidase activity in the vaginal bacterium Gardnerella vaginalis. Journal of Biological Chemistry. 294, 5230-5245;
- Jay Vornhagen, Phoenicia Quach, Erica Boldenow, Sean Merillat, Christopher Whidbey, et. al.. (2016). Bacterial Hyaluronidase Promotes Ascending GBS Infection and Preterm Birth. mBio. 7;
- R Wiggins. (2001). Mucinases and sialidases: their role in the pathogenesis of sexually transmitted infections in the female genital tract. Sexually Transmitted Infections. 77, 402-408;
- Emmanuel Amabebe, Dilly O. C. Anumba. (2022). Mechanistic Insights into Immune Suppression and Evasion in Bacterial Vaginosis. Curr Microbiol. 79;
- Charlene Africa, Janske Nel, Megan Stemmet. (2014). Anaerobes and Bacterial Vaginosis in Pregnancy: Virulence Factors Contributing to Vaginal Colonisation. IJERPH. 11, 6979-7000;
- Lauren Anton, Briana Ferguson, Elliot S. Friedman, Kristin D. Gerson, Amy G. Brown, Michal A. Elovitz. (2022). Gardnerella vaginalis alters cervicovaginal epithelial cell function through microbe-specific immune responses. Microbiome. 10;
- Elinor Shvartsman, Janet E. Hill, Paul Sandstrom, Kelly S. MacDonald. (2023). Gardnerella Revisited: Species Heterogeneity, Virulence Factors, Mucosal Immune Responses, and Contributions to Bacterial Vaginosis. Infect Immun. 91;
- Nicolas S. Merle, Remi Noe, Lise Halbwachs-Mecarelli, Veronique Fremeaux-Bacchi, Lubka T. Roumenina. (2015). Complement System Part II: Role in Immunity. Front. Immunol.. 6;
- Sujatha Srinivasan, Martin T. Morgan, Tina L. Fiedler, Danijel Djukovic, Noah G. Hoffman, et. al.. (2015). Metabolic Signatures of Bacterial Vaginosis. mBio. 6;
- David J. Delgado-Diaz, David Tyssen, Joshua A. Hayward, Raffi Gugasyan, Anna C. Hearps, Gilda Tachedjian. (2020). Distinct Immune Responses Elicited From Cervicovaginal Epithelial Cells by Lactic Acid and Short Chain Fatty Acids Associated With Optimal and Non-optimal Vaginal Microbiota. Front. Cell. Infect. Microbiol.. 9;
- Bin Zhu, Zhi Tao, Laahirie Edupuganti, Myrna G. Serrano, Gregory A. Buck. (2022). Roles of the Microbiota of the Female Reproductive Tract in Gynecological and Reproductive Health. Microbiol Mol Biol Rev. 86;
- Erna Bayar, Phillip R. Bennett, Denise Chan, Lynne Sykes, David A. MacIntyre. (2020). The pregnancy microbiome and preterm birth. Semin Immunopathol. 42, 487-499;
- Jennifer M. Fettweis, Myrna G. Serrano, J. Paul Brooks, David J. Edwards, Philippe H. Girerd, et. al.. (2019). The vaginal microbiome and preterm birth. Nat Med. 25, 1012-1021;
- Beom Seok Park, Jie-Oh Lee. (2013). Recognition of lipopolysaccharide pattern by TLR4 complexes. Exp Mol Med. 45, e66-e66;
- Ari Urakubo, L.Fredrik Jarskog, Jeffrey A. Lieberman, John H. Gilmore. (2001). Prenatal exposure to maternal infection alters cytokine expression in the placenta, amniotic fluid, and fetal brain. Schizophrenia Research. 47, 27-36;
- Alexandra R Willcockson, Tulip Nandu, Cheuk-Lun Liu, Shanmugasundaram Nallasamy, W Lee Kraus, Mala Mahendroo. (2018). Transcriptome signature identifies distinct cervical pathways induced in lipopolysaccharide-mediated preterm birth†,‡. Biology of Reproduction. 98, 408-421;
- Xinyang Yan, Jiao Jiao, Xiuxia Wang. (2025). Inflammatory mechanisms and therapeutic advances in chronic endometritis. Front. Immunol.. 16;
- Karen Grewal, Yun S. Lee, Ann Smith, Jan J. Brosens, Tom Bourne, et. al.. (2022). Chromosomally normal miscarriage is associated with vaginal dysbiosis and local inflammation. BMC Med. 20;
- Yuxin Fan, Yanhong Gu, Yi Xian, Qinya Li, Youli He, et. al.. (2024). Efficacy and safety of different drugs for the treatment of bacterial vaginosis: a systematic review and network meta-analysis. Front. Cell. Infect. Microbiol.. 14;
- Alison Muñoz-Barreno, Fausto Cabezas-Mera, Eduardo Tejera, António Machado. (2021). Comparative Effectiveness of Treatments for Bacterial Vaginosis: A Network Meta-Analysis. Antibiotics. 10, 978;
- Eric Armstrong, Anke Hemmerling, Steve Miller, Kerianne E Burke, Sara J Newmann, et. al.. (2022). Sustained effect of LACTIN-V (Lactobacillus crispatus CTV-05) on genital immunology following standard bacterial vaginosis treatment: results from a randomised, placebo-controlled trial. The Lancet Microbe. 3, e435-e442;
- Sayyeda Farwa Mazhar, Muhammad Afzal, Ahmad Almatroudi, Samman Munir, Usman Ali Ashfaq, et. al.. (2020). The Prospects for the Therapeutic Implications of Genetically Engineered Probiotics. Journal of Food Quality. 2020, 1-11;
- Ahinoam Lev-Sagie, Debra Goldman-Wohl, Yotam Cohen, Mally Dori-Bachash, Avner Leshem, et. al.. (2019). Vaginal microbiome transplantation in women with intractable bacterial vaginosis. Nat Med. 25, 1500-1504;
- Dongwen Ma, Yidan Chen, Tingtao Chen. (2019). Vaginal microbiota transplantation for the treatment of bacterial vaginosis: a conceptual analysis. FEMS Microbiology Letters. 366;
- Sangappa B Chadchan, Vertika Singh, Ramakrishna Kommagani. (2022). Female reproductive dysfunctions and the gut microbiota. Journal of Molecular Endocrinology. 69, R81-R94;
- Roberto Flores, Jianxin Shi, Barbara Fuhrman, Xia Xu, Timothy D Veenstra, et. al.. (2012). Fecal microbial determinants of fecal and systemic estrogens and estrogen metabolites: a cross-sectional study. J Transl Med. 10;
- Josey Muske, Kathryn Knoop. (2023). Contributions of the microbiota to the systemic inflammatory response. Microbiota and Host. 1;
- Fan Tang, Mengqi Deng, Chunyu Xu, Ruiye Yang, Xuechao Ji, et. al.. (2024). Unraveling the microbial puzzle: exploring the intricate role of gut microbiota in endometriosis pathogenesis. Front. Cell. Infect. Microbiol.. 14;
- Efthalia Moustakli, Sofoklis Stavros, Periklis Katopodis, Anastasios Potiris, Peter Drakakis, et. al.. (2025). Gut Microbiome Dysbiosis and Its Impact on Reproductive Health: Mechanisms and Clinical Applications. Metabolites. 15, 390;
- H Borgdorff, R Gautam, S D Armstrong, D Xia, G F Ndayisaba, et. al.. (2016). Cervicovaginal microbiome dysbiosis is associated with proteome changes related to alterations of the cervicovaginal mucosal barrier. Mucosal Immunology. 9, 621-633;
- Kassem Makki, Edward C. Deehan, Jens Walter, Fredrik Bäckhed. (2018). The Impact of Dietary Fiber on Gut Microbiota in Host Health and Disease. Cell Host & Microbe. 23, 705-715;
- Zhi-Wei Guan, En-Ze Yu, Qiang Feng. (2021). Soluble Dietary Fiber, One of the Most Important Nutrients for the Gut Microbiota. Molecules. 26, 6802;
- Medha Priyadarshini, Alexandra Thomas, Anna C. Reisetter, Denise M. Scholtens, Thomas M.S. Wolever, et. al.. (2014). Maternal short-chain fatty acids are associated with metabolic parameters in mothers and newborns. Translational Research. 164, 153-157;
- Izaskun García-Mantrana, Marta Selma-Royo, Sonia González, Anna Parra-Llorca, Cecilia Martínez-Costa, María Carmen Collado. (2020). Distinct maternal microbiota clusters are associated with diet during pregnancy: impact on neonatal microbiota and infant growth during the first 18 months of life. Gut Microbes. 11, 962-978;
- Blanca Elizabeth Ruiz-Álvarez, Valentina Cattero, Yves Desjardins. (2025). Prebiotic-like Effects of Proanthocyanidin-Rich Aronia Extract Supplementation on Gut Microbiota Composition and Function in the Twin-M-SHIME® Model. Pharmaceuticals. 18, 793;
- Chuanhong Luo, Xichuan Wei, Jiao Song, Xiaorong Xu, Haozhou Huang, et. al.. (2022). Interactions between Gut Microbiota and Polyphenols: New Insights into the Treatment of Fatigue. Molecules. 27, 7377.







