Много — не значит хорошо: «Ультрикс», «Гриппол», «Совигрипп» — что выбрать?
25 сентября 2019
Много — не значит хорошо: «Ультрикс», «Гриппол», «Совигрипп» — что выбрать?
- 243571
- 37
- 15
Изображение вируса «свиного» гриппа (H1N1) из лаборатории CDC
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Наступила осень, а за ней придет зима с вечными простудами и гриппом, поэтому вопрос как сделать так, чтобы не болеть, снова актуален. Но если с обычными сезонными вирусами ничего не поделаешь, то уберечься от гриппа можно попытаться, например, при помощи вакцинации. И тут встают два вопроса: насколько эффективны вакцины против гриппа и какой из них лучше привиться?
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Несмотря на то, что к прививкам против гриппа многие относятся довольно скептически, с каждым годом количество привитых людей растет, и если в 1998 году против гриппа привилось около 6,5 млн россиян [1], то спустя 20 лет прививки сделало рекордное количество жителей нашей страны – 70,8 млн (практически 50% населения)! Однако все это время нас прививали только трехкомпонентными вакцинами, при этом в других странах еще семь лет назад появились вакцины нового поколения, состоящие из четырех компонентов [2]. В 2019 году два таких препарата — «Гриппол® Квадривалент» и «Ультрикс® Квадри» — появятся на отечественных просторах. И хотя в первую очередь ими планируют прививать группы риска (беременных, врачей, студентов, призывников, а также людей с хроническими заболеваниями), это — отличная новость для всех, ведь такие вакцины более эффективны, потому что защищают от двух штаммов вируса гриппа типа А и от обеих линий вируса типа В.
Мутации и вариации
Известно три разновидности вируса гриппа, опасных для человека:
- тип А (Alphainfluenzavirus) — наиболее подвержен мутациям и является постоянной головной болью Всемирной организации здравоохранения (ВОЗ);
- тип В (Betainfluenzavirus) — более стабилен, но все же может видоизменяться;
- тип С (Gammainfluenzavirus) — наиболее стабилен, поэтому к нему вырабатывается длительный иммунитет. Эпидемичных вспышек не дает, чаще всего приводит к нетяжелому заболеванию у детей.
Если бы все типы вируса гриппа были похожи на тип С, больших проблем с ними не было. Однако тип А постоянно мутирует, поэтому довольно часто появляются его новые вариации (штаммы), с которыми наша иммунная система еще не знакома [2]. Из-за этой изменчивости классификация вирусов гриппа достаточно сложная: внутри каждого типа существуют подтипы (в случае с типом В — линии), в которые объединяют штаммы вируса. Причем, штаммы подтипов могут быть как родственными (то есть эволюционно недалеко ушедшими друг от друга), так и непохожими.
Иногда различия между штаммами подтипа имеют довольно серьезные последствия: например, в феврале 2019 года циркуляция двух таких генетически неоднородных «родственников» — штаммов H3N2 — стала причиной задержки решения ВОЗ по поводу состава вакцины сезона 2019–2020 [3]. Экспертам потребовался целый месяц дополнительного мониторинга, чтобы принять решение, какой из штаммов рекомендовать для вакцины. В итоге эта задержка скажется на более поздних сроках поставки некоторых вакцин (в основном для пожилых людей старше 65 лет), которые попадут на рынки только в ноябре 2019 года.
Основную роль в эволюции вирусов гриппа (рис. 1) играют антигенный дрейф (antigenic drift) и антигенный сдвиг (antigenic shift). В результате антигенного дрейфа происходит постепенное изменение свойств вируса из-за мутаций в вирусном геноме и естественного отбора наиболее «удачных» вариантов, способных с легкостью заражать животных и человека. Антигенный сдвиг связан с реассортацией и представляет собой «рождение» новой вирусной частицы от двух разных штаммов (часто в этом процессе принимают участие вирусы, заражающие различных сельскохозяйственных животных).
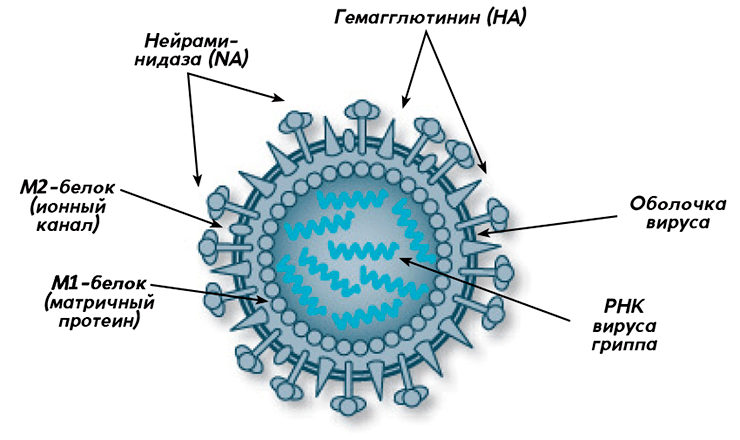
Рисунок 1. Строение вируса гриппа (типы А и В)
Реассортация очень напоминает то, как у двух родителей «получаются» дети: когда два разных вириона вируса попадают в одну клетку и начинают размножаться, они могут обменяться частями своего генома. В результате получится новая вариация вируса, которая может значительно отличаться от своих предков. Скорее всего, все пандемии гриппа, в том числе и «испанка» , были вызваны реассортацией вирусов [12]. Что важно, для вируса гриппа типа В характерен только антигенный дрейф, и это делает его менее проблемным с точки зрения разработки вакцины.
Про пандемию испанского гриппа читайте в моей новой статье «Птичий грипп: самая страшная пандемия» на «Биомолекуле».
Когда лучше сделать прививку?
Вакцинация против гриппа — это ежегодная прививка , которая защищает от трех или четырех наиболее распространенных в данной местности штаммов вируса. Это значит, что каждый год на основании рекомендаций ВОЗ и региональной ситуации национальные комитеты по контролю над гриппом составляют рекомендации антигенного состава будущей вакцины [15], [16]. Однако чаще всего эти рекомендации совпадают с рекомендациями ВОЗ, которые публикуются отдельно для северного и южного полушарий.
Большинству людей прививают одну дозу вакцины, однако детям от шести месяцев до двух лет (и до девяти лет в случае их первой вакцинации [17]) рекомендованы две дозы с минимальным интервалом в один месяц. Исследования показывают, что в этом случае эффективность вакцинации увеличивается [18], [2].
Состав противогриппозных вакцин все время меняется: например, в сезоне 2019–2020 были заменены оба штамма вируса типа А, и в итоге в четырехкомпонентную вакцину вошли:
- A/Brisbane/02/2018 (H1N1);
- A/Kansas/14/2017 (H3N2);
- B/Colorado/06/2017 (линия B/Victoria/2/87);
- B/Phuket/3073/2013 (линия B/Yamagata/16/88).
В трехкомпонентную вакцину, соответственно, рекомендовано включить первые три штамма вируса [16]. Однако бывает и так, что каждый год в составе вакцин повторяется название одного из штаммов. Значит ли это, что постоянно прививают одно и то же? Нет, даже в этом случае штаммы могут существенно различаться, в том числе и по генам, не входящим в классификацию.
Как долго длится иммунитет после вакцинации и имеет ли он пролонгированный эффект на будущий год? К сожалению, эффективность прививок против гриппа недолговечна. Она зависит от времени, прошедшего с момента прививки и штамма вируса: в среднем, считается, что защита снижается примерно на 7% в месяц для H3N2 и штаммов линии В и на 6–11% — для H1N1 [17]. Конечно, скорость и степень снижения могут различаться, но эффективной защиты, скорее всего, хватает на год [11].
В связи с этим возникает вопрос: «Когда лучше сделать прививку?» Оптимальный срок рассчитывают, исходя из начала подъема заболеваемости гриппом (обычно она приходится на январь-февраль), темпов снижения поствакцинального иммунитета и времени, необходимого на выработку защиты после вакцинации (две недели). И, хотя прививочная кампания начинается в сентябре, прививку лучше сделать в середине или даже конце октября [17]. Однако сильно затягивать тоже не стоит — в этом случае увеличиваются шансы подхватить грипп в самом начале эпидсезона.
Как выбирают штаммы и почему четыре лучше трех?
Если в двух словах описать процесс выбора штаммов для состава вакцины, это будет игра в «угадай штамм» (что, впрочем, сильно отличается от «ткни пальцем в небо»). Процесс «угадывания» достаточно сложен и требует отлаженной работы глобальной системы надзора за гриппом под эгидой ВОЗ — Global Influenza Surveillance and Response System (GISRS). В нее входят более 100 национальных центров по гриппу (NICs), находящихся в разных странах.
В течение всего года специалисты NICs анализируют циркулирующие штаммы вирусов на основании лабораторных анализов пациентов с респираторными заболеваниями, выделяют из общей массы пробы с вирусом гриппа и выбирают подходящих кандидатов для дальнейшего изучения в одном из пяти центров ВОЗ (WHO CCs) [19]. Отбор идет по принципу типичности вируса для данного региона и новизне, которую определяют по его реакции с антителами из набора ВОЗ. Дальнейшая работа осуществляется уже в центрах ВОЗ, где штаммы культивируют, анализируют, сравнивают между собой, составляют карты антигенности, строят математические модели и в итоге на основании всех этих данных выбирают претендентов в состав вакцины [19]. Как происходит этот процесс и сколько времени занимает каждая стадия, показано на рисунке 2.
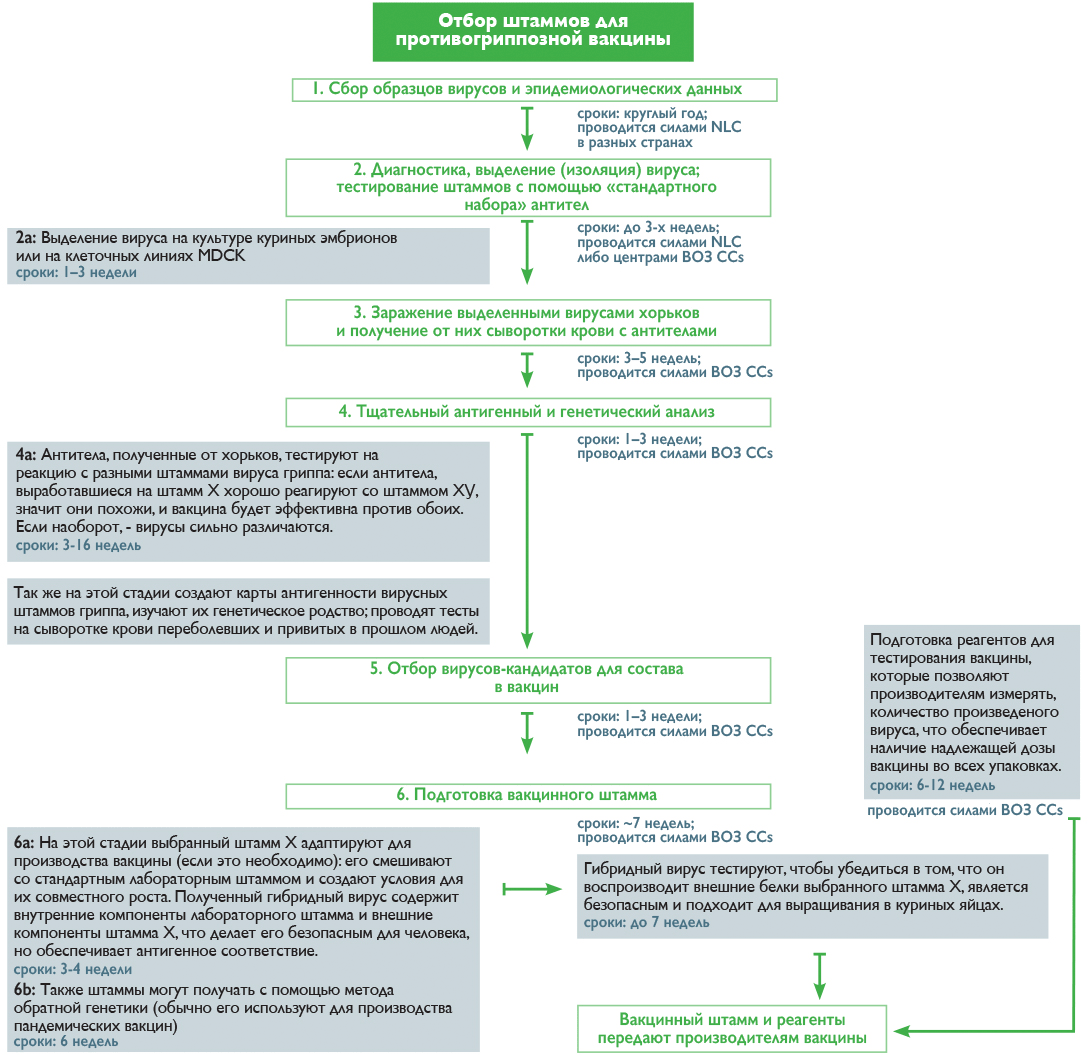
Рисунок 2. Процесс отбора штаммов для противогриппозной вакцины
И наконец, дважды в год проходят Сезонные совещания ВОЗ, посвященные составам противогриппозных вакцин (Seasonal influenza vaccine composition meeting), на которых объявляют рекомендации для будущего сезона: в феврале — для северного полушария, в сентябре — для южного. Как только составы обнародованы, и производители получают вакцинные штаммы, запускается процесс производства, на который уходит около полугода (видео 1). Однако ошибки в планировании могут задержать весь цикл, что скажется на количестве произведенной вакцины или на сроках ее поставки.
Видео 1. Производство противогриппозных вакцин
Почему все-таки четырехкомпонентная вакцина лучше трехкомпонентной, если циркулирующих штаммов гораздо больше? Все дело в линии В, вирусы которой обычно циркулируют вместе, но в разных пропорциях [3], поэтому в случае с вакцинами, состоящими из трех компонентов, штамм линии В всегда является компромиссным вариантом. Экспертам ВОЗ приходится выбирать большее из двух зол, но так как невозможно точно предсказать ситуацию, которая будет наблюдаться через восемь месяцев, периодически случаются ошибки, сказывающиеся на эффективности вакцины. Например, в сезоне 2017–2018 она оказалась ниже ожидаемой, так как ВОЗ прогадала со штаммом вируса типа В, предположив, что доминировать будет линия Victoria, а оказалось — Yamagata [20]. Кроме того, уже не первый год наблюдается низкая эффективность вакцины в отношении штамма H3N2. Точная причина неизвестна, но существует несколько предположений:
- Адаптация штамма во время производства может приводить к некоторым изменениям (антигенному несоответствию), и иммунитет развивается уже к новому штамму, который отличается от циркулирующего.
- Циркулирующие штаммы подтипа H3N2 меняются быстрее, чем другие — им хватает полугода (то есть времени, прошедшего с момента объявления рекомендаций ВОЗ), чтобы измениться и стать менее похожим на вакцинный штамм.
- Стандартной дозы, содержащейся в вакцине, может быть недостаточно для эффективной защиты [18], [21].
Какой должна быть идеальная вакцина?
Вакцины против гриппа бывают живыми (интраназальные вакцины, применяются редко) и инактивированными. Современные инактивированные делятся на нескольких категорий:
- Цельновирионные вакцины («Микрофлю»), в состав которых входит инактивированный неразрушенный (цельный) вирион вируса (рис. 3а). Несмотря на то, что эти вакцины наиболее эффективны, их практически не используют из-за более высокой реактогенности.
- Расщепленные, или сплит-вакцины («Ваксигрип»), включающие в себя не цельный вирус, а его частицы — наружные и внутренние типоспецифические белки (рис. 3б).
- Субъединичные вакцины («Инфлювак») состоят только из поверхностных антигенов — гемагглютинина и нейраминидазы (рис. 3в). Также к ним относятся субъединичные адъювантные вакцины («Совигрипп», «Гриппол плюс»), в состав которых добавлен адъювант.
- Виросомальные вакцины («Инфлексал® V») — инактивированные вакцины нового поколения, которые создают на основе субъединичных или сплит-вакцин. Отличаются они тем, что кроме поверхностных антигенов в их состав включены мембранный белок и липиды вируса гриппа. Эти компоненты формируют виросомы — структуры, имитирующие вирион вируса. Такие вакцины считаются более эффективными, нежели сплит- или субъединичные, при этом они не уступают им в безопасности [22].
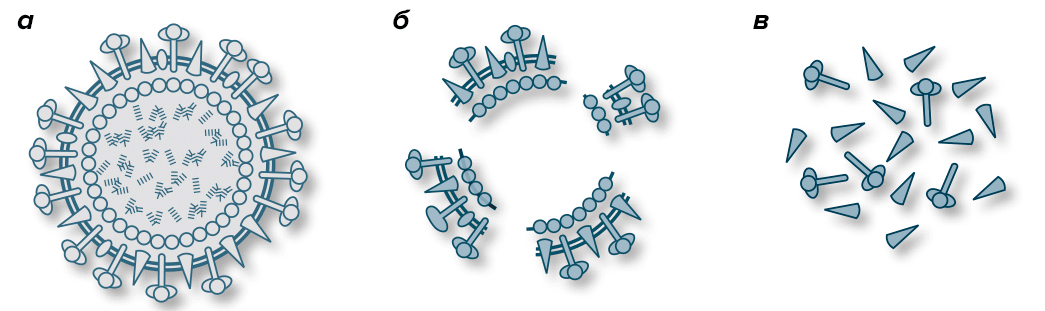
Рисунок 3. Виды антигенов инактивированных вакцин. а — Инактивированный вирусный вирион в цельновирионной вакцине. б — Расщепленный инактивированный вирион в сплит-вакцине. в — Частички антигена в субъединичной вакцине.
Все вышеперечисленные вакцины являются вакцинами против сезонного гриппа .
В отдельную группу выделяют препандемические и пандемические вакцины. Их производят в случае возникновения угрозы пандемии. Препандемические (зоонозные) состоят из штамма зарождающегося вируса животного происхождения, который, по мнению экспертов, обладает пандемическим потенциалом, пандемические — из штамма, вызвавшего пандемию (такие вакцины появляются на волне заболеваемости) [15].
Однако выбрать штаммы для состава — лишь полдела. Главное, чтобы вакцина была эффективной. Для этого существуют определенные критерии.
Во-первых, за последние 20 лет было проведено множество исследований разных противогриппозных вакцин, и их результаты привели к определенному «стандарту», которому должно соответствовать количество гемагглютинина каждого штамма (далее — антиген) — 15 мкг на дозу вакцины [23]. Однако при этом ВОЗ замечает, что «на основании клинического опыта некоторые страны могут уменьшать количество антигенов» [23].
Во-вторых, существуют требования к титрам антител после вакцинации (в том числе и для вакцин с адъювантами), которые указаны в таблице 1.
| Показатель | Люди от 18 до 60 лет | Люди старше 60 лет |
|---|---|---|
| 1. Кратность нарастания среднего геометрического титра антител после вакцинации (GMT increase) | 2,5 раза | 2 раза |
| 2. Уровень сероконверсии * (процент привитых с нарастанием титра антител минимум в четыре раза по сравнению с исходым) | 40% | 30% |
| 3. Уровень серопротекции (число лиц с защитным титром) ** | 70% | 60% |
| * — В тестах, измеряющих ингибирование гемагглютинина (HI), сероконверсия соответствует отрицательной сыворотке до вакцинации (HI < 1:10) и сыворотке крови после вакцинации HI ≥ 1:40. ** — Серопротекция соответствует проценту привитых с сывороткой HI ≥ 1:40. | ||
Для сезонных вакцин необязательно соблюдение всех трех условий; соответствие всем требованиям необходимо только для пандемических [24]. Мало того, сейчас титр HI ≥ 1:40 уже не считается надежным фактором для определения эффективности защиты (50–70% против клинических симптомов гриппа), так как уровни защиты могут варьировать в зависимости от индивидуальных характеристик, групп населения, возрастных групп и даже от типа вакцины [25].
В-третьих, есть отдельные требования к вакцинам, содержащим адъюванты:
- Совместимость адъюванта с антигенными компонентами вакцины.
- Доказательство последовательной связи адъюванта с вакцинными антигенами во время производства и в течение срока годности.
- Данные о влиянии адъюванта на эффективность вакцины.
- Биохимическая чистота адъюванта [23].
Если все это суммировать, то идеальная вакцина должна быть безопасной (низкореактогенной ), содержать 15 мкг гемагглютинина на дозу, вызывать определенные уровни титров антител у привитых в зависимости от их возраста (при этом количество эффективно привитых должно быть не менее 70% среди взрослого населения до 60 лет). Если же вакцина содержит адъювант, он должен быть безопасным, связанным с антигенами и вызывать иммунный ответ в соответствии со строгими стандартами.
Что касается безопасности, то благодаря широкому использованию сплит- и субъединичных вакцин, прививки против гриппа демонстрируют низкую реактогенность. В основном наблюдаются местные реакции (у 10–64 привитых из 100) и повышение температуры (чаще всего у детей: 12 из 100 привитых) [26].
Чем же прививаться?
Это вопрос, который волнует многих. В России прививают следующими вакцинами:
- Живые:
- «Ультравак» (НПО «Микроген», Россия). Минимальный возраст вакцинации — 3 года.
- Инактивированные трехкомпонентные:
- «Ваксигрип» (Sanofi, Франция) — сплит-вакцина. Содержит по 15 мкг антигенов каждого штамма. Минимальный возраст вакцинации — 6 месяцев.
- «Ультрикс» (ООО «ФОРТ», Россия) — сплит-вакцина. Антигенный состав: 15 ± 2,2 мкг каждого штамма вируса. Минимальный возраст вакцинации — 6 месяцев.
- «Флю-М» (ФГУП «Санкт-Петербургский научно-исследовательский институт вакцин и сывороток» ФМБА России) — еще одна сплит-вакцина, которая содержит по 15 мкг антигенов. Минимальный возраст вакцинации — 6 лет.
- «Гриппол плюс» («НПО Петровакс Фарм», Россия) — субъединичная вакцина с синтетическим адъювантом полиоксидонием. Минимальный возраст вакцинации — 6 месяцев. Эту вакцину часто путают с «Грипполом», который до 2017 года выпускал НПО «Микроген» (сейчас он снят с производства). Действительно, у вакцин много общего: обе вакцины являются полимер-субъединичными, в обеих по 5 мкг штаммов вируса гриппа типа А и адъювант полиоксидоний. Различались они только количеством штамма вируса гриппа типа В (в «Грипполе» — 11 мкг, в «Гриппол Плюс» — 5 мкг) и наличием консерванта (в «Грипполе Плюс» его нет).
- «Совигрипп» (НПО «Микроген» или ООО «ФОРТ», Россия) — субъединичная вакцина с синтетическим адъювантом совидоном; содержит 5 мкг антигена каждого штамма типа А и 11 мкг — типа В. Минимальный возраст вакцинации — 6 месяцев (версия без консерванта).
- Инактивированные четырехкомпонентные:
- «Ультрикс® Квадри» (ООО «ФОРТ», Россия) — сплит-вакцина, содержащая два штамма вируса гриппа типа А и два штамма обеих циркулирующих линий вируса типа В в количестве 15 ± 2,2 мкг каждого. Минимальный возраст вакцинации — 18 лет.
- «Флю-М Тетра» (ФГУП «Санкт-Петербургский научно-исследовательский институт вакцин и сывороток» ФМБА России) — почти то же самое, что и «Ультрикс Квадри»: четырехкомпонентная расщепленная вакцина. Минимальный возраст вакцинации — 18 лет.
- «Гриппол® Квадривалент» («НПО Петровакс Фарм», Россия) — инактивированная субъединичная адъювантная вакцина. Содержит два штамма вируса гриппа типа А и два штамма обеих циркулирующих линий вируса типа В в количестве по 5 мкг каждого и адъювант полиоксидоний. Минимальный возраст вакцинации — 18 лет.
До недавнего времени в нашей стране прививали только трехкомпонентные вакцины, но так как с 2019 года появляются две новые, состоящие из четырех компонентов, вариантов для выбора становится больше. Однако извечный вопрос «Что делать?», то есть какую вакцину выбрать, приобретает все бóльшую актуальность. Дело в том, что из-за пониженного содержания антигенов (5 мкг) и полиоксидония, адъювантные свойства которого часто вызывают у скептиков большие сомнения [32], вокруг «Гриппола Плюс» постоянно ведутся разговоры о неэффективности. И часто из всего разнообразия врачи рекомендуют остановиться либо на импортных препаратах, либо на «Ультриксе», потому что в них соблюден стандарт в 15 мкг антигенов и нет сомнительных адъювантов.
Однако помимо количества антигена важна еще технология выращивания вируса и его очистки, а насколько качественно это делает ООО «ФОРТ», сказать сложно. Да и с количеством антигенов в этой вакцине все не так однозначно, ибо оно может быть меньше или даже больше заявленных 15 мкг. Детальная информация по этому вопросу есть в инструкции, в которой указано, что в одной дозе (0,5 мл) вакцины содержится «(15±2,2) мкг гемагглютинина» [33] (а, например, во французском «Ваксигрипе» антигенов ровно по 15 мкг на дозу [34]).
Мало того, «Ультрикс» — это вакцина-загадка с туманной биографией. Она была зарегистрирована в 2008 году и называлась «Грифор», но в 2012 году была переименована в «Ультрикс». До 2015 года включительно эта вакцина значилась как «цельновирионная» (то есть содержала цельный инактивированный вирион вируса гриппа) и была зарегистрирована под кодом J07BB01 по ATX («цельновирионные инактивированные вакцины»). А в 2016 году «Ультрикс» вдруг превратился в инактивированную расщепленную вакцину с новым кодом J07BB02 [33]. При этом в исследованиях 2013–2016 годов она значится как «виросомальная вакцина» [22], [35–38], и только в последние 2–3 года ее изучали как «расщепленную». К какому именно типу она в итоге относится, сказать трудно, но в актуальной инструкции [33] про виросомы не сказано ни слова (хотя должно было бы — сравните с инструкцией к виросомальному «Инфлексал® V»). Поэтому, чтобы не запутаться, более-менее актуальные данные по иммуногенности «Ультрикса» лучше искать в исследованиях, проведенных позже 2015 года, и на сайте производителя. И тут начинается самое интересное: данные производителя не информативны, так как узнать из них можно лишь то, что вакцина соответствует критериям СРМР (в настоящее время — CHMP), и об уровнях заболеваемости ОРВИ у привитых и непривитых (привитые болели меньше, но как понять, насколько реже они болели именно гриппом?). Кроме того, данные по уровням сероконверсии известны только у «привитых с высокими рисками заболевания гриппом и ОРВИ», но не приведено ни попарное сравнение, ни количество серонегативных привитых [39].
Исследования тоже оставляют желать лучшего, и после отсева тех, которые изучали вирусомальный «Ультрикс», становится совсем грустно, потому что публикаций мало, да и изучают они то безопасность, то сероконверсию, то заболеваемость привитых гриппом и ОРВИ [36], [39], [40]. Какие тут можно делать далеко идущие выводы? Привитые, конечно, меньше болеют, но насколько это заслуга вакцинации — не понятно.
Заболеваемость привитых ОРВИ в нашей стране изучают неспроста: существует мнение, которое приписывают В.К. Таточенко [37], что «некоторые вакцины против гриппа (сплит- и цельновирионные), содержащие РНК вируса гриппа, обладают способностью усиливать выработку эндогенных интерферонов», что может содействовать защите от заболевания не только вирусом гриппа, но и другими респираторными вирусами [37]. Насколько все это соответствует действительности, сказать трудно, однако в международной практике подобное свойство противогриппозных вакцин не рассматривается. А на сайте американских Центров по контролю и профилактике заболеваний (CDC) прямым текстом написано: «Вакцины против гриппа НЕ защищают от инфекций и болезней, вызванных другими вирусами, которые могут вызывать похожую на грипп симптоматику» [18].
Теперь переходим к «Грипполу Плюс». Прародителем этой вакцины был «Гриппол», который в 1996 году разработали специалисты «НПО Петровакс Фарм» в сотрудничестве компанией Solvay Pharma, в 2010 году вошедшей в состав Abbott. В 2008 году ее усовершенствовали (уменьшили количество антигенов штамма вируса линии В до 5 мкг, а также начали использовать куриные эмбрионы для культивации вирусов) и переименовали в «Гриппол Плюс» [41]. Довольно долгое время в него фасовали голландские антигены [41], [42], и, возможно, до сих пор некоторая часть вакцин состоит из импортных «запчастей». Несмотря на пониженное содержание антигена (5 мкг), что, как сказано выше, допускается стандартом ВОЗ [23], вакцина соответствует главному критерию — уровням сероконверсии у привитых, которые, согласно исследованиям, составляют в среднем 80–90% ко всем трем антигенам вируса гриппа [43–45]. При этом понижение количества антигена объясняется довольно просто: это позволяет сделать добавление адъюванта, так как адъюванты усиливают (иногда регулируют) иммунную реакцию на ослабленный возбудитель [46]. Осталось только доказать, что полиоксидоний — адъювант.
Полиоксидоний, или бромид азоксимера, — синтетический иммуномодулятор, адъювант, сополимер, призванный усиливать иммунный ответ на вакцинацию [47], [48]. В его инструкции указано, что он оказывает «прямое воздействие на фагоцитирующие клетки и естественные киллеры», а также стимулирует образование антител и синтез интерферонов. Но так как доказательная база по полиоксидонию не безупречна, несмотря на наличие некоторых отечественных исследований, нельзя с уверенностью утверждать о его адъювантных свойствах.
Безопасен ли полиоксидоний — очень интересный вопрос. С одной стороны, многолетнее применение обоих «Грипполов» говорит в пользу его безопасности. С другой — нет веских доказательств и заслуживающих доверия клинических исследований, которые бы убедительно отвечали на этот вопрос. Однако, по словам Михаила Цыферова, президента «НПО Петровакс Фарм», в компании занимаются обновлением доказательной базы по полиоксидонию и, «чтобы закрепить доверие пациентов и специалистов», препарат тестируют в европейских странах (Словакия [51]) и во «французской лаборатории».
Что касается «Совигриппа», еще одной отечественной адъювантной субъединичной вакцины с пониженным содержанием антигена, то претензии к ней те же, что и к «Грипполу Плюс»: 5 мкг антигена вместо 15 и адъювант совидон, заслуживающих доверия исследований которого нет. И хотя «Совигрипп» тоже соответствует критериям ВОЗ по иммуногенности, обеспечивая высокие уровни сероконверсии (не менее 82% — к штамму H1N1; 78,5% — к H3N2; 74,7% — к B/Brisbane/33/2008) и серопротекции (77,2%, 70,9% и 74,7% соответственно) [52], отсутствие крупных сравнительных исследований с зарубежными вакцинами не снимает вопросы о его эффективности и безопасности.
Муки выбора
Ничего не поделаешь: у российских вакцин (в том числе и у разрекламированного «Ультрикса») есть слабые места, и чтобы снять с них подозрение в неэффективности, необходимо провести крупные клинические исследования, в которых будут сравнивать уровни сероконверсии, серопротекции и заболеваемость гриппом среди привитых (или хотя бы «гриппоподобными заболеваниями), а не ОРВИ. Справедливости ради, стоит сказать, что подобные исследования есть у «Гриппола Плюс» [43], [45], [53], [54] (правда, они небольшие, и по их результатам выходит, что у него «сходная эффективность» с импортными препаратами [43]). В качестве примера я выбрала, наверное, наиболее крупное исследование, в котором участвовали 300 взрослых добровольцев [43]. Сравнивались полимер-субъединичная вакцина «Гриппол Плюс», субъединичная вакцина «Ифлювак» и сплит-вакцина «Ваксигрип» (табл. 2).
| Параметр иммуногенности* | Требование СРМР** | Результаты исследования | ||
|---|---|---|---|---|
| Группа 1 («Гриппол Плюс») | Группа 2 («Инфлювак») | Группа 3 («Ваксигрип») | ||
| Штамм А/H1N1 | ||||
| Фактор сероконверсии | Более 2,5 | 7,20 | 7,57 | 8,06 |
| Уровень сероконверсии | Более 40% | 93,2%*** | 94,6% | 94,4% |
| Уровень серопротекции | Более 70% | 95% | 95% | 96% |
| Штамм A/H3N2 | ||||
| Фактор сероконверсии | Более 2,5 | 3,78 | 4,59 | 4,32 |
| Уровень сероконверсии | Более 40% | 67,4% | 77,8% | 92,5% |
| Уровень серопротекции | Более 70% | 90,9% | 90% | 96% |
| Штамм линии В | ||||
| Фактор сероконверсии | Более 2,5 | 2,70 | 2,50 | 3,27 |
| Уровень сероконверсии | Более 40% | 71,4% | 90% | 93,8% |
| Уровень серопротекции | Более 70% | 99% | 100% | 100% |
| * — Оценку иммуногенности проводили по уровню специфических антител к гемагглютинину вируса гриппа каждого штамма в сыворотках крови, полученных до прививки и на 28 день после вакцинации. ** — Сейчас эта организация называется CHMP. *** — Проценты привитых. | ||||
Но, честно говоря, таких исследований единицы, поэтому выводы приходится делать по косвенным данным — официальной статистике заболеваемости гриппом в зависимости от количества привитых в нашей стране (рис. 4).
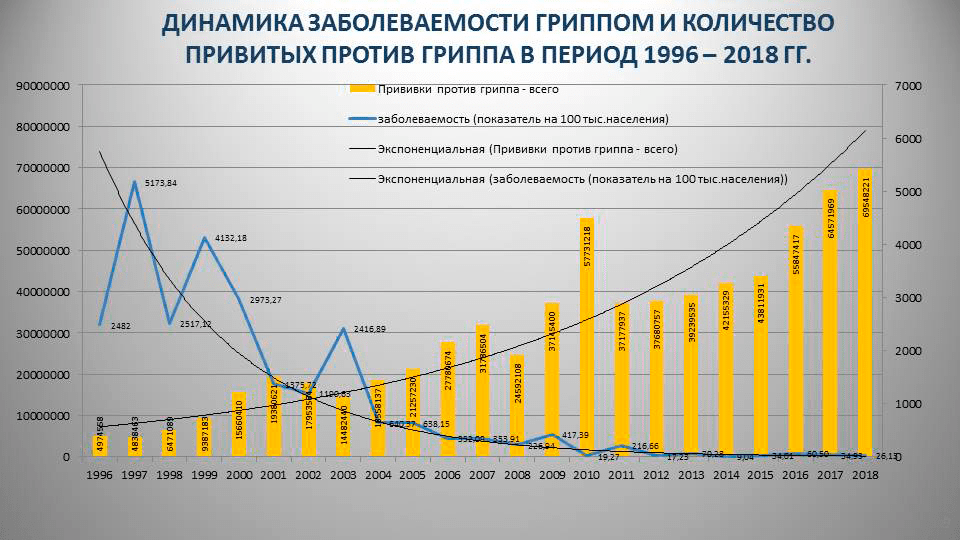
Рисунок 4. Заболеваемость гриппом и количество привитых против гриппа в России за 1996–2018 годы
За 20 лет заболеваемость гриппом в России сократилась почти в 10 раз, и на графике четко видно, что чем больше привитых, тем меньше случаев гриппа. Вопрос лишь в том, какими вакцинами прививается большинство россиян. Фактически, массовая вакцинация против гриппа в нашей стране осуществляется за счет госбюджета, поэтому львиная доля средств уходит на отечественные препараты: в 2018 году для вакцинации было закуплено 62,3 млн доз «Совигриппа» и «Ультрикса»; в 2017 – 58,4 млн доз. Естественно, большинство россиян прививается бесплатно. Например, в сезоне 2015–2016 из 39,4 млн привитых отечественными вакцинами 15,2 млн привились «Совигриппом»; 13,5 млн — «Грипполом Плюс»; 8,4 млн — «Грипполом»; 2,2 млн — «Ульриксом». Другие вакцины выбрали 5,5 млн человек [55]. При этом заболеваемость привитых гриппом распределилась так (учитываем, что ВОЗ ошиблась с вакцинным штаммом линии В в трехкомпонентных вакцинах):
- 7,6 на 100 000 населения — «Гриппол Плюс»;
- 7,2 — «Гриппол»;
- 3,1 — «Совигрипп»;
- 0,5 — «Ультрикс».
В то же время для бесплатной вакцинации импортные вакцины практически не закупают, и привиться ими можно в основном в коммерческих клиниках. Не удивительно, что они не выдерживают конкуренции, и их доля постоянно сокращается. Так что в большинстве случаев выбор, действительно, стоит между отечественными вакцинами. И лично мне сложно ответить на вопрос, какая из них «лучший выбор», потому что недостатки можно найти у любой. Мало того, я не уверена в том, что 15 мкг антигенов автоматически сделают вакцину эффективной: эффективность нужно доказать, а если доказательства слабые, антигенный состав не поможет! Поэтому на фоне неизвестной эффективности «Ультрикса» все претензии к «Грипполу Плюс» и «Совигриппу» кажутся больше похожими на маркетинговые войны, нежели на реальные аргументы. По крайней мере, у «Гриппола» есть ограниченная доказательная база (пусть и «отечественного производства», но у «Ультрикса» пока нет и ее). Кроме того, «Петровакс Фарм» настроен по-боевому и будет собирать доказательства в пользу эффективности своей адъювантной вакцины. Но если вы так и не решили, на чем остановить выбор, существует еще один способ: поехать в ближайшее зарубежье и привить импортную противогриппозную вакцину, у которой есть внятные клинические исследования, которая произведена в полном соответствии со всевозможными требованиями и не содержит сомнительных адъювантов.
Автор благодарит врача-биофизика Кирилла Скрипкина за помощь в подготовке материала.
Литература
- Селькова Е.П., Алешкин В.А, Полежаева Н.А. (2017). Итоги иммунопрофилактики гриппа в эпидемическом сезоне 2015/2016 гг. «Эпидемиология и инфекционные болезни. Актуальные вопросы». 1, 20–28;
- Гриппозные вакцины: документ по позиции ВОЗ. (2012). World Health Organization;
- Recommended composition of influenza virus vaccines for use in the 2019–2020 northern hemisphere influenza season. (2019). World Health Organization;
- Вопросы здравоохранения. Грипп. World Health Organization;
- Информационные бюллетени. Грипп. (2018). World Health Organization;
- Коншина О.С., Ерофеева М.К., Никифорова А.Н., Максакова В.Л. (2016). Вакцинопрофилактика гриппа в современных условиях. «Медицинский совет». 7, 86–89;
- Вакцинация беременных против гриппа. Федеральные клинические рекомендации. (2015). Роспотребнадзор;
- Elyse Olshen Kharbanda, Gabriela Vazquez-Benitez, Paul A. Romitti, Allison L. Naleway, T. Craig Cheetham, et. al.. (2017). First Trimester Influenza Vaccination and Risks for Major Structural Birth Defects in Offspring. The Journal of Pediatrics. 187, 234-239.e4;
- Guidelines for vaccinating pregnant women. (2016). CDC;
- Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям. (2014). Приказ Минздрава России №125н (ред. от 24.04.2019);
- Influenza. (2019). Immunization Action Coalition;
- Базыкин Г. (2016). Грипп: эволюция вируса и универсальная вакцина. «Постнаука»;
- Смирнова Т.Д., Даниленко Д.М., Слита А.В. (2013). Участие цитоскелета клетки в инфекционном цикле вирусов гриппа А. «Цитология». 2, 92–100;
- Magen Francis, Morgan King, Alyson Kelvin. (2019). Back to the Future for Influenza Preimmunity—Looking Back at Influenza Virus History to Infer the Outcome of Future Infections. Viruses. 11, 122;
- Солдатов А.А., Авдеева Ж.И., Бондарев В.П. (2017). Процедура обновления штамма вакцины против гриппа в странах ЕС. «Вопросы качества. БИОпрепараты. Профилактика, диагностика, лечение». 17, 3–12;
- Addendum to the recommended composition of influenza virus vaccines for use in the 2019–2020 northern hemisphere influenza season. (2019). World Health Organization;
- Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2017–18 Influenza Season. (2017). CDC;
- Vaccine Effectiveness: How Well Do the Flu Vaccines Work? (2018). CDC;
- A Description of the Process of Seasonal and H5N1 Influenza Vaccine Virus Selection and Development. (2007). World Health Organization;
- Seasonal influenza — Annual Epidemiological Report for 2017–2018. (2018). ECDC;
- Statement from FDA Commissioner Scott Gottlieb, M.D., on FDA’s ongoing efforts to help improve effectiveness of influenza vaccines. (2018). FDA;
- Малахов А.Б. и Дронов И.А. (2014). Иммунопрофилактика гриппа в свете нового российского национального календаря профилактических прививок. «Русский медицинский журнал». 31, 2207;
- Recommendations for the production and control of influenza vaccine (inactivated). (2005). World Health Organization;
- Leonoor Wijnans, Bettie Voordouw. (2016). A review of the changes to the licensing of influenza vaccines in Europe. Influenza Other Respi Viruses. 10, 2-8;
- Guideline on Influenza Vaccines. Guideline on Influenza Vaccines. (2016). European Medicines Agency (EMA);
- Information sheet observed rate of vaccine reactions influenza vaccine. (2012). World Health Organization;
- Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2018–19 Influenza Season. (2018). CDC;
- David A. Gruenberg, Marcus S. Shaker. (2011). An update on influenza vaccination in patients with egg allergy. Current Opinion in Pediatrics. 23, 566-572;
- John M. James, Robert S. Zeiger, Mitchell R. Lester, Mary Beth Fasano, James E. Gern, et. al.. (1998). Safe administration of influenza vaccine to patients with egg allergy. The Journal of Pediatrics. 133, 624-628;
- Irene Fung, Jonathan M. Spergel. (2012). Administration of influenza vaccine to pediatric patients with egg-induced anaphylaxis. Journal of Allergy and Clinical Immunology. 129, 1157-1159;
- Flu Vaccine and People with Egg Allergies. (2017). CDC;
- Мищенко Е. (2018). Чем нас лечат: Полиоксидоний. Полимер на страже иммунитета. Indicator;
- Ультрикс® Вакцина гриппозная инактивированная расщепленная. (2019). «Форт»;
- Vaxigrip®. (2006). World Association for Vaccine Education;
- Шамшева О.В. (2015). Отечественная вакцина нового поколения для профилактики гриппа. «Детские инфекции». 14, 13–16;
- Михайлова Е.В., Яшина А.Е., Романовская А.В., Хворостухина Н.Ф. (2016). Клиническая эффективность, безопасность, иммуногенность отечественной противогриппозной вакцины нового поколения. «Вестник Волгоградского государственного медицинского университета». 3, 100–103;
- Гренкова Т.А., Селькова Е.П., Гудова Н.В. (2015). Отечественная виросомальная вакцина оценка эффективности и безопасности. «Медицинский совет». 4, 96–101;
- Тюрина А.А., Василюк В.Б., Захаров К.А., Веселова Т.В., Жуков А.В. (2015). Фармакоэкономическое обоснование эффективности применения вакцины Ультрикс® для профилактики заболеваемости гриппом и острыми респираторными вирусными инфекциями. «Журнал инфектологии». 4, 37–42;
- Клинические исследования вакцины «Ультрикс». Национальная иммунобиологическая компания (Нацимбио);
- Новик Л.В., Челноков Б.Н., Яковлев Н.А. (2016). Результаты применения вакцины «Ультрикс» на предприятии газотранспортной системы ПАО «Газпром». TERRA MEDICA®;
- Некрасов А.В. и Пучкова Н.Г. (2008). Стратегия совершенствования и методы оценки гриппозных вакцин. Гриппол плюс — современная защита от гриппа. «Русский медицинский журнал». 23, 1–4;
- Широкова И. (2012). Вакцины — специфический сегмент фармрынка. «Ремедиум». 12, 22–29;
- Харит С.М., Лиознов Д.А., Рулева А.А., Фридман И.В., Чирун Н.В., Апрятина В.А. (2017). Сравнительная оценка реактогенности и иммуногенности коммерческих гриппозных инактивированных вакцин: полимер-субъединичной Гриппол плюс, субъединичной Инфлювак, сплит-акцины Ваксигрип. «Эпидемиология и вакцинопрофилактика». 16, 24–30;
- Войцеховская Е.М., Вакин В.С., Васильева А.А., Кузнецова Е.В., Лонская Н.И., Ельшина Г.А. и др. (2009). Результаты анализа иммуногенности новой гриппозной вакцины Гриппол плюс. «Эпидемиология и Вакцинопрофилактик». 1, 40–45;
- Бокучава Е.Г., Намазова-Баранова Л.С., Ткаченко Н.Е., Броева М.И., Новикова Д.А., Гайворонская А.Г. и др. (2016). Клинико-иммунологическая эффективность иммунопрофилактики гриппа у детей с аллергическими болезнями. «Медицинский совет». 1, 118–122;
- Вакцинация в контексте «нано»;
- Vera A. Dyakonova, Svetlana V. Dambaeva, Boris V. Pinegin, Rakhim M. Khaitov. (2004). Study of interaction between the polyoxidonium immunomodulator and the human immune system cells. International Immunopharmacology. 4, 1615-1623;
- Петров Р.В., Хаитов P.M., Некрасов А.В., Аттаулаханов Р.И., Пучкова Н.Г., Иванова А.С. и др. (2000). Полиоксидоний: механизм действия и клиническое применение. «Медицинская иммунология». 2, 271–278;
- John S. Tregoning, Ryan F. Russell, Ekaterina Kinnear. (2018). Adjuvanted influenza vaccines. Human Vaccines & Immunotherapeutics. 14, 550-564;
- Адъюванты на основе сквалена в вакцинах. (2006). World Health Organization;
- Peter Pružinec, Natalia Chirun, Audrius Sveikata. (2018). The safety profile of Polyoxidonium in daily practice: results from postauthorization safety study in Slovakia. Immunotherapy. 10, 131-137;
- Никифорова А.Н., Исакова-сивак И.Н., Ерофеева М.К., Фельдблюм И.В., Руденко Л.Г. (2014). Результаты изучения безопасности и иммуногенности отечественной субъединичной адъювантной вакцины Совигрипп у добровольцев 18–60 лет. «Эпидемиология и вакцинопрофилактика». 2, 72–78;
- Амиреев С. (2017). Результаты сравнительного ретроспективного эпидемиологического и клинического исследования реактогенности и заболеваемости у взрослых лиц после применения двух гриппозных вакцин — «Гриппол® плюс» и «Инфлювак» в Республике Казахстан. «Вестник Казахского Национального медицинского университета». 4, 222–228;
- Sokolova T.M., Shuvalov A.N., Poloskov V.V., Shapoval I.M., Kostinov M.P. (2014). Grippol, Vaxigrip and influvac vaccines--inductors of innate and adaptive immunity factor genes in human blood cells. Zh. Mikrobiol. Epidemiol. Immunobiol. 5, 37–43;
- Ломакин А.Г. (2017). Результаты оценки эффективности вакцин против гриппа. Ключевые аспекты обеспечения качества производства вакцин. «Форт»;
- Gary J. Nabel. (2013). Designing Tomorrow's Vaccines. N Engl J Med. 368, 551-560.