MOFs: наше будущее?
23 сентября 2019
MOFs: наше будущее?
- 3975
- 0
- 4
Структура ZIF-8
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Химия — одна из основных существующих наук. Достижения, которая привносит она, используются во многих других сферах деятельности. Из этой статьи вы узнаете о таких соединениях, как металлоорганические каркасы (metal-organic frameworks, MOFs), и о том, что интересного они могут дать человеку.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Органика или неорганика?
Современная химическая наука поражает количеством разнообразных разделов, которые входят в ее состав. Но одними из основных разделов по-прежнему остаются неорганическая и органическая химии. Органическая химия — это, как известно, химия соединений углерода. А неорганическая химия — ветвь химии, изучающая другие элементы, кроме углерода, и их соединения. И кажется, что неорганика и органика — абсолютно разные разделы одной дисциплины; разве могут быть они связаны? Оказывается, могут! Существуют так называемые металлоорганические соединения, в которых присутствует связь металл-углерод. Химия данных соединений, соответственно, называется металлоорганической. В область рассмотрения металлоорганики часто также входят вещества, где углерод связан с бором, кремнием, мышьяком и фосфором. В связи с этим используется и более широкий термин — «элементоорганическая химия».
Металлоорганические соединения известны людям вот уже несколько веков. 27 августа 1758 года француз Луи Клоде Каде де Гассикур, фармацевт по профессии, представил в Королевскую академию наук статью о веществе, которое назвал дымящей жидкостью Кадэ. Как установил многим позже (аж через 80 лет) химик Бунзен, в этом веществе присутствует связь As—C. Само вещество представляет собой в основном (CH3As)2O, причудливо именуемое окисью какодила. Несколько позже — в первой половине XX века — мышьякорганические вещества стали активно использовать в качестве различных лекарственных средств (в силу малой токсичности самих веществ для человека), как тонизирующие и общеукрепляющие средства при болезнях, связанных с понижением уровня гемоглобина (например, туберкулеза или малярии). Другие мышьяксодержащие лекарства — сальварсан, неосальварсан, мафарсен — применяли в XX веке для лечения сифилиса (рис. 1 и 2) [1].
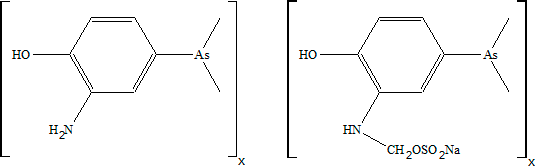
Рисунок 1. Структуры сальварсана (слева) и неосальварсана (справа)
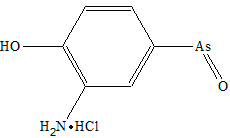
Рисунок 2. Структура мафарсена
Так начинался путь металлорганической химии. Но что же мы наблюдаем сегодня? Чего достигли ученые, работая в этой области знаний? Давайте посмотрим.
Что такое MOFs и каковы их свойства?
Металлоорганика развивалась очень бурно, даже взрывообразно, после разработки мышьякорганических лекарств. Было синтезировано огромное количество металлорганических соединений, нашедших свое применение во многих областях: катализе и синтезе, биоанализе (например, в магнитно-резонансной томографии и иммуноанализе), в качестве препаратов против самых разнообразных болезней, в качестве биосенсоров и т.д. [1]. Огромным достижением данной области стало получение металлоорганических каркасов, которые по-английски называются metal-organic frameworks, или кратко — MOFs. У этих соединений есть и другие названия, к примеру, «металлорганические координационные полимеры». Слово «координационные» здесь указывает на то, что MOFs имеют координационные связи. Под координационной понимают связь, которая образуется тогда, когда атом некоторого соединения (называемого лигандом, от латинского слова ligare — связывать [2]) выступает в качестве донора пары электронов для металла, который принимает эти электроны (акцептор электронов) [3], [4]. Таким образом, становится ясно, что MOFs состоят из металлов, а точнее, из их ионов (или даже кластеров ионов), для которых был предложен термин «коннекторы», а также лигандов органического происхождения, называемых в данном случае также линкерами. Последние связаны друг с другом как раз посредством коннекторов. В качестве линкеров часто выступают остатки карбоновых кислот (карбоксилаты) или азотсодержащие гетероциклические соединения, часто имидазолат-ионы [5]. Получают же каркасные структуры взаимодействием кислот (или гетероциклов) с так называемыми неорганическими вторичными структурными блоками (secondary building units, SBU; рис. 3). Разнообразные блоки и линкеры представлены на рисунке 4.
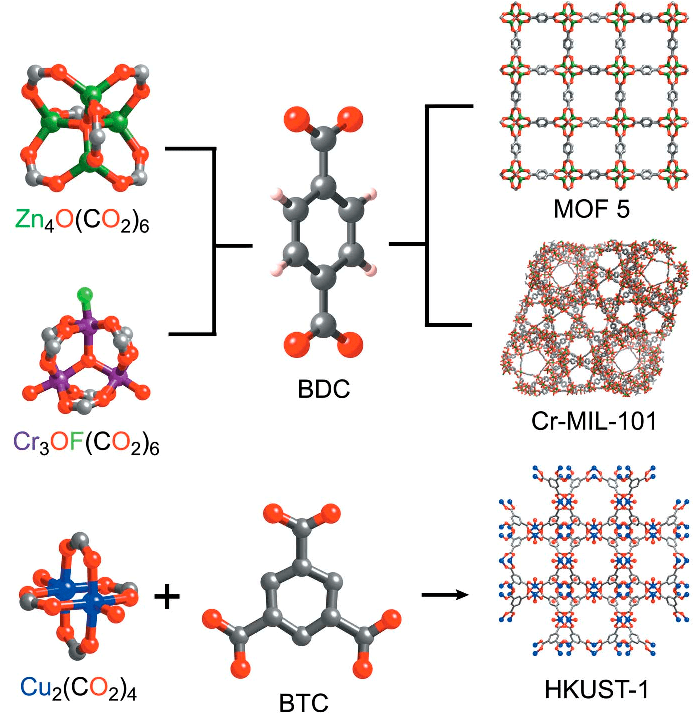
Рисунок 3. Получение различных металлорганических каркасов. Условные обозначения: BDC — 1,4-бензолдикарбоновая кислота; BTC — 1,3,5-бензолтрикарбоновая кислота. Черным цветом обозначен атом углерода С; красным — О; белым — Н; зеленым — Zn; салатовым — F; фиолетовым — Cr; синим — Cu.
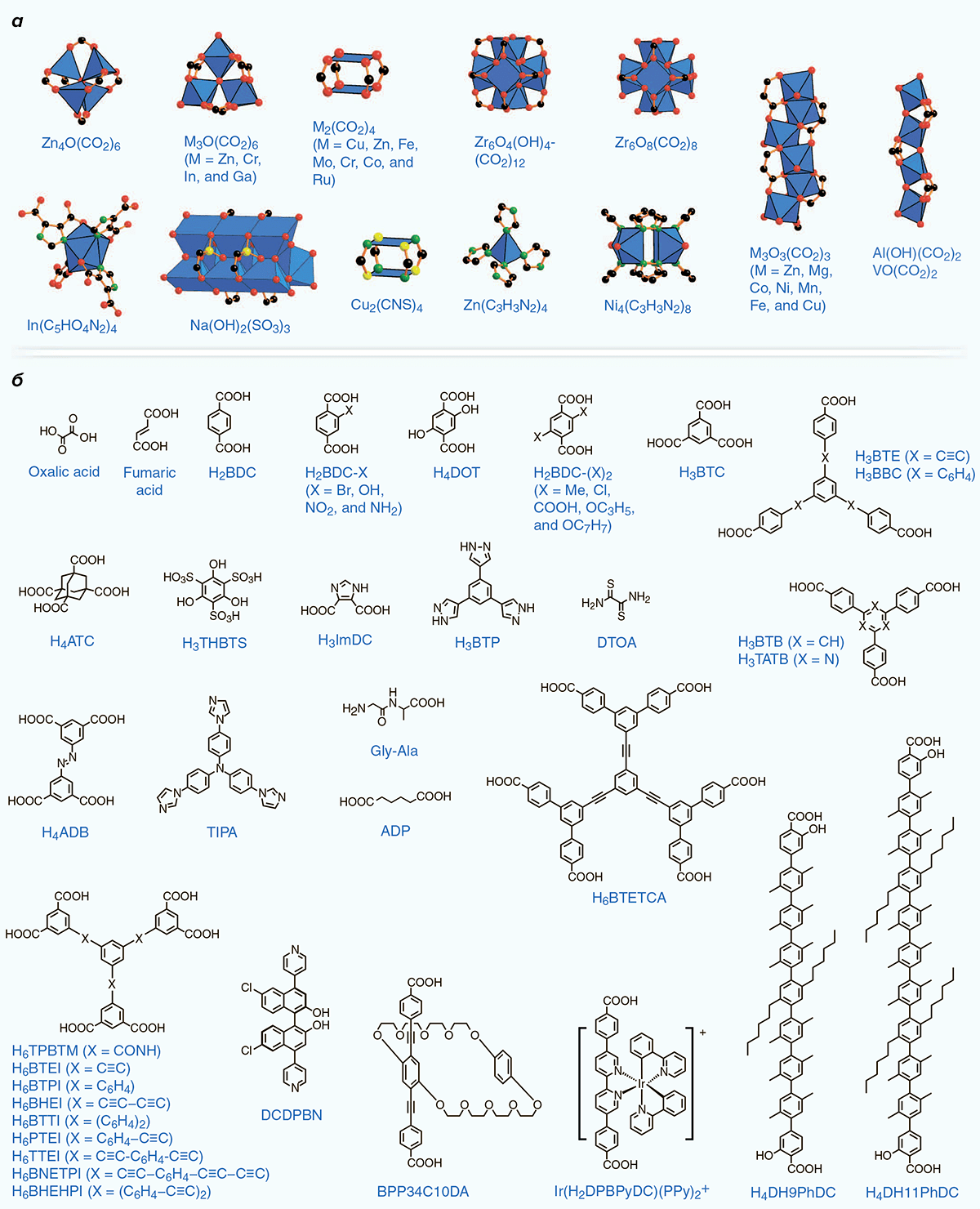
Рисунок 4. Неорганические вторичные структурные блоки (а) и органические линкеры (б). Черным окрашены атомы С; красным — О; зеленым — N; желтым — S; фиолетовым — P; светло-зеленым — Cl; голубые многогранники — ионы металлов.
Конечно, для синтеза MOFs, как, впрочем, и для синтеза многих других веществ, недостаточно просто смешать вещества. Требуются специальные условия. Методы синтеза изображены на рисунке 5. Как видим, здесь представлены такие методы получения металлорганических каркасов, как сольвотермальный (синтез под действием высокого давления, в кипящем растворителе), микроволновый (синтез по действием микроволнового излучения), сонохимический (синтез под действием ультразвука), механохимический, электрохимический и метод медленного выпаривания (не требует никаких излучений, электричества, механического воздействия). Для каждого способа на рисунке приведены время и температура [6].
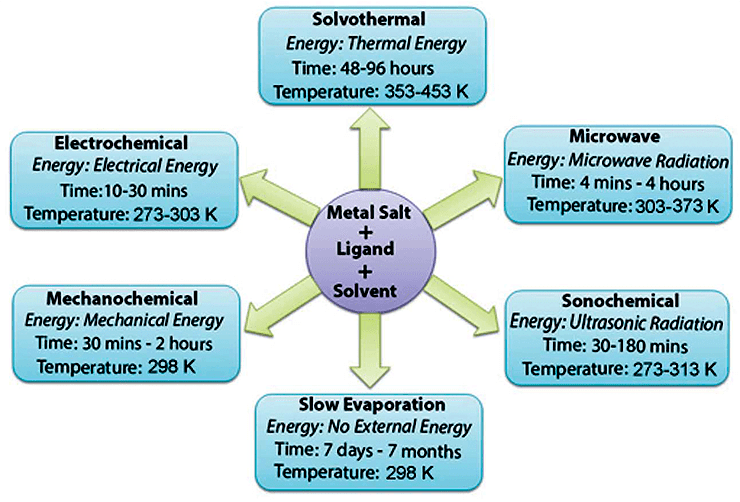
Рисунок 5. Методы получения металлоорганических каркасов
В ходе этого синтеза получаются пористые каркасные структуры, как это и изображено на рисунке 3. А пористость MOFs — это одно из главнейших их свойств, которое определяет в том числе биомедицинское значение рассматриваемых соединений. Пористость каркасов очень высокая и может достигать 90%. Размеры и форму пор можно контролировать, выбирая различные линкеры. Еще, выбирая способ приготовления MOFs, мы можем контролировать размер (от десятых долей миллиметра до нескольких нанометров) и форму самих кристаллов каркасов, что, безусловно, важно для различных областей применения [5]. Иными словами, получение MOFs — воистину творческий процесс!
MOFs: как применить?
Только представьте: к сегодняшнему дню синтезировано уже более чем 20 000 металлорганических каркасов [7]! Такое внимание ученых привлекают большие возможности этих соединений. Каркасы применимы и в энергетике, и в катализе, но мы рассмотрим именно их биомедицинское значение.
Основные направления использования MOFs разнообразны: адресная доставка лекарств, диагностика, биосенсоры. Пока что по всем этим направлениям идут интенсивные исследования, но уже достигнуты значительные результаты [8]. Обратимся к адресной доставке лекарственных средств.
Как было замечено ранее, металлорганические каркасы — это высокопористые соединения. Но раз в MOF есть поры, то мы можем туда что-то поместить [9]: на первых порах предложили использовать металлоорганические каркасы как контейнеры для хранения водорода. Хотя MOFs могут хранить не только водород, но и другие молекулы, к примеру, метан СН4, углекислый газ СО2 и оксид азота (II) NO. Однако для биомедицинского применения особенно важен тот факт, что металлорганические каркасы могут вмещать в себя лекарства.
Существует достаточное количество различных наноразмерных носителей для лекарств: это и полимерные носители, и липосомы (они представляют собой микроскопические сферические частицы, состоящие из фосфолипидов, похожих на фосфолипиды клеточных мембран), и углеродные материалы, различные неорганические наночастицы (золото, серебро, платина, оксиды металлов, оксид кремния) [10]. Так зачем нам еще и MOF?
Если использовать полимерные частицы или липосомы, то они часто бывают биосовместимыми, однако для них не всегда характерно контролируемое высвобождение лекарства, при котором достигается наибольший терапевтический эффект. Проблема при использовании наночастиц в качестве носителей лекарств в том, что эти наночастицы могут слипаться — собираться в агрегаты, — а также накапливаться в органах, например, печени или легких, что приводит к токсическим эффектам. Можно использовать и цеолиты — неорганические пористые вещества. Но они не вмещают в себя достаточное количество препарата и высвобождают его очень медленно. Недостаток цеолитов и в том, что они токсичны по отношению к клеткам человеческого организма [5], [11].
Металлорганические каркасы, чтобы вступить в ряды наноразмерных носителей лекарственных препаратов, конечно, должны обладать рядом свойств: низкой токсичностью, биоразлагаемостью, биосовместимостью и устойчивостью по отношению к воде. И MOFs c необходимыми характеристиками уже получены! К примеру, MIL-100 и MIL-101 (рис. 6) — одни из перспективных MOFs благодаря устойчивости к водной среде и очень низкой токсичности. В 2006 году MIL-101, состоящий из ионов хрома (III) и терефталат-ионов, был использован для доставки противовоспалительного лекарственного средства ибупрофена. В этот MOF удалось поместить целых 1,4 г препарата на 1 г каркаса. Ибупрофен высвобождается из пор MIL-101 в течение шести дней, а значит, можно использовать эту комбинацию соединений в качестве препарата пролонгированного (то есть длительного) действия, что позволило бы поддерживать необходимую дозу ибупрофена в организме [5], [8].
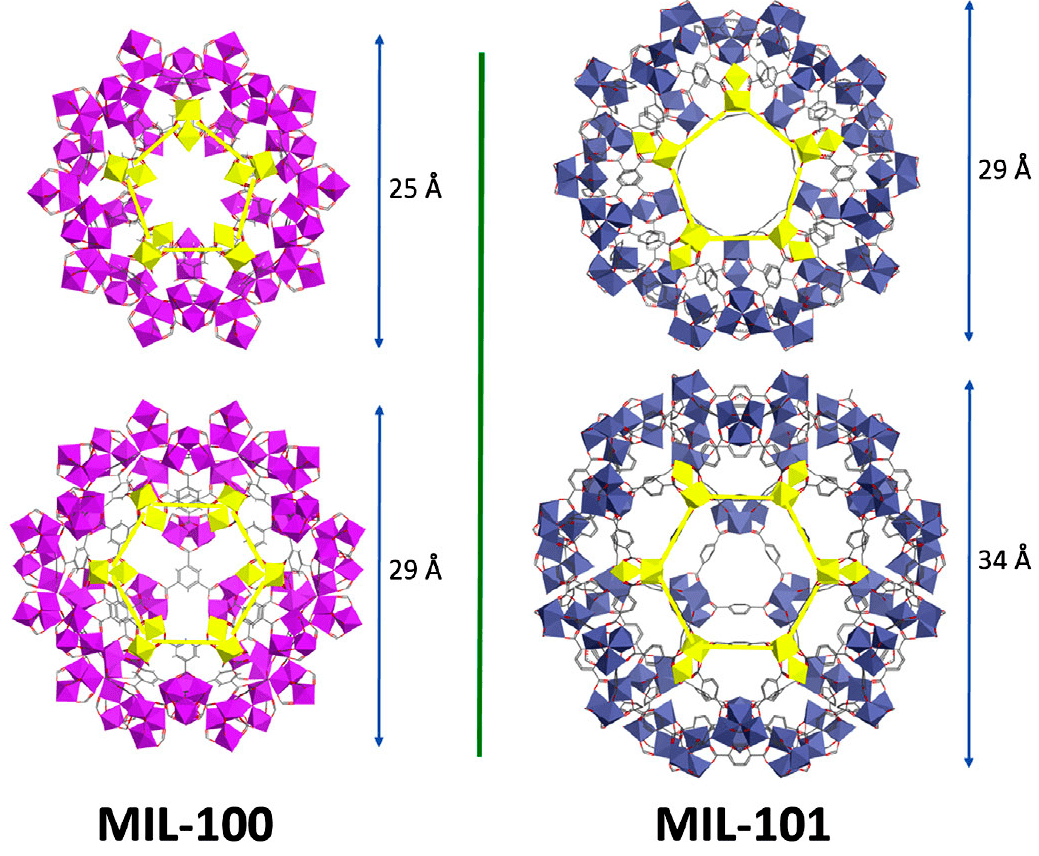
Рисунок 6. Структуры MIL-100 и MIL-101
Впрочем, контролируемая доставка лекарства — непростая задача. Одно дело — поместить внутрь организма наноноситель с внедренным в него лекарством. Совсем другое — высвободить препарат в нужном месте. Но нет нерешаемых задач: ученые научились заставлять лекарства высвобождаться под действием какого-либо фактора. Общая схема подобной системы на основе MOF представлена на рис. 7. Видно, что MOF, нагруженный лекарством, проходит внутрь клетки. Затем на MOF действует какой-то фактор — внешний или внутренний. К внешним факторам относятся магнитное поле, температура, давление, свет, ионы. К внутренним — pH, концентрация АТФ, окислительно-восстановительный потенциал. После воздействия структура MOF меняется, и лекарство выходит из пор наружу.
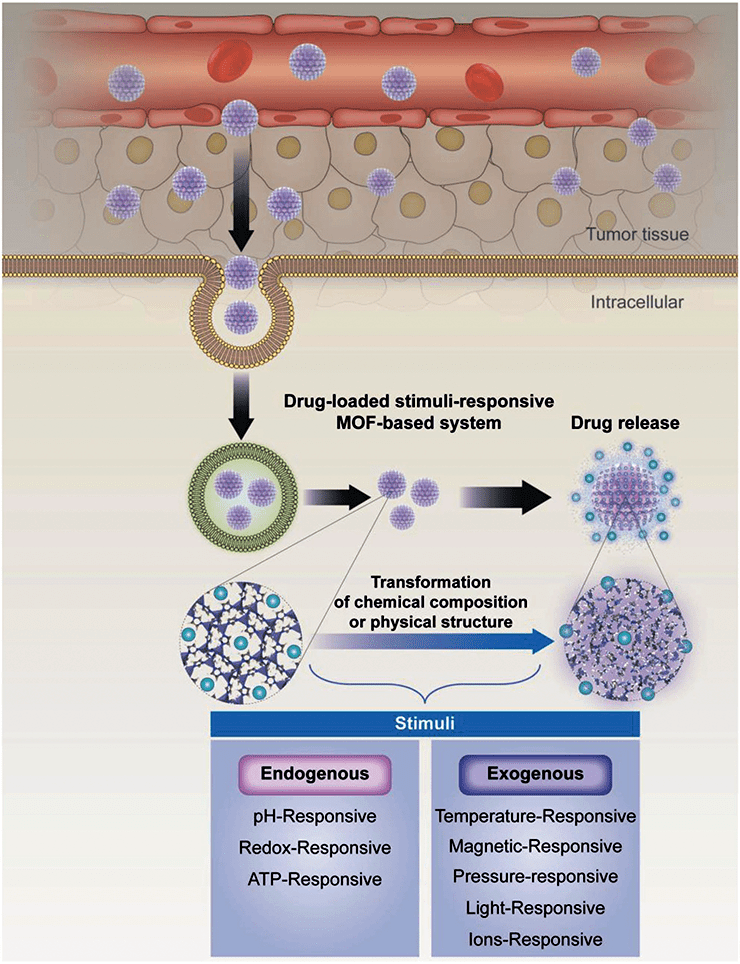
Рисунок 7. Схематичное изображение факторзависимой системы для высвобождения лекарств на основе MOF
Известнейшим примером является система прокаинамид/bioMOF-1. Антиаритмический препарат прокаинамид обычно существует в виде гидрохлорида, то есть в подкисленной форме. В этой форме благодаря наличию аминогруппы, способной присоединять протон от кислоты, вещество находится в виде положительно заряженной частицы, которая может связываться внутри пор с отрицательно заряженным bioMOF-1. Высвобождение прокаинамида из пор каркаса было протестировано в часто используемом в биологических исследованиях натрий-фосфатном буферном растворе, содержащем хлориды натрия и калия, а также гидрофосфат натрия Na2HPO4 и дигидрофосфат калия KH2PO4. В этом растворе имеются положительные заряженные ионы натрия. Эти ионы проникают в поры каркаса и взаимодействуют с ним, при этом вытесняя катионы прокаинамида. Таким образом, система прокаинамид/bioMOF-1 является ион-чувствительной. Уже протестированы и другие ион-чувствительные системы на основе MOFs, включающих в свой состав ионы железа, циркония, индия и др. [11], [12].
Удивительно, но в поры металлоорганических каркасов можно загружать не только низкомолекулярные лекарственные средства, но и более крупные молекулы, такие как витамины вроде B12 [5] и даже белки. При этом в некоторых случаях можно поместить не одну большую молекулу. Вот один из примеров подобного рода: в каркас с названием ZIF-8 поместили две молекулы — молекулу инсулина и молекулу фермента глюкозооксидазы. Инсулин применяется для лечения диабета I типа. Когда ZIF-8 попадает в организм, глюкозооксидаза превращает глюкозу в глюконовую кислоту, тем самым понижая pH. При этом ZIF-8, будучи pH-чувствительным, разлагается, высвобождая инсулин, регулирующий уровень глюкозы в крови [11].
В общем, как мы видим, адресная доставка лекарств с помощью MOF — это широчайшая область, предоставляющая самые разнообразные возможности. Но могут ли сами MOF быть лекарствами? Оказывается, могут. Ранее в этой статье был упомянут bioMOF-1. Почему же он bio? А потому, что в его основе находится биосовместимый ион цинка. Многие металлорганические каркасы конструируют из биологически активных линкеров (таких как аминокислоты, белки и пептиды, азотистые основания, углеводы) и коннекторов (ионов металлов: кальция, магния, железа, натрия и др.), дабы добиться биосовместимости. Подобные MOFs часто называют bioMOFs. Пример такого bioMOF — это MOF-705, который может выступать в качестве лекарственного препарата. Этот металлорганический каркас состоит из ионов натрия и органического линкера на основе L-аспарагиновой кислоты, которая является одной из незаменимых аминокислот. Последний компонент очень важен, ведь он стимулирует фермент глутаматсинтетазу, обезвреживающий токсичный для нас свободный аммиак, превращая его в нетоксичную форму — глутамин. Также L-аспарагиновая кислота выполняет и некоторые другие полезные функции в нашем организме, например, участвует в переносе ионов магния и кальция. Поэтому действие MOF-705 основано на том, что, попадая в кислую среду желудка, он разлагается на лекарственные компоненты [5].
Но довольно о доставке лекарственных средств. Давайте посмотрим, каким еще образом можно использовать металлорганические каркасы.
Иные стороны MOFs
MOFs могут найти применение и в такой области, как биосенсорика: они могут быть биочипами [13]. То есть MOF в данном случае — это некий носитель, платформа, к которой «прицепляют» нуклеиновую кислоту. Далее эта нуклеиновая кислота связывается с другой нуклеиновой кислотой.
Вот конкретный пример: для выявления вируса Судана (вид вируса Эбола) в 2015 был предложен биочип на основе каркаса Сu-MOF, включающего в свой состав ионы меди. К каркасу за счет различных взаимодействий (электростатического взаимодействия и водородных связей) была прикреплена молекула однонитевой ДНК, комплементарная РНК вируса и меченая флуоресцентным красителем. После соединения ДНК с MOF флуоресценция, исходящая от метки, исчезала. Затем к полученному комплексу добавляли РНК вируса Судана, что приводило к высвобождению комплекса меченой ДНК и РНК, причем флуоресценция красителя возобновлялась. Схема, иллюстрирующая данный пример, приведена на рисунке 8.
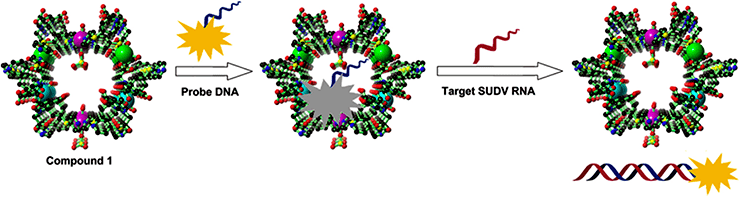
Рисунок 8. Схема обнаружения РНК вируса Судана. Желтым обозначена флуоресцентная метка.
Подобным образом действуют и биочипы на основе других MOF для определения таких вирусов, как вирус иммунодефицита человека.
Кроме того, разработано уже и множество электрохимических биосенсоров. Основа такого сенсора — электрод. Поверхность электрода модифицируют, чтобы далее появилась возможность провести электрохимическую реакцию и поймать электрический сигнал, по которому можно судить о наличии анализируемого объекта в пробе. Электрический сигнал возникает вследствие окислительно-восстановительной реакции, а MOF может служить катализатором такой реакции. На рис. 9 как раз изображена схема одного из перспективных биосенсоров с MOF.
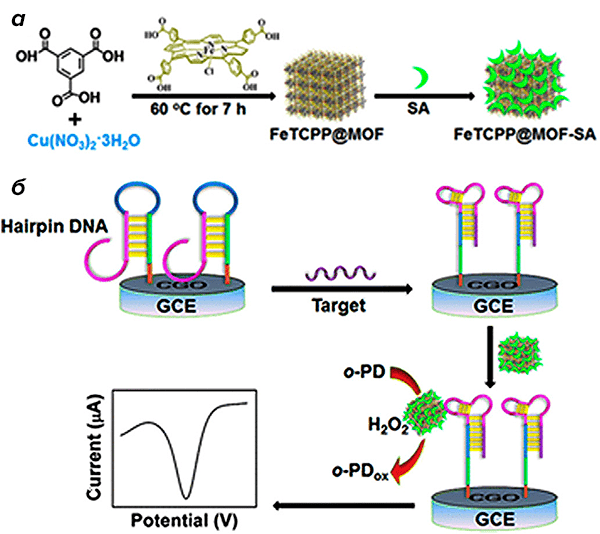
Рисунок 9. Применение MOF для создания электрохимического биосенсора. а — Синтез FeTCPP@MOF-SA. б — Схема действия электрохимического биосенсора на основе FeTCPP@MOF (CGO — твердый электролит с формулой Ce0,9Gd0,1O2–δ).
Поверхность стеклянного углеродного электрода (glassy carbon electrode, GCE) модифицируют, прикрепляя к ней ДНК-шпильку (hairpin DNA). Далее берут пробу, содержащую объект анализа — однонитевую ДНК (single-stranded DNA, ssDNA), комплементарную ДНК-шпильке. ДНК-шпилька изначально представляет собой «петлю». Но, комплементарно взаимодействуя с ssDNA, шпилька раскрывается. Таким образом, мы получаем так называемый SA-аптамер. Аптамер — это нуклеотидная последовательность, которая может взаимодействовать с определенной биомолекулой. В нашем случае — с белком стрептавидином (SA). Стрептавидин подводится к аптамеру особым образом: с помощью нужного MOF. Из рисунка 9 можно видеть, что данный MOF получают взаимодействием соли меди, ионы которой выступают в качестве коннекторов, и 1,3,5-бензолтрикарбоновой кислоты, являющейся линкером. При этом в каркас инкапсулируют вещество, содержащее порфириновую структуру (как в гемоглобине). Заключительный этап синтеза — закрепление молекул стрептавидина на поверхности MOF. Образуется сложное соединение FeTCPP@MOF-SA. Оно крепится на аптамере за счет нековалентного связывания со стрептавидином. Прикрепленный таким образом MOF имеет подход к поверхности электрода, где проходит электрохимическая реакция окисления о-фенилендиамина пероксидом водорода. MOF, как и указывалось ранее, является катализатором данной реакции. За счет этого окислительно-восстановительного процесса возникает измеряемый электрический сигнал [14].
Разнообразные сенсоры на основе MOF были предложены для обнаружения не только нуклеиновых кислот, но и других молекул: белков, антигенов, антител, ферментов, глюкозы, ионов металлов (Fe2+, Cu2+), анионов вроде фторид-иона [8].
Еще одна сфера применения MOFs — это методы диагностики: оптическая визуализация и разнообразные виды томографии, такие, как фотоакустическая, магнитно-резонансная, позитронно-эмиссионная. Все эти методы диагностики порой объединяют под термином «молекулярная визуализация».
Возьмем, например, МРТ. Магнитно-резонансная томография — это метод получения медицинского изображения для исследования органов и тканей с использованием такого явления, как ядерный магнитный резонанс. Такое изображение во многих случаях позволяет отличить больные ткани от здоровых. Изображение, получаемое методом ЯМР, порой нужно улучшить. И делают это с помощью определенных веществ — контрастных агентов. Эффективность контрастных агентов оценивается по параметру, который называется релаксивностью. Причем параметров релаксивности два: r1 и r2. Они показывают, как скорости релаксации меняются с изменением концентрации контрастного агента. Чем выше эти параметры по значению, тем лучше.
Релаксация — упрощенно говоря, возврат ядра из возбужденного состояния с высокой энергией в обычное, с низкой.
Часто в качестве контрастных агентов используют соединения гадолиния. Существует множество коммерчески доступных агентов, часть из них представлена на рисунке 10.
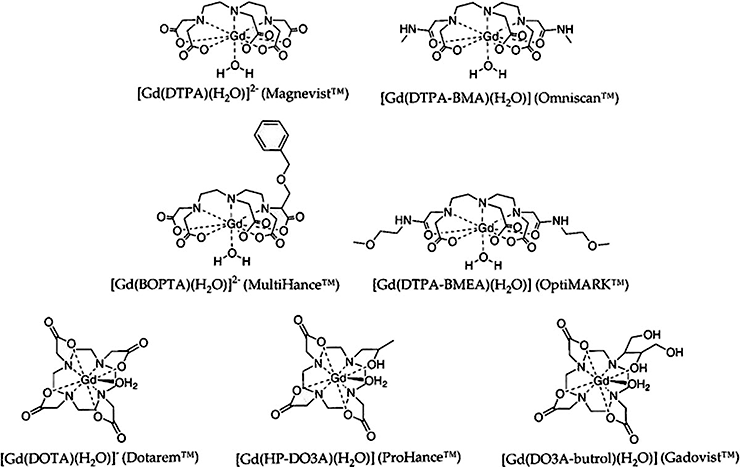
Рисунок 10. Контрастные агенты на основе соединений гадолиния
Поэтому предложенные для этой цели MOF также были созданы именно на основе гадолиния. Одним из них стал металлорганический каркас на основе Gd3+ и [Fe(CN)6]2–, поверхность которого была покрыта полисахаридом хитозаном. Частицы такого каркаса были устойчивы в воде и показывали более высокие значения релаксивностей, нежели коммерчески доступные соединения гадолиния. Этот MOF — определенно, перспективный контрастный агент в магнитно-резонансной томографии [8], [15].
Заключение
Исходя из всего вышесказанного, становится очевидным, что металлорганические каркасы — это весьма перспективные соединения. Увы, в рамках одной статьи вряд ли удастся рассказать о многочисленных возможностях, которые дают MOFs, и вряд ли можно представить невообразимое количество представленных в литературе примеров металлорганических каркасов. Как сложится их судьба? Какое еще применение найдут для них ученые? Окажется ли, что MOF — это наше будущее?
Литература
- Жауэн Ж. Биометаллорганическая химия. М.: «Бином. Лаборатория знаний», 2014. — 494 с.;
- Sharpe A.G. and Housecroft C.E. (2005). Inorganic chemistry. Edinburgh: Pearson Education Limited, 2005. — 949 p.;
- Короновавший ионы;
- Раздвинувший границы химии;
- Исаева В.И. и Кустов Л.М. (2018). Металлоорганические каркасы — новая вселенная в химии. «Химия и жизнь». 2, 2–8;
- Chandan Dey, Tanay Kundu, Bishnu P. Biswal, Arijit Mallick, Rahul Banerjee. (2014). Crystalline metal-organic frameworks (MOFs): synthesis, structure and function. Acta Crystallogr Sect B. 70, 3-10;
- Hong Cai, Yong-Liang Huang, Dan Li. (2019). Biological metal–organic frameworks: Structures, host–guest chemistry and bio-applications. Coordination Chemistry Reviews. 378, 207-221;
- Jingrong Zhou, Gan Tian, Lijuan Zeng, Xueer Song, Xiu-wu Bian. (2018). Nanoscaled Metal-Organic Frameworks for Biosensing, Imaging, and Cancer Therapy. Adv. Healthcare Mater.. 7, 1800022;
- Биология и химия: перспектива научного поиска, или Супрамолекулярная химия изучает кукурбитурил;
- Постнов В.Н., Наумышева Е.Б., Королев Д.В., Галагудза М.М. (2013). Наноразмерные носители для доставки лекарств. «Биотехносфера». 6, 16–27;
- Yuan Liu, Yanli Zhao, Xiaoyuan Chen. (2019). Bioengineering of Metal-organic Frameworks for Nanomedicine. Theranostics. 9, 3122-3133;
- Wen Cai, Junqing Wang, Chengchao Chu, Wei Chen, Chunsheng Wu, Gang Liu. (2019). Metal-Organic Framework-Based Stimuli-Responsive Systems for Drug Delivery. Adv. Sci.. 6, 1801526;
- Молекулярные биосенсоры на базе полимеров с начинкой из квантовых точек;
- Diaa I. Osman, Said M. El-Sheikh, Sheta M. Sheta, Omnia I. Ali, Aliaa M. Salem, et. al.. (2019). Nucleic acids biosensors based on metal-organic framework (MOF): Paving the way to clinical laboratory diagnosis. Biosensors and Bioelectronics. 141, 111451;
- Mohammad A. Chowdhury. (2017). Metal-Organic-Frameworks as Contrast Agents in Magnetic Resonance Imaging. ChemBioEng Reviews. 4, 225-239;
- H. Furukawa, K. E. Cordova, M. O'Keeffe, O. M. Yaghi. (2013). The Chemistry and Applications of Metal-Organic Frameworks. Science. 341, 1230444-1230444;
- Yang Chen, Feifei Zhang, Yong Wang, Chengyin Yang, Jiangfeng Yang, Jinping Li. (2018). Recyclable ammonia uptake of a MIL series of metal-organic frameworks with high structural stability. Microporous and Mesoporous Materials. 258, 170-177.