
Молодой в старческом обличии
25 декабря 2024
Молодой в старческом обличии
- 1075
- 0
- 1
Рекорд долгожительства поставила больная прогерией Тиффани Ведекинд (род. 1978) из города Колумбус, штат Огайо, которая дожила до настоящего времени.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В бесконечном потоке молодых и красивых лиц, смотрящих на нас с экранов смартфонов, все мы стремимся как можно дальше оттянуть процесс старения. И дело не только в эстетической составляющей, но и в здоровом и сильном организме, являющимся, как нам кажется, неотъемлемой частью молодости. Но возможно ли, будучи еще ребенком, оказаться в теле старика? К сожалению, да. Причиной тому может стать болезнь, именуемая прогерией, и в этой статье вы сможете узнать не только причины, механизмы и способы лечения этого заболевания, но и понять, какую роль играет понимание патогенеза и потенциальных способов терапии в поиске лекарства против старения.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Все мы в детстве мечтали побыстрее повзрослеть. Но что, если бы это желание исполнилось? И, как вы уже догадались, совсем не так, как мы об этом думали. Прогерия — это редкое генетическое заболевание, при котором происходит ускоренное старение организма. Различают детскую форму прогерии — синдром Хатчинсона-Гилфорда — и взрослую — синдром Вернера. Связаны они с мутациями в разных генах, но имеют схожую клиническую картину.
Синдром Вернера — это аутосомно-рецессивное заболевание, передающееся от родителей к ребенку, которое развивается вследствие мутаций в гене WRN. Это значит, что даже у фенотипически здоровых родителей, являющихся носителями патогенных вариантов гена WRN, ответственного за данное заболевание, может родиться больной ребенок. В норме белок WRN поддерживает структурную активность и функциональную целостность ДНК. Однако аномальный белок, продуцируемый в результате мутации, не выполняет эти функции. Это способствует укорочению теломер и преждевременному старению.
В свою очередь, синдром Хатчинсона-Гилфорда, или детская прогерия, вызывается случайными мутациями в генах и не является наследственной. Изменения происходят в гене LMNA, и белок преламин, который кодируется этим геном, превращается не в ламин A, а в прогерин, который в норме отсутствует в здоровых клетках. Прогерин нарушает нуклеоцитоплазматический транспорт, вызывает увеличение ядрышек, укорочение теломер и нарушение функций митохондрий [1].
Старость не в радость, или почему мы стареем
Теории старения
В попытках ответить на вопрос о биологическом смысле старения ученые выдвинули две теории: запрограммированного (или нестохастического) и незапрограммированного (стохастического) старения.
Как видно из названия, разница между ними в наличии или отсутствии некой генетической программы старения. Приверженцы первой теории заявляют, что старение — важный инструмент эволюции, необходимый для контроля над размером популяции. Незапрограмированное старение, по версии исследователей, напрямую зависит от накопленных в течение жизни повреждений. Действительно, старый — значит опытный [2].
Недавно была предложена теория, которая лежит посередине между двумя предыдущими. В ней старение рассматривается как результат «недостатков» генетической программы развития [3].
Не менее интересна данаидская теория, которая пришла к нам из Древней Греции. Данаиды были женщинами, осужденными вечно носить воду в дырявых сосудах за убийство своих мужей. Организмы подобны этим сосудам, то есть анатомически они несовершенны, поэтому не могут вечно удерживать жизнь (воду) [4]. Теории старения представлены на рисунке 1.
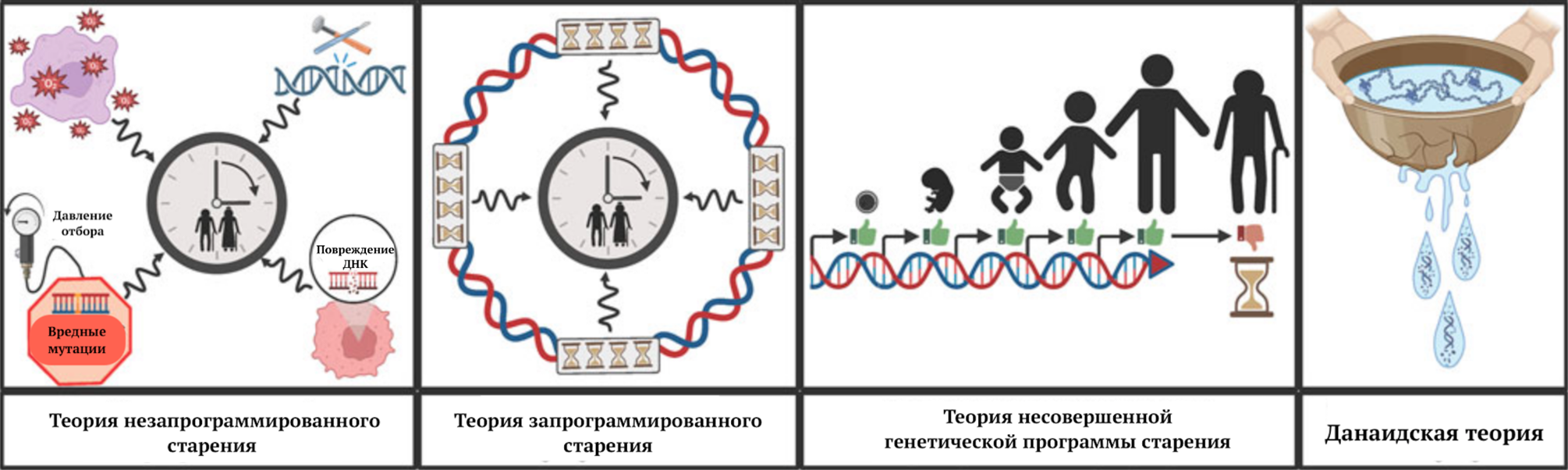
Рисунок 1. Теории старения.
[4], с изменениями
Дойдем до сути: в чем механизм старения
Прогерин, важнейший белок, задействованный в процессе старения, обнаруживается в клетках здоровых людей, но с возрастом его количество увеличивается. При естественном процессе старения морфология клеточных ядер сходна с таковой у детей, больных прогерией [5]. Обусловлено это активным синтезом прогерина.
Накопившийся прогерин нарушает нормальное строение ядерной оболочки, оттесняя хроматин к периферии (рис. 2). Такие изменения приводят к нарушению проходимости ядерных пор, поэтому затрудняется транспорт крупных частиц (например, субъединиц рибосом и мРНК). Таким образом, снижается синтез белка, в том числе и молекул, участвующих в цитоплазматическом транспорте. Это приводит к нарушению метаболизма клетки [6].
Клетка становится подвержена атаке АФК (активных форм кислорода), так как в митохондрии перестает поступать достаточно антиоксидантов из-за нарушения ядерного транспорта. Под действием АФК и нуклеаз сокращается длина теломерной ДНК. Из-за этого происходит остановка клеточного цикла, и организм стареет [6].
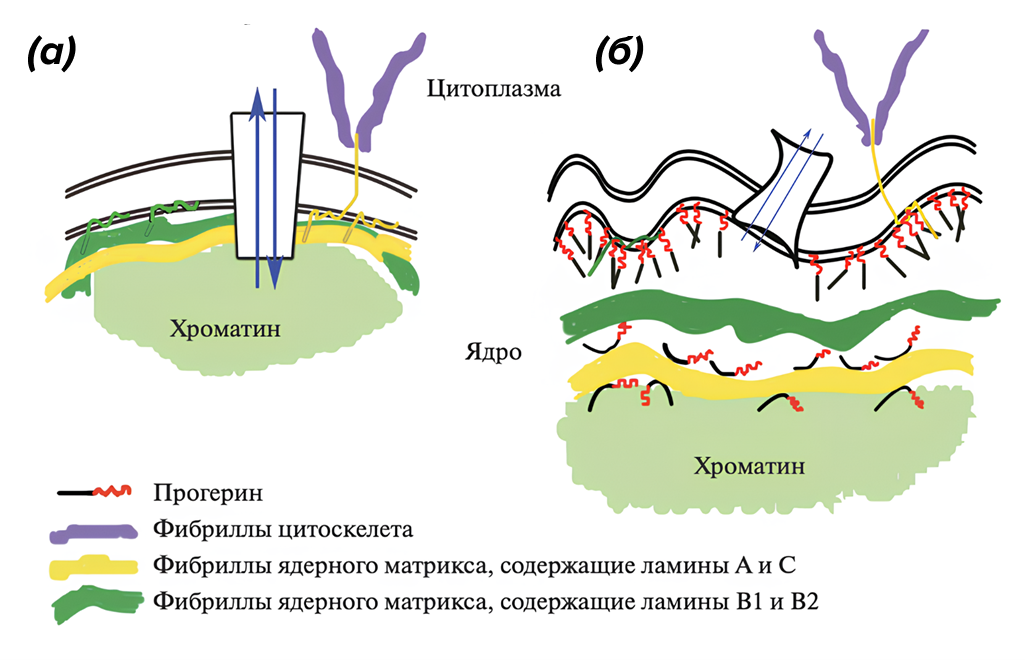
Рисунок 2. (а) — неповрежденная ядерная оболочка; (б) — ядерная с встроенным прогерином.
[6], с изменениями
Диагностика
Подсветим белок?
Детская прогерия вызвана накоплением белка прогерина в клетках. Он образуется в результате мутации в гене LMNA, что приводит к синтезу аномального белка. Тяжесть заболевания зависит от уровня прогерина [7].
Метод флуоресцентной микроскопии стал перспективным методом визуализации данного белка. Это необходимо как для диагностики заболевания, так и для разработки лекарств от прогерии. На основе декурсинола (вещество с высоким сродством к прогерину) ученые смогли создать флуоресцентный зонд, который способен выявлять прогероидные клетки у мышей (рис. 3). Эксперименты проводили на мышах, имеющих сходную с человеком картину заболевания: укороченную продолжительность жизни, костные и сердечно-сосудистые отклонения [7].
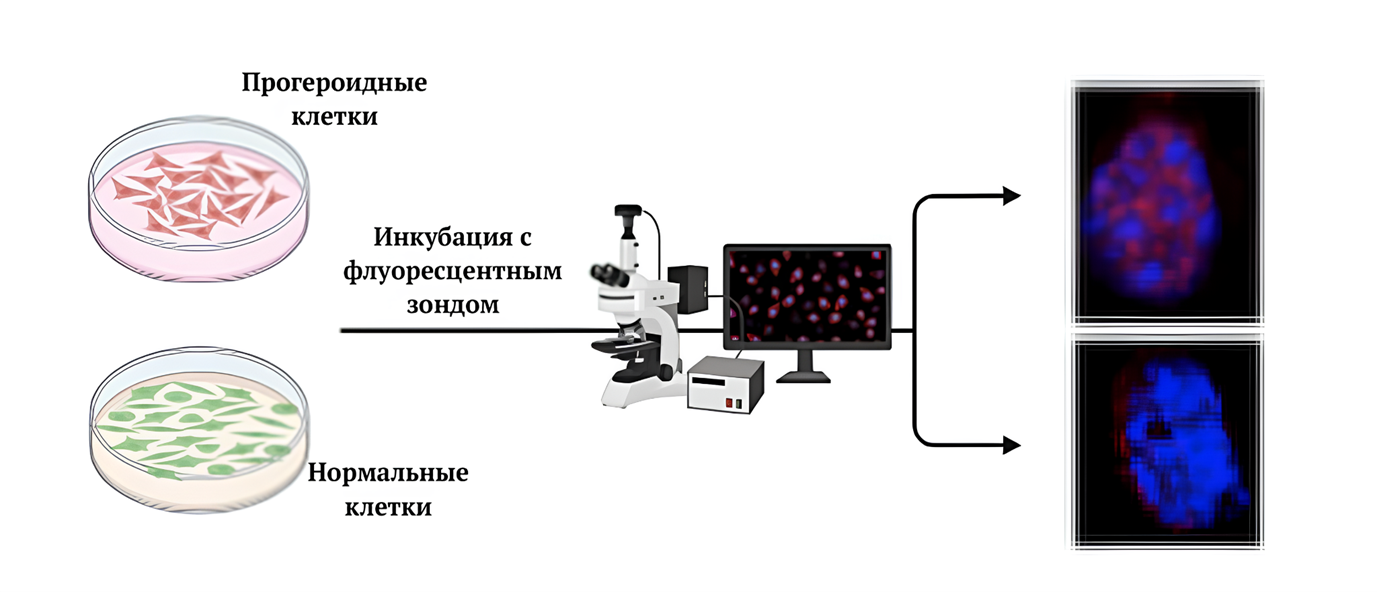
Рисунок 3. Выявление прогероидных и нормальных клеток при помощи флуоресцентного зонда.
[7], с изменениями
Хрома, выходи из дома!
Синдром прогерии Хатчинсона-Гилфорда связан с изменением структуры хроматина. Оно провоцирует ядерное ремоделирование и нарушает работу белков-регуляторов группы polycomb (англ. Polycomb-group proteins, PcG). Поэтому большой интерес для врачей и ученых представляет метод секвенирования хроматина под названием SAMMY-seq. Данный метод позволяет обнаружить изменения структуры гетерохроматина на ранней стадии в первичных фибробластах у больных прогерией. SAMMY-seq основан на последовательном извлечении нескольких порций хроматина, соответствующих все более уплотненным и менее доступным хроматиновым участкам, которые затем изучаются. На рисунке 4 показано, как фракции хроматина последовательно выделяются после обработки детергентом Triton X-100, ДНКазой и буферами с высоким содержанием соли и мочевины. Затем ДНК извлекается, обрабатывается ультразвуком и секвенируется [8]. Впоследствии увидев мутации в определенных генах и их участках, врачи могут поставить диагноз и назначить терапию.
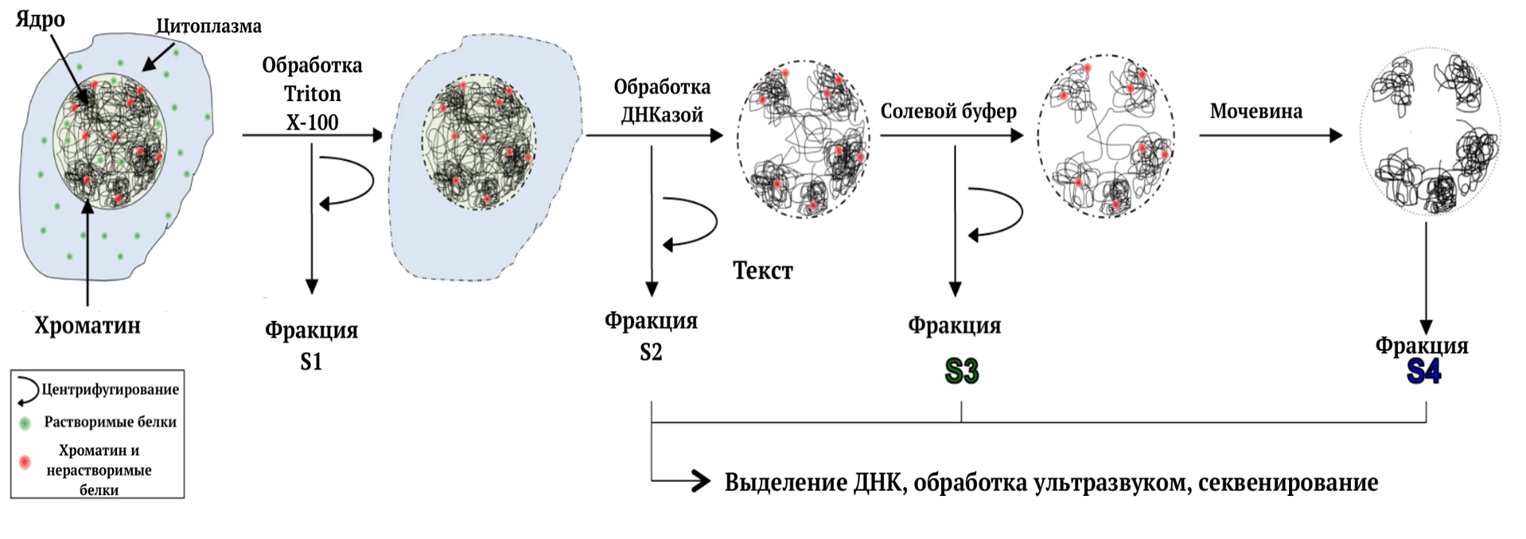
Рисунок 4. Схематическое изображение метода SAMMY-seq.
[8], с изменениями
Лечение
Молодость, не убегай!
У людей с синдромом Вернера наблюдается ускоренное старение, низкий рост, двусторонняя катаракта, атрофия кожи, охриплость голоса, выпадение волос. Зачастую уже в 30 лет у больных развивается сахарный диабет 2 типа, гипогонадизм, остеопороз, атеросклероз. Наиболее частыми причинами смерти у людей с таким диагнозом являются инфаркт миокарда, различные инфекции и рак.
Для лечения людей с синдромом Вернера врачи используют стандартные рекомендации: вести здоровый образ жизни, отказаться от курения, регулярно выполнять физические упражнения, следить за весом. Таким пациентам также необходим контроль уровня глюкозы в крови, уход за кожей. К серьезным медицинским вмешательствам относятся противоопухолевая терапия и хирургическое лечение катаракты. Средняя продолжительность жизни при синдроме Вернера составляет 54 года.
Давай, давай лечиться!
Потенциально возможным и эффективным лечением детской прогерии можно назвать окислительную терапию, в основе которой лежит свободно-радикальная теория старения. Окислительный стресс, наблюдаемый даже в отсутствии свободных радикалов, лег в основу расширения свободно-радикальной теории и привел к формулировке окислительно-восстановительной гипотезы окислительного стресса. Дисбаланс между окисленными и восстановленными формами соединений, таких как глутатион/глутатиондисульфид и НАД/НАДФ, с преобладанием окисленных играет критическую роль в старении [9].
Недавнее исследование показало, что добавление магния в пищу мышей с прогерией улучшает синтез АТФ и увеличивает синтез глутатиона (он нужен для защиты клетки от свободных радикалов). В результате у мышей с прогерией снижается производство активных форм кислорода, увеличивается масса и продолжительность жизни (рис. 5) [10].
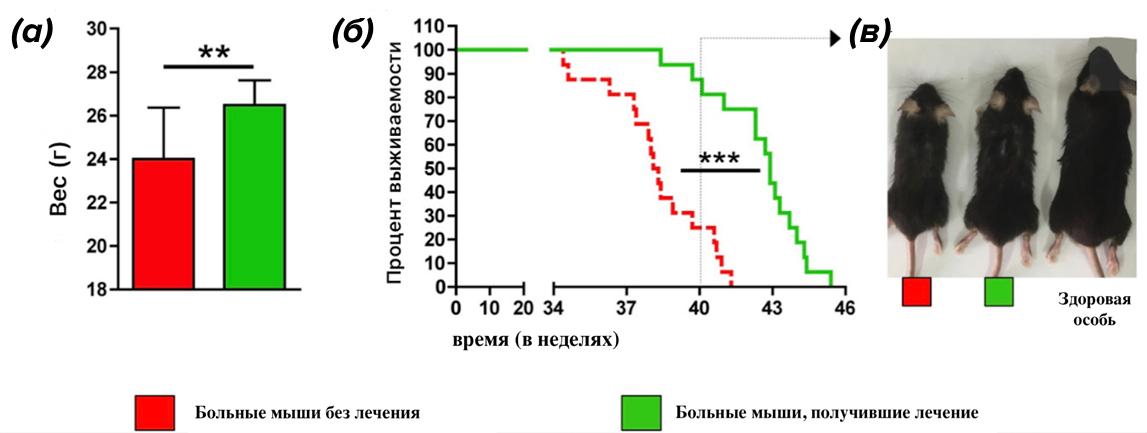
Рисунок 5. Лечение магнием увеличивает продолжительность жизни мышей. (а) — график массы тела мышей; (б) — график выживаемости мышей; (в) — фотографии 40‐недельных экспериментальных мышей и здоровой особи.
[10], с изменениями
На пути к бессмертию
Кишечный микробиом контролирует обмен веществ, отвечает за иммунитет и управляет нейроэндокринными путями. Нарушение микрофлоры кишечника (дисбиоз) может к привести к различным заболеваниям: ожирению, сахарному диабету 2 типа, проблемам с печенью и сердцем и даже раку (рис. 6). Но его точную роль в старении ученым еще предстоит выяснить.
У людей, страдающих прогерией, чаще наблюдается дисбиоз кишечника, а у долгожителей обнаруживается значительное увеличение количества Verrucomicrobia и уменьшение количества нарушающих работу кишечника псевдомонадот (Pseudomonadota) [11].
Исследования показали, что трансплантация фекальной микробиоты от диких мышей повышает качество и продолжительность жизни мышей с прогерией [12], [13].
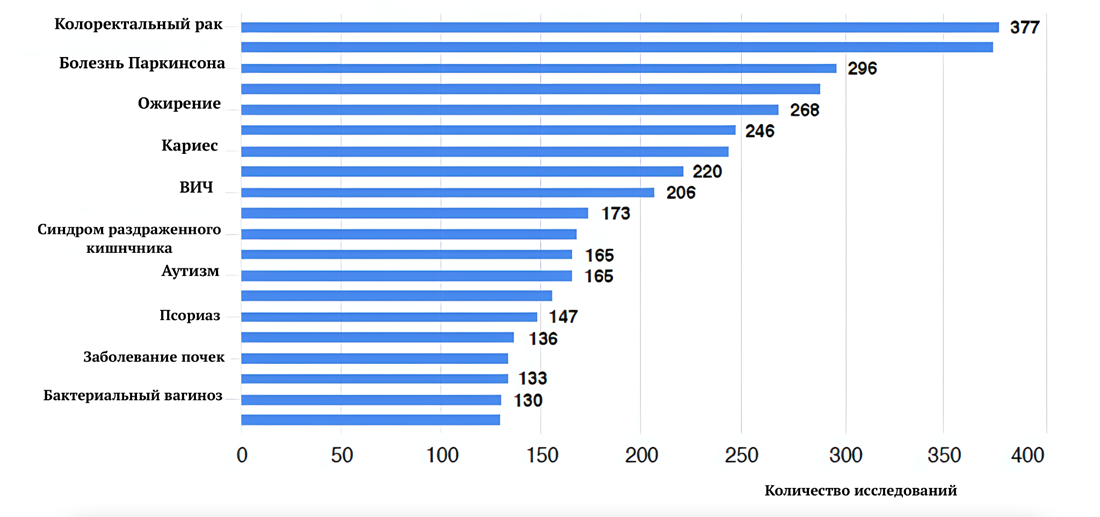
Рисунок 6. Заболевания, связанные с дисбиозом.
[13], с изменениями
Новые горизонты в терапии
Прогерин оказывает токсическое действие на клетку, поэтому учеными были разработаны альтернативные методы лечения, направленные на уменьшение токсичности этого белка.
Мутация одного основания в гене LMNA приводит к неправильному сплайсингу и впоследствии к трансляциии белка прогерина, вызывающего синдром Хатчинсона—Гилфорда (HGPS, от англ. Hutchinson—Gilford progeroid syndrome) (рис. 7) [14]. Образующийся токсичный белок вызывает быстрое старение и сокращает продолжительность жизни детей с прогерией примерно до 14 лет [15].
Исправление патогенных аллелей, вызывающих разрушительные заболевания, является давней проблемой в медицине. Одним из перспективных методов в борьбе с прогерией считается использование редакторов оснований. Редакторы оснований — это помощники в редактировании генома, которые преобразуют целевые пары оснований без создания двухцепочечных разрывов ДНК. Редакторы оснований цитозина (от англ. cytosine base editors, CBE) преобразуют C-G в T-A, тогда как редакторы оснований аденина (от англ. adenine base editors, ABE) превращают A-T в G-C.
ABE используют полученную в лабораторных условиях дезоксиаденозиндезаминазу для преобразования аденина в инозин (который образует пары оснований, подобные гуанину) на небольшом участке цепи и заставляют клетку заменять комплементарный тимин цитозином путем надреза с последующим восстановлением структуры молекулы (рис. 7) [15].
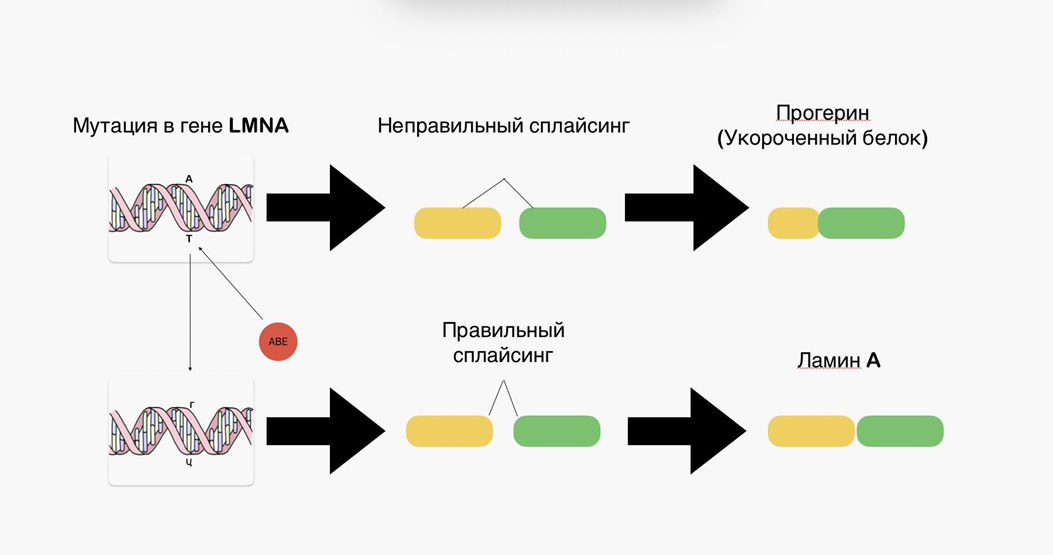
Рисунок 7. Действие ABE на мутантный участок гена и замена нуклеотидный пары.
Метод модуляции сплайсинга работает на технологии пропуска экзона. Он базируется на антисмысловых олигонуклеотидах (от англ. antisense oligonucleotides, ASO). [16]. Имея в виду тот факт, что ламинопатии, в том числе и прогерия, возникают из-за мутаций, изменяющих процессинг ламина А, ASO были разработаны для воздействия на экзон 11 гена LMNA, как показано на рисунке 8 [17]. Такой метод позволяет сместить соотношение мРНК, кодирующей ламин А, к мРНК, кодирующей ламин С.
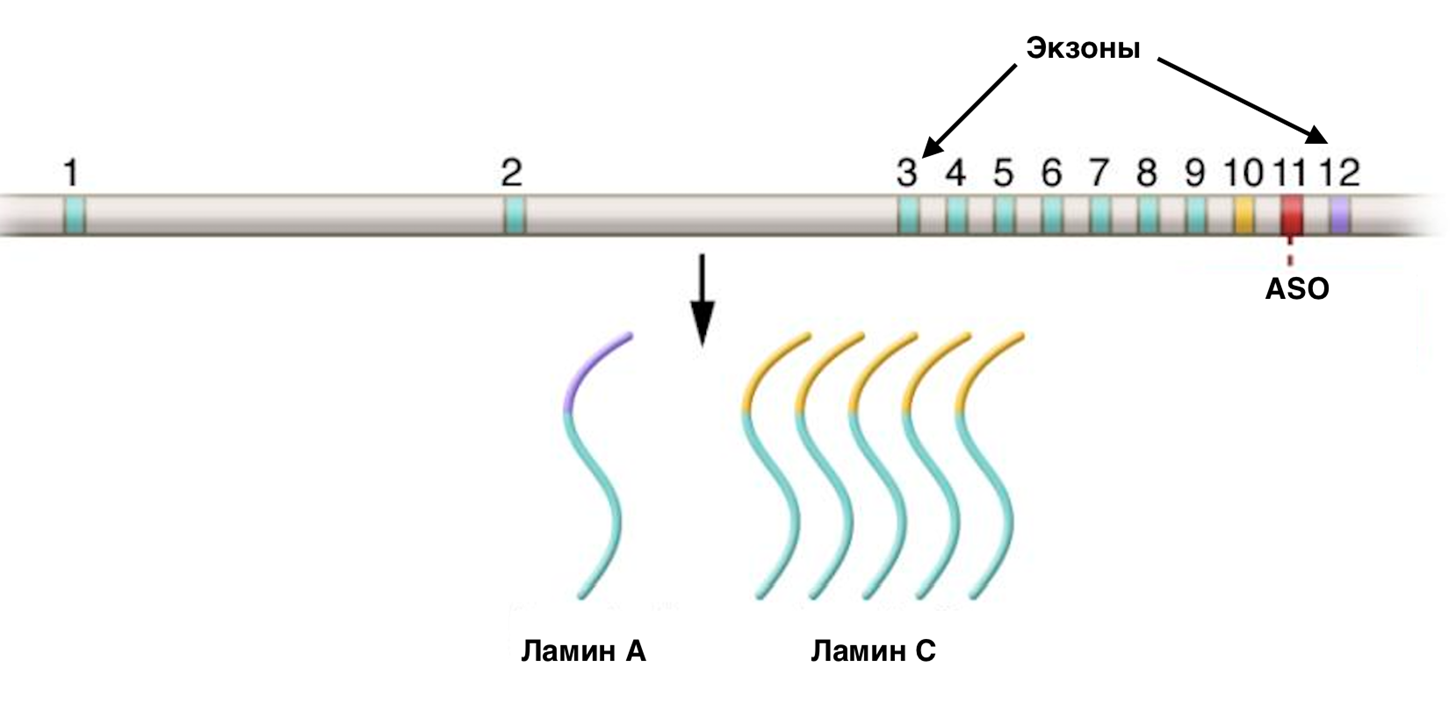
Рисунок 8. ASO смещают синтез ламина A в сторону ламина С.
[17], с изменениями
ASO снижают уровень ламина А и частоту возникновения аномалий формы ядра в фибробластах HGPS. На рисунке 9 показано, что при проведении иммуноферментного анализа клетки, обработанные ASO, окрашивались в зеленый цвет с антителом к ламину А и в красный цвет — с антителом к ламину С. При смешении видно, что большинство клеток имеют фенотип HGPS. Это значит, что ламин А и ламин С производятся примерно в одинаковых количествах. Снижение уровня экспрессии ламина показано стрелками [18].
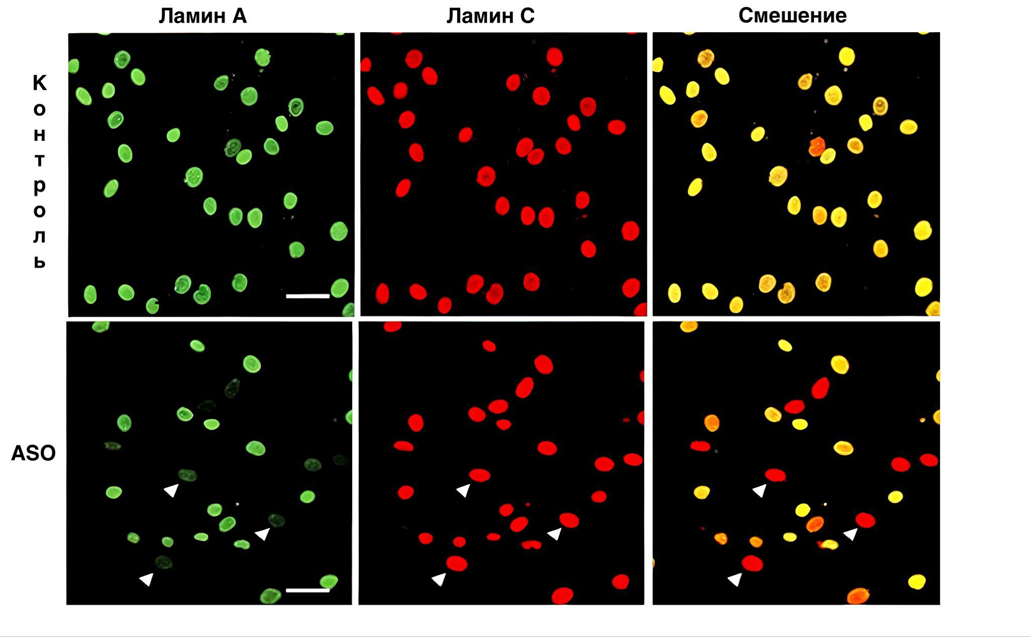
Рисунок 9. Увеличение экспрессии ламина С в клетках, обработанных ASO.
[18], с изменениями
В качестве терапии, направленной на устранение основного звена патогенеза, у больных прогерией могут быть использованы иммуносупрессоры: рапамицин и сульфорафан. Оба препарата усиливают разрушение прогерина по аутофагически-лизосомальному пути, что может стать вероятной стратегией борьбы против детской прогерии [19]. Рапамицин (ингибитор пути mTOR, от англ. Mechanistic Target of Rapamycin) ускоряет обмен прогерина, не давая ему пагубно воздействовать на клетку и поддерживая метаболический гомеостаз. Рапамицин способен не только улучшать ядерную морфологию и организацию гетерохроматина, но и восстанавливать функции сердечно-сосудистой системы и тонус мышц [17].
В эксперименте мыши с дефицитом ламина A и C, получавшие рапамицин, живут дольше и сохраняют бóльшую массу тела (рис. 10) [20].
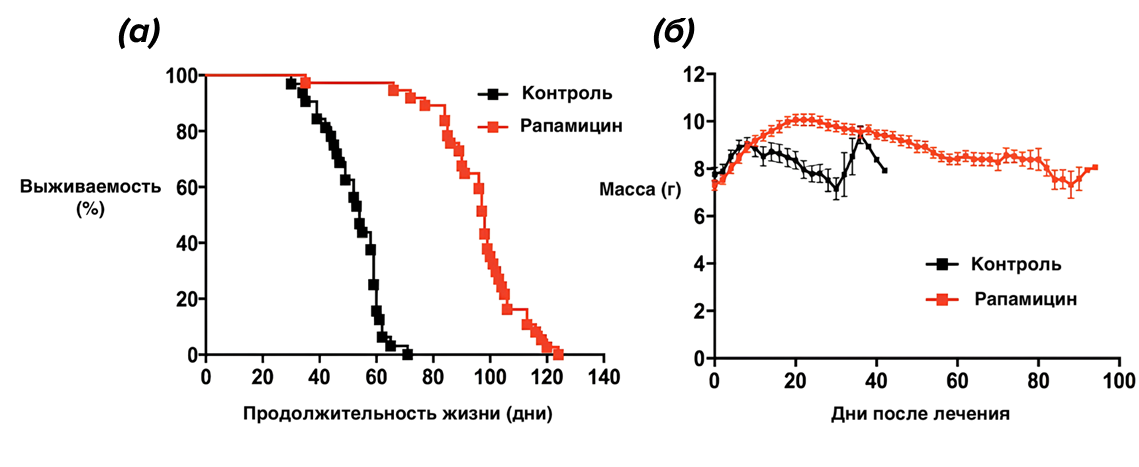
Рисунок 10. Положительное влияние рапамицина. (а) — график продолжительности жизни мышей; (б) — график изменения массы тела мышей.
[20], с изменениями
Комбинированная лекарственная терапия показала эффективность в правильном выстраивании хромосом на периферии ядра и прикреплении теломер к цитоскелету ядра [21].
Заключение
Понимание молекулярно-генетических механизмов прогерии послужило пусковым механизмом для моделирования заболевания на клеточном и организменном уровнях. Благодаря таким моделям ученые выяснили, как изменения в структуре ядра приводят к различным патологиям. При прогерии, а также во время природного запрограммированного старения происходят сходные изменения в клетках: потеря периферического гетерохроматина, повреждения ДНК, укорочение теломер и накопление стареющих клеток [22]. Исследования прогерии внесли значительный вклад в разработку различных методов борьбы со старением и, возможно, в будущем ученым удастся изобрести «эликсир вечной молодости».
Таким образом, более глубокие исследования прогероидных синдромов и других ламинопатий оправданы и могут предоставить возможности для разработки новых методов лечения этих разрушительных заболеваний.
Литература
- Утц С.Р., Тальникова Е.Е., Шерстнева В.Н., Румянцева Е.В. (2014). Прогерия. Саратовский научно-медицинский журнал. 10, 522–524;
- Antonio G. Tartiere, José M. P. Freije, Carlos López-Otín. (2024). The hallmarks of aging as a conceptual framework for health and longevity research. Front. Aging. 5;
- João Pedro de Magalhães. (2023). Ageing as a software design flaw. Genome Biol. 24;
- Maarten J. Wensink, Alan A. Cohen. (2022). The Danaid Theory of Aging. Front. Cell Dev. Biol.. 9;
- Paola Scaffidi, Tom Misteli. (2006). Lamin A-Dependent Nuclear Defects in Human Aging. Science. 312, 1059-1063;
- Мосевицкий М.И. (2022). Прогерин и его роль в ускоренном и естественном старении. Молекулярная биология. 56, 181–205;
- Jon Macicior, Daniel Fernández, Silvia Ortega-Gutiérrez. (2024). A new fluorescent probe for the visualization of progerin. Bioorganic Chemistry. 142, 106967;
- Endre Sebestyén, Fabrizia Marullo, Federica Lucini, Cristiano Petrini, Andrea Bianchi, et. al.. (2020). SAMMY-seq reveals early alteration of heterochromatin and deregulation of bivalent genes in Hutchinson-Gilford Progeria Syndrome. Nat Commun. 11;
- Ricardo Villa-Bellosta. (2020). Redox theory in progeria. Aging. 12, 20934-20935;
- Ricardo Villa‐Bellosta. (2020). Dietary magnesium supplementation improves lifespan in a mouse model of progeria. EMBO Mol Med. 12;
- G. Rizzatti, L. R. Lopetuso, G. Gibiino, C. Binda, A. Gasbarrini. (2017). Proteobacteria: A Common Factor in Human Diseases. BioMed Research International. 2017, 1-7;
- Clea Bárcena, Rafael Valdés-Mas, Pablo Mayoral, Cecilia Garabaya, Sylvère Durand, et. al.. (2019). Healthspan and lifespan extension by fecal microbiota transplantation into progeroid mice. Nat Med. 25, 1234-1242;
- Julia Álvarez, José Manuel Fernández Real, Francisco Guarner, Miguel Gueimonde, Juan Miguel Rodríguez, et. al.. (2021). Microbiota intestinal y salud. Gastroenterología y Hepatología. 44, 519-535;
- Ping Lin, Jianxin Jiang, Min Wu. (2021). CRISPR base editor treats premature-aging syndrome. Sig Transduct Target Ther. 6;
- Luke W. Koblan, Michael R. Erdos, Christopher Wilson, Wayne A. Cabral, Jonathan M. Levy, et. al.. (2021). In vivo base editing rescues Hutchinson–Gilford progeria syndrome in mice. Nature. 589, 608-614;
- Bulmaro Cisneros, Ian García-Aguirre, Marlon De Ita, Isabel Arrieta-Cruz, Haydeé Rosas-Vargas. (2023). Hutchinson-Gilford Progeria Syndrome: Cellular Mechanisms and Therapeutic Perspectives. Archives of Medical Research. 54, 102837;
- Elizabeth M. McNally, Eugene J. Wyatt. (2016). Welcome to the splice age: antisense oligonucleotide–mediated exon skipping gains wider applicability. Journal of Clinical Investigation. 126, 1236-1238;
- John M. Lee, Chika Nobumori, Yiping Tu, Catherine Choi, Shao H. Yang, et. al.. (2016). Modulation of LMNA splicing as a strategy to treat prelamin A diseases. Journal of Clinical Investigation. 126, 1592-1602;
- Natalia V. Buchinskaya, Aida Zh. Akhenbekova, Aliya A. Bugybay, Mikhail M. Kostik. (2022). Progeria (Hutchinson-Gilford Syndrome): Literature Review and Clinical Case. Vopr. sovr. pediatr.. 21, 253-264;
- Chen-Yu Liao, Sydney S. Anderson, Nicole H. Chicoine, Jarrott R. Mayfield, Emmeline C. Academia, et. al.. (2016). Rapamycin Reverses Metabolic Deficits in Lamin A/C-Deficient Mice. Cell Reports. 17, 2542-2552;
- Mehmet U. Bikkul, Craig S. Clements, Lauren S. Godwin, Martin W. Goldberg, Ian R. Kill, Joanna M. Bridger. (2018). Farnesyltransferase inhibitor and rapamycin correct aberrant genome organisation and decrease DNA damage respectively, in Hutchinson–Gilford progeria syndrome fibroblasts. Biogerontology. 19, 579-602;
- Oliver Dreesen, Alexandre Chojnowski, Peh Fern Ong, Tian Yun Zhao, John E. Common, et. al.. (2013). Lamin B1 fluctuations have differential effects on cellular proliferation and senescence. Journal of Cell Biology. 200, 605-617.






