Наномеханика для адресной доставки лекарств – насколько это реально?
21 ноября 2015
Наномеханика для адресной доставки лекарств – насколько это реально?
- 5572
- 2
- 3
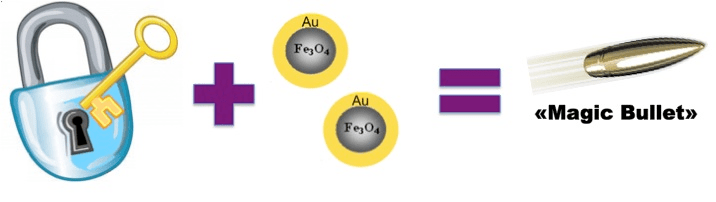
Авторская картинка-ребус. Первое слагаемое — принцип «ключ—замок», о котором идет речь в нашей статье; второе слагаемое — магнитные наночастицы с золотой оболочкой. Полученный в результате препарат имеет перспективное применение в адресной доставке лекарств, реализуя концепцию «магической пули» П. Эрлиха.
коллаж автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Трудно себе представить, сколько раз за последние несколько десятилетий научное сообщество слышало словосочетание «адресная доставка лекарств». И не случайно, так как эти магические три слова, реализованные на практике, могут совершить коренной переворот в современной медицине. К сожалению, все теоретическое многообразие систем доставки на практике часто сводится лишь к одному носителю — липосомам, — да и то проблема контролируемого высвобождения лекарств для них окончательно не решена. В качестве возможной альтернативы липосомам, а также многим другим «контейнерам» для адресной доставки лекарств в данной статье рассматривается «наномеханический» подход с участием магнитных наночастиц. Что же это такое? Прочтите и узнайте!
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Вступление. Что такое адресная доставка лекарств
Вернемся от липосомального транспорта [1] на более чем сто лет назад. Впервые о возможности адресной доставки лекарств заговорил в конце XIX века великий немецкий бактериолог Пауль Эрлих, предложив термин «волшебная пуля» (рис. 1). Этот термин подразумевал препарат, который избирательно находит в организме и убивает опухолевые клетки, не повреждая при этом здоровые ткани [2]. Строго говоря, концепция волшебной пули содержит в себе две проблемы: направленное конструирование новых лекарственных препаратов — драг-дизайн (drug design) — и систем для их адресной доставки (drug delivery).
Основные понятия, используемые как в драг-дизайне, так и в задачах доставки — это мишень и лекарство [3]. Мишень — это макромолекулярная биологическая структура, предположительно связанная с определенной функцией, нарушение которой приводит к заболеванию, и на которую необходимо совершить определенное воздействие. Лекарство — это химическое соединение, специфически взаимодействующее с мишенью и модифицирующее клеточный ответ, создаваемый мишенью. Если в качестве мишени выступает рецептор, то лекарство будет, скорее всего, его лигандом (соединением, специфическим образом взаимодействующим с активным сайтом рецептора). Задача драг-дизайна состоит в том, чтобы, во-первых, выбрать правильную мишень, воздействуя на которую можно специфическим образом регулировать конкретные биохимические процессы, во-вторых, выполнить поиск и/или дизайн химических соединений, которые потенциально могут стать лекарствами. Задача адресной доставки, соответственно, заключается в доставке лекарства к мишени. Далее мы сосредоточимся на последней проблеме, в то время как вопросы, связанные с драг-дизайном, подробно освещены в статьях «Драг-дизайн: как в современном мире создаются новые лекарства» [3] и «Торжество компьютерных методов: предсказание строения белков» [4], опубликованных на «Биомолекуле».
В современном научном мире под адресной доставкой лекарств понимают транспорт молекул лекарственного вещества в заданную область организма, органа или клетки при помощи управляемого носителя, в качестве которого могут выступать другие молекулы и/или наночастицы. На клеточном уровне такой транспорт чаще всего представляет собой рецептор-опосредованный эндоцитоз — захват клеткой внешнего материала, осуществляемый путем образования мембранных везикул, при котором рецепторы мембраны связываются либо с молекулами самого поглощаемого вещества, либо с лигандами, находящимися на его поверхности [5]). При этом в зоне контакта клетки с носителем, содержащим лекарство, возникают гидродинамические, электростатические, стерические и многие другие виды взаимодействий [6]. Таким образом, адресно доставить что-либо в клетку — не такая простая задача, как может показаться. Почему же это направление исследований является столь заманчивым для ученых?
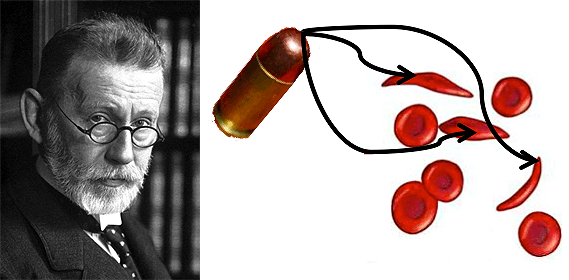
Рисунок 1. Пауль Эрлих (1854–1915; слева) и его концепция «волшебной пули» (справа) в интерпретации автора статьи: пуля действует только на пораженные серповидноклеточной анемией клетки крови.
В терапии трудноизлечимых на сегодняшний день заболеваний определяющую роль играет подбор оптимальной концентрации препарата в очаге поражения. Для того, чтобы лекарство было эффективным, важно, чтобы его молекулы попали к нужным клеткам: антидепрессанты попали в мозг, противовоспалительные средства — в места воспалений, антираковые препараты — в опухоль и т.д. В подавляющем большинстве случаев никто не может гарантировать, что нужная доля лекарственного вещества, введенная в организм в виде инъекций или таблеток, на самом деле достигла цели. В действительности большая часть целевого препарата попадает в печень, а также выводится из организма при помощи выделительной системы (например, почками). Наиболее очевидным решением этой проблемы является повышение начальной концентрации вводимого препарата. Но здесь мы сталкиваемся с другой проблемой — многие лекарства в этом случае могут стать токсичными, то есть, оказывая лекарственное воздействие на одни органы, они будут подавлять жизнедеятельность других. Это особенно важно для противораковых препаратов, которые убивают не только больные, но и здоровые клетки.
Как осуществить?
Именно поэтому ученые всего мира ведут активные работы по адресной доставке лекарств, которые будут попадать точно в цель, не повреждая другие органы. Главная особенность такого типа доставки — нужно защитить лекарство, чтобы оно не вступало в химические реакции по пути к больному органу, а начало действовать лишь в нужном месте. Это можно сделать, поместив молекулы в защитный контейнер, к которому предъявляется ряд требований:
- Материал контейнера не должен сам вступать в химические реакции, которые нарушат взаимодействие лекарства с больными клетками;
- Материал контейнера должен каким-либо образом способствовать транспорту лекарства в требуемое место в организме;
- Само строение и состав контейнера должны позволять контролируемое высвобождение лекарства в требуемый момент времени.
Наибольшую проблему на сегодняшний день представляет именно высвобождение лекарства из контейнера, которое, как правило, требует дистанционного регулирования. Как сделать так, чтобы, например, оболочка капсулы, находящейся в больном органе (недоступная для непосредственного воздействия), непроницаемая сейчас, через несколько минут стала проницаемой, позволяя лекарству выйти наружу?
Предлагаемая система
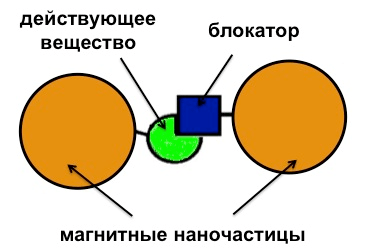
Рисунок 2. Система для адресной доставки лекарств на основе наночастиц.
рисунок автора
Поскольку идеального решения, удовлетворяющего всем критериям, на текущий момент еще не найдено, в Лаборатории химического дизайна бионаноматериалов химического факультета МГУ был предложен и разработан оригинальный вариант системы для адресной доставки лекарственных препаратов (рис. 2). В состав этой системы входят три основных компонента: магнитные наночастицы, действующее вещество и его блокатор. Давайте разберемся, зачем все это нужно.
Действующее вещество — это и есть лекарство, которое нужно доставить к больному органу. Блокатор (конкретные примеры будут описаны позже) полностью подавляет действие лекарства — то есть, не дает ему вступать в химические реакции, имитируя контейнер. В состав магнитных наночастиц входит оксид железа, и они обладают способностью притягиваться к магниту. Поэтому, прикладывая магнитное поле извне организма, можно направлять частицы, а значит, и прикрепленное к ним лекарство, к очагу поражения (более подробно этот вопрос описан далее во врезке). Так выполняется требование «адресности» доставки. Магнитные наночастицы можно покрыть нетоксичной оболочкой (например, из полимера или благородного металла), а в качестве блокатора выбрать вещество, не наносящее вред организму (как и лекарство) — побочных реакций у системы не будет. Остается разобраться с самым главным вопросом — а как же сделать лекарство активным, когда оно будет доставлено в нужное место?
Ингибитор, фермент и субстрат. Принцип «ключ—замок»
Теперь пришло время сделать небольшое теоретическое отступление и рассказать о загадочной молекуле — блокаторе — и ее комплексе с лекарством.
На самом деле, примеры таких «парных» молекул известны практически всем, кто занимается биохимией — это комплексы «антиген—антитело», «фермент—субстрат», «фермент—ингибитор», «рецептор—лиганд» и некоторые другие. Очень упрощенно можно сказать, что в основе парных взаимодействий этих молекул лежит так называемый принцип «ключ—замок» (риc. 4), когда две молекулы настолько хорошо подходят друг другу по форме, заряду и т.д., что они, находясь вместе в каком-либо замкнутом пространстве, стремятся «найти» друг друга и образовать очень прочную связь. Примечание «очень упрощенно» означает то, что модель «ключ—замок» была самой первой попыткой объяснить высокое сродство антигена к антителу и фермента к субстрату. Далее ее сменила модель индуцированного соответствия, которая подразумевала, что «ключ» принимает свою форму только в контакте с «замком» (поэтому такую концепцию назвали «рука—перчатка»). В более поздних работах было обнаружено, что некоторые «парные» молекулы вообще не имеют определенной структуры [10], [11]. Поэтому в силу наибольшей простоты и наглядности мы будем пользоваться именно моделью «ключ—замок», безусловно, помня о том, что вопросы межмолекулярного распознавания в действительности намного сложнее, и разработка более совершенных концепций продолжается до сих пор [12].
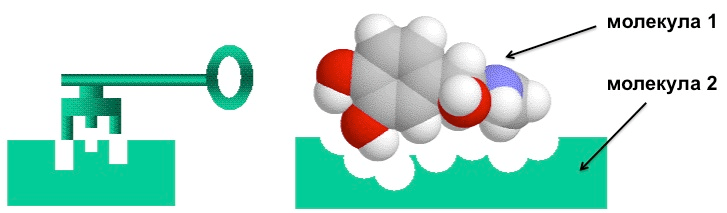
Рисунок 4. Иллюстрация принципа «ключ—замок».
Антитела, а также ферменты могут выступать в качестве лекарственных препаратов [13], а свою активность они теряют, соответственно, в присутствии антигенов или ингибиторов. В проведенной экспериментальной работе изучались комплексы магнитных наночастиц с ферментами, поэтому остановимся подробнее на комплексах «фермент—субстрат» и «фермент—ингибитор» (о взаимодействии антигенов с антителами можно прочитать в литературе [14]).
Ферменты — биологические катализаторы, облегчающие протекание многих реакций в организме. Фермент образует комплекс с субстратом — веществом, которое в процессе химической реакции превращается в другое — продукт (рис. 5, сверху).
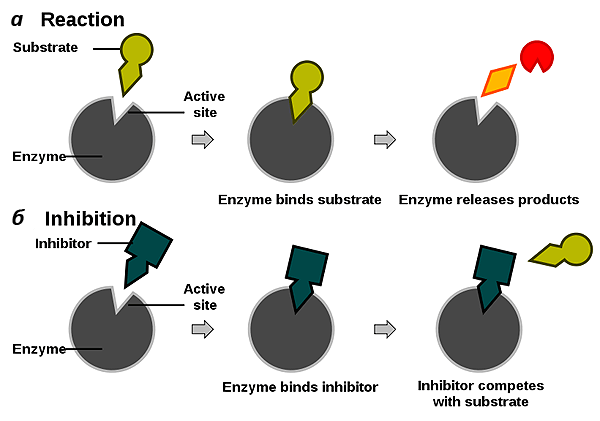
Рисунок 5. Схематическое изображение комплексов «фермент—субстрат» (a) и «фермент—ингибитор» (б).
Ранее уже было сказано, что структуры фермента и субстрата подходят друг к другу, как ключ к замку. Именно это обусловливает их прочную связь друг с другом, а также высокую избирательность ферментов к типу реакции, на скорость которой они могут повлиять. В то же время, существует еще один тип молекул, способный образовывать не менее устойчивый комплекс с ферментами — это ингибиторы. Они схожи по структуре с субстратами (рис. 5б), однако не превращаются в продукт, а лишь препятствуют связыванию субстрата с ферментом.
Таким образом, если мы хотим использовать фермент в качестве адресно доставляемого лекарства, то рассчитываем, что его терапевтическим действием будет как раз превращение субстрата в продукт, которое должно произойти исключительно в больном органе. В качестве блокатора мы берем ингибитор, который не дает ферменту участвовать в химических реакциях. Но, как только фермент достигнет определенного места в организме, нужно убрать с него ингибитор и сделать возможным взаимодействие фермента и субстрата. Как? В этом нам помогут магнитные наночастицы.
Зачем еще нужны магнитные наночастицы
Опять же, некоторое время назад мы говорили, что магнитными наночастицами можно управлять извне при помощи магнитного поля. Будем изучать случай, когда частицы состоят из молекул, обладающих собственным магнитным моментом (он обусловлен внутренним движением электронов). Соответственно, вся частица также будет обладать некоторым суммарным магнитным моментом, причем его направление будет произвольным относительно магнитных моментов других частиц. Для их создания можно использовать довольно разнообразные материалы; в ходе работы мы синтезировали наночастицы оксида железа Fe3O4, образующего в природе минерал магнетит.
Мысленно поместим такие частицы между полюсами постоянного магнита (рис. 6). Тогда внешнее магнитное поле (которое для наглядности представлено большими пунктирными стрелками, направленными вверх) будет стремиться повернуть первоначально хаотически ориентированные магнитные моменты частиц (маленькие стрелочки) в одну сторону, то есть, тоже вверх. Расчеты показывают [15], что при диаметре более 10–12 нм магнитные моменты частиц магнетита становятся параллельными магнитному моменту внешнего поля преимущественно за счет механического поворота самих частиц как целого (в физике этот процесс называется Броуновской релаксацией).
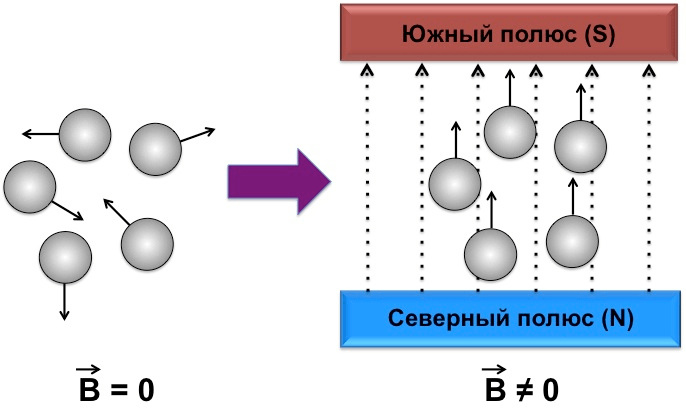
Рисунок 6. Поведение магнитных частиц во внешнем магнитном поле постоянного магнита (обозначено символом В).
рисунок автора
А что будет, если мы прикрепим к магнитным наночастицам в растворе другие молекулы и поместим их в магнитное поле? Тогда при вращении магнитных наночастиц будет также вращаться и все, что закреплено на них, под действием возникающих механических сил, для которых мы провели численные оценки [16]. В первом приближении оказалось, что эти силы не зависят от частоты поля и вязкости растворителя, но линейно зависят от индукции поля. Было обнаружено, что в такой системе для магнитных наночастиц радиусом 10 нм в поле B = 0,1 Tл можно получить силу ≈ 100 пН, а для наночастиц с радиусом 20 нм в поле B = 0,2 Тл — силу ≈ 1000 пН. Из литературы, посвященной методам силовой спектроскопии на одиночных молекулах [17], известно, такой диапазон сил достаточен для проведения любых манипуляций с белковыми макромолекулами. Именно этот принцип положен в основу разрыва связи между ферментом и ингибитором в нашей системе для доставки лекарств. И именно поэтому в названии статьи мы говорим о наномеханике — то есть, о реализации механических процессов в наномасштабах.
Потенциальное действие системы
Таким образом, первоначально у нас есть две порции наночастиц магнетита Fe3O4, покрытых золотой (инертной) оболочкой Au. К одной порции мы пришиваем фермент, а к другой — ингибитор этого фермента (рис. 7, слева). Затем мы смешиваем две порции этих частиц друг с другом, они попарно взаимодействуют между собой, фермент связывается с ингибитором и становится неактивным (рис. 7, справа).
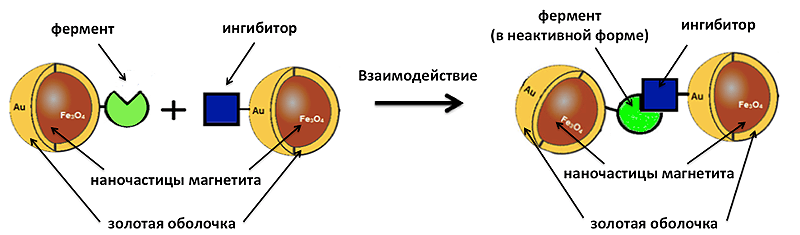
Рисунок 7. Система на основе магнитных наночастиц до взаимодействия фермента и ингибитора (слева) и после их взаимодействия (справа).
рисунок автора
Если затем поместить эту систему во внешнее магнитное поле (например, внутрь катушки с обмоткой, по которой течет ток; направление поля обозначено большой фиолетовой стрелкой), то при механическом вращении частиц (см. предыдущий раздел) связь между ферментом и ингибитором будет деформироваться (рис. 8).
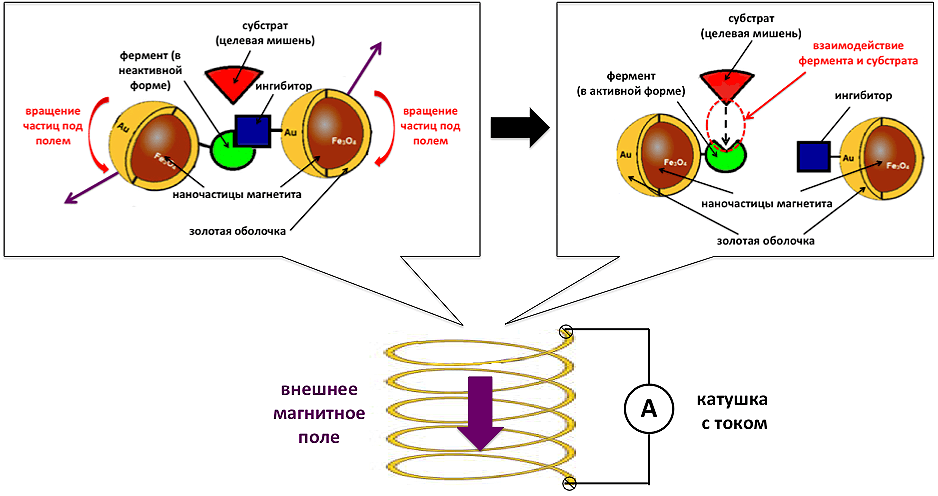
Рисунок 8. Поведение системы на основе магнитных наночастиц, фермента и ингибитора в магнитном поле катушки с током. Иллюстрация сил, действующих на частицы (слева), разрыв связи между ферментом и ингибитором (справа).
рисунок автора
При любом начальном положении магнитных моментов частиц (маленькие фиолетовые стрелки на рис. 8, слева), кроме идеально совпадающего, они будут тянуть фермент и ингибитор в разные стороны, словно растягивать пружину. А если пустить по обмотке катушки переменный ток, то повороты частиц будут происходить многократно в различных направлениях, и через небольшой промежуток времени связь фермент—ингибитор полностью разорвется (рис. 8, справа). В этот момент фермент станет доступным для субстрата (который не связан с магнитной наночастицей и поэтому более подвижен), и, наконец, произойдет каталитическая реакция между ферментом и субстратом, которая является нашей целью.
Какие результаты есть на сегодняшний день?
На начальном этапе работы мы получили водные растворы наночастиц магнетита Fe3O4 диаметром 10 нм (рис. 9а), далее они покрывались защитной оболочкой из золота толщиной около 5 нм (рис. 9б) [18].
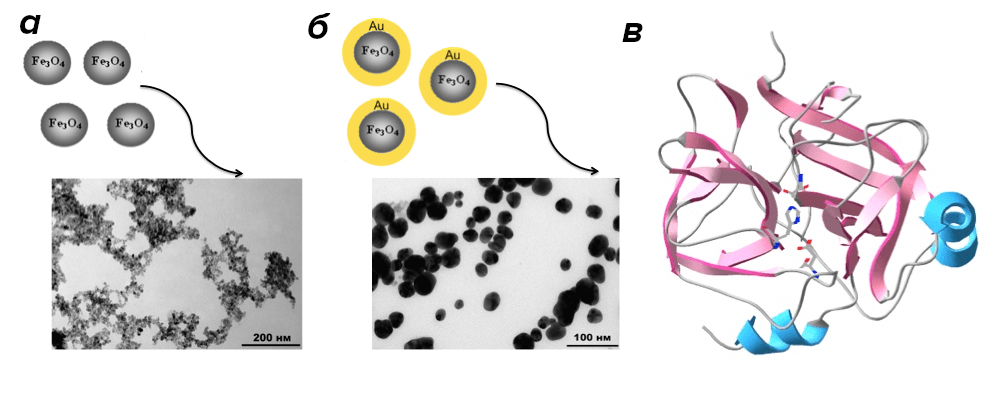
Рисунок 9. Наночастицы магнетита диаметром 10±2 нм (а), наночастицы магнетит—золото диаметром 23±3 нм (б), полученные в работе, и схематичное изображение химотрипсина (в).
[18], рисунок адаптирован
После этого к частицам пришивали фермент химотрипсин (диаметром около 2 нм, схематическое изображение на рис. 9в) либо ингибитор трипсина, который способен блокировать действие фермента. В организме человека химотрипсин содержится в секрете поджелудочной железы и участвует в расщеплении белков пищи в тонком кишечнике. Разумеется, теоретически возможна ситуация, когда химотрипсин понадобится доставить адресно в организм человека, страдающего расстройством пищеварения. Однако на данном этапе мы скорее выбрали этот фермент в качестве достоверной модели, так как его химические свойства (размер, молекулярная масса, элементный состав, специфичность к реакциям) хорошо описаны в литературе. Эксперименты над полученной системой из магнитных наночастиц, фермента и его ингибитора проводили in vitro, то есть, в пробирке, не помещая частицы в живой организм.
Далее встал вопрос — что взять за меру активности фермента? По своей химической природе химотрипсин катализирует гидролиз — расщепление химической связи под действием воды. Поэтому в качестве модели была выбрана химическая реакция гидролиза субстрата пара-нитроанилида-N-бензоил-L-тирозина (BTNA), катализируемая химотрипсином (рис. 10). Продуктом этой реакции является пара-нитроанилин, окрашенный желтым цветом (максимальное поглощение света происходит при 380–400 нм) [19].
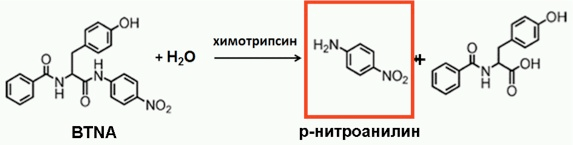
Рисунок 10. Реакция гидролиза субстрата BTNA, используемого в работе.
рисунок автора
За тем, как протекает эта реакция, удобно следить при помощи спектрофотометра — прибора, способного измерять поглощение видимого света или, проще говоря, интенсивность окраски раствора. Для этих исследований ученые нашей лаборатории специально сконструировали прибор, который совмещает в себе функции спектрофотометра и катушки с током — то есть, позволяет прикладывать внешнее магнитное поле и одновременно с этим измерять зависимость поглощения раствора от времени, которая и будет являться мерой активности фермента.
Итак, нам необходимо было сравнить скорости реакции гидролиза BTNA под действием химотрипсина при трех различных условиях:
- с магнитными наночастицами связан только химотрипсин, нет ингибитора, нет магнитного поля;
- с магнитными наночастицами связан комплекс фермента с ингибитором (рис. 7, справа), нет магнитного поля. Для этого смешивали две порции растворов наночастиц (одни из них были связаны с ферментом, другие — с ингибитором), выдерживали некоторое время вместе, затем добавляли субстрат BTNA и помещали в спектрофотометр;
- с магнитными наночастицами связан комплекс фермента с ингибитором (рис. 7, справа), включено магнитное поле. Для этого выполняли эксперимент, аналогичный описанному в пункте 2, включая магнитное поле после добавления субстрата.
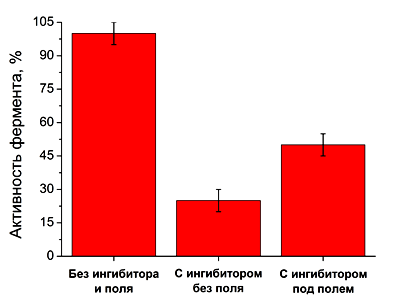
Рисунок 11. Скорость реакции гидролиза субстрата (активность фермента) при различных условиях эксперимента.
рисунок автора
Скорость реакции гидролиза BTNA (активность фермента), полученную в пункте 1, брали за «точку отсчета», то есть, 100%. Было установлено, что при связывании химотрипсина с ингибитором (пункт 2) его активность падает до 25–30% от исходной (рис. 11), а при включении магнитного поля (пункт 3) повышается до 50–55% от исходной, то есть, комплекс фермента с ингибитором частично разрушается, и фермент лучше взаимодействует с субстратом. Иными словами, включив магнитное поле, мы смогли увеличить активность химотрипсина, связанного с ингибитором, в два раза.
Любой человек, знакомый с термином «магнитная гипертермия» — то есть, с направленным нагревом опухолевых клеток при помощи магнитных наночастиц, — может сказать, что наблюдаемое явление увеличения/уменьшения скорости реакции объясняется не структурными перестройками в связях фермента и ингибитора, а локальным нагревом в смеси. Однако стоит заметить, что мы специально использовали низкую частоту переменного поля в экспериментах (50 Гц по сравнению со 100–1000 кГц, которые применяются для магнитной гипертермии), а нагрев пропорционален частоте, поэтому любые термические эффекты были сведены к минимуму [16]. Обработка магнитным полем фермента и фермента в комплексе с ингибитором, но без магнитных наночастиц, не приводила к изменению скорости реакции.
В идеальном случае в комплексе химотрипсина с ингибитором, связанным с магнитными наночастицами в отсутствие поля (пункт 2), ингибитор полностью подавляет активность фермента (она равна нулю). После же действия магнитного поля на этот комплекс (пункт 3) активность фермента восстанавливается до исходной (без ингибитора и поля, пункт 1).
То, что мы не достигли таких значений в условиях нашего эксперимента, может объясняться несовершенством системы — не весь фермент связался с частицами на этапе синтеза, либо он мог связаться более чем с одной частицей и стать пространственно недоступным. Мысленно такой фермент (или ингибитор) можно представить себе как бисеринку, зажатую на нитке между двумя большими бусинами (магнитными частицами). Мы думаем, каждый согласится, что продеть нитку (образовать химическую связь) одновременно через эту бисеринку и еще одну, которая тоже прикреплена к одной или двум большим бусинам, практически невозможно. Эти недостатки могут быть устранены подбором количества и соотношения магнитных частиц, фермента и ингибитора при сшивке их друг с другом. На данный момент активно ведется испытание и доработка системы таким образом, чтобы оптимистичный сценарий ее работы, описанный в пункте «потенциальное действие», реализовывался максимально полно.
В будущем, когда модельная система с химотрипсином и его ингибитором будет доведена до совершенства in vitro, мы перейдем к экспериментам с терапевтическим ферментом аргиназой, а также ее ингибитором (например, норвалином). Это направление исследований крайне актуально, так как аргиназа способна расщеплять аргинин до орнитина и мочевины, а несколько лет назад было установлено, что снижение концентрации аргинина в крови эффективно замедляет развитие рака печени у человека [20]. Изучаемая нами система на основе магнитных наночастиц, которая высвобождает фермент из его комплекса с ингибитором под действием поля, безусловно, может помочь решить главную проблему — доставить аргиназу к печени, и не потерять при этом ее активность.
Заключение
Таким образом, в нашей лаборатории был разработан и экспериментально подтвержден принципиально новый подход к высвобождению лекарства, которое при помощи магнитных наночастиц можно адресно доставить в требуемое место в организме при условии фокусировки и оптимизации силы магнитного поля (см. врезку). Суть процесса заключается в механическом разрыве связи между молекулами лекарства-фермента и молекулами его блокатора-ингибитора (молекулы обоих типов связаны с магнитными наночастицами) под действием магнитного поля. Учитывая малые масштабы системы, такой способ был назван наномеханическим. Мы рассчитываем, что проведенные эксперименты станут основой для развития нового направления в адресной доставке лекарств, в частности, терапии онкологических заболеваний печени (см. выше), что приведет к созданию коммерчески доступного терапевтического препарата и даст пациентам с ныне неизлечимыми заболеваниями надежду на выздоровление.
Экспериментальный материал, который лег в основу статьи, был собран не только мной, а силами всего коллектива нашей группы:
- аспирантка 1 года обучения факультета наук о материалах МГУ им. М.В. Ломоносова Ефремова Мария Владимировна;
- выпускник бакалавриата факультета наук о материалах МГУ им. М.В. Ломоносова Барулин Александр Владимирович;
- д.х.н., профессор химического факультета МГУ им. М.В. Ломоносова Клячко Наталья Львовна;
- д. ф.-м.н., профессор ТГУ им. Г.Р. Державина Головин Юрий Иванович;
- д.х.н., доцент химического факультета МГУ им. М.В. Ломоносова Мажуга Александр Георгиевич.
Литература
- Theresa M. Allen, Pieter R. Cullis. (2013). Liposomal drug delivery systems: From concept to clinical applications. Advanced Drug Delivery Reviews. 65, 36-48;
- Ивонин А.Г., Пименов Е.В., Оборин В.А., Девришов Д.А., Копылов С.Н. (2012). Направленный транспорт лекарственных препаратов: современное состояние вопроса и перспективы. Известия Коми научного центра УрО РАН. 1, 46–55;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Торжество компьютерных методов: предсказание строения белков;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Невидимая граница: где сталкиваются «нано» и «био»;
- L. Harivardhan Reddy, José L. Arias, Julien Nicolas, Patrick Couvreur. (2012). Magnetic Nanoparticles: Design and Characterization, Toxicity and Biocompatibility, Pharmaceutical and Biomedical Applications. Chem. Rev.. 112, 5818-5878;
- Sibnath Kayal, Raju Vijayaraghavan Ramanujan. (2010). Anti-Cancer Drug Loaded Iron–Gold Core–Shell Nanoparticles (Fe@Au) for Magnetic Drug Targeting. J. Nanosci. Nanotech.. 10, 5527-5539;
- Manuel Arruebo, Rodrigo Fernández-Pacheco, M. Ricardo Ibarra, Jesús Santamaría. (2007). Magnetic nanoparticles for drug delivery. Nano Today. 2, 22-32;
- За пределами порядка;
- Недоупорядоченные белки;
- Молекулярная поверхность: что в облике тебе моём?;
- Jing Ren, Fang Wang, Guangquan Wei, Yong Yang, Ying Liu, et. al.. (2012). MRl of Prostate Cancer Antigen Expression for Diagnosis and lmmunotherapy. PLoS ONE. 7, e38350;
- Антитела: введение. (2015). База знаний по биологии человека;
- Balachandran Jeyadevan. (2010). Present status and prospects of magnetite nanoparticles-based hyperthermia. J. Ceram. Soc. Japan. 118, 391-401;
- Головин Ю.И., Клячко Н.Л., Головин Д.Ю., Ефремова М.В., Самодуров А.А., Сокольски-Папков М., Кабанов А.В. (2013). Новый подход к управлению биохимическими реакциями в магнитной наносуспензии с помощью низкочастотного магнитного поля. Письма в ЖТФ. 39, 24–32;
- Keir C Neuman, Attila Nagy. (2008). Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5, 491-505;
- Alexander Majouga, Marina Sokolsky-Papkov, Artem Kuznetsov, Dmitry Lebedev, Maria Efremova, et. al.. (2015). Enzyme-functionalized gold-coated magnetite nanoparticles as novel hybrid nanomaterials: Synthesis, purification and control of enzyme function by low-frequency magnetic field. Colloids and Surfaces B: Biointerfaces. 125, 104-109;
- Natalia L. Klyachko, Marina Sokolsky-Papkov, Nikorn Pothayee, Maria V. Efremova, Dmitry A. Gulin, et. al.. (2012). Changing the Enzyme Reaction Rate in Magnetic Nanosuspensions by a Non-Heating Magnetic Field. Angew. Chem. Int. Ed.. 51, 12016-12019;
- Markus Munder. (2009). Arginase: an emerging key player in the mammalian immune system. British Journal of Pharmacology. 158, 638-651.