Молекулярная поверхность: что в облике тебе моём?
05 января 2015
Молекулярная поверхность: что в облике тебе моём?
- 3261
- 8
- 7
Уникальный проект компании Visual Science превосходно показывает «портрет» аденовируса. То же самое и с поверхностью отдельных молекул, в общем-то.
-
Автор
-
Редакторы
Компьютерное моделирование биологических молекул зачастую основано не на квантовой механике, описывающей строение вещества максимально корректно, а на наборе приближений, уводящих нас от физических «истоков», но позволяющих решать практически важные задачи с использованием ЭВМ. Одним из таких упрощений является концепция молекулярных поверхностей, представляющая молекулу в виде твердого тела, на поверхности которого распределены какие-либо физические свойства. Несмотря на кажущийся примитивизм, этот подход является довольно плодотворным, внося свою лепту в решение актуальных проблем молекулярной биологии, — например, дизайна новых антибиотиков и изучения молекулярных механизмов заболеваний.
Для нас — существ, обитающих в мире с тремя пространственными координатами, — поверхности имеют особое значение. Переход из пространства на поверхность дает нам возможность, например, положить яблоко на стол или проложить маршрут путешествия из пункта А в пункт Б. Располагая координатами этих замечательных мест, несложно отметить их на карте (являющейся двумерным отображением трехмерного тела — нашей планеты) и решить, какими средствами осуществить поездку. Однако если с поверхностью Земли или другого макроскопического объекта все более-менее понятно, то, что такое поверхность молекулы, — на первый взгляд совершенно неясно. Конечно, с одной стороны такая поверхность является абстракцией, — потому что обычные физические поверхности (например, поверхность воды) перестают существовать при переходе к атомному масштабу. Однако, с другой стороны, молекулярная поверхность, представленная в виде совокупности сфер, изображающих атомы (или каким-то схожим образом), является очень удобным инструментом для описания межмолекулярных взаимодействий, лежащих в основе всего макроскопического мира.
Распознавание по принципу «свой—чужой»
Вся молекулярная биология, а, значит, и земная жизнь, держатся на поразительно четкой системе межмолекулярного распознавания, которая позволяет генетической программе реализоваться в форме сложнейших многоклеточных организмов, а, по правде говоря, определяет и саму возможность существования этой генетической программы. Мы не будем здесь углубляться в молекулярную эмбриологию, а отметим лишь, что удивительная сложность живых организмов не записана в ДНК буквально (в самом деле, туда же не внесены координаты всех атомов в организме), а получается как бы сама собой, на основе процессов самоорганизации и распознавания одними молекулами других, вследствие чего из отдельных «кирпичиков» и строятся клетки, а затем и организм.
Например, ДНК- и РНК-полимеразы с очень высокой точностью распознают матрицу — молекулу нуклеиновой кислоты, которая на первый взгляд во всех местах одинакова (и напоминает моток проволоки), но при ближайшем рассмотрении отличается последовательностью нуклеотидов. Или матричная РНК, при посредстве которой информация из ДНК превратится в, допустим, белок-рецептор, — она безошибочно узнается рибосомой, многочисленными факторами инициации, элонгации и терминации трансляции (всё это — белки), а удлинение синтезируемой полипептидной цепочки на каждый новый остаток аминокислоты происходит вследствие распознавания триплета молекулой транспортной РНК. Если синтезируемый белок является секретируемым или мембранным, — словом, ему нужно попасть в другое место, нежели цитоплазма, где работает синтезирующая его рибосома, — он содержит сигнальную последовательность, которая распознается специальным SRP-комплексом, направляющим его по нужному «адресу» (например, в транслокон). Транслокон же, в свою очередь, на основе свойств самого белка может распознать в нем мембранный рецептор (по гидрофобности образующих его фрагментов) и направить его в мембрану клетки (а не секретировать за ее пределы). Мембранные рецепторы являются «глазами» и «ушами» клетки, потому что отвечают за распознавание и передачу внутрь всех внешних сигналов (таких как свет [1], мембранный потенциал [2], [3], химические и гормональные импульсы [4], [5]), заодно объединяя миллиарды отдельных клеток в слаженно действующий организм. Ну и, наконец, сигналы, воспринимаемые этими рецепторами, могут активировать или затормозить активность генной экспрессии, с которой и начинался этот длинный абзац .
Автор просит принять во внимание то, что он не собирался изложить всю молекулярную биологию в одном абзаце, а лишь хотел напомнить читателям, что каждый без исключения процесс в живой клетке основан на высокоточном, ну или, по крайней мере, очень избирательном распознавании одних молекул другими.Поэтому описание всех процессов вышло беглым и вынужденно упрощенным.
Так при чем же тут молекулярные поверхности? Дело в том, что именно они — реальные или воображаемые — являются зоной межмолекулярной коммуникации и распознавания, определяя, «подойдут» ли молекулы друг другу, и «узнает» ли одна другую из тысячи. В науке такое распознавание измеряется свободной энергией взаимодействия двух молекул, а причиной передачи сигнала, вызываемой взаимодействием, являются электронно-конформационные переходы, приводящие к изменению конформации и/или свойств молекул после образования комплекса, что делает возможным продолжение эстафеты узнавание → передача.
Попробуем ответить на вопрос — а что же такое молекулярные поверхности? — более подробно.
Твердь атомных сфер
В древние времена люди были уверены, что купол неба является твердым телом, на котором выложены созвездия и по которому проносится солнечная колесница. В действительности всё оказалось не так. Аналогично, и образующие молекулы атомы вообще-то нельзя представлять в виде шариков: если выяснить в справочнике характерные размеры протона, нейтрона, электрона и образованных из них атомов, то окажется, что атом на >99% состоит из «пустоты». Впрочем, учитывая волновые свойства электрона и его способность образовывать электронные оболочки, для практических целей представлять себе атомы в виде твердых сфер все-таки можно. Впервые это сделал голландский ученый Ян Дидерик Ван дер Ваальс, получивший в 1910 году Нобелевскую премию по физике [6]. С тех пор его именем и называется средний эффективный радиус атома, изменяющийся в пределах 1–2 Å для разных химических элементов. На практике его можно считать равным половине минимального расстояния, на которое удается сблизить два одинаковых атома данного типа, принадлежащих к разным молекулам. (Если два атома объединены химической связью, то расстояние между ними будет меньше суммы ван-дер-ваальсовых радиусов этих атомов.) Молекулярные модели, основанные на представлении об атомах как твердых сферах, легли в основу распространенного CPK-конструктора (рис. 1а) [7].

Рисунок 1. Эволюция концепции молекулярной поверхности. а — Наиболее часто встречающаяся в физическом мире, поверхность ван дер Ваальса знакома нам по масштабным макетам молекул. На фотографии: прославленный химик Лайнус Полинг читает лекцию. б — Иллюстрация алгоритма «катящейся сферы», позволяющего получить поверхность, доступную растворителю, и поверхность Коннолли (молекулярную поверхность). в — Иллюстрация из оригинальной статьи Майкла Коннолли [10], в которой молекулярная поверхность гема цветами делится на разные области: выпуклую, вогнутую и седлообразную.
Взглянув на ван-дер-ваальсову модель молекулы, пытливый взгляд сразу поймет, что она внутри изобилует пустотами. Подобно мешку с ёлочными шарами, в молекуле будет много свободного места, однако еще один шарик туда уже не положишь. Так же обстоит дело и с атомами: молекулы растворителя (чаще всего, воды) не могут проникнуть в эти небольшие полости, что привело ученых к концепции поверхности, доступной растворителю (accessible surface area или solvent-accessible surface; рис. 1б). Предложенная в 1971 году Ли и Ричардсом [8], такая поверхность рассчитывается математически как множество точек, равноудаленных от ван-дер-ваальсовой поверхности молекулы, и изображает ту поверхность, которой реально могут достичь молекулы растворителя. Обычно такой расчет делается по алгоритму «катящейся сферы» [9], радиус которой принимают равным 1,4 Å — эффективному радиусу молекулы воды.
Близкородственной к этому является поверхность Коннолли [10], или молекулярная поверхность, соответствующая тому объему, внутрь которого не может проникнуть сфера растворителя (рис. 1в). Именно эта разновидность поверхности используется чаще всего для визуализации молекул или для расчетов физико-химических свойств, о которых речь пойдет далее.
Вещи, лежащие на поверхности
Описанные выше модели поверхности молекулы не являются исключительно игрой трудолюбивого ума ученых. Это — адекватный инструмент исследования молекул и проведения многих необходимых расчетов. Наиболее частое применение — вычисление полярной / неполярной площади поверхности, соотношение которых будет определять свободную энергию переноса молекулы из одной фазы (например, неполярной) в другую (полярную) и, соответственно, степень гидрофобности или гидрофильности молекулы. На основе термодинамического явления, называемого гидрофобным эффектом [11], происходит сворачивание биополимеров, стремящихся экранировать свои гидрофобные фрагменты от полярного растворителя — воды (или наоборот, если речь идет о мембранных белках). Этот процесс сворачивания, именуемый также фолдингом, напрямую связан с поверхностными явлениями и минимизацией площади контакта некоторых фрагментов гибкой белковой цепочки с окружающей средой.
Кроме того, как и в случае всем знакомой географической карты, двумерное изображение поверхности молекулы можно сделать крайне информативным, нанеся на него различные физико-химические характеристики и/или важные особенности структуры. Одно из часто встречающихся применений — расчет и цветовая визуализация электростатического потенциала на молекулярной поверхности, определяющего зарядовые взаимодействия молекул между собой. Еще один пример — картирование молекулярного «рельефа» на поверхности — расположение «ущелий», «холмов» и «равнин», наглядно показывающих, насколько гладкой или шероховатой является поверхность на том или ином участке. В частности, эта информация, вместе с локализацией на карте позиций доноров и акцепторов водородной связи, определяет нахождение сайтов «связанной» воды — мест, где молекулы растворителя задерживаются особенно долго.
Следует также добавить, что форма поверхности и ее свойства меняются при изменении конформации молекулярной системы, например, за счет тепловых колебаний атомов или межмолекулярных взаимодействий. То есть поверхность молекулы — это ее своеобразный динамический «портрет», наблюдать за «гримасами» которого очень интересно и информативно. В частности, собрав большую коллекцию таких портретов (например, в результате расчета молекулярной динамики), можно воссоздать усредненную карту поверхности, а также выявить наиболее статичные и подвижные области на ней. Это позволяет добавить к молекулярному портрету еще и временную компоненту — наглядно представить, насколько гибкими или жесткими могут быть в данных условиях отдельные участки молекулы.
Одним из самых практически важных применений концепции молекулярных поверхностей в современной компьютерной биологии является докинг — алгоритм предсказания свободной энергии взаимодействия двух молекул и возможной пространственной структуры комплекса, которую они образуют, связавшись друг с другом. С позиций молекулярной биологии это позволяет реконструировать часть «эстафеты» распознавания и передачи сигнала; для практики же наиболее важна сфера рационального дизайна лекарственных и биологически активных молекул [12], специфически взаимодействующих с выбранными мишенями и корректирующих работу того или иного молекулярного пути.
К сожалению, наука пока не достигла тех высот, чтобы докинг безошибочно решал возложенные на него задачи, и на практике рассчитывать на легкое и правильное моделирование структуры комплекса двух молекул, а тем более адекватного предсказания значений свободной энергии их связывания не приходится. Осложнено это сразу несколькими довольно трудноразрешимыми обстоятельствами — проблемой сэмплирования (т.е. исследования конформационного пространства системы), проблемой усреднения и проблемой силовых полей, — но мы здесь не будем на этом останавливаться и основное внимание уделим молекулярным поверхностям как таковым.
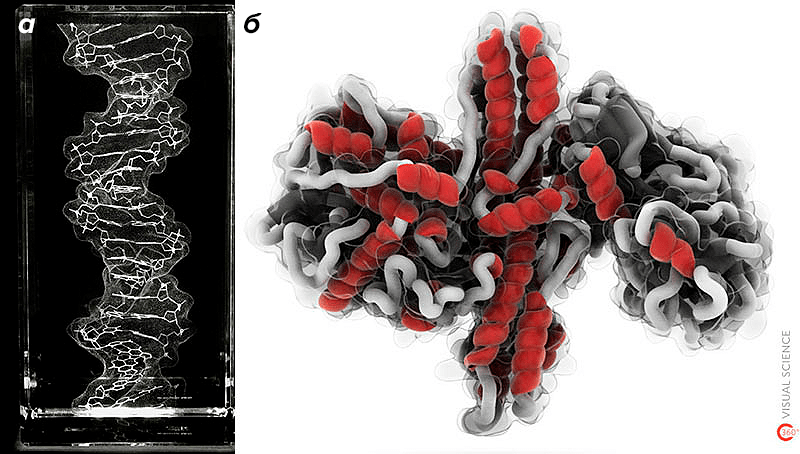
Рисунок 2. Поверхности в визуализации молекул. а — Объемная картина ДНК, выгравированная лазером в стеклянном блоке. б — Модель ботулотоксина, в которой элементы вторичной структуры белка заключены внутрь «стеклянной» молекулярной поверхности.
сайт bathsheba.com и VisualScience
Ну и, наконец, молекулярные поверхности очень красивы: каждая из них представляет собой практически готовый художественный объект, а после минимальной обработки почти любая может стать шедевром (рис. 2).
Будь проще, и люди к тебе потянутся
Выше уже было сказано, что представление о молекуле как о наборе твердых сфер, ну или даже как о более гладкой и динамической поверхности, доступной растворителю — в известной степени упрощение. Молекула является квантово-механическим объектом, и редукция ее описания от многоэтажных гамильтонианов до простой геометрии является несомненным и намеренным упрощением. На аналогичном упрощении, кстати, стоит вся область молекулярного моделирования, базирующаяся на эмпирических силовых полях: из практических соображений корректная, но неподъемная квантовая механика заменяется на «простую» ньютоновскую физику, тем не менее способную достаточно адекватно описать динамические свойства биологических полимеров (хоть и принципиально оставляя «за бортом» такие важные моменты, как химические превращения или спектроскопические эффекты). Подробнее о философии эмпирических силовых полей можно прочесть в статье «Молекулярная динамика биомолекул. Часть I. История полувековой давности» [13].
Однако и молекулярная поверхность сама по себе является достаточно сложным объектом как чисто геометрически, так и с позиций вычислительных алгоритмов: компьютерные файлы с рассчитанными поверхностями и значениями различных физико-химических параметров в них могут быть очень громоздкими, особенно в случае молекул с большой молекулярной массой и при выборе высокой плотности точек на поверхности. В этой связи можно пойти в упрощениях еще дальше.
В случае, когда поверхность молекулы без существенных потерь можно приблизить какой-либо простой геометрической формой — например, плоскостью, цилиндром или сферой, — работа с поверхностями может стать существенно проще и продуктивнее. Вместо трехмерного объекта сложной формы анализ будет сводиться к (квази)двумерному случаю, данные в котором можно представить в регулярной форме (например, в виде плоской, цилиндрической или сферической сетки). Такое упрощение представления, хотя вносит определенные искажения в исходные данные, позволяет сделать анализ более простым и, главное, однозначным: в этом случае он будет сводиться к сравнению однотипных массивов данных.
Рассмотрим три примера того, как расчеты с молекулярными поверхностями позволяют извлечь из компьютерного моделирования биологическую информацию. Эти исследования были проведены в Лаборатории моделирования биомолекулярных систем Института биоогранической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова Российской академии наук.
Поверхность как плоскость: «ахиллесова пята» бактериальной мембраны
Мембрана является принципиально важным компонентом любой живой клетки; фактически, возникновение биомембраны является историей зарождения жизни на Земле в ее современной форме [14–16]. Строение мембран весьма консервативно и имеет свои отличительные черты в каждом из трех доменов жизни. Так, мембрана бактерий отличается от мембраны эукариот отрицательным зарядом (мембраны последних в целом электронейтральны), а также наличием особой липидной молекулы, имеющей длинный гидрофобный изопреноидный «хвост» и гидрофобную «голову» пептидогликановой природы, — липида-II [17]. Он служит «челночным переносчиком» этого пептидогликанового фрагмента, являющегося строительным блоком клеточной стенки, окружающей бактериальную клетку подобно авоське. Клеточная стенка для бактерий жизненно важна, а, значит, и липид-II является строго необходимым компонентом.
Эта уникальная молекула встречается только в бактериальной мембране, и, поскольку это не биополимер, последовательность которых легко мутирует с участием генетических механизмов, обладает консервативной химической структурой. Именно это обстоятельство определило, что на данную молекулу направлены атаки множества природных антибиотиков, специфически распознающих липид-II в бактериальной мембране и имеющих бактериостатическое и бактерицидное действие.
Оставив за рамками этой статьи общебиологическое и медицинское значение антибиотиков, действующих через распознавание липида-II, сосредоточимся непосредственно на самом процессе распознавания. Когда удалось установить пространственную структуру комплекса липида-II с одним из узнающих его антибиотиков — низином [18], оказалось, что главным структурным фрагментом, который «выдает» липид-II и делает его «ахиллесовой пятой» мембраны бактерий, является пирофосфат — химическая группировка, не встречающаяся в других окружающих липидах.
Однако высокоточное распознавание антибиотиком липида-II объяснить очень непросто: на достаточно большой (по сравнению с размером молекулы, конечно) поверхности мембраны бактерии расположено очень небольшое число (≈2000) молекул липида-II, а действующие концентрации антибиотика крайне малы. Каким образом в этих условиях происходит первичная «встреча» двух молекул?
В результате компьютерного анализа поверхности бактериальной мембраны в окрестностях липида-II выяснилось, что последний, в силу высокой гибкости своего длинного «хвоста», вносит существенные изменения в структуру окружающих его фосфолипидов и в распределение гидрофобных свойств на поверхности мембраны. Это позволили выяснить расчеты молекулярной динамики фрагмента бактериальной мембраны («контролем» выступал равный по размеру фрагмент мембраны эукариот): на проекционных «картах», изображающих динамическое распределение гидрофобности, липид-II оказывается в центре гидрофобного «атолла» достаточно большого размера и характерного времени жизни (рис. 3). Существование этого амфифильного паттерна (к слову сказать, отсутствующего в мембране эукариот даже в присутствии липида-II), видимо, является уникальной особенностью, привносимой на поверхность мембраны бактерий длинной и гибкой молекулой липида-II. Исследование опубликовано в журнале Scientific Reports [19].
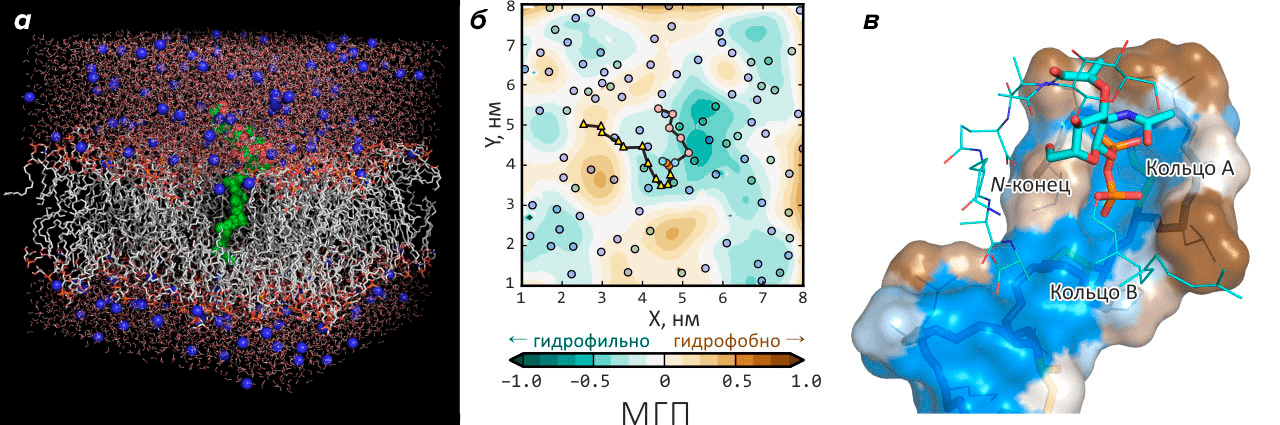
Рисунок 3. Липид-II — «ахиллесова пята» мембраны бактерий. а — Липид-II в бактериальной мембране (компьютерная модель). Серым показаны хвосты липидов, красно-оранжевым — головки, зеленым — липид-II, синим — ионы натрия в растворителе (воде). б — Липид-II в бактериальной мембране образует амфифильный «атолл». Карта молекулярного гидрофобного потенциала (МГП), показывающая, что в мембране в присутствии гибкой молекулы липида-II возникает долгоживущий амфифильный паттерн, напоминающий океанский атолл: подковообразная гидрофобная область + гидрофильная «лагуна» в центре. Кружками изображено положение молекул фосфолипидов. Различные части липида-II показаны цветными геометрическими фигурами, которые соединены между собой линией. в — Возможный механизм распознавания антибиотиком низином молекулы липида-II в мембране. «Пирофосфатная клетка» — структура, возникающая, когда антибиотик низин «вцепляется» в липид-II. Гидрофобная поверхность молекулы низина показана коричневым, а гидрофильная — голубым цветом. «Скелет» низиновой молекулы показан палочками внутри поверхности. Палочками снаружи поверхности показан фрагмент молекулы липида-II. Видно, что пространственные гидрофобные свойства низина повторяют таковые для «атолла» (см. карту), образующегося на бактериальной мембране вокруг молекулы липида-II: в середине находится гидрофильная, а по краям — гидрофобная области. Такое соответствие позволяет объяснить, как антибиотикам удается обнаружить столь редко встречающуюся молекулу липида-II среди множества других, казалось бы, на нее похожих.
Сделанные расчеты позволяют предположить, что распознавание антибиотиком своей мембранной мишени происходит в два этапа. Второй, более специфический, осуществляется захватом пирофосфатной группы липида-II в «клетку» водородных связей, образуемых макроциклами в структуре антибиотика (рис. 3в). Однако первый этап, возможно, заключается в распознавании антибиотиком амфифильного паттерна, «выдающего» липид-II, скрывающийся где-то в мембране. Возможно, учет этого гипотетического механизма позволит сказать новое слово в создании нового поколения мембранных антибиотиков, безопасных для человека и свободных от бремени резистентности, нависшего над большинством «классических» антибиотиков. Подробнее об этой работе можно прочесть в научно-популярной статье «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы» [20].
Поверхность как цилиндр: трансмембранная передача сигнала рецепторами факторов роста
Рецепторные тирозинкиназы (РТК) — важный класс мембранных рецепторов, воспринимающих многочисленные факторы роста, цитокины и гормоны (в том числе, инсулин и гормон роста). В геноме человека закодировано 58 таких рецепторов, подразделяемых на 20 семейств . Нарушение работы многих этих белков приводит к развитию онкологических процессов, поэтому изучение их биологии является не только важной фундаментальной проблемой, но и актуальным вопросом молекулярной медицины.
Чуть подробнее о классификации РТК можно прочесть в статье, посвященной открытию рецептора щелочного pH, также относящегося к этому семейству: «Рецептор „нетрадиционной ориентации“» [21].
Особенность строения этих рецепторов заключается в том, что они состоят из большого внеклеточного домена, распознающего лиганд, и большого внутриклеточного домена, где осуществляется фосфорилирование и который передает сигнал на внутриклеточные биохимические каскады. Трансмембранный (ТМ) же домен, соединяющий их и пронизывающий липидный бислой мембраны клетки, состоит из единственной α-спирали. Механизм активации этих рецепторов при связывании лиганда (например, фактора роста фибробластов) заключается в димеризации двух молекул рецептора, причем происходит это именно в ТМ-домене (см. рис. 4а). Знание механизма димеризации РТК в мембране позволит лучше разобраться в природе онкогенных мутаций и, возможно, ослабить их влияние, создав с помощью рационального компьютерного дизайна молекулы, корректирующие нарушение димеризации и исправляющие повышенную активность РТК, часто приводящую к раковому перерождению клеток.

Рисунок 4. Предсказание механизма димеризации ТМ-сегментов рецепторных тирозинкиназ. а — Схема строения и димеризации РТК: показаны рецепторный, трансмембранный и киназный домены. б — Схема работы алгоритма PREDDIMER на примере сегмента эфринового рецептора (участвует в эмбриогенезе). 1. Конструирование идеальной α-спирали на основе аминокислотной последовательности ТМ-домена. 2. Расчет гидрофобных / гидрофильных свойств на молекулярной поверхности. 3. Построение двумерных цилиндрических карт-разверток поверхности (гидрофобность + рельеф). 4. Поиск оптимального совмещения двух карт, соответствующего наилучшему соответствию двух поверхностей. 5. Реконструкция структуры спирального димера.
Несмотря на то, что в последние годы достигнут существенный прогресс в установлении с помощью экспериментов пространственной структуры димеров ТМ-фрагментов РТК, методы компьютерного моделирования также играют важную роль в решении этой биологической задачи. В ряде случаев они позволяют решить проблему предсказания возможной структуры такого димера со значительно меньшими затратами, а, главное, предложить несколько вероятных вариантов упаковки, каждый из которых может реализоваться при изменении условий, в которых находится рецептор (т.е., создать ансамбль возможных конформаций).
В Лаборатории моделирования биомолекулярных систем подошли к решению этой задачи не «в лоб» (поместив два ТМ-фрагмента рецептора в мембрану и запустив длительный расчет молекулярной динамики), а приняв во внимание во многом геометрическую суть задачи, где нужно установить возможный мотив скрещивания двух примерно цилиндрических тел. При этом учитывают не только пространственную комплементарность ТМ-спиралей, но и соответствие их физико-химических свойств (гидрофобности), а все вычисления производят на уровне цилиндрических карт-разверток, сравнивать которые намного проще, нежели трехмерные тела сложной формы (рис. 4б) [22]. Данный алгоритм был реализован в веб-сервере PREDDIMER, размещенном на сайте Лаборатории, анонс которого опубликован в журнале Bioinformatics [23]. Сервер позволяет реконструировать набор димерных структур для заданных ТМ-последовательностей, а также визуализировать полученные конформации в виде 3D-моделей и 2D-карт поверхностной гидрофобности α-спиралей с отмеченной областью димеризации.
Тестирование сервера на 11 ТМ-последовательностях, для которых ранее были получены 3D-конформации с помощью метода ЯМР-спектроскопии, показывает, что алгоритм делает предсказания с довольно высокой точностью. Подробнее об этом алгоритме можно прочесть в пресс-релизе на сайте Института биоорганичесой химии «In silico-предсказание трансмембранных димеров для битопных белков» [24].
Поверхность как сфера: «белковая топография» объясняет селективность α-нейротоксинов из яда скорпионов
Одним из излюбленных объектов изучения в Институте биоорганической химии являются природные яды. В них часто содержатся нейротоксины, мишенью которых служат ионные каналы и рецепторы в мембранах клеток нервной системы или мышц. Изучение этих молекул позволяет лучше понять работу нейрорецепторов и научиться ее регулировать — как для задач фундаментальной нейробиологии, так и для медицинских приложений, заключающихся в коррекции нарушений работы нервной системы.
Например, в яде скорпионов обнаружены так называемые α-нейротоксины, воздействующие на насекомых или млекопитающих: первые можно назвать инсектотоксинами, а вторые — млекотоксинами. «Биомолекула» уже публиковала историю про изучение этих молекул (см. «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [25]), однако в тот раз речь шла об общебиологическом значении изучения природных ядов в комплексе с мишенями их воздействия, а сейчас мы остановимся на компьютером алгоритме сравнения структуры различных α-токсинов, который позволил выявить заметные различия между группами млеко- и инсектотоксинов и объяснить причину их специфического действия на молекулярном уровне.
Перед исследователями стояла задача: детально изучив атомное строение молекул и свойства двух групп α-токсинов — действующих на ионные каналы млекопитающих или насекомых — выявить значимые различия в структуре, определяющие их селективность. Для этой цели был предложен алгоритм, названный «белковой топографией» [26] из-за отчетливого сходства с картированием земной поверхности: в связи с почти сферической формой нейропептидов, их форму было решено приблизить сферой (рис. 5а). Учет молекулярной динамики, расчет молекулярной поверхности с распределением на ней гидрофобных свойств, приближение формы молекулы сферой и построение сферических проекций позволили провести групповой анализ. Суть подхода — поиск на двумерных картах токсинов общих закономерностей и специфических паттернов, сопоставление этих данных с известной величиной активности и избирательностью действия таких белков. В итоге в молекулах α-токсинов удалось выявить функциональные «модули», которые отличаются по своим свойствам и, предположительно, отвечают за специфическое действие токсинов из разных групп (рис. 5б). Гипотеза была проверена путем синтеза токсина с заранее неизвестной специфичностью и измерения его биологической активности. Результаты эксперимента подтвердили сделанные предсказания; исследование опубликовано в Journal of Biological Chemistry [27], о чем рассказывает пресс-релиз на сайте Института биоорганической химии [28].
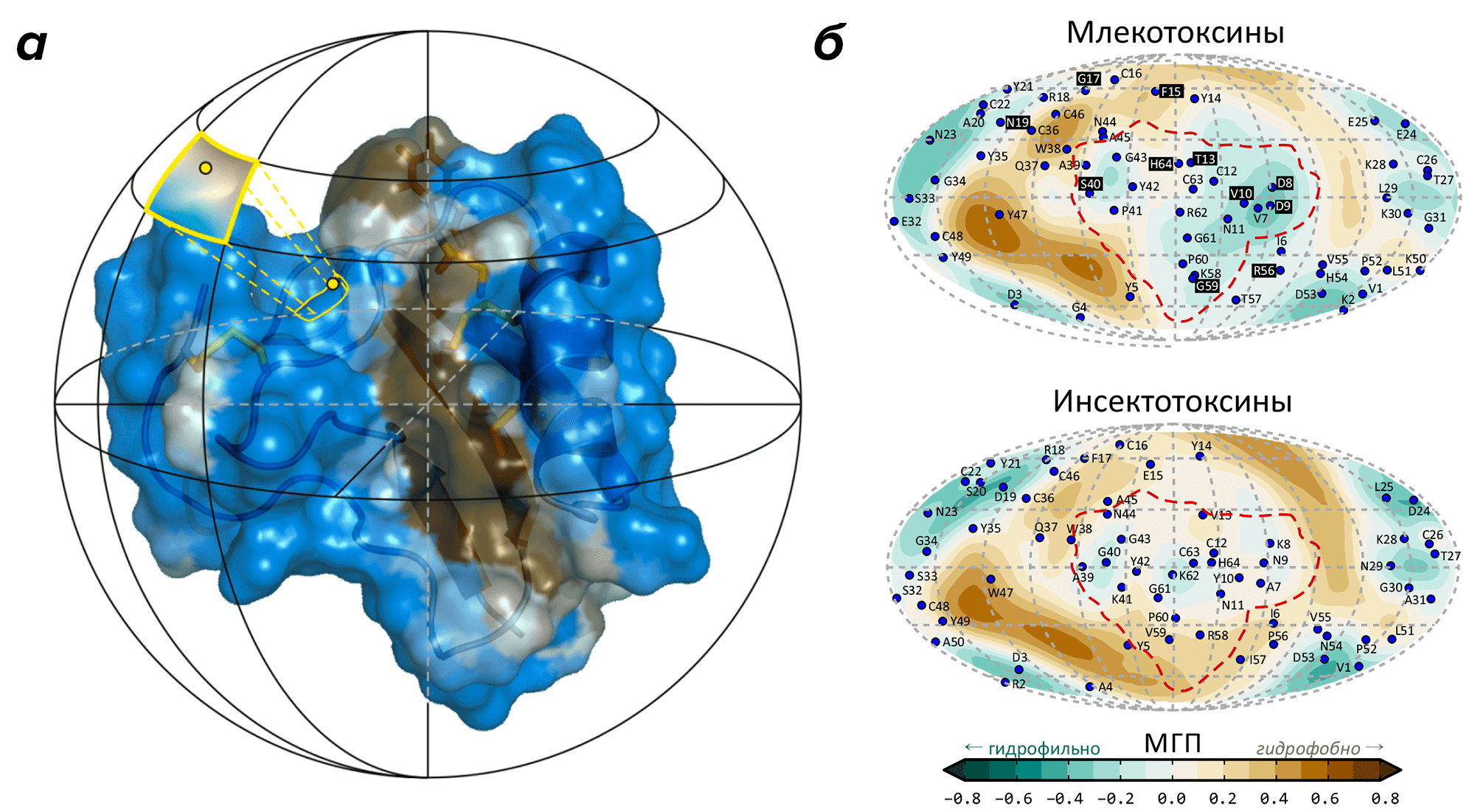
Рисунок 5. Метод белковой топографии подчеркивает различия модулей специфичности млеко- и инсектотоксинов. а — Белковая топография основана на сферическом картировании свойств, распределенных на поверхности сферы (таких как молекулярный гидрофобный потенциал, МГП [15]). Одним из результатов является карта-развертка, позволяющая «разглядеть» молекулу целиком со всех сторон. б — Карты гидрофобных / гидрофильных свойств для млеко- (сверху) и инсектотоксинов (снизу). Наибольшее различие карт наблюдается в районе модуля специфичности, очерченного красным контуром. Синие точки соответствуют проекциям аминокислотных остатков, а на карте млекотоксинов черная подложка в подписи указывает на повышенную эволюционную вариабельность остатков.
[27] (панель б)
Применение алгоритма белковой топографии, основанного на работе с молекулярными поверхностями и расчетах молекулярной динамики, открывает новые перспективы в поиске структурно-функциональных зависимостей в биоактивных пептидах и небольших белках. Знание этих зависимостей делает возможным применение биоинженерного подхода к дизайну специфических аналогов природных нейропептидов и нейромодуляторов и открывает новые возможности для медицины и сельского хозяйства.
Перспектива на поверхности
Рассмотренные три примера показывают, что сравнительно несложные манипуляции с молекулярными поверхностями позволяют извлекать из компьютерных расчетов биологических молекул по-настоящему уникальную информацию. Помимо наглядного визуального представления, это дает возможность напрямую сравнивать характеристики поверхностей разных молекул, количественно оценивать изменения поверхностных свойств, происходящие в результате связывания молекул или конформационных переходов и т.д. Применение вычислительных технологий, основанных на детальном рассмотрении свойств молекулярных поверхностей, позволяет выявить детали, недоступные традиционным структурным методам, открывает новые пути в таких практически важных областях как создание новых антибиотиков, лечение раковых и неврологических заболеваний, получение безопасных инсектицидов. Конечно, этот подход не претендует на абсолютную физическую корректность, поскольку не моделирует статистических ансамблей и не рассчитывает термодинамических констант, но зато он позволяет по-новому взглянуть на хорошо зарекомендовавшую себя концепцию молекулярных поверхностей и раскрыть смысл, который они несут для молекулярной биологии.
Есть все основания утверждать, что такой «механистический» подход к квантовым объектам — молекулам — будет продолжать приносить свои плоды, потому что многие вещи, хотя и лежат на поверхности, но не заметны, пока не взглянешь на них под правильным углом.
Сокращенная версия этой статьи опубликована в «Природе» [29].
Литература
- Зрительный родопсин — рецептор, реагирующий на свет;
- Формирование мембранного потенциала покоя;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Рецептор медиатора настроения;
- Ян Дидерик Ван-дер-Ваальс. N-t.ru;
- На заре молекулярной графики;
- B. Lee, F.M. Richards. (1971). The interpretation of protein structures: Estimation of static accessibility. Journal of Molecular Biology. 55, 379-IN4;
- A. Shrake, J.A. Rupley. (1973). Environment and exposure to solvent of protein atoms. Lysozyme and insulin. Journal of Molecular Biology. 79, 351-371;
- M. Connolly. (1983). Solvent-accessible surfaces of proteins and nucleic acids. Science. 221, 709-713;
- Физическая водобоязнь;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- К вопросу о происхождении жизни;
- Липидный фундамент жизни;
- Появление и эволюция клеточной мембраны;
- Eefjan Breukink, Ben de Kruijff. (2006). Lipid II as a target for antibiotics. Nat Rev Drug Discov. 5, 321-323;
- Shang-Te D Hsu, Eefjan Breukink, Eugene Tischenko, Mandy A G Lutters, Ben de Kruijff, et. al.. (2004). The nisin–lipid II complex reveals a pyrophosphate cage that provides a blueprint for novel antibiotics. Nat Struct Mol Biol. 11, 963-967;
- Anton Chugunov, Darya Pyrkova, Dmitry Nolde, Anton Polyansky, Vladimir Pentkovsky, Roman Efremov. (2013). Lipid-II forms potential “landing terrain” for lantibiotics in simulated bacterial membrane. Sci Rep. 3;
- Элементы: «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы»;
- Рецептор «нетрадиционной ориентации»;
- Anton A. Polyansky, Pavel E. Volynsky, Roman G. Efremov. (2012). Multistate Organization of Transmembrane Helical Protein Dimers Governed by the Host Membrane. J. Am. Chem. Soc.. 134, 14390-14400;
- Anton A. Polyansky, Anton O. Chugunov, Pavel E. Volynsky, Nikolay A. Krylov, Dmitry E. Nolde, Roman G. Efremov. (2014). PREDDIMER: a web server for prediction of transmembrane helical dimers. Bioinformatics. 30, 889-890;
- Чугунов А. (2012). In silico-предсказание трансмембранных димеров для битопных белков. сайт ИБХ РАН;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Anna D. Koromyslova, Anton O. Chugunov, Roman G. Efremov. (2014). Deciphering Fine Molecular Details of Proteins’ Structure and Function with a Protein Surface Topography (PST) Method. J. Chem. Inf. Model.. 54, 1189-1199;
- Anton O. Chugunov, Anna D. Koromyslova, Antonina A. Berkut, Steve Peigneur, Jan Tytgat, et. al.. (2013). Modular Organization of α-Toxins from Scorpion Venom Mirrors Domain Structure of Their Targets, Sodium Channels. J. Biol. Chem.. 288, 19014-19027;
- Чугунов А. (2012). «Белковая топография» объясняет селективное действие α-нейротоксинов из яда скорпионов. сайт ИБХ РАН;
- Чугунов А.О. и Ефремов Р.Г. (2014). Поверхность молекулы — источник биологической информации. «Природа». 10, 3–10.