Население кожи: как микробиом влияет на ее общее состояние и при чем тут генетика?
21 декабря 2021
Население кожи: как микробиом влияет на ее общее состояние и при чем тут генетика?
- 7536
- 2
- 10
Рисунок в полном размере.
рисунок авторов статьи
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Акне, или в просторечии прыщи, по приблизительным оценкам есть у 70% людей и почти 85% подростков. Акне — сложное многофакторное заболевание, и нам стало интересно, какую роль в нем играют микроорганизмы, обитающие на коже. Известно, что у еще не родившегося ребенка кожа стерильна, но вскоре после рождения она колонизируется разнообразными микроорганизмами окружающей среды. Они и формируют микробиом наших внешних покровов. Мы решили подробно рассмотреть, ладят ли бактерии и кожа, какие отношения формируются между бактериями — и как на это влияет генетика и среда.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — некоммерческая школа-пансион «Летово».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
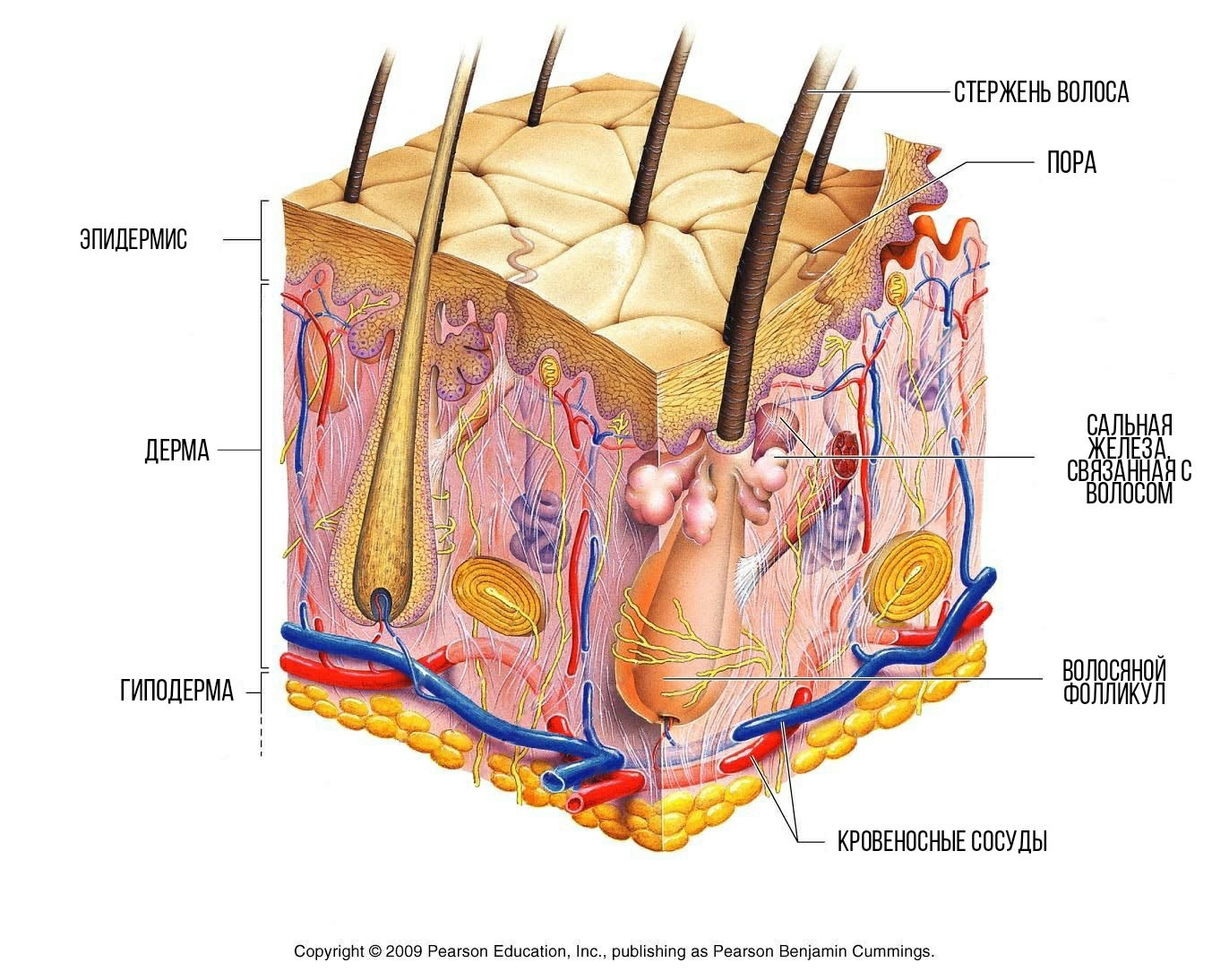
Строение кожи
Кожа человека состоит из трех слоев (рис. 1).
Гиподерма, или подкожно-жировая клетчатка, — самый глубокий слой. Это главное хранилище жира в организме.
Дерма (или собственно кожа) располагается между эпидермисом и гиподермой. Она представляет собой соединительную ткань с многочисленными волокнами коллагена и эластина. Во многом определяет состояние кожи — увлажненность и упругость.
Дерма контактирует с базальным слоем, который дает начало верхнему слою — эпидермису. Основные клетки эпидермиса — кератиноциты. Они по мере своего роста двигаются от базальной мембраны вверх, выделяя липиды. Выделяют несколько слоев кератиноцитов — в зависимости от возраста и состояния клеток, которые сменяются примерно за месяц [1].
Мы еще не упомянули о производных эпидермиса. Сальные, потовые, серные и молочные железы, волосы имеют с ним одно происхождение. Сальные железы выделяют кожное сало (себум), которым с удовольствием питаются микроорганизмы.
Кожа — отдельная экологическая ниша, в которой формируются сложные микробные сообщества. Совокупность населяющих кожу микроорганизмов, или микробиом, — динамичная система со своими закономерностями. Тут, как и в любой экосистеме, между организмами существуют разные связи. А также микроорганизмы взаимодействуют со средой, которая во многом диктует условия их существования [2].
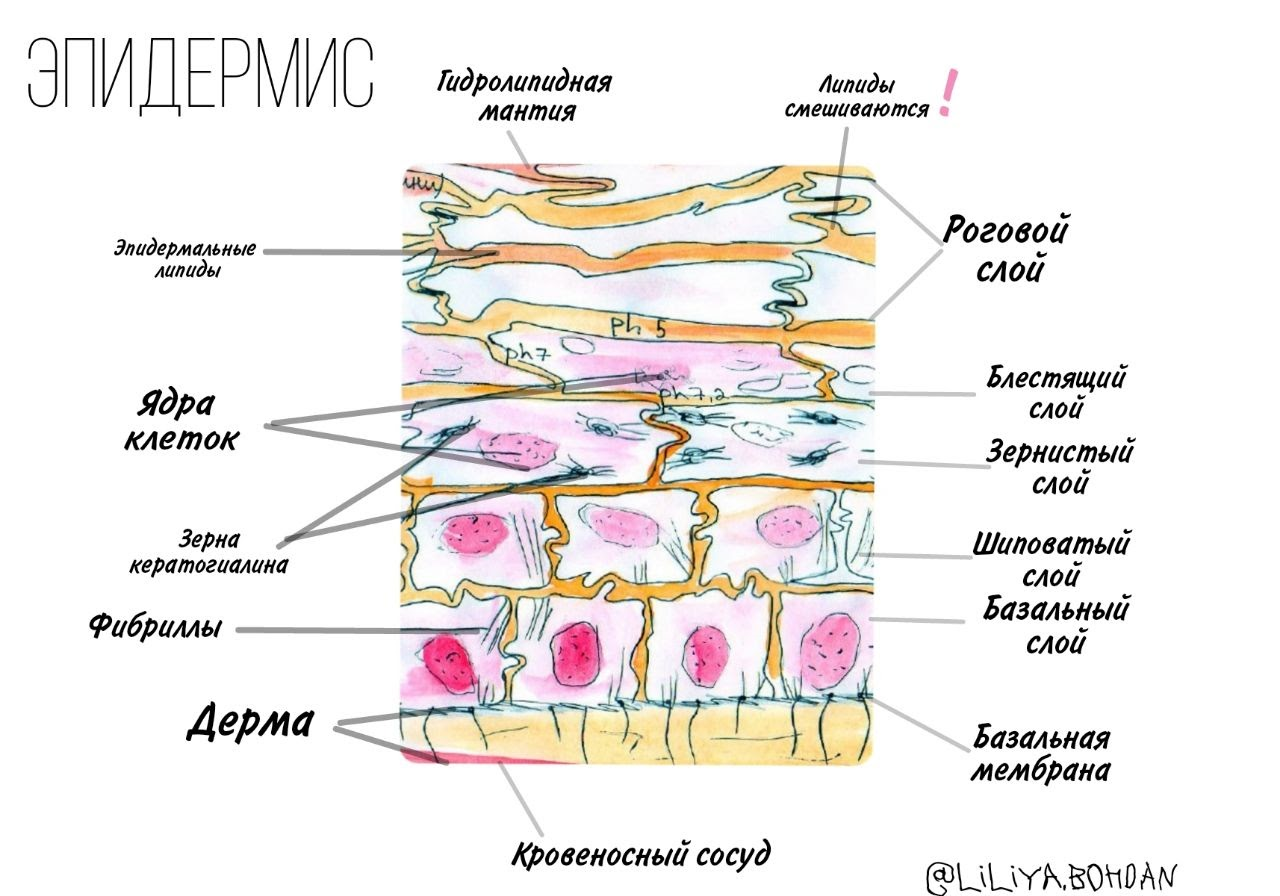
Теперь поговорим про кожный барьер. Это система из разнообразных липидов и кератиноцитов, защищающая кожу от обезвоживания и механических повреждений. Но в рамках статьи нас интересует, что кожный барьер нужен для предотвращения воздействия бактерий и патогенов на жизнедеятельность клеток кожи [3].
Кожный барьер принято разделять на две составляющие — гидролипидную мантию и липидо-эпидермальный барьер (рис. 2). Главная функциональная особенность гидролипидной мантии, состоящей в основном из выделений сальных и потовых желез, — кислая среда, pH примерно от 4,7 до 5,7. Благодаря ей перестают размножаться и погибают вредоносные бактерии. Липидо-эпидермальный барьер представляет из себя множество мертвых клеток, скрепленных между собой липидами, которые они по мере взросления постепенно выделяли во внешнюю среду. Именно он защищает кожу от обезвоживания, снижая трансэпидермальную потерю влаги (ТЭПВ), а также является вторым звеном защиты после гидролипидной мантии от проникновения в кожу бактерий и аллергенов.
Однако не стоит считать, что кожный барьер полностью защищает нас от патогенов. При исследованиях все же было обнаружено присутствие бактерий в дерме и гиподерме [4].
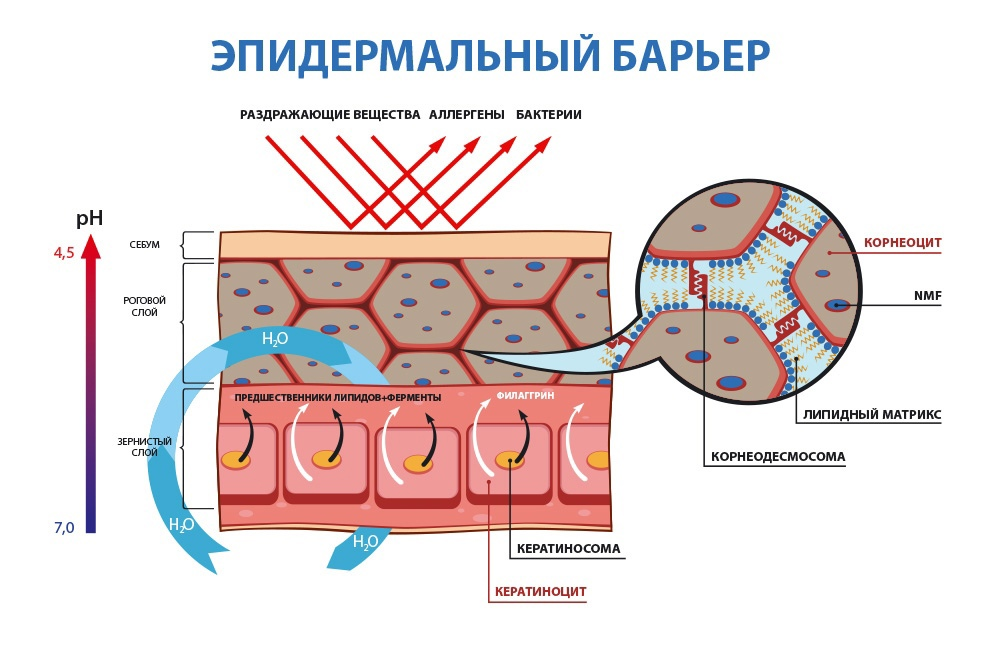
Рисунок 2. Кожный барьер не защищает кожу от проникновения бактерий полностью. Кератиноциты по мере роста выделяют многочисленные пластины, содержащие липиды (кератиносомы). Благодаря межклеточным связкам — корнеодесмосомам — и липидам, корнеоциты, то есть мертвые клетки рогового слоя эпидермиса, скрепляются между собой, формируя цельную структуру, и увлажняются NMF — натуральным увлажняющим фактором. Это молекулы, которые помогают удержать больше воды в эпидермисе: свободные аминокислоты, мочевина, лактаты и др.
сайт Cosmetomed
Патогенез акне
Основной механизм возникновения акне — увеличение выработки кожного сала и количества дифференцирующихся кератиноцитов под действием андрогенов. В результате закупориваются поры, возникает анаэробная среда, и агрессивные штаммы P. acnes начинают активно размножаться. Это рано или поздно замечает наш организм, запускаются сложные воспалительные механизмы, и возникает акне [5].
Но не все так просто: акне, как уже говорилось, многофакторная болезнь, и факторов, которые могут запустить ее, довольно много:
- Генетические особенности. Выделяют несколько наследственных форм акне. Например, связанные с геном АR (андрогенный рецептор). Иногда акне связано не с избытком андрогенов, а с гиперчувствительностью рецепторов андрогенов.
- Нейроэндокринные нарушения.
- Питание.
- Избыток йода и брома, витамина B12 [5].
- Некоторые лекарства и химические вещества (известно около 210).
- Применение антибиотиков широкого спектра действия. (Раньше так могли лечить акне). Они действовали против бактерий, но не против грибов рода Malassezia, выделения которых также раздражают сальные железы [5].
- Курение.
- Стресс [5]. Хотя часто сам факт наличия акне и невозможности избавиться от него являются стрессом.
- Фотоповреждение.
- Неправильно подобранная косметика.
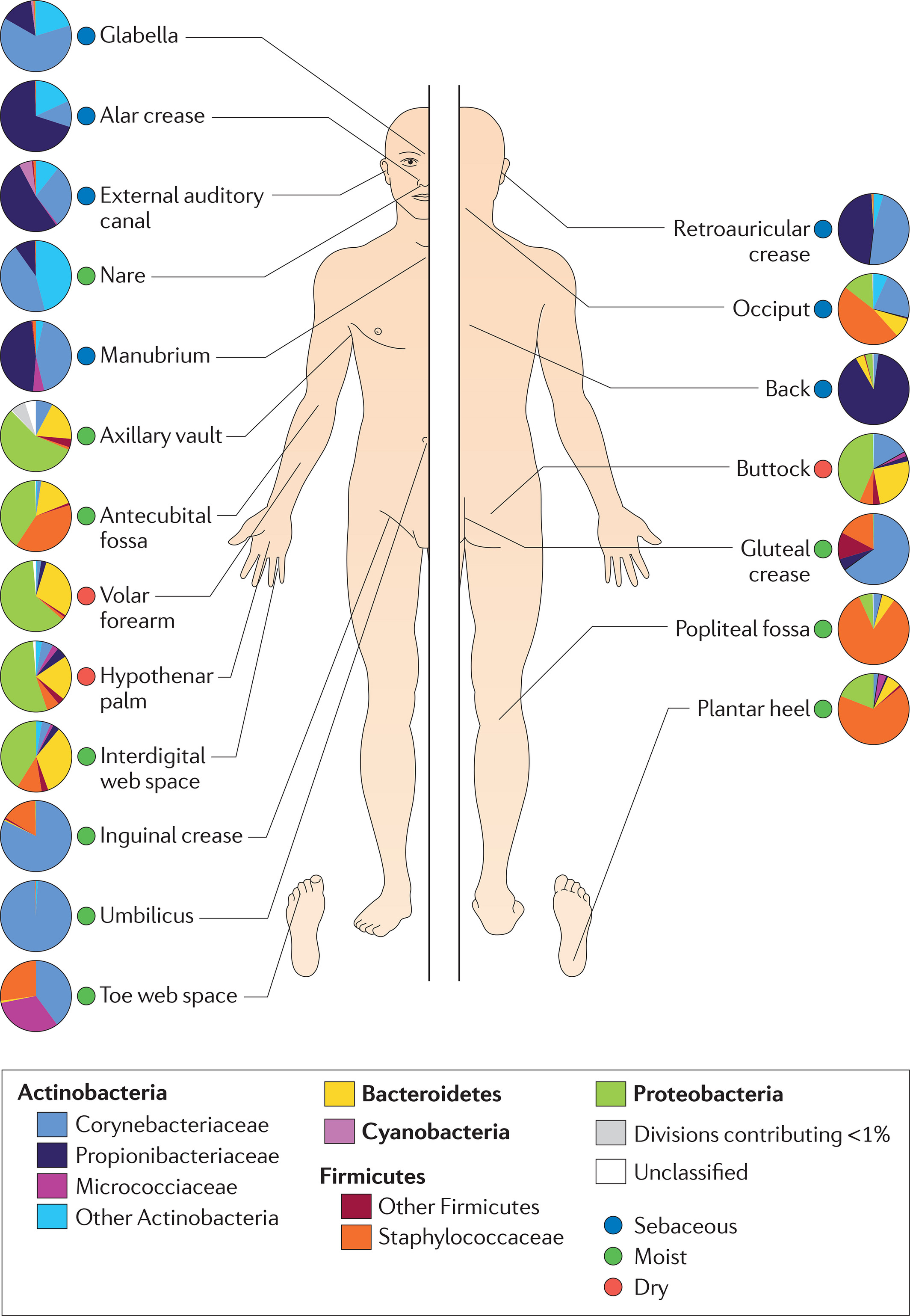
Рисунок 3. Распределение семейств бактерий на коже человека. В таблице внизу под разными цветами указаны названия семейств бактерий; им соответствуют цвета в диаграммах на основной схеме. Рядом с диаграммами — разноцветные точки: синие — зоны с повышенным производством себума, зеленые — влажные, красные — сухие.
Микробиом кожи
Карта. Кто где живет
Давайте рассмотрим наиболее распространенные микроорганизмы и места их обитания на коже. Те из них, кто живет в одном месте на теле, оказывают друг на друга наибольшее влияние.
P. acnes и P. granulosum обнаруживаются в областях, богатых сальными железами. P. acnes преобладает на коже головы, лба, ушей, на спине и крыльях носа. Это основной колонизатор сальных желез.
Влажные области, такие как пупок или подмышечная впадина, в основном содержат виды Staphylococcus и Corynebacteria. Подмышечная область заселена грамположительными бактериями родов Staphylococcus, Micrococcus, Corynebacterium а также некоторыми Propionibacterium (рис. 3) [7].
В более сухих местах обитают преимущественно Staphylococcus, Micrococcus, Corynebacterium, Enhydrobacter и Streptococcus
Возможно, упомянутое нами ранее название P. acnes натолкнуло вас на мысль, что именно эти бактерии и вызывают акне.
Прежде всего следует вспомнить, что акне — это сложное и многофакторное заболевание, которое не может зависеть от одной бактерии. Некоторые исследования даже показывают, что здоровые кожные фолликулы представляют собой среду обитания, допускающую заселение только P. acnes, тогда как у пациентов с акне обнаружили Staphylococcus epidermidis и другие виды. Поэтому роль P. acnes достаточно неоднозначна, и есть даже вероятность, что P. acnes не вызывают акне, а наоборот, защищают от него [8].
Как бактерии приспособились жить на коже
Микробиом кожи формируется под влиянием большого разнообразия переменных: возраст, пигментация кожи, факторы среды (солнечные лучи, косметика, которой мы постоянно пользуемся) [7], [9], [10].
Распределение видов на поверхности мы уже рассмотрели, копнем вглубь. Выявлено, что нижняя часть блестящего слоя эпидермиса (рис. 1) имеет щелочную реакцию, средняя — нейтральную, и уже мертвые клетки — кислую [1]. Таким образом, условия среды зависят не только от места на теле, но и от глубины, на которой бактерии заселяют кожу.
Все организмы стремятся увеличивать свою численность, и бактерии не исключение. Вот часть выработанных ими успешных стратегий:
- Изменчивые белки. Бактерии одного вида отличаются друг от друга, и иммунитет хуже опознает и расправляется с ними.
- Белки, обеспечивающие прикрепление к эпителию. Чем лучше бактерии закрепятся на эпидермисе, тем больше будет этого вида [11].
- Вещества, которые мешают жить конкурентам: антибиотики, SCFAs (короткоцепочечные жирные кислоты), и так далее [12].
- Вещества, которые действует против других штаммов того же вида [13].
Ладят ли бактерии и наш иммунитет?
Бактерии могут активировать различные сигнальные пути в клетках кожи человека (рис. 4).
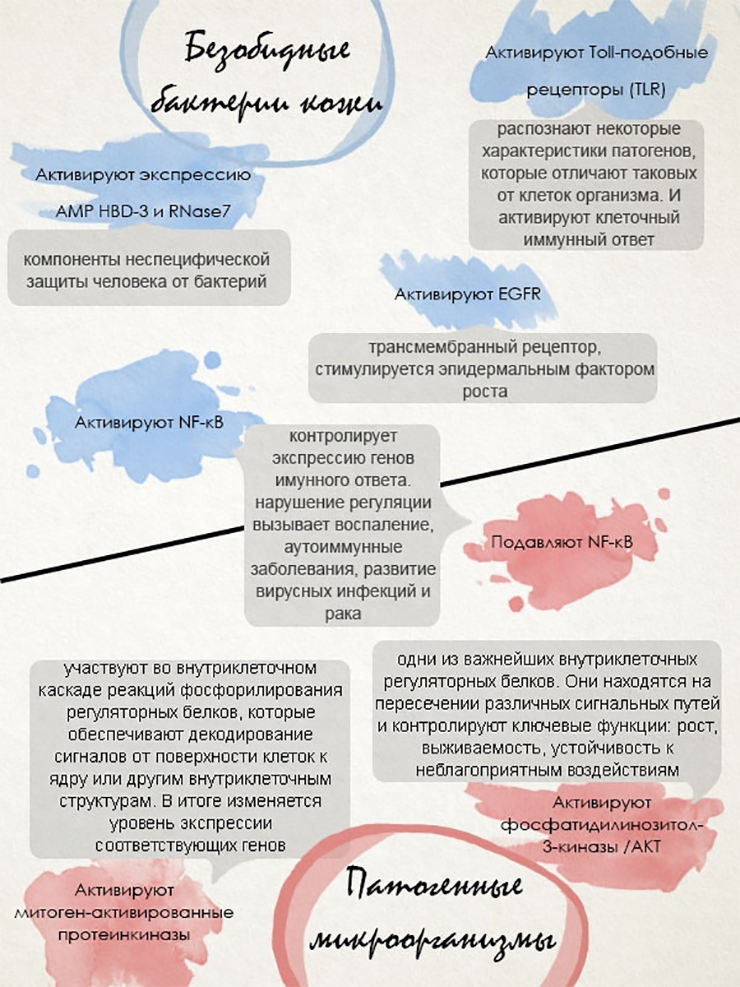
Рисунок 4. Действие микроорганизмов может быть позитивным, негативным или нейтральным. Примером отношений между бактериями и кожей может служить врожденная способность кожи определять микроорганизмы с помощью Toll-подобных рецепторов (TLRs). Другие типы взаимодействий показаны на рисунке: вверху — влияние обычных бактерий кожи, внизу — патогенных. На цветном фоне — описания молекул. Схема довольно условная и реальных взаимодействий гораздо больше. И они сложнее.
авторский рисунок
Бактерии способны влиять на врожденный иммунный ответ кератиноцитов, делая их более или менее реактивными [14].
Связаны ли микробиом и акне?
Мы уже поняли, что на коже обитают различные бактерии, которые могут быть как полезными, так и патогенными. Теперь же следует рассмотреть их связь с акне.
Итак, бактерии и грибы колонизируют кожу потому, что для них это удобная среда обитания, так как в ней есть подходящий источник пищи — например, какой-нибудь вид эпидермальных липидов. И тут мы подходим к крайне интересному моменту. Этот липид выделился на поверхность из клетки под контролем генов. В итоге: что есть истинная причина акне — патогенная бактерия или гены? Влияние генов или среды (т. е. сформировавшегося микробиома)?
Р. acnes — полезна или вредна для здоровья?
Ранее мы уже упоминали P. acnes и обещали разобраться с ней подробнее. В этой части статьи мы поговорим о полезных и вредных чертах, различных взаимодействиях этой бактерии, а также возможности определения ее на себе.
Полезные черты
Р. acnes имеет общие свойства с молочными пропионибактериями, которые считаются безвредными — и даже полезными [12]. Подобные ей организмы обладают множеством положительных свойств: синтез витамина B12, рибофлавина, фолиевой кислоты. P. acnes также способна регулировать число других бактерий, производя SCFAs (короткоцепочечные жирные кислоты). Ферментация глицерина с помощью P. acnes и S. epidermidis может подавлять рост наиболее распространенного патогенного микроорганизма кожи Staphylococcus aureus. Это препятствует колонизации опасной бактерией кожных ран [15].
Условно-патогенные черты
Патогенезом акне называют механизм развития болезни, в котором P. acnes играет значительную роль. Она секретирует ферменты, разрушающие компоненты ткани человека, и может усугублять ряд других заболеваний [16], [17].
Закупоренная сальная железа создает анаэробную среду. Она благоприятна для P. acnes и способствует чрезмерному росту. Но при развитии акне там обнаруживали не только эту бактерию, но и другие микроорганизмы, в том числе S. epidermis. То есть в процесс вовлечена точно не одна P. acnes.
Взаимоотношения бактерий неоднозначны. S. epidermidis расщепляет жирные кислоты до более коротких SCFA. Получается, что она может сдерживать чрезмерный рост P. acnes и косвенно улучшать ситуацию с угрями [18]. Хотя не так давно мы говорили о том, что S. epidermidis и P. acnes вместе «защищают» нас от Staphylococcus aureus (золотистого стафилококка).
Взаимодействие между P. acnes и другими бактериями
P. acnes и родственные ей виды могут продуцировать бактериоцины (вещества, которые вызывают повреждение структур бактериальной клетки). Они обычно действуют против близкородственных видов, но по крайней мере один из них (пропионицин) подавляет даже некоторые грамотрицательные бактерии и грибы. К тому же P. acnes способна производить 2 вида тиопептидных антибиотиков (с высоким содержанием серы). Они сильно угнетают синтез белка у грамположительных бактерий. А некоторые штаммы P. acnes способны подавлять другие штаммы своего же вида! [13]
Бактериоцины и бактериоциноподобные вещества P. acnes могут быть ответственны за успешную конкуренцию с другими микроорганизмами, что объясняет ее доминирующее присутствие в здоровых фолликулах.
Взаимодействие между P. acnes и клетками кожи
Как еще объяснить доминирование P. acnes? У нее выявлено 4 белка, способных вызвать иммунный ответ организма. Некоторые из них изменчивы (DsA1 и DsA2). Получается, что в рамках одного вида бактерии немного отличаются, как бы маскируются. Так P. acnes уклоняется от иммунитета.
Внутри кератиноцитов есть рецепторы TLR9, которые способны улавливать бактериальную ДНК. Когда с ними связывается P. acnes, происходит очень интересная вещь: на бактерию как бы закрывают глаза и она, таким образом, может существовать внутри клетки в течение нескольких недель. После чего все-таки запускается воспаление [19].
Что происходит на здоровой коже и коже с акне?
Посмотрев на белки, можно довольно точно сказать, по какой «программе развития» пошла клетка. Так вот, в сальных железах здоровой кожи много белков, которые участвуют в защите от клеточных стрессов и активных форм кислорода.
Однако сальные железы людей с акне обнаружили белки, которые участвуют в восстановлении тканей. Это показывает, что что-то пошло не так и ткань была повреждена. Идентифицированные чужеродные белки были исключительно из P. acnes. Самые распространенные — факторы CAMP (про них — в следующем разделе), а также белки, обеспечивающие прикрепление бактерий к эпителию.
Казалось бы, все вполне ясно: P. acnes в данном случае ведет себя как агрессор. Но не тут-то было! Оказывается, эти же белки P. acnes обнаруживают и на здоровой коже. Это еще раз подтверждает неоднозначную роль P. acnes в развитии акне [11].
Метаболическая активность P. acnes
Участие в воспалении
Ряд исследований in vitro показал, что определенные штаммы P. acnes умеют запускать воспаление в клетках кожи через разные механизмы [19-22], в то время как другие штаммы связаны со здоровой кожей [23], [24]. Анализ генома P. acnes выявил предполагаемые различия между ними, которые помогут объяснить ее двоякую роль [25].
Понятно, что есть и белки, которые кодируются в геномах всех P. acnes, например, факторы CAMP (Christie-Atkins-Munch-Peterson) (всего их 5). Доказано, что ингибирование CAMP2 ослабляет воспаление на модели уха мыши. Их точная роль in vivo не выяснена, но, видимо, они достаточно важны, раз сохраняются у всех P. acnes.
Выводы
Разнообразие микроорганизмов на нашем теле огромно. Можно представить кожу как гигантскую страну, население которой постоянно меняется под влиянием внешнего мира, иммунной системы и взаимодействия с соседними странами. То есть с микробиомом поверхности глаз, кишечника, слизистых. Совокупность геномов и метаболических путей некоторых микробных симбионтов может работать во благо нашего организма [26], ведь некоторые бактерии способны осуществлять полезные для человека реакции. Таких представителей микробиома можно оценивать как еще один орган человека [27].
Изменения внутри нашего организма корректируют условия жизни бактерий. Так, при повышенной секреции кожного сала происходят изменения его качественного состава.
Микробиом — сложная динамическая система. Если мы более полно охарактеризуем взаимоотношения внутри него, это может дать дополнительный взгляд на современную эволюцию человека. Поможет оценить, влияют ли — и как — развивающиеся технологии, изменения в образе жизни на здоровье и предрасположенность к заболеваниям. В частности, к акне.
Сейчас точно известно, что количественные и качественные изменения микробиома осложняют течение акне. Считается, что выделения P. acnes содержат несколько белков, которые могут провоцировать воспаление. Однако, поскольку акне — многофакторное заболевание, стоит принимать во внимание другие причины, такие как уход, генетика, стресс, питание и др. К тому же, P. acnes имеет ряд полезных черт: «защищает» нас от S. aureus, выступая в роли пробиотика. Так что некорректно винить во всем ее.
Стали появляться исследования, показывающие, что введение препаратов нормальной флоры улучшает состояние кожи (Aspergillus, Bifida Ferment Lysate, Lactobacillus/Rye Flour Ferment Filtrate). Они показывают, что одним из перспективных направлений в лечении акне [28] (и не только) могут стать про- и пребиотики, препараты на их основе.
Из-за сложных систем взаимодействия микро- и макроорганизмов результат не всегда предсказуем. Изучение функции микробиома в норме и патологии — актуальная задача медицины. И еще предстоит ответить на много вопросов.
Благодарим за прочтение статьи! С удовольствием ответим на ваши вопросы в комментариях.
Литература
- Кошевенко Ю.Н. «Кожа человека. Структура, физиология, предназначение функциональных элементов кожного органа человека». М.: «Адвансед Солюшнз», 2016. — 360 с.;
- K. Bhate, H.C. Williams. (2013). Epidemiology of acne vulgaris. British Journal of Dermatology. 168, 474-485;
- Patrick Duckney, Heng Kuan Wong, José Serrano, Diaraf Yaradou, Thierry Oddos, Georgios N Stamatas. (2013). The role of the skin barrier in modulating the effects of common skin microbial species on the inflammation, differentiation and proliferation status of epidermal keratinocytes. BMC Res Notes. 6;
- Teruaki Nakatsuji, Hsin-I. Chiang, Shangi B. Jiang, Harish Nagarajan, Karsten Zengler, Richard L. Gallo. (2013). The microbiome extends to subepidermal compartments of normal skin. Nat Commun. 4;
- Дэнби Ф. «Акне». М.: «ГЭОТАР-Медиа», 2020. — 444 с.;
- Барретт-Хилл Ф. «Косметическая химия для косметологов и дерматологов». М.: издательский дом «Косметика & Медицина», 2020. — 216 с.;
- B. Dréno, E. Araviiskaia, E. Berardesca, G. Gontijo, M. Sanchez Viera, et. al.. (2016). Microbiome in healthy skin, update for dermatologists. J Eur Acad Dermatol Venereol. 30, 2038-2047;
- M. Bek-Thomsen, H. B. Lomholt, M. Kilian. (2008). Acne is Not Associated with Yet-Uncultured Bacteria. J Clin Microbiol. 46, 3355-3360;
- Jiyeon Si, Sunghee Lee, Jin Mo Park, Joohon Sung, GwangPyo Ko. (2015). Genetic associations and shared environmental effects on the skin microbiome of Korean twins. BMC Genomics. 16;
- Никонов Е.Л., Гуревич К.Г., Терентьев А.Ю. (2019). Микробиота различных локусов организма. Микробиота. 1, 58–89;
- Malene Bek-Thomsen, Hans B. Lomholt, Carsten Scavenius, Jan J. Enghild, Holger Brüggemann. (2014). Proteome Analysis of Human Sebaceous Follicle Infundibula Extracted from Healthy and Acne-Affected Skin. PLoS ONE. 9, e107908;
- Muya Shu, Yanhan Wang, Jinghua Yu, Sherwin Kuo, Alvin Coda, et. al.. (2013). Fermentation of Propionibacterium acnes, a Commensal Bacterium in the Human Skin Microbiome, as Skin Probiotics against Methicillin-Resistant Staphylococcus aureus. PLoS ONE. 8, e55380;
- Kamil Piwowarek, Edyta Lipińska, Elżbieta Hać-Szymańczuk, Marek Kieliszek, Iwona Ścibisz. (2018). Propionibacterium spp.—source of propionic acid, vitamin B12, and other metabolites important for the industry. Appl Microbiol Biotechnol. 102, 515-538;
- Ines Wanke, Heiko Steffen, Christina Christ, Bernhard Krismer, Friedrich Götz, et. al.. (2011). Skin Commensals Amplify the Innate Immune Response to Pathogens by Activation of Distinct Signaling Pathways. Journal of Investigative Dermatology. 131, 382-390;
- Yuping Lai, Anna L. Cogen, Katherine A. Radek, Hyun Jeong Park, Daniel T. MacLeod, et. al.. (2010). Activation of TLR2 by a Small Molecule Produced by Staphylococcus epidermidis Increases Antimicrobial Defense against Bacterial Skin Infections. Journal of Investigative Dermatology. 130, 2211-2221;
- G.J.M. Christensen, H. Brüggemann. (2014). Bacterial skin commensals and their role as host guardians. Beneficial Microbes. 5, 201-215;
- Patrick L.J.M. Zeeuwen, Michiel Kleerebezem, Harro M. Timmerman, Joost Schalkwijk. (2013). Microbiome and skin diseases. Current Opinion in Allergy & Clinical Immunology. 13, 514-520;
- Yanhan Wang, Sherwin Kuo, Muya Shu, Jinghua Yu, Stephen Huang, et. al.. (2014). Staphylococcus epidermidis in the human skin microbiome mediates fermentation to inhibit the growth of Propionibacterium acnes: implications of probiotics in acne vulgaris. Appl Microbiol Biotechnol. 98, 411-424;
- Sandrine Tchaptchet, Marina Gumenscheimer, Christoph Kalis, Nikolaus Freudenberg, Christoph Hölscher, et. al.. (2012). TLR9-Dependent and Independent Pathways Drive Activation of the Immune System by Propionibacterium Acnes. PLoS ONE. 7, e39155;
- Tsuyoshi Tanabe, Ikuo Ishige, Yoshimi Suzuki, Yukie Aita, Asuka Furukawa, et. al.. (2006). Sarcoidosis and NOD1 variation with impaired recognition of intracellular Propionibacterium acnes. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1762, 794-801;
- Andrew McDowell, Susanna Valanne, Gordon Ramage, Michael M. Tunney, Josephine V. Glenn, et. al.. (2005). Propionibacterium acnes Types I and II Represent Phylogenetically Distinct Groups. J Clin Microbiol. 43, 326-334;
- Berolla Sahdo, Eva Särndahl, Fredrik Elgh, Bo Söderquist. (2013). Propionibacterium acnesactivates caspase-1 in human neutrophils. APMIS. 121, 652-663;
- Hans B. Lomholt, Mogens Kilian. (2010). Population Genetic Analysis of Propionibacterium acnes Identifies a Subpopulation and Epidemic Clones Associated with Acne. PLoS ONE. 5, e12277;
- Sorel Fitz-Gibbon, Shuta Tomida, Bor-Han Chiu, Lin Nguyen, Christine Du, et. al.. (2013). Propionibacterium acnes Strain Populations in the Human Skin Microbiome Associated with Acne. Journal of Investigative Dermatology. 133, 2152-2160;
- Tim N Mak, Monika Schmid, Elzbieta Brzuszkiewicz, Guanghong Zeng, Rikke Meyer, et. al.. (2013). Comparative genomics reveals distinct host-interacting traits of three major human-associated propionibacteria. BMC Genomics. 14;
- Steven R. Gill, Mihai Pop, Robert T. DeBoy, Paul B. Eckburg, Peter J. Turnbaugh, et. al.. (2006). Metagenomic Analysis of the Human Distal Gut Microbiome. Science. 312, 1355-1359;
- Peter J. Turnbaugh, Ruth E. Ley, Micah Hamady, Claire M. Fraser-Liggett, Rob Knight, Jeffrey I. Gordon. (2007). The Human Microbiome Project. Nature. 449, 804-810;
- Hyuck Hoon Kwon, Ji Young Yoon, Seon Yong Park, Seonguk Min, Dae Hun Suh. (2014). Comparison of Clinical and Histological Effects between Lactobacillus-Fermented Chamaecyparis obtusa and Tea Tree Oil for the Treatment of Acne: An Eight-Week Double-Blind Randomized Controlled Split-Face Study. Dermatology. 229, 102-109.