
Названы лауреаты Нобелевской премии-2015 по химии
08 октября 2015
Названы лауреаты Нобелевской премии-2015 по химии
- 981
- 0
- 0
Слева направо: Томас Линдаль, Пол Модрич и Азиз Санджар.
-
Автор
-
Редакторы
Нобелевскую премию по химии в этом году разделили поровну швед Томас Линдаль, американец Пол Модрич и турок Азиз Санджар. Их открытия теснейшим образом связаны с биологией. Трое ученых независимо друг от друга описали три разных механизма репарации (устранения ошибок и повреждений) ДНК.
На пресс-конференции во время объявления имен нобелевских лауреатов по химии прозвучало несколько интересных вопросов от журналистов, и один из них — «Почему же Нобелевский комитет не дал за это премию раньше?» Причина номинации действительно значимая, но дело в том, оправдывались члены комитета, что каждый год они рассматривают четыре сотни номинантов, и наградить всех невозможно.
Главный поставщик предположений о том, кто (не) станет нобелиатом в текущем году — агентство Thomson Reuters. На сей раз оно снова не угадало с лауреатами. Впрочем, надо признать, что в этом году предположения оказались довольно близки к реальности. Прогноз агентства состоял в том, что Нобелевскую премию в этом году получат:
- либо изобретатели литий-ионных аккумуляторов, которые сейчас используются и в телефонах, и в водителях сердечного ритма;
- либо те, кто открыл систему CRISPR/Cas9, благодаря которой в будущем можно будет редактировать геном человека;
- либо ученые, разработавшие методику проведения биоортогональных химических реакций — таких, которые можно проводить в живых клетках без боязни их повредить.
Темы, бесспорно, важные. Два варианта из трех очень тесно связаны с биологией — может быть, даже теснее, чем с химией. Но... мимо. Реальная формулировка премии в этом году звучит так: «За раскрытие механизмов репарации ДНК».
Выходи по одному: Томас Линдаль и эксцизионная репарация оснований
Молекула дезоксирибонуклеиновой кислоты очень длинная, она состоит из двух цепочек по несколько сотен тысяч нуклеотидов в каждой. Одна из составляющих каждого нуклеотида — азотистое основание, то есть их в ДНК тоже сотни тысяч. Всего в ДНК четыре разных вида таких оснований — аденин (A), тимин (T), гуанин (Г) и цитозин (Ц). В РНК роль тимина исполняет урацил (У). По молекулярному строению они все очень похожи и в некоторых условиях могут трансформироваться друг в друга. Проще всего проходит трансформация цитозина в урацил: первому достаточно потерять свою аминогруппу.
В то же время, от того, в каком порядке будет расположено множество нуклеотидов ДНК, зависит строение синтезируемых клеткой белков, а значит, и большинство признаков организма. Соответственно, если на место какого-нибудь Ц встанет У, последствия для организма могут быть значительными — особенно если учесть тот факт, что азотистые основания во время синтеза ДНК оказываются не на своем месте примерно в одном случае из тысячи. Ричард Докинз в книге «Слепой часовщик» приводит красочный пример того, что происходило бы, не будь возможности исправить такие ошибки в ДНК. Представьте себе ряд наборщиц текста, которым нужно перепечатать объемную книгу. Одна девушка набирает страницу текста и передает ее другой. Та не знает, как выглядел изначальный текст, и может использовать только листок от предыдущей в ряду. Даже очень хорошая наборщица делает в среднем одну опечатку на страницу. Без возможности ее исправить текст уже к тысячной наборщице превращается в бессмысленную кашу [1]. То же самое происходило бы с генами эмбриона животного задолго до образования у него органов, если бы не существовало механизмов исправления ошибок в расположении азотистых оснований.
Все это знал Томас Линдаль. В начале 1970-х годов он обнаружил у бактерий фермент, отыскивающий ошибки в расположении азотистых оснований. Фермент назвали ДНК-гликозилазой. В 1986 году Линдалю удалось выделить и клонировать ген этого фермента и расшифровать механизм работы ДНК-гликозилазы. Выяснилось, что гликозилаза находит и вырезает один-единственный нуклеотид с «чужим» азотистым основанием. Затем он заменяется на «правильный», после чего фермент лигаза сшивает разрезанные куски цепи ДНК. Вырезание — это эксцизия, а поскольку вырезается только одно азотистое основание, процесс назвали base excision repair — эксцизионная репарация оснований (рис. 1). В 1996 году эксцизионную репарацию оснований удалось воспроизвести в клетках человека [2].
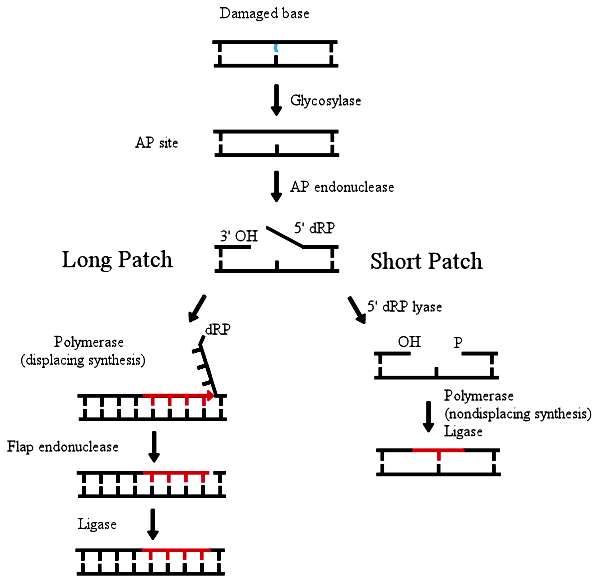
Рисунок 1. Механизм эксцизионной репарации оснований.
Азиз Санджар и бактерии против ультрафиолета
Азиз Санджар получил первое высшее образование по медицине в Стамбуле и несколько лет после выпуска проработал врачом. Впрочем, Санджар довольно быстро понял, что медицина — не совсем его профиль, и начал изучать биохимию. Больше всего его увлекал один факт, похожий на магию: если бактерии облучить большой дозой ультрафиолета (достаточной, чтобы нарушить последовательность нуклеотидов в ДНК), а потом посветить на них синим светом, повреждения ДНК у таких бактерий восстанавливаются. Работая в Техасском университете в Далласе под руководством Клода Руперта, в 1976 году Санджар обнаружил фермент, ответственный за «чудесное исцеление» бактерий — фотолиазу. Фотолиаза стала темой диссетрации Санджара на соискание степени доктора философии.
К сожалению, репарация ДНК бактерий под действием синего света мало интересовала большинство лабораторий. Из-за этого Азиза никуда не хотели брать постдоком. Чтобы продолжить научную карьеру и при этом работать над интересной для себя темой, Азиз Санджар устроился лаборантом в Йель. Работая там, Санджар обнаружил второй механизм фоторепарации (восстановления структуры ДНК после повреждений ультрафиолетом) — эксцизионную репарацию нуклеотидов (рис. 2). У бактерий она обеспечивается совместным действием ферментов, которые синтезируются на основе информации генов uvrA, uvrB и uvrC.
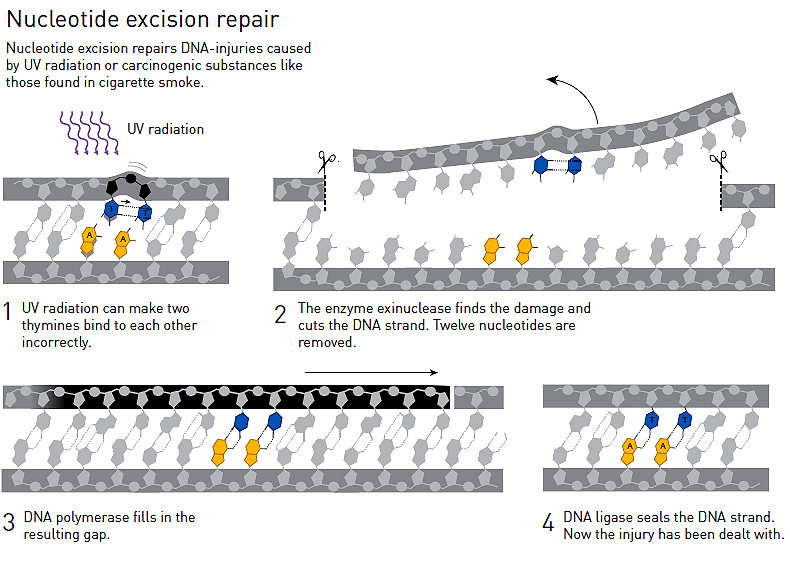
Рисунок 2. Механизм эксцизионной репарации нуклеотидов.
Под действием ультрафиолета соседние тимины в одной цепочке ДНК образуют ковалентную связь друг с другом. При этом водородная связь между двумя цепочками ДНК в месте комплементарного взаимодействия тимина и аденина второй цепочки рвется. Это приводит к дальнейшим ошибкам при удвоении ДНК. Отсоединить один тимин от другого сложно, поэтому логичнее вырезать небольшой кусок ДНК, на котором они находятся, и вставить на его место правильную последовательность неповрежденных нуклеотидов. Этим последовательно занимается фермент эксцинуклеаза (вырезает 12 нуклеотидов, в том числе злосчастные тимины), а также уже знакомые нам ДНК-полимераза (вставляет нужную последовательность нулеотидов) и ДНК-лигаза (сшивает отрезки одной цепи ДНК). У людей подобный механизм тоже имеет место. Более того, те, у кого гены-аналоги uvrA, uvrB и uvrC содержат мутации, подвержены большему риску рака кожи: ультрафиолет оказывает более пагубное влияние на ДНК их клеток кожи [2].
Пол Модрич и несовпадение нуклеотидов
Пол Модрич родился и вырос в США, сейчас он работает в медицинском институте Говарда Хьюза. Отец Модрича, учитель биологии, через год после вручения Нобелевской премии Уотсону и Крику настоял на том, чтобы его сын обратил внимание не только на ботанику и зоологию, но и на «эту историю с ДНК». Пол последовал совету отца, и вскорости изучение ДНК стало всем делом его жизни. Модрич стал аспирантом в Стэнфорде, а позднее — постдоком в Гарварде.
Пол изучал то, как проходят процессы метилирования ДНК и зачем они нужны. Метилирование — это присоединение метильных группы (-CH3) к нуклеотидам ДНК. Метильные группы могут служить ориентирами для других ферментов, взаимодействующих с ДНК. Например, они могут подавать сигнал «резать здесь» для рестриктазы. Помимо этого, как показали Пол Модрич и его коллега Мэттью Мезельсон, у метилирования ДНК есть еще одна функция. Участки для метилирования выбираются не случайно. Как правило, это те фрагменты ДНК, на которых нуклеотиды обеих цепочек соединены комплементарно, то есть А стоит напротив Т, Г стоит напротив Ц, и наоборот. Там, где нуклеотиды соседних цепей не образуют комплементарные пары (т.е. имеет место несостыковка — mismatch), метилирование происходит редко. Это сигнал для ферментов MutL и MutS о том, что перед ними неверная последовательность ДНК, часть нуклеотидов которой нужно заменить. Таким образом, MutL и MutS запускают процесс репарации ошибочно спаренных оснований, а завершают его все те же рестриктаза и лигаза [2].
Как и в случае репарации, описанной Азизом Санджаром, нарушение репарации ошибочно спаренных оснований приводит к заболеваниям у человека, — например, к пигментной ксеродерме, состоянию, когда выход на солнце может многократно повысить риск рака кожи у человека. Кроме того, некоторые наследуемые виды рака прямой кишки также вызываются неполадками в репарации ошибочно спаренных оснований [3].
Заключение
Нобелевская премия по химии в этом году получилась в духе классических тем «Биомолекулы» — одновременно молекулярно-биологическая и с направленностью в биомедицину. Открытия, которые номинировали на премию, уже нашли реальное практическое применение в онкологии и медицине наследственных заболеваний. В этом их отличие от основного предполагаемого претендента на премию — системы CRISPR/Cas9. Последняя, безусловно, вещь прорывная, но пока чисто фундаментальная и на практике к человеку не применимая. Впрочем, стоит учесть, что изначально работы Санджара, Линдаля и Модрича тоже носили характер фундаментальных. Часть из них была проведена исключительно из любопытства. Об этом в своем интервью напоминает Пол Модрич: «Вот поэтому стоит изучать не только то, что выгодно в данный момент, но и то, что тебе просто интересно. Никогда не знаешь, куда такие исследования заведут... Впрочем, немного удачи никогда не помешает».
Литература
- Докинз Р. Слепой часовщик. Как эволюция доказывает отсутствие замысла во Вселенной. М.: Corpus, 2015. — 496 c.;
- The Nobel Prize in Chemistry. (2015). Описание достижений нобелевских лауреатов на сайте Шведской королевской академии наук;
- Lindahl T., Wood R.D. (1999). Quality control by DNA repair. Science. 286, 1897–1905..





