Нервная система под давлением: как ренин-ангиотензин-альдостероновая система управляет нашим настроением и работой мозга
27 января 2026
Нервная система под давлением: как ренин-ангиотензин-альдостероновая система управляет нашим настроением и работой мозга
- 384
- 0
- 2
Хореография нейронов: ритмы мозговой активности.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Долгое время ученые рассматривали ренин-ангиотензин-альдостероновую систему (РААС) как дирижера, управляющего лишь двумя аспектами нашего организма: нашим артериальным давлением и водно-солевым балансом. Однако последние исследования выявили ее значительное влияние на центральную нервную систему. РААС модулирует нейронные процессы в глубинных структурах мозга, что сказывается на уровне тревожности, резистентности к депрессии и когнитивных функциях в пожилом возрасте.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — Благотворительный фонд «Белая лилия», который поддерживает школьников, студентов профильных вузов, научных коллективов врачей и ученых по разработке и созданию прорывных технологий в области медицины.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое классическая РААС?
Упрощенный алгоритм ее работы выглядит так:
- Почки чувствуют падение давления или недостаток соли и выделяют аспартатную протеиназу ренин. Он синтезируется в виде проренина, который в процессе протеолиза (гидролиза белка) активируется и высвобождается в кровь.
- Ренин в крови действует на белок-предшественник ангиотензиноген (производится в печени) и превращает его в декапептид ангиотензин I. Это пока еще «спящее» вещество.
- Ангиотензин I в кровеносных сосудах, легких и других тканях под действием ангиотензинпревращающего фермента (АПФ) превращается в октапептид ангиотензин II.
- Ангиотензин II живет в крови всего несколько минут, после этого подвергается протеолизу. Он вызывает сужение кровеносных сосудов, побуждает надпочечники выделять альдостерон (гормон, отвечающий за удержание натрия и воды в организме), стимулирует центр жажды в головном мозге и способствует высвобождению вазопрессина из гипофиза. Все эти механизмы в совокупности приводят к повышению артериального давления и увеличению объема крови, что помогает восстановить нормальный баланс в организме [1], [2].
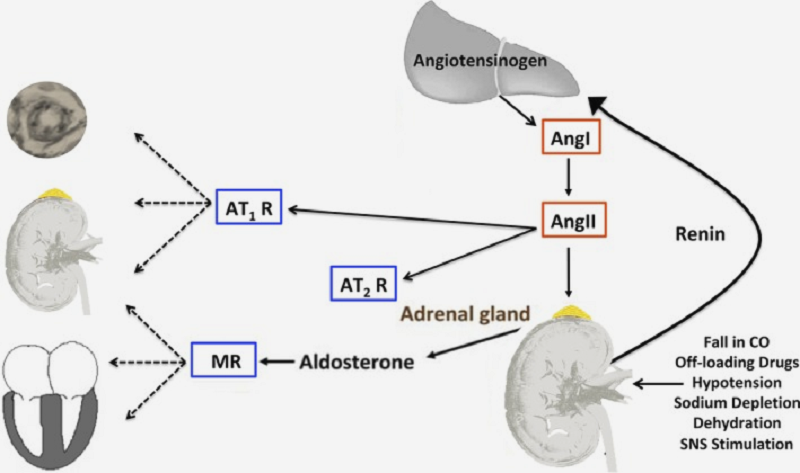
Рисунок 1. Схема классической РААС.
Две группы ученых (Браун-Менендес и др., Пейдж и Хелмер) открыли ренин в 1940 году, и с тех пор ведутся активные исследования на эту тему.
От периферии к центру: открытие независимой мозговой РААС
Неожиданно в 1971 году Гантен и др. установили существование в головном мозге локальной ренин-ангиотензиновой системы, практически идентичной по своему составу периферической. В ней производятся те же компоненты: и ангиотензиноген, и ренин, и АПФ, и рецепторы к ангиотензину II.
Эта мозговая РААС функционирует с высокой степенью автономии, независимо от системной регуляции. Ее задача — не регулировать системное давление, а управлять ключевыми функциями мозга.
В отличие от классической модели, где ключевую роль играет ангиотензин II, в центральной нервной системе наблюдается более сложная картина. Помимо ангиотензина II, здесь задействованы также ангиотензин IV, который синтезируется из ангиотензина II под действием аминопептидаз A и N, и ангиотензин (1–7). Последний может образовываться как из ангиотензина II, так и из ангиотензина I под действием АПФ [3].
Также есть несколько основных типов рецепторов этой системы: АТ1-рецепторы, АТ2-рецепторы, АТ4-рецепторы и Mas-рецепторы. Их баланс во многом определяет наше психическое состояние.
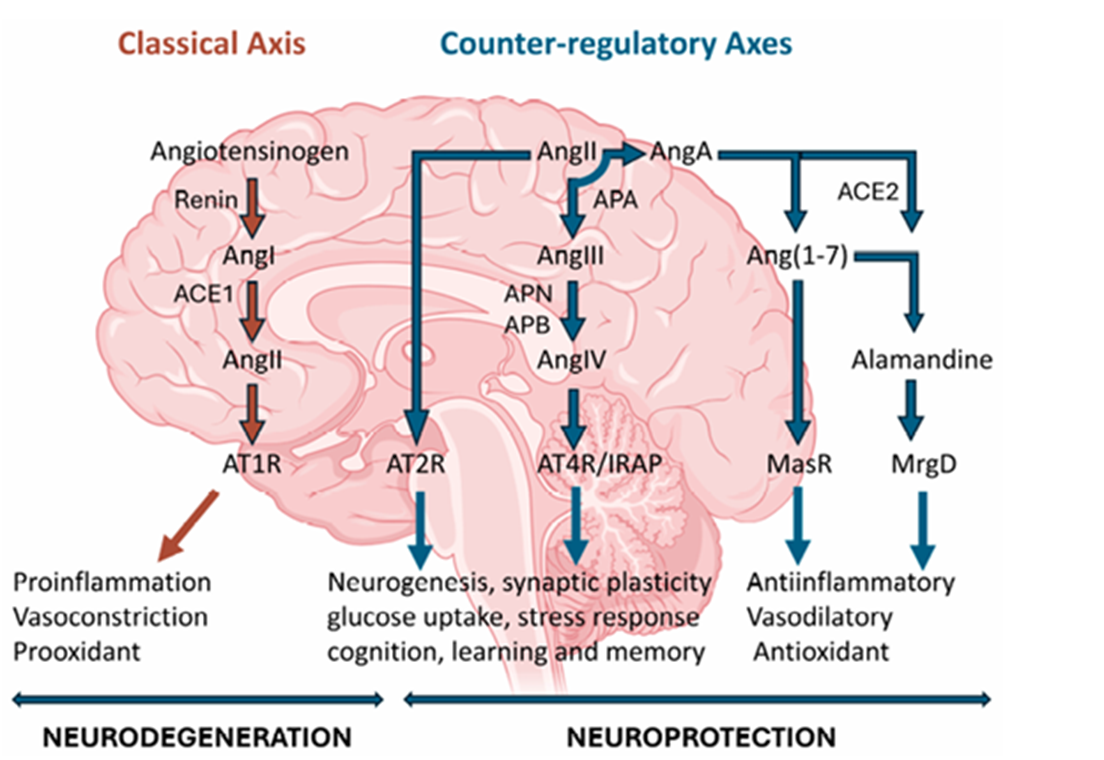
Рисунок 2. Схема РААС в мозге.
Расположение РААС в ЦНС
Что касается локализации РААС в головном мозге, ангиотензиноген в основном вырабатывается в астроцитах (90%) почти во всех областях мозга [5]. Активность AT1-рецепторов в астроцитах вызывает воспаление, но при этом укрепляет гематоэнцефалический барьер. Активность AT2-рецепторов и Mas-рецепторов в астроцитах оказывает противовоспалительное действие [6]. Экспрессия ангиотензиногена в нейронах также была зарегистрирована, но в меньшей степени [5].
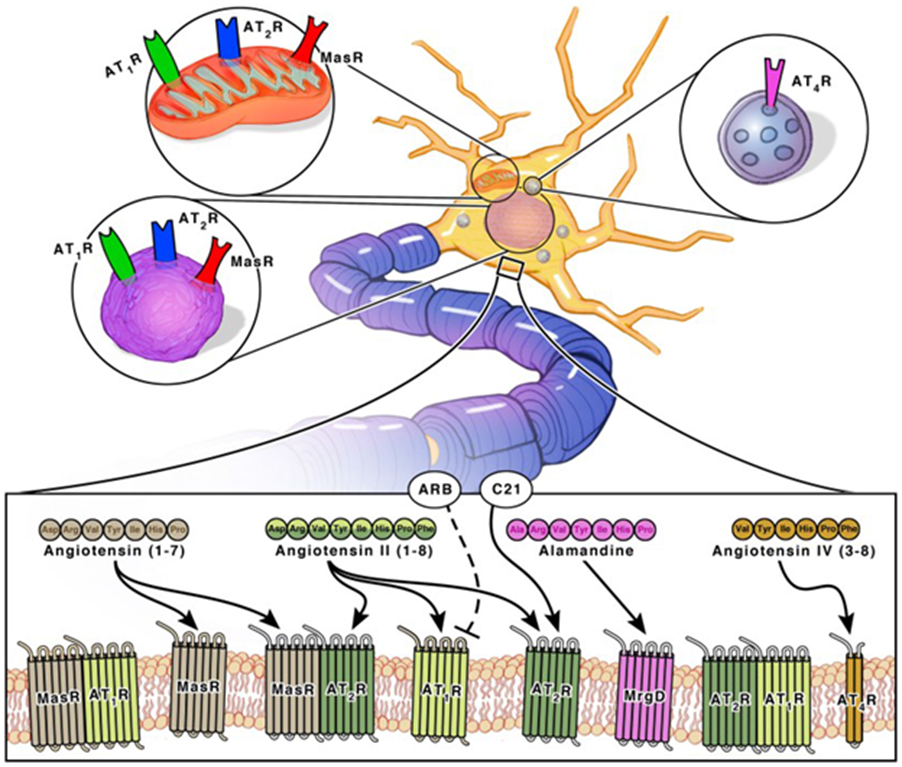
Рисунок 3. Расположение рецепторов в ЦНС.
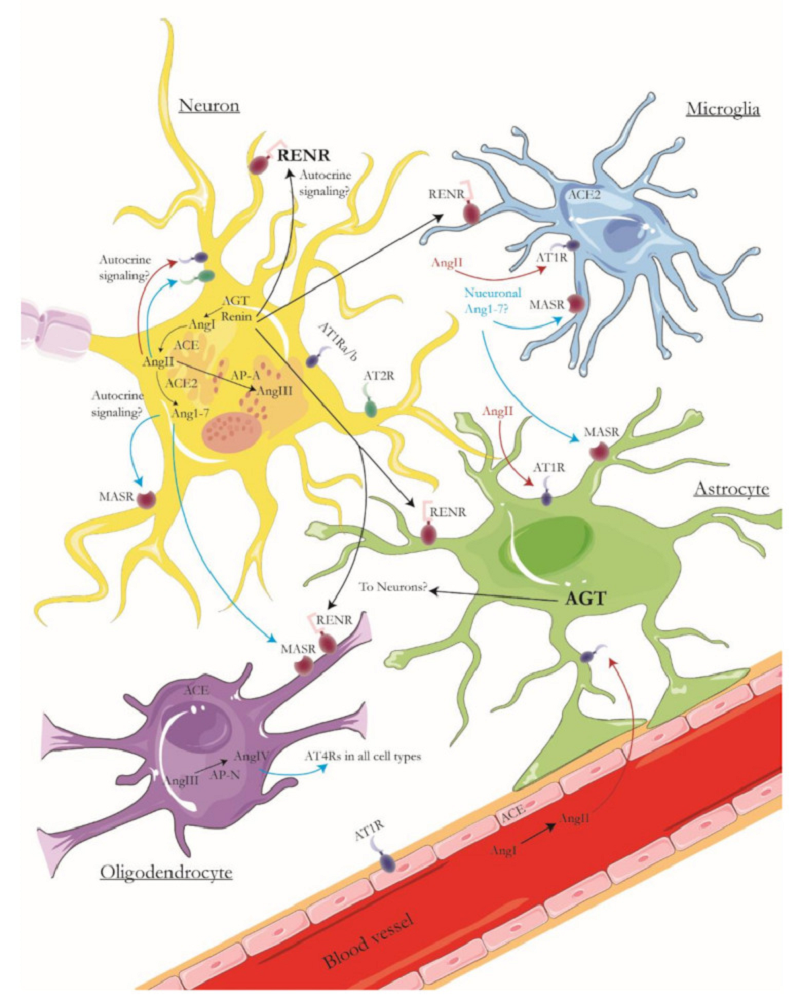
Рисунок 4. Нейроны, микроглия, астроциты, олигодендроциты и РААС.
Как AT1, так и AT2 также локализуются в олигодендроцитах и микроглии коры головного мозга, гиппокампа и базальных ганглиев, особенно на поверхности клеток и внутриклеточно, что позволяет регулировать окислительный стресс [5], [6].
Эффекты активации РААС в ЦНС
Ангиотензин II, активируя АТ1-рецепторы:
- Стимулирует выброс гормона стресса (кортизола) и усиливает активность в отделах мозга, ответственных за страх и тревогу, таких как миндалевидное тело.
- Запускает в мозге воспалительные каскады и способствует образованию свободных радикалов, которые повреждают и убивают нейроны.
- Сужает сосуды, ухудшая питание нейронов [8].
- Создает гиперпроницаемость ГЭБ (гематоэнцефалического барьера).
- Нарушает работу астроцитов [5].
Если же ангиотензин II связывается с AT2-рецепторами, то он:
- Стимулирует рост и удлинение аксонов и дендритов.
- Защищает нейроны от повреждений, вызванных инсультом и окислительным стрессом.
- Участвует в процессах обучения, памяти.
- Модулирует активность ионных каналов, влияя на передачу нервных импульсов.
- Снижает уровень противовоспалительных цитокинов [9].
Ангиотензин IV может активировать АТ4-рецепторы, которые:
- Играют ключевую роль в обучении и памяти за счет повышения синаптической пластичности (способность синапса усиливаться или ослабевать с течением времени в ответ на увеличение или уменьшение их активности).
- Усиливают высвобождение ацетилхолина и дофамина [6], [10].
Активация Mas-рецептора ангиотензином (1–7) приводит к:
- Вазодилатации (расслабление и расширение кровеносных сосудов).
- Уменьшению повреждения клеток, вызванного окислительным стрессом.
- Увеличению выработки оксида азота (NO), который способствует расширению сосудов и улучшению кровообращения.
- Защите нервных клеток и улучшению их выживаемости за счет активации определенных сигнальных путей.
- Стимуляции роста новых кровеносных сосудов (ангиогенез) в головном мозге.
- Снижению высвобождения норадреналина.
- Модуляции уровня дофамина и ГАМК, что важно для регуляции настроения [11], [12].
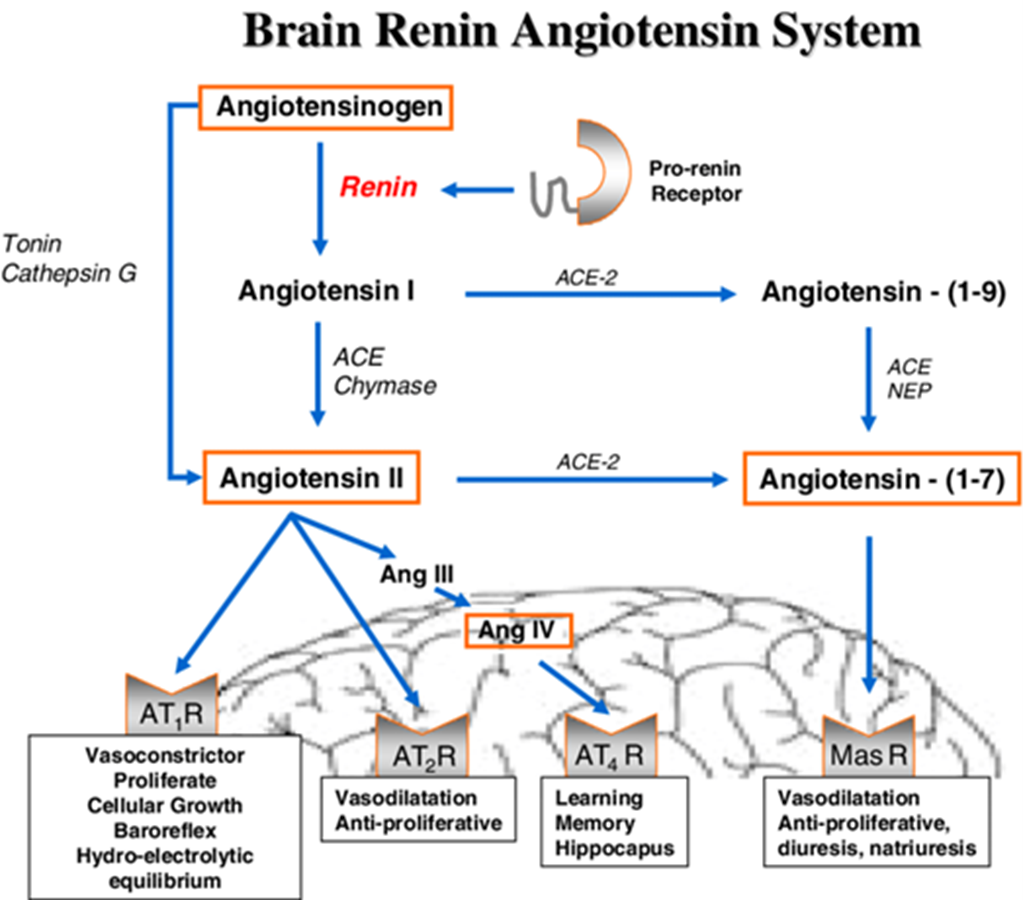
Рисунок 5. Рецепторы РААС и мозг.
Могут ли препараты, обычно используемые для регуляции артериального давления, оказывать влияние на работу мозга?
Существует два основных вида лекарств для регуляции давления, связанных с РААС:
- Ингибиторы АПФ: блокируют образование ангиотензина II, увеличивают уровни брадикинина, энкефалинов и субстанции P (участвует в передаче боли), влияют на симпатическую активность.
- Сартаны (БРА — блокаторы рецепторов ангиотензина): блокируют действие ангиотензина II на АТ1-рецепторы, которые модулируют мозговой кровоток, гомеостаз, автономные пути и эндокринную систему [4], [5], [14].
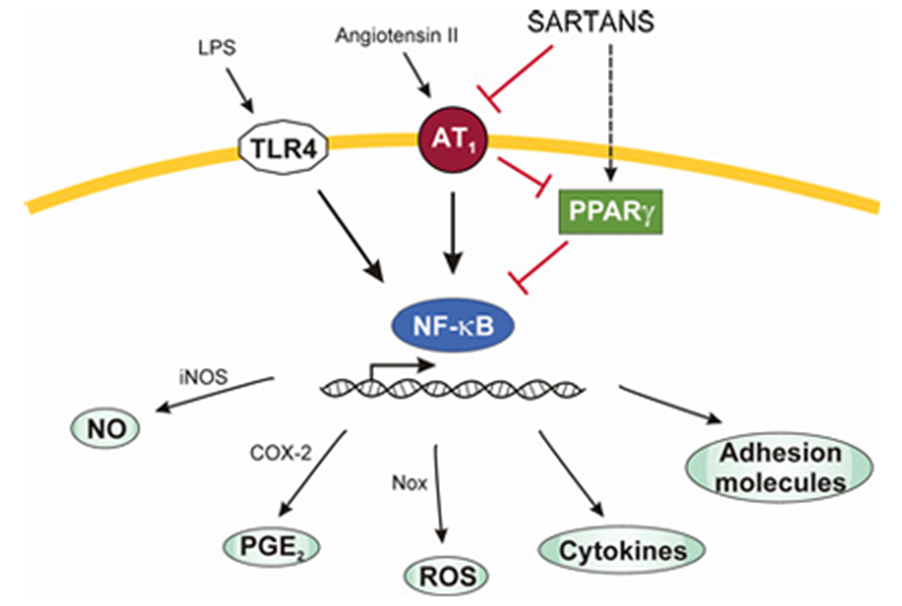
Рисунок 6. Влияние препаратов на рецепторы РААС.
Далее мы рассмотрим некоторые заболевания и возможное влияние на них этих лекарств.
Болезнь Альцгеймера и РААС: есть ли связь?
Болезнь Альцгеймера (БА) связана с накоплением в мозге токсичного белка амилоида-бета (Aβ), который образует бляшки и приводит к гибели нейронов. Также в нейронах накапливается патологический тау-белок.
Процесс образования амилоида:
- В мембранах нейронов находится белок, называемый предшественником амилоида (APP). Он играет важную роль в нормальной работе мозга, включая развитие, память и способность нейронов обмениваться сигналами (синаптическую пластичность).
- При определенных условиях APP расщепляется специальными ферментами. В результате образуется пептид, известный как Aβ (бета-амилоид).
- Молекулы Aβ слипаются, образуя сначала олигомеры (наиболее токсичная форма), а затем фибриллы и амилоидные бляшки. Эти скопления Aβ повреждают нейроны и нарушают связи между ними (синапсы), что приводит к ухудшению когнитивных функций [15].
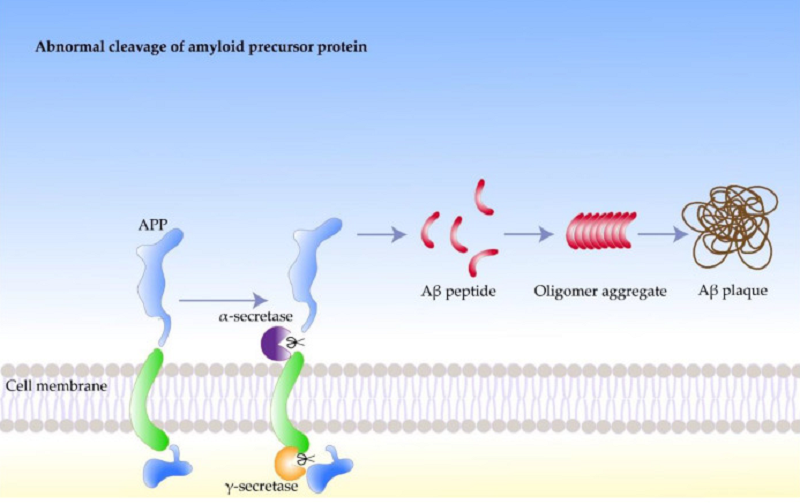
Рисунок 7. Образование амилоида-бета (Aβ) при болезни Альцгеймера.
У пациентов с БА обнаружены:
- сниженная активность АПФ в мозге;
- пониженный уровень Ang-(1-7) в плазме и мозге;
- повышенное соотношение Ang II / Ang-(1-7) [12].
Исследования на мышах показывают, что активация рецептора AT2 может снижать накопление амилоидных бляшек и уменьшать патологическую модификацию тау-белка (гиперфосфорилирование) [9]. Также увеличение активности АПФ или уровня Ang-(1-7) улучшало когнитивные функции и снижало патологию [12]. Препараты, стимулирующие AT2, показали улучшение памяти в экспериментах на животных и связаны с более низким риском развития деменции и БА. [9] Ингибиторы АПФ и БРА могут оказывать положительное влияние за счет снижения уровня ангиотензина II и увеличения уровня вещества P, которое способствует разрушению бета-амилоида [13].
Клинической значимости пока нет, но гипотеза изучается. Идея влияния на болезнь Альцгеймера через РААС остается теоретической.
РААС и болезнь Паркинсона
Болезнь Паркинсона – это прогрессирующее нейродегенеративное заболевание. Ключевыми маркерами болезни являются аномальные белковые скопления, известные как тельца Леви, и поврежденные нервные отростки (нейриты Леви). Основной причиной двигательных нарушений, характерных для Паркинсона, является потеря дофаминовых нейронов в области мозга, называемой черной субстанцией [16], [17].
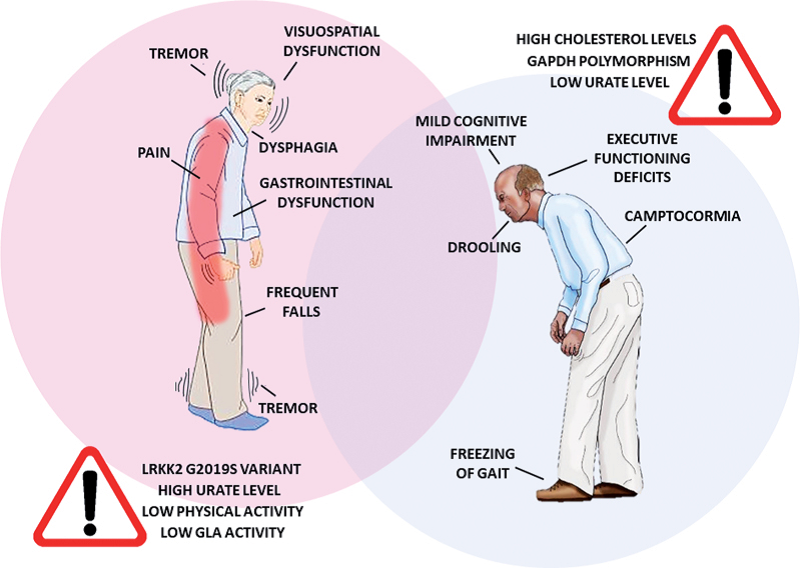
Рисунок 8. Проявление болезни Паркинсона.
В этой же области присутствует рецептор AT2. Исследования показывают, что стимуляция AT2 может способствовать защите дофаминергических нейронов. Однако с течением времени активность рецепторов снижается, что может делать человека более уязвимым к развитию болезни Паркинсона [4], [9].
Инсульт
Инсульт — это острое состояние, при котором внезапно нарушается кровоток в головном мозге. Это приводит к гибели нейронов в зоне поражения, что, в свою очередь, вызывает быстрое (от минут до часов) развитие очаговых неврологических симптомов (нарушения движений, речи, чувствительности, координации, зрения и т.д.) или общих мозговых расстройств (потеря сознания, сильная головная боль, рвота). Эти проявления сохраняются более 24 часов или могут стать причиной смерти в короткие сроки из-за сосудистых проблем мозга [18].
Активация рецептора AT2 способствует уменьшению зоны повреждения мозга после ишемии, улучшает кровообращение в головном мозге и снижает уровень окислительного стресса [9].
БРА и ингибиторы АПФ показали на животных моделях способность снижать вероятность развития инсульта (прежде всего ишемического) и уменьшать тяжесть повреждения мозга в случае его возникновения. Применение этих препаратов улучшает мозговое кровообращение, восстанавливает нормальный тонус сосудов и защищает мозг от повреждений, вызванных ишемией [13].
Ангиотензин (1-7) обладает выраженным защитным действием на нервные клетки при различных типах инсульта. Он способствует уменьшению размера инфаркта, улучшает неврологические функции и снижает летальность. Эти положительные эффекты обусловлены снижением воспалительных процессов, уменьшением окислительного стресса и стимуляцией ангиогенеза [12].
Депрессия и тревожность
Депрессия и тревожность — достаточно распространенные проблемы, которые имеют множество причин возникновения. В том числе на их развитие влияет и РААС. Ангиотензин II, действуя через рецептор AT1, способен провоцировать проявления депрессии и тревоги. В то же время, защитные пути, такие как система Ang(1-7)/MasR, оказывают противоположное, успокаивающее и антидепрессивное действие [4], [12], [13].
Стрессовые ситуации приводят к увеличению количества рецепторов AT1 в головном мозге, что коррелирует с высвобождением гормонов стресса, таких как кортикотропин-рилизинг-фактор [19].
Влияние на алкогольную зависимость
Данные доклинических исследований на животных моделях позволяют предположить, что блокирование рецепторов AT₁ в головном мозге (с помощью БРА) может способствовать снижению потребления алкоголя и ослаблению некоторых негативных последствий его приёма, таких как повышение артериального давления. Предполагается, что снижение гиперактивности РААС в мозге может представлять собой одно из перспективных направлений для разработки новых подходов к терапии алкогольной зависимости [13].
Память и обучение
- Ангиотензин II, воздействуя на AT1 рецепторы, негативно влияет на процесс закрепления воспоминаний. Блокировка АТ1-рецепторов (с помощью БРА) способствует улучшению способности к запоминанию пространственной информации и уменьшению уровня тревожности.
- Ангиотензин IV (через AT4 рецепторы) и Ангиотензин (1-7) (через Mas рецепторы) стимулируют изменения в синапсах, что приводит к улучшению памяти [13].
Появление новых перспектив
В итоге оказалось, что система, которая отвечает за такие базовые вещи, как давление и водно-солевой баланс, напрямую дирижирует и нашим внутренним миром — настроением, памятью, устойчивостью к стрессу.
Конечно, это не значит, что теперь все должны пить таблетки от давления для улучшения настроения. Но это открывает фантастические перспективы для создания новых лекарств. Уже сейчас идут клинические испытания, как старые добрые сартаны и ингибиторы АПФ могут помочь при лечении депрессии, не поддающейся обычным антидепрессантам, или на ранних стадиях снижения памяти. Наука стирает границы между телом и психикой, и это по-настоящему впечатляет.
Литература
- Кольман Я., Рём К.-Г. Наглядная биохимия (пер. с нем.), 3-е изд. М.: «Мир», 2009. — 469 с.;
- Marisa K. Ames, Clarke E. Atkins, Bertram Pitt. (2019). The renin‐angiotensin‐aldosterone system and its suppression. Veterinary Internal Medicne. 33, 363-382;
- Куликов Ю.А., Сливкин А.И., Афанасьева Т.Г. Фармацевтический энциклопедический словарь. М.: «ВЕДАНТА», 2015;
- Cristina Cueto-Ureña, María Jesús Ramírez-Expósito, María Pilar Carrera-González, José Manuel Martínez-Martos. (2025). Physiopathology of the Brain Renin-Angiotensin System. Life. 15, 1333;
- Filipa Gouveia, Antoni Camins, Miren Ettcheto, Joana Bicker, Amílcar Falcão, et. al.. (2022). Targeting brain Renin-Angiotensin System for the prevention and treatment of Alzheimer’s disease: Past, present and future. Ageing Research Reviews. 77, 101612;
- LaDonya Jackson, Wael Eldahshan, Susan Fagan, Adviye Ergul. (2018). Within the Brain: The Renin Angiotensin System. IJMS. 19, 876;
- Raúl Loera-Valencia, Francesca Eroli, Sara Garcia-Ptacek, Silvia Maioli. (2021). Brain Renin–Angiotensin System as Novel and Potential Therapeutic Target for Alzheimer’s Disease. IJMS. 22, 10139;
- Juan M. Saavedra. (2012). Angiotensin II AT1 receptor blockers as treatments for inflammatory brain disorders. Clinical Science. 123, 567-590;
- Marie-Odile Guimond, Nicole Gallo-Payet. (2012). The Angiotensin II Type 2 Receptor in Brain Functions: An Update. International Journal of Hypertension. 2012, 1-18;
- O. von Bohlen und Halbach, D. Albrecht. (2006). The CNS renin-angiotensin system. Cell Tissue Res. 326, 599-616;
- Adrian Martyniak, Przemysław J. Tomasik. (2022). A New Perspective on the Renin-Angiotensin System. Diagnostics. 13, 16;
- Natalia L. Rukavina Mikusic, Angélica M. Pineda, Mariela M. Gironacci. (2021). Angiotensin-(1-7) and Mas receptor in the brain. Exploration of Medicine. 2, 268-293;
- M. Ian Phillips, Edilamar Menezes de Oliveira. (2008). Brain renin angiotensin in disease. J Mol Med. 86, 715-722;
- Ruchika Nandha, Harpal Singh. (2012). Renin angiotensin system: A novel target for migraine prophylaxis. Indian J Pharmacol. 44, 157;
- Chen Ma, Fenfang Hong, Shulong Yang. (2022). Amyloidosis in Alzheimer’s Disease: Pathogeny, Etiology, and Related Therapeutic Directions. Molecules. 27, 1210;
- Sigurlaug Sveinbjornsdottir. (2016). The clinical symptoms of Parkinson's disease. Journal of Neurochemistry. 139, 318-324;
- Silvia Cerri, Liudmila Mus, Fabio Blandini. (2019). Parkinson’s Disease in Women and Men: What’s the Difference?. Journal of Parkinson’s Disease. 9, 501-515;
- D V Kandyba. (2016). STROKE. Rossiĭskiĭ semeĭnyĭ vrach. 20, 5;
- Bernardo H. M. Correa, Luca Becari, Marco Antônio Peliky Fontes, Ana Cristina Simões-e-Silva, Lucas M. Kangussu. (2022). Involvement of the Renin-Angiotensin System in Stress: State of the Art and Research Perspectives. CN. 20, 1212-1228.